2018年高中化学第一章物质结构元素周期律1.1.1元素周期表课件新人教版必修2
化学必修元素周期表ppt课件

ppt课件.
41
总结:
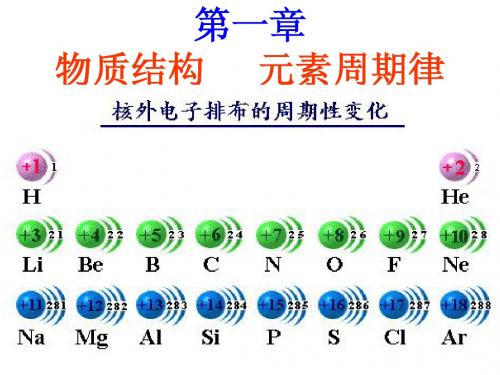
碱金属的原子结构
Li Na K Rb Cs
1.相似性:
最外层上都只 有一个电子
化学性质相似
1) 都易失电子表现强还 原性
2) 化合物中均为+1价
核电荷数
2.递变性: 电子层数
原子半径
核对最 外层电 子的引 力
失电 子能 力
还原 性
金 属 性
(电子层数的影响大于核电荷数的影响)
很好 逐渐增大(K特殊) 单质的熔沸点逐渐降低
ppt课件.
40
通过比较碱金属单质与氧气、水的反应, 我们可以看出,元素性质与原子结构有密 切关系,主要与原子核外电子的排布,特 别是 最外层电子数 有关。原子结构相 似的一族元素,它们在化学性质上表现出
相似性 和递变性 。
在元素周期表中,同主族元素从上到下原 子核外电子层数依次 增多 ,原子半径逐 渐 增大 ,失电子能力逐渐 增强 ,金 属性逐渐 增强 。
通过大量实验和研究,人们得出了如下结论:
碱金属元素原子的最外层都有1个电子,它们的化学性
质彼此相似 ,它们都能与 水 等非金属单质以及氧气 反应,表现出金属性(还原性).
4Li+O2=2Li2O
2Na+O2=Na2O2 2Na+2H2O=2NaOH +H2↑
2K+2H2O=2KOH +H2↑
上述反应的产物中,碱金属元素的化合价都是 +1 。
49
卤族元素: 氟(F)
F +9 2 7
氯(Cl)
Cl + 1 7 2 8 7
溴(Br)
Br +35 2 8 18 7
碘(I)
I +53 2 8 1818 7
人教版高中化学必修二课件:1.1《元素周期表》(共37张PPT)

2KI+Br2 = I2+2KBr 静置后,液体分层, 氧化性: Br2 > I2
上层 无色 ,
下层 紫色 。
结论
氧化性:Cl2 > Br2 > I2 还原性:I - > Br - > Cl 小结: 氧化性:F2> Cl2> Br2>I2 还原性:F-> Cl- > Br- > I-
氧化性:F2> Cl2> Br2>I2。 Cl2可从溴、碘的盐 溶液中置换出相应的卤素单质,F2与氯、溴、 碘的盐溶液可以置换出相应的卤素单质吗?
H2+F2 = 2HF H2+Cl2 = 2HCl 暗处剧烈反应并爆炸;HF很稳定 光照或点燃反应;HCl较稳定
H2+Br2 = 2HBr
H2+I2
加热500℃ ,HBr不稳定
2HI 需不断加热,HI同时分解
■都能跟氢气反应,体现相似性 反应通式:H2 + X2 = 2HX (X= F、Cl、Br、I) ■单质氧化性减弱,体现递变性
① 除9、10、18纵行(列序)外,族序数=列序个位数。(记忆方法) ②18个纵行,只16个族;0族和第VIII族不属主族,也不属副族。
一、碱金属元素结构和化学性质的相似性和递变性
Li Na K Rb Cs
1.相似性:
最外层上都只 有一个电子 2.递变性: 核电荷数↑ 电子层数↑ 原子半径↑ 失电子能力↑ 化学性 质相似
3.请在下面的线框中用色笔画出周期表的轮廓。并标出族序数,写
出七个主族元素(可参考课本)和 0族元素的元素符号。
周期 ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB VIIB
IB IIB ⅢA ⅣA ⅤA Ⅵ AⅦA 0 种类
元素周期表PPT

第 七 周期
0族
各周期的 元素数目:
一 二三四五 六七
2、 8、 8、 18、18、 32、 32
稀有气体的
原子序数:
你现在学习的是第11页,课件共37页
一二三 四五 六 七 2、 10、 18、 36、 54、 86、 118
1、 2、
你现在学习的是第12页,课件共37页
A AC
二.元素的性质与原子结构
Li
Na K
Rb Cs
核电荷数增多 电子层数增多
原子半径增大
随核电荷数的增加,原子半径 增大,失电子能力逐渐增强,元素
的金属性增强,单质还原性逐渐 增强。
结论:碱金属都具有强还原性,且随核电荷数的增加,元素的
金属性逐渐增强,氢氧化物的碱性逐渐增强。
你现在学习的是第15页,课件共37页
(3)碱金属的主要物理性质及递变规律
1、元素周期表结构:七主七副七周期 Ⅷ族0族镧锕系 2、元素周期表中从左至右各族的顺序:一、八依次现,一、零再一遍。
3、112种元素
稀有气体元素:6 种
非金属元素: 16种
金属元素:
90种
单质:
气体: H2、F2、Cl2、O2、N2、稀有气体 液体: Br2、Hg 固体:大多数
你现在学习的是第8页,课件共37页
砹的化合物不可能具有的性质是( )B
A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应
C、HAt非常不稳定
D、砹氧化性弱于碘
2、
B
你现在学习的是第27页,课件共37页
三、核素
知识回顾
质子
原子核
原子
中子
核外电子
(一)原子的组成
原子核特点:原子核居于原子的中心,体积很小,但原子质量主要集中 在原子核,原子核带正电荷,它由质子和中子构成。
人教版高中化学必修一《原子结构与元素周期表》物质结构元素周期律PPT(第2课时)

▪ c.分类:
▪ 短周期:包括__第__一__、__二_、__三__周__期________
。
第四、五、六、七周期
▪ 长周期:包括____________ _________。
▪ ②族
▪ a.个数:元素周期表有_1_8_个纵行,但只有1_6_ 个族
。 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
▪ⅠAb原Ⅱ.A子特Ⅲ的B点Ⅳ最:B 外元ⅤB层素Ⅵ电B周子Ⅶ期B 数表中Ⅷ主族元ⅠB素Ⅱ的B 族ⅢA序ⅣA数Ⅴ等A 于ⅥA其ⅦA 0 ____________________。
▪ c.分类:
▪ 主族Ⅳ:A在族序数后标A,如周期表中第14纵行表示为 ▪ 第副_族_:__在__族__序族数。后标B,如周期表中第6纵行表示为
递增的顺序从上到下排成纵行。
钾(K) 钙(Ca)
周期(横 周期序数 = 电子层数
短周期 第一行周期):2 种元素
第二周期:8 种元素 第三周期:8 种元素
长周期 第四周期:18 种元素
第五周期:18 种元素 第六周期:32 种元素 第七周期:32种元素
(镧系元素) (锕系元素)
主族: ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
零族称为 稀有气体 元素
思考:Cl的位置的描述:第三周期第VIIA族
第III周期 第3周期 第三周期
第七主族 VII族 VIIA族
1、氦元素原子最外层有两个电子, 为什么不把它排在ⅡA族?
2、哪周期元素种类最多?族呢?
第六周期、第七周期
第ⅢB
课 1.已知某主族元素的原子结构示意图如
堂 下,判断其位于第几周期?第几族?
【授课】第一章物质结构元素周期律复习课件【精品】
(3)同周期元素随原子序数递增,主要化合价呈 周期性变化;
最高正价:+1~+7 最低负价:由-4~-1
3、元素性质呈周期性变化的根本原因是 元素原子的核外电子排列呈周期性变化 4、同周期、同主族元素结构、性质的递 变规律及金属元素、非金属元素的分区: 分界线左边是金属元素,分界线右边 是非金属元素,最右一个纵行是稀有气体 元素。见下图: 注意:金属性、非金属性是元素的性质
32
1、理解几个概念:
1)元素:具有相同核电荷数(质子数)的同一类原子的总称。 2)核素:把具有一定数目质子和一定数目中子的一种原子 叫做核素。 3)同位素:质子数相同而中子数不同的同一元素的不同 原子互称为同位素。(同一种元素的不同核素互称为同位素 ) 如:1H、2H、3H;12C、14C
1、1H、2H、3H、H+、H2是( D ) A.氢的5种同位素 B.5种氢元素 C.氢的5种同素异形体 D.氢元素的5种不同微粒
· · · ·
· · H Cl · · · ·
· ·
分子结构和化学键
用电子式表示离子键、共价键的形成过程
.
2
+ +
· · H Cl · ·
· ·
H×
×
H
· ·
离子键和共价键的比较
离 子 键 成键微粒 阴、阳离子 成键本质 静电作用 · 表示方法 Na+ [: ·:Cl ] 共 价 键 原子 共用电子对
注意:NH4+的盐除外。
复习课 第一章 物质结构 元素周期律
(一)原子结构
(二)元素周期表 (三)元素周期律
(一)原子结构知识
原子
A
zX
{ {
原子核
决定 元素 质子z 种类
人教版高中化学必修二第一章第一节 《元素周期表 》课件(共15张PPT)

B.原子的核外电子数
C.原子核内的质子数
√D.原子的中子数
1.原子序数为 x 的元素位于第IA族,那么原子序 数为 x+2 的元素肯定不会在( )
√ A.第 IA 族 B.第ⅢB族 C.第ⅢA族 D.0族
【提示】若x为氢元素,则A正确;若x为锂或钠, 则C正确;若x在第4、5、6、7周期,则B项正确。 故答案为D。
3.第ⅠA族和0族元素的原子序数
4.每周期元素的种数
一、元素周期表的结构 “三短”“四长”;“七主”“七副”“0族和Ⅷ族” 二、元素原子结构与其在周期表中位置的关系.
周期序数=电子层数 主族序数=最外层电子数
原子序数
核外电子排布
周期表中位置
1.不能作为元素周期表中元素排列顺序的依据是
A.原子的核电荷数
螺旋式元素周期表
金字塔式元素周期表
1869年,俄国化学家门捷列夫将 元素按照相对原子质量由小到大 依次排列,制出了第一张元素周 期表,这就是现代元素周期表的 雏形。
第一章 物质结构 元素周期律
第一节 元素周期表
【思考与交流】
周期表的结构
阅读教材P4、5页并结合周期表,讨论以下问题
1.元素周期表的编排原则是什么?周期表有多 少横行,多少纵行,多少族?
A.若X是氢,则Y是氦
√C.若X是氟,则W是硫
B.若Y是氦,则Z是钠 D.若Y是氟,则Z是铝
例.已知某主族元素的原子结构示意图如下,判断 其位于第几周期,第几族?
【提示】X为第4周期,第ⅠA族;Y为第5周期,第 ⅦA族。
【记一记】
周期表的结构
1.原子序数=核电荷数=质子数=核外电子数
2.周期序数=电子层数 主族序数=最外层电子数
【化学】1[1].1.1《元素周期表》教案 (人教版必修2)
第一章物质结构元素周期律第一节元素周期表第一课时●教学目标:使学生了解元素周期表的结构以及周期、族等概念。
●教学重点:元素周期表的结构●教学方法:启发、诱导、阅读、讨论、练习、探究等●教学用具:投影仪、多媒体、元素周期表挂图等●教学过程【引入】丰富多彩的物质世界是由一百多种元素组成的,这一百多种化学元素有什么内在联系呢?那么,有没有一种工具可以把我们已知的一百多种元素之间的这种内在联系很好地表现出来呢?答案是肯定的。
那就是元素周期表,也是我们本节课所要讲的主要内容。
【板书】第一节元素周期表(第一课时)【阅读】请同学们阅读课本第四页的文字,回答:(1)哪一位科学家首先制得了第一张元素周期表?(2)编排第一张元素周期表时,是以什么为编排顺序?现在的周期表又以什么为编排顺序?(3)什么叫原子序数?它和核电核数、质子数有什么关系?【板书】原子序数=核电核数=质子数=核外电子数【探究】你能否将1—18号元素编成一个小小的周期表?要求:1.将性质相似的元素归类。
2.体现元素性质的周期性递变规律。
编制原则:1.将最外层电子数相同的元素归为一列。
2.将相同电子层数相同的元素排在一行。
3.按原子序数的递增编排。
【投影】收集具代表性的由学生所编制的周期表。
用实物投影仪投影到屏幕上。
设计1:设计2:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar H HeLi Be B C N O F Ne Na Mg Al Si P S Cl Ar【讨论】请大家讨论一下以上两种周期表的编排,哪一种更为合理呢?【小结】虽然He的最外层电子数与Be和Mg相同,但He原子的最外层已经排满了,达到了稳定结构,而Be和Mg都没达到稳定结构,因此He的性质与Be和Mg并不相似,反而与同是达到稳定结构的Ne和Ar相似,所以将He、Ne、Ar归为一列更合理。
【讲述】把电子层数目相同的元素,按原子序数递增的顺序从左到右排成横行;再把不同横行中最外层的电子数相同的元素,按电子层数递增的顺序由上而下排成纵行。
高中化学第1章原子结构元素周期律第2节元素周期律和元素周期表第1课时元素周期律课件鲁科版必修第二册
小,则离子半径:C2->D->B+>A2+。由以上分析可知B正确。
重难探究•能力素养全提升
探究一
微粒半径大小比较
[问题探究]
卤水学名为盐卤,是由海水或盐湖水制盐后,残留于盐池内的母液。蒸发冷
却后析出氯化镁结晶,称为卤块。盐卤是我国北方制豆腐常用的凝固剂,能
使豆浆中的蛋白质凝结成凝胶,再挤出多余的水分便可形成豆腐。用盐卤
作凝固剂制成的豆腐,硬度、弹性和韧性较强,称为老豆腐,也称北豆腐、
r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。
(2)相同最外层电子数——“序大径大”。
①规律:同一主族元素原子最外层电子数相同,从上到下,原子半径逐渐
增大。
②举例:r(Li)<r(Na)<r(K)<r(Rb)<r(Cs)。
(3)相同元素。
①同种元素的原子和离子半径——“阴大阳小,原子中间”。
D.原子最外层电子数:A>B>D>C
答案 B
解析 原子序数=核电荷数=原子核外电子数,aA2+、bB+、cC2-、dD-的电子层
结构相同,即核外电子数相同,根据离子电荷的多少及正负可推知原子的电
子层数:A=B>C=D,原子序数:a>b>d>c,原子最外层电子数:B<A<C<D。当
电子层数相同时,核电荷数越多,原子半径越小,结合电子层数A=B>C=D,所
[自我检测]
判断下列说法是否正确,正确的画“√”,错误的画“×”。
新教材人教版高中化学必修第一册 全册精品教学课件(共1079页)
3.分散系及其分类
(1)分散系的定义 分 散 系 : 将 __一__种__(或__多__种__)_ 物 质 以 粒 子 形 式 分 散 到 __另__一__种__(或__多__种__)___物质里所形成的体系,称为分散系。
(2)分散系的组成 分散系中被__分__散__成__粒__子___的物质叫做___分__散__质______,另一 种物质叫做___分__散__剂______。
(6)直径介于 1~100 nm 之间的粒子称为胶体( ) (7)氢氧化铁胶体为无色透明的液体,能产生丁达尔效应( ) (8)丁达尔效应可用来鉴定溶液与胶体( )
[答案] (1)× (2)√ (3)× (4)× (5)× (6)× (7)× (8)√
2.清晨,阳光射入密林中的现象如图。请分析其中的道理, 然后完成下列问题。
(2)研究对象 ①同素异形体是指单质,不是指化合物。 ②互为同素异形体的不同单质是由同一种元素组成的,构成 它们的原子的核电荷数相同。 (3)同素异形体的“同”“异”的含义 ①“同”——指元素相同; ②“异”——指形成单质不同,结构不同,性质有差异。 (4)同素异形体的“结构决定性质” ①同素异形体的结构不同,性质存在差异。 ②物理性质不同,化学性质有的相似,有的相差较大。
(3)胶体的性质
1.判断正误(正确的打“√”,错误的打“×”) (1)互为同素异形体的物质的性质完全相同( ) (2)碳酸钾是钾盐,也是碳酸盐( ) (3)根据组成元素的差异,可以把物质分为纯净物和混合物( ) (4)CuSO4·5H2O 是混合物( ) (5)蔗糖溶液、淀粉溶液属于溶液,云、雾、烟属于胶体( )
(2)Fe(OH)3 胶体的制备
△ 制备原理:___F_e_C__l3_+__3_H_2_O_=__=_=_=_=_F_e_(O__H_)_3_(胶__体__)_+__3_H_C__l ____ 具体操作:往烧杯中注入 25 mL 蒸馏水,将烧杯中的蒸馏水 加热至沸腾,向沸水中逐滴加入 5~6 滴___饱__和___F_e_C_l_3 溶__液_____, 继续煮沸至溶液呈____红__褐__色___________,停止加热。
化学:1.1.1《元素周期表-周期表结构》课件
决定
最外层电子数
。
第 一 节
1829 年,德国科学家德贝莱纳在对当时已知的54种元素进行了系统的分析研究之后,提
元 出了元素的“三元素组”规则。他发现了几组元素,每组都有三个化学性质相似的成员。 素
周
并且,在每组中,居中的元素的原子量,近似于两端元素原子量的平均值。 如锂钠钾、
期 表
钙锶钡、磷砷锑、氯溴碘。
元素周期表的由来
B=11
Al=27.4
?=68
Ur=116 Au=197?
C=12
Si=28
?=70
Sn=118
N=14
P=31
As=75 Sb=122 Bi=210
O=16
S=32
Se=79.4 Te=128?
F=19
Cl=35.5
Br=80
I=127
Li=7
Na=23
K=39
Rb=85.4 Cs=133 Tl=204
①七个横行,七个周期。其中:三个短周期(1、2、 ),三个长周期(4、5、6),一个不完全周期(7)
②每一周期元素电子层数相同,从左到右原子序数递增。
③周期序数=电子层数
类别 短周期
长周期 不完全周期
周期序数 1 2 3 4 5 6 7
包括元素种数
2 8 8 18 18 32 26
稀有气体元素原子序数
十分相似,总称镧系元素。 第7周期中,89号元素锕(Ac)到103号元素铹 (Lr),共15种元素,它们原子的电子层结构和
性质也十分相似,总称锕系元素。
含元素最多的周期是哪一个?
4、课堂小结
元素周期表的结构: 七主七副七周期, Ⅷ族零族镧锕系。
元素原子结构与其在周期表中位置的关系:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
个 族 (8、9、10三个纵行共同组成一个 族 )。
(2)周期表中每一格的信息(以氧元素为例)。
3.(1)钠原子的原子结构示意图 离子的离子结构示意图是
是,钠 ,二者在结构
核电荷数(质子数)相同 上的相同点是 ,不同点是 电子层数、核外电子数不同 。阳离子的质子数与核外电 子数的关系是 质子数=核外电子数+所带电荷数 。
原子序数= 核电荷数 = 质子数 = 核外电子数 。
(2)编排原则 电子层数
原子序数
最外层电子数 电子层数
[对应练习]
1.下列说法正确的是(
)
A.我们常用的元素周期表中元素排序的依据是元素的相对 原子质量 B.元素周期表中同一横行元素原子的电子层数相同 C.元素周期表有16个纵行
D.元素周期表已发展成一个稳定的形式,它不可能再有新
(2)氯原子的原子结构示意图是 子的离子结构示意图是
,氯离 ,二者在结构上
核电荷数、电子层数相同 的相同点是 ,不同点 是 核外电子数不同 。阴离子的质子数与核外电子数的关系 是 质子数=核外电子数-所带电荷数 。
4.判断正误: (1)相对原子质量就是一个原子的实际质量。( (2)碳12原子是指碳原子的相对原子质量是12。( ) )
数-10。
(2)主族和副族的位置关系 主族后副族交叉“行”,遇“Ⅲ”就交换。 (1)第ⅡA族与第ⅢB族,即第2、3列。 (2)第ⅡB族与第ⅢA族,即第12、13列。
(1)为什么将Li、Na、K等元素编在元素周期表的同一个主
族?
答:同一主族元素的原子最外层电子数相同而电子层数不同 ,Li、Na、K等元素的原子最外层电子数都为1,且电子层数依 次增加。 (2)元素周期表中所含元素种类最多的是哪一个族? 答:元素周期表中所含元素种类最多的为第ⅢB族,因在第6 和第7周期包括了镧系和锕系各15种元素,共计32种元素。
第一节 第1课
元素周期表 元素周期表
[目标定位 ]
1.了解元素周期表的发展历程,认识对元素
科学分类的意义。2.了解元素周期表的结构,能描述元素周 期表的编排原则及周期和族的概念。3.掌握原子结构与元素 在周期表中位置的关系,能判断元素在周期表中的位置。
1.初中学过的元素及相关概念 (1)元素:具有相同 核电荷数 (或 核内质子数 )的一类原子的 总称。
(2)相对原子质量:国际上以 碳12原子质量的1/12 作为标准, 其它原子的质量 跟它相比所得到的比值,符号为 Ar 。
(3)原子序数:按元素原子的 核电荷数 编号,且原子序数=
核电荷数 =
递增的顺序给元素 核外电子数 。
2.初中学过的元素周期表简介 (1)元素周期表的结构:元素周期表有7个横行,18个纵 周期 ,每一个纵行叫做一 行。每一个横行叫做一个
D.C、N、O的原子序数依次增加
【答案】 A
一、元素周期表的发展历程 1.第一张元素周期表 门捷列夫
2.元素周期表形式的完善 (1)演变:为未知元素留下的空位先后被填满。 (2)现行元素周期表的编排依据:由相对原子质量改为 原子的核电荷数 。 3.现行元素周期表的编排原则 (1)原子序数 ①含义:按照元素在 周期表中 的顺序给元素的编号。 ②原子序数与原子结构的关系:
【解析】 同主族元素原子最外层电子数相同,A为 He是
稀有气体子序数为8的元素的原子结构示意图,并确定其 在周期表中的位置。
探究点一 1.周期
元素周期表的结构
(1)列序数与主族和副族序数的关系 列序数<8,主族和副族的族序数=列序数;列序数= 8或 9或10,为第Ⅷ族;列序数>10,主族和副族的族序数=列序
C.第ⅠA族的元素全部是金属元素
D.短周期是指第一、二、三、四周期 【答案】 A
探究点二
元素周期表在元素推断中的应用
1.利用元素的位置与原子结构的关系推断。 (1)应用关系:
等式一:周期序数=电子层数
等式二:主族序数=最外层电子数 等式三:原子序数=核电荷数=核外电子数 等式四:主族元素的最高正价=族序数;最低负价的绝对 值=8-族序数
(3)最外层电子数是2的元素一定为ⅡA族的元素吗? 答:不一定。可能是第ⅡA族元素,可能是稀有气体元素 He,也可能是过渡元素。
1.1869年,俄国化学家门捷列夫制作出了第一张元素周
期表,揭示了化学元素间的内在联系,成为化学史上的重要 里程碑之一。下列有关元素周期表的说法正确的是( A.元素周期表含元素最多的族是第ⅢB族 B.元素周期表有18个族 )
(2)特点:同一周期中,元素原子的 电子层数
等于周期序数。 (3)分类
一、二、三 四、五、六、七
相同,且
2.族(纵行) (1)数目:元素周期表中有 18 个纵行, 16 个族。 (2)特点:同一主族中元素原子的 最外层电子数 相同,且
等于其主族族序数。
(3)分类 7 ⅥA 7
ⅢB 8、9、10 18 8 2 A
A
(4)常见族的元素的特别名称 第ⅠA族(除氢): 元素; 碱金属 元素;第ⅦA族: 卤族
稀有气体元素。 0族:
[对应练习] 3.在元素周期表中,第一、二、三周期中所含元素种数 分别为( )
A.2、8、8
C.2、8、18
B.8、8、18
D.8、18、18
【解析】 元素周期表中一~六周期的元素种类数分别为 2 、8、8、18、18、32,故A正确。 【答案】 A
的变化了 【答案】 B
2.已知元素的原子序数,不可以推断元素原子的( A.质子数 C.核外电子数 B.核电荷数 D.离子所带的电荷数
)
【解析】 据原子序数=核电荷数=质子数=核外电子数,
故选D。 【答案】 D
二、元素周期表的结构 1.周期(横行) (1)数目:现行的元素周期表有 7 个横行,即 7 个周期。
(3) 同一元素的核电荷数、质子数、核外电子数和相对原
子质量都相同。( ) ) ) (5)×
(4)C元素的原子序数为12。(
(5)符号“O”只表示该元素为氧元素。( 【答案】 (1)× (2)√ (3)× (4)×
5.(2014· 济南中考)如图为元素周期表的一部分,下列说法
错误的是(
)
A.碳元素只能形成一种单质 B.氮原子的核外电子数为7 C.氧的相对原子质量为16.00
