高中化学酸碱和盐的溶解性表大全
部分酸、碱和盐的溶解性表(20℃)
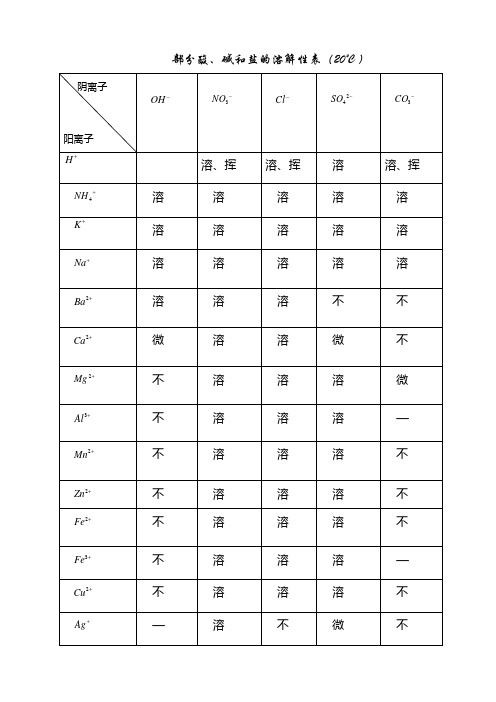
阴离子
阳离子
溶、挥
溶、挥
溶
溶、挥
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
不
不
微
溶
溶
微
不
不
溶
溶
溶
微
不
溶
溶
溶
—
不
溶溶Biblioteka 溶不不溶
溶
溶
不
不
溶
溶
溶
不
不
溶
溶
溶
—
不
溶
溶
溶
不
—
溶
不
微
不
注:“溶”表示那种物质可溶于水;“不”表示那种物质不溶于水;“微”表示微溶于水;“挥”表示挥发性,“—”表示那种物质不存在或遇到水就分解了。
必记知识点:
1.有色沉淀:
——蓝色 ——红褐色
2.不溶于硝酸的白色沉淀:
,
3.所有的硝酸盐,所有的钠盐,所有的钾盐,所有的铵盐都是溶于水的。
酸碱盐的溶解性口诀大全

酸碱盐溶解性表顺口溜:钾钠铵硝皆可溶、盐酸不溶银亚汞;硫酸不溶钡和铅,碳磷酸盐多不溶;多数酸溶碱少溶,只有钾钠铵钡钙。
酸碱盐溶解性表
OH-NO3-Cl-SO4 2-CO3 2-H+H2O(不属于酸碱盐)溶、挥(硝酸)溶、挥(盐酸)溶(硫酸)溶、挥(碳酸)NH4+溶、挥(氨水,氢氧化铵)溶溶溶溶K+溶(苛性钾)溶溶溶溶Na+溶(氢氧化钠)溶溶溶溶Ba 2+溶溶溶不不Ca 2+微(熟石灰)溶溶微不Mg 2+不溶溶溶微Al 3+不溶溶溶-Mn 2+不溶溶溶不Zn 2+不溶溶溶不Fe 2+不溶溶溶不Fe 3+不溶溶溶-Cu 2+不溶溶溶-Ag+-溶不微不溶解性顺口溜
酸碱盐溶解性口诀
酸类多数都易溶,硅酸微溶是独种。
碱类钾钠钡铵溶,钙是微溶余不溶。
硫酸铅钡沉水中,微溶钙银与亚汞。
盐类溶有钾钠铵,外加易溶硝酸盐。
碳酸能溶钾钠铵,其余俱沉水中间。
盐酸沉淀银亚汞,还有微溶氯化铅。
适用于初中的顺口溜
钾钠铵盐硝酸盐。
放入水中易溶完。
硫酸盐类也易溶。
但要除去钙钡银。
盐酸盐除银亚汞。
碳酸、磷酸盐只有钾钠铵溶。
酸、碱、盐的溶解性表(20℃)
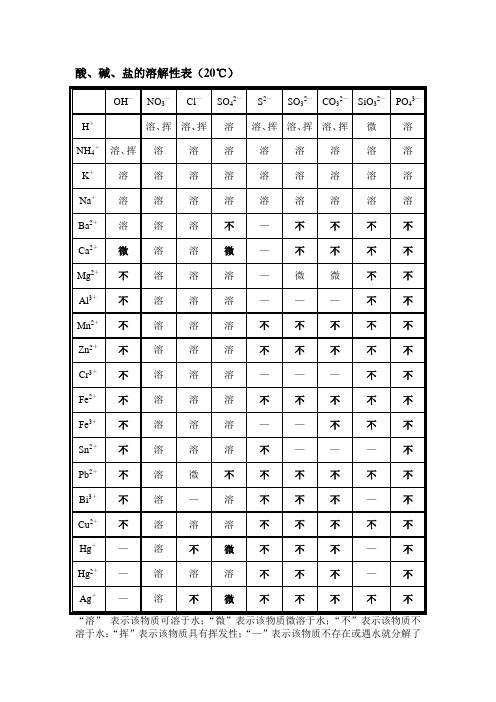
OH—
NO3—
Cl—
SO42—
S2—
SO32—
CO32—
SiO32—
PO43—
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
溶、挥
微
溶
NH4+
溶、挥
溶
溶
溶
溶
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
—
不
不
不
不
Ca2+
微
溶
溶
微
—
不
不
不
不
Mg2+
不
溶
溶
溶
—
微
微
不
不
Al3+
不
溶
溶
溶
—
—
—
不
不
Mn2+
不
溶
溶
溶
不
不
不
不
不
Zn2+
不
溶
溶
溶
不
不
不
不
不
Cr3+
不
溶
溶
溶
—
—
—
不
不
Fe2+
不
溶
溶
溶
不
不
不
不
不
Fe3+
不
溶
溶
溶
—
—
不
不
不
部分酸、碱和盐的溶解性表(室温)

部分酸、碱和盐的溶解性表(室温)
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“——”表示那种物质不存在或遇到水就分解了。
背诵口诀:1.(铵、钾、钠、钡)碱可溶,
2.硝盐入水影无踪。
3.碳酸(铝、铁、铜)不存,
4.(镁)在碳酸是微溶。
5.硫酸(钙、银)微(钡)不,
6.氯盐只有(银)不溶。
7.碱(银)室温入水分,
8.碳酸(钾、钠、铵)可溶。
注:①“碱”指的是OH−,即氢氧根离子。
②口诀中未标注Ca(OH)2是微溶。
③硝盐指的是硝酸根离子与金属(铵根)离子组成的盐。
④括号内的物质均为金属离子。
⑤氯盐指的是氯离子与金属(铵根)离子组成的盐。
释义:1.氢氧化铵、氢氧化钾、氢氧化钠、氢氧化钡都可以溶于水。
2.硝酸根离子与金属(铵根)离子组
成的盐都可以溶于水。
(仅指上表)
3.碳酸铝、碳酸铁、碳酸铜在水溶液
中是不存在的。
4.碳酸镁在水中是微溶。
5.硫酸钙、硫酸银在水中是微溶,硫
酸钡不溶于水。
6.在氯离子与金属(铵根)离子组成
的盐中只有氯化银不溶于水。
7.氢氧化银在室温下遇水会分解。
8.碳酸钾、碳酸钠、碳酸铵溶于水。
酸碱盐的溶解性表

说明:此为2(rc时的情况。
"溶"表示那种物质可溶于水, "不"表示不溶于水,"微"表示微溶于水,"挥"表示挥发性,表示那种物质不存在或遇到水就分解了背诵口诀1 •钾钠鞍盐都可溶,氯化物不溶氯化银硫酸盐钙银微溶换不溶硝酸盐遇水影无踪钾钠锁钙碱可溶红褐铁,蓝絮铜其它沉淀白色呈注:4初中用够了.红褐铁,代表铁盐沉淀为红褐色[fe(oh)2氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状沉淀。
2•氯化银【不溶酸】,碳酸钙,碳酸换,硫酸顿【不溶酸】,氢氧化铝.氢氧化镁,为白色沉淀。
氢氧化铁〔红褐色〕氢氧化铜〔蓝色〕说明【】内为前一物质的特点2•钾钠镀盐全都溶其他全都不能溶AgCL BaSO4酸也不溶-氧气的性质:4〕单质与氧气的反响:〔化合反响〕1. 镁在空气中燃烧:2Mg + 02点燃2MgO2. 铁在氧气中燃烧:3Fe + 202点燃Fe3O43.铜在空气中受热:2Cu + 02加热2CuO4.铝在空气中燃烧:4A! + 302点燃2AI2O35.氢气中空气中燃烧:2H2 + 02点燃2H2O6•红磷在空气中燃烧〔研究空气组成的实验〕:4P + 502点燃2P2O57. 硫粉在空气中燃烧:S + 02点燃SO28. 碳在氧气中充分燃烧:C+O2点燃CO29. 碳在氧气中不充分燃烧:2C + 02点燃2CO(2)化合物与氧气的反响:10. 一氧化碳在氧气中燃烧:2CO + 02点燃2CO211. 甲烷在空气中燃烧:CH4 + 202点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 302点燃2CO2 +3H2O⑶氧气的来源:13 •玻义耳研究空气的成分实验2HgO加热Hg+ 02 t14 •加热高猛酸钾:2KMnO4协热K2MnO4 + MnO2 + 02 t〔实验室制氧气原理A15 •过氧化氢在二氧化猛作催化剂条件下分解反响:H2O2MnO22H2O+ 02 t〔实验室制氧气原理2]二自然界中的水:电2H2T+ 02 t17. 生石灰溶于水:CaO + H2O == Ca(OH)218. 二氧化碳可溶于水:H2O + CO2==H2CO319.镁在空气中燃烧:2Mg + 02点燃2MgO 21.氢气复原氧化铜:H2 + CuO加热Cu + H2O 22.镁复原氧化铜:Mg + CuO加热Cu + MgO四、碳和碳的氧化物:⑴碳的化学性质23.碳在氧气中充分燃烧:C + 02点燃CO2 24 .木炭复原氧化铜:C+ 2CuO高温2Cu + CO2t 25.焦炭复原氧化铁:3C+ 2Fe203高温4Fe + 3CO2T⑵煤炉中发生的三个反响:〔几个化合反响〕26 •煤炉的底层:C + 02点燃CO2 27.煤炉的中层:CO2 + C高温2CO 28.煤炉的上部蓝色火焰的产生:2CO + 02点燃2CO2⑶二氧化碳的制法与性质:29 •大理石与稀盐酸反响〔实验室制二氧化碳〕:CaCO3 + 2HC! == CaC!2 + H2O + CO2t 30・碳酸不稳定而分解:H2CO3 == H2O + CO2t 31・二氧化碳可溶于水:H2O +CO2== H2CO332 •高温熾烧石灰石〔工业制二氧化碳〕:CaCO3高温CaO + CO2t 33 •石灰水与二氧化碳反响[鉴别二氧化碳〕:Ca(OH)2 + CO2 === CaCO3 1+ H2O⑵金属单质+盐+氢气 〔詈换反⑷一氧化碳的性质:34 . 一氧化碳复原氧化铜:CO + CuO 加热Cu + CO2 35. 一氧化碳的可燃性:2CO + 02点燃2CO2五燃料及其利用:37.甲烷在空气中燃烧:CH4 + 202点燃CO2 + 2H2O 38 •酒精在空气中燃烧:C2H5OH + 302点燃2CO2 + 3H2O 39.氢气中空气中燃烧:2H2 + 02点燃2H2O/u 金属(1)金属与氧气反响:40・镁在空气中燃烧:2Mg + 02点燃2MgO 41・铁在氧气中燃烧:3Fe + 202点燃Fe3O4 42. 铜在空气中受热:2Cu + 02加热2CuO43. 铝在空气中形成氧化膜:4A! + 302 = 2AI2O344. 锌和稀硫酸 Zn + H2SO4 = ZnSO4 + H2t 45. 铁和稀硫酸 Fe + H2SO4 = FeSO4 + H2t 46. 镁和稀硫酸 Mg + H2SO4 = MgSO4 + H2t 47. 铝和稀硫酸2AI +3H2SO4 = A!2(SO4)3 +3 H2!其它反响:Na2CO3辖幕醫Zn+ 2HC_n n znc_2+ H2T萍幕醫Fe+ 2HC一n n艮一2+H2T棘幕鬣Mg+ 2HC一n h Mgc_2+ H2T・茄君帝聆嬲2A_+ 6HC一nu2A_C一3+ 3 H2T二的翻般网+即〔两蒔〕..................鬓專+器 B 1B^8 - Fe + CCSO4n n FeSO4 +Cu盘〔匕霍+的a ...即+釧川〔总〔2〕糜+的醫喜....... 弱+为 56・ 咕e2O3+6HC一HH2Fec_3+3H257・$203 + 3H2SO4n n+ 3H2O58・ - a c o+ 2HC_Hucuc一2 + H2O59・ ^s s ss -aco+H2SO4n n CUSO4 + H.〔〕嬲+気弱;s ^s7二一(4)另一种酸61. 盐酸和氢氧化钙反响:2HCI + Ca(OH)2 == CaCI2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCI + AI(OH)3 == A/C/3 + 3H2O63. 硫酸和烧碱反响:H2SO4 + 2NaOH == Na2SO4 + 2H2O 64 .大理石与稀盐酸反响:CaCO3 + 2HC! == CaC!2 + H2O + CO2t 65碳酸钠与稀盐酸反响:Na2CO3 + 2HCI = = 2NaC! + H2O+ CO2t 66 •碳酸氢钠与稀盐酸反响:NaHCO3 + HC!== NaC! + H2O + CO2t67.硫酸和氯化坝溶液反响:H2SO4 + BaCI2== BaSO4 !+ 2HC!2、碱的化学性质⑴碱+非金属氧化物 .............. 盐+水68 •苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69 •苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O盐+水74.铁和,铜溶液另一种酸70 •苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71 •消石灰放在空气中变质:Ca(OH)2 + CO2二二CaCO3 I + H2O72.消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 1+ H2O〔3〕碱+盐 ......... 另_种碱+另一种盐73.氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3l+ 2NaOH 3.盐的化学性质(1)盐〔溶液〕+金属单质・……另一种金属+另一种盐 75碳酸钠与稀盐酸反响:Na2CO3 + 2HCI==2NaCI + H2O + CO2t碳酸氢钠与稀盐酸反响:NaHCO3 + HC/== NaCI + H2O + CO2t⑶盐+碱 ............ 另一种碱+另一种盐76.氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3!+ 2NaOH⑷盐+盐两种新盐77•氯化钠溶液和硝酸银溶液:NaCI + AgNO3二二AgClJ +〔2〕碱 +⑵盐+NaNO3 78・硫酸钠和氯化锁:Na2SO4 + BaC/2 == BaSO4l + 2NaC!钾钠硝钱均可溶.盐酸盐不溶AgCI.硫酸盐不溶BaSO4,碳•溶解性口诀一钾钠链盐溶水快,◎硫讎除去坝铅钙。
酸碱盐可溶性表及口诀

酸碱盐可溶性表及口诀溶解性表:口诀酸碱盐溶解性表说明:此为20℃时的情况。
"溶"表示那种物质可溶于水,"不"表示不溶于水,"微"表示微溶于水,"挥"表示具有挥发性,"---"表示那种物质不存在或遇到水就分解了。
口诀一:钾,钠,铵盐,硝酸盐,都能溶解水中间.盐酸盐不溶银亚汞,硫酸盐不溶钡和铅, 微溶有钙银.碳酸盐多不溶,溶者只有钾钠铵,碳酸氢溶镁微溶.钾,钠,铵,钡碱都溶氢氧化钙是微溶挥发者有氢氧铵,硝酸、氯化、碳酸氢口诀二:钾钠铵硝酸盐溶水快,①硫酸盐除去钡铅钙。
②氯化物不溶氯化银,硝酸盐溶液都透明。
③口诀中未有皆下沉。
④注: ①钾钠铵盐都溶于水; ②硫酸盐中只有硫酸钡、硫酸铅、硫酸钙不溶; ③硝酸盐都溶于水; ④口诀中没有涉及的盐类都不溶于水;口诀三:钾、钠、铵盐、硝酸盐; (钾盐、钠盐、铵盐、硝酸盐均可溶于水)氯化物除银、亚汞; (氯化物除氯化银、氯化亚汞外均可溶于水)硫酸盐除钡和铅; (硫酸盐除硫酸钡、硫酸铅外均可溶于水)碳酸、磷酸盐,只溶钾、钠、铵。
说明:以上四句歌谣概括了8类相加在水中溶解及不溶的情况。
口诀四:钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶。
口诀五:钾、钠、硝酸溶, (钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞, (盐酸盐里除氯化银和氯化亚汞外都溶。
)再说硫酸盐,不容有钡、铅, (硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐, (碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵, (只有相应的钾盐、钠盐和铵盐可溶)最后说碱类,钾、钠、铵和钡。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住。
口诀六:钾钠铵盐硝酸盐,完全溶解不困难。
氯化亚汞氯化银,硫酸钡和硫酸铅。
生成沉淀记心间,氢硫酸盐和碱类。
高中化学酸、碱和盐的溶解性表大全
溶
溶
溶
溶
微
微
不
不
Al3﹢
不
溶
溶
溶
一
一
一
不
不
Mn2﹢
不
溶
溶
溶
不
不
不
不
不
Zn2﹢
不
溶
溶
溶
不
不
不
不
不
Cr3﹢
不
溶
溶
溶
一
一
一
不
不
Fe2﹢
不
溶
溶
溶
不
不
不
不
不
Fe3﹢
不
溶
溶
溶
一
一
一
不
不
Sn2﹢
不
溶
溶
溶
不
一
一
一
不
Pb2﹢
不
溶
微
不
不
不
不
不
不
Bi3﹢
不
溶
一
溶
不
不
不
一
不
Cu2﹢
不
溶
溶
溶
不
不
不
不
不
Hg﹢
一
溶
不
微
不
不
不
一
不
Hg2﹢
一
溶
溶
溶
不
不
不
一
不
Ag﹢
一
溶
不
微
不
不
不
不
不
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“一”表示那种物质不存在或遇到水就分解了。
酸碱盐的溶解性表口诀高中

酸碱盐的溶解性表口诀高中酸碱盐的溶解性表口诀是学习酸碱盐的基础,在高中物理化学中有着重要的作用。
一般来说,酸碱盐的溶解性会与溶质的性质,溶解介质的性质,溶液的倍量有关。
那么,我们需要记住酸碱盐的溶解性表口诀,以便能够正确地判断某一酸碱盐是否能够溶于某一介质中,更加深入地学习酸碱盐的方面。
在高中物理化学中,酸碱盐的溶解性表口诀是学习酸碱盐的一个重要知识点,可以记住以下口诀:溶于水的有HCl、NaOH、KNO3、NaHCO3,而溶于醇的有HNO3、H2SO4、C2H5OH、NaClO。
下面我们来看看酸碱盐的溶解性表口诀的一些具体内容:一、 HCl、NaOH、KNO3、NaHCO3都能溶于水,其中HCl是一种强酸,NaOH是一种强碱,而KNO3和NaHCO3则都是碱性无机盐。
二、 HNO3、H2SO4、C2H5OH、NaClO都能溶于醇,其中HNO3是一种强酸,H2SO4是一种强碱,而C2H5OH和NaClO则都是碱性无机盐。
三、汞是一种重要的金属,也能够溶于稀硫酸,这是一种强酸,它的溶解度受温度的影响,随着温度的升高,汞的溶解度也会增加。
四、铝能够溶于硫酸铝,硫酸铝是一种弱酸,属于酸性无机盐,它的溶解度也受温度的影响,随着温度的升高,铝的溶解度也会增加。
五、碳酸钠可以溶于水,也可以溶于乙醇,碳酸钠是一种弱碱,属于碱性无机盐,它的溶解度受温度的影响,随着温度的升高,碳酸钠的溶解度也会增加。
六、氯化氢(HCl)可以溶于水,也可以溶于乙醇,它属于强酸,它的溶解度受温度的影响,随着温度的升高,氯化氢的溶解度也会增加。
七、氢氧化钙(Ca(OH)2)可以溶于水,也可以溶于乙醇,它属于强碱,它的溶解度受温度的影响,随着温度的升高,氢氧化钙的溶解度也会增加。
以上就是高中物理化学中酸碱盐的溶解性表口诀的一些具体内容,希望大家能够记住,以便在学习酸碱盐的方面更加深入地理解。
从口诀中我们可以得知,溶解在酸碱盐中是非常重要的,它的溶解性受到溶质的性质,溶解介质的性质,溶液的倍量以及温度等因素的影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶
溶
溶
溶
微
微
不
不
Al3﹢
不
溶
溶
溶
一
一
一
不
不
Mn2﹢
不
溶
溶
溶
不
不
不
不
不
Zn2﹢
不
溶
溶
溶
不
不
不
不
不
Cr3﹢
不
溶
溶
溶
一
一
一
不
不
Fe2﹢
不
溶
溶
溶
不
不
不
不
不
Fe3﹢
不
溶
溶
溶
一
一
一
不
不
Sn2﹢
不
溶
溶
溶
不
一
一
一
不
Pb2﹢
不
溶
微
不
不
不
不
不
不
Bi3﹢
不
溶
一
溶
不
不
不
一
不
Cu2﹢
不
溶
溶
溶
不
不
不
不
不
Hg﹢
一
溶
不
微
不
不
不
一
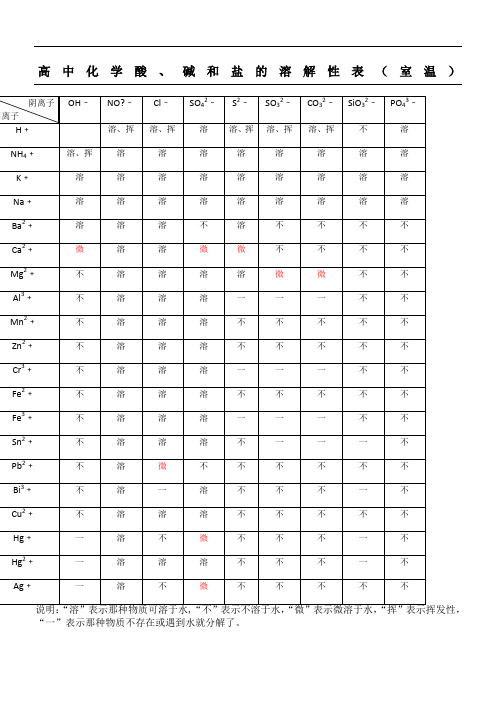
高中化学酸、碱和盐的溶解性表(室温)
阴离子
阳离子
OH﹣
NO?﹣
Cl﹣
SO42﹣
S2﹣
SO32﹣
CO32﹣
SiO32﹣
PO43﹣
H﹢
溶、挥
溶、挥
溶
溶、挥
溶、挥
溶、挥
不
溶
NH4﹢
溶、挥
溶
溶
溶
溶
溶
溶
溶溶Leabharlann K﹢溶溶溶
溶
溶
溶
溶
溶
溶
Na﹢
溶
溶
溶
溶
溶
溶
溶
溶
溶
Ba2﹢
溶
溶
溶
不
溶
不
不
不
不
Ca2﹢
微
溶
溶
微
微
不
不
不
不
Mg2﹢
不
Hg2﹢
一
溶
溶
溶
不
不
不
一
不
Ag﹢
一
溶
不
微
不
不
不
不
不
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“一”表示那种物质不存在或遇到水就分解了。
