2021版高考化学一轮复习阶段滚动检测(二)(含解析)鲁科版
高三化学一轮复习45分钟滚动提升训练卷(2) 鲁科版
45分钟滚动提升训练卷(二)[考查范围:第三~第五单元分值:100分]一、选择题(本题共7道小题,每题6分,共42分。
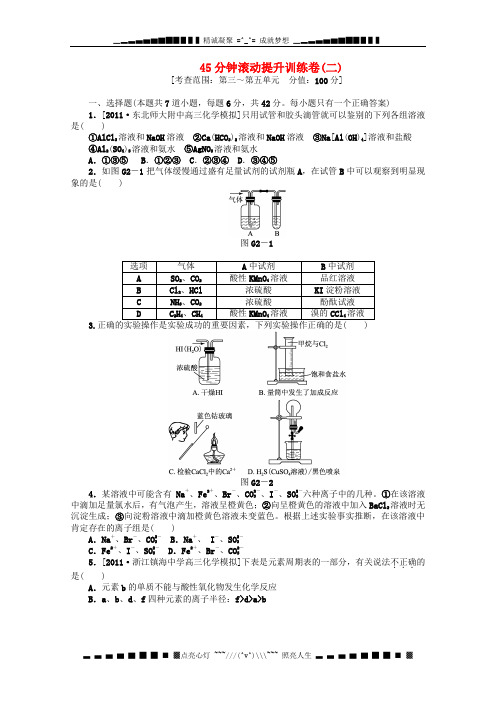
每小题只有一个正确答案)1.[2011·东北师大附中高三化学模拟]只用试管和胶头滴管就可以鉴别的下列各组溶液是( )①AlCl3溶液和NaOH溶液②Ca(HCO3)2溶液和NaOH溶液③Na[Al(OH)4]溶液和盐酸④Al2(SO4)3溶液和氨水⑤AgNO3溶液和氨水A.①③⑤ B.①②③C.②③④D.③④⑤2.如图G2-1把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )图G2-13.图G2-24.某溶液中可能含有Na+、Fe2+、Br-、CO2-3、I-、SO2-3六种离子中的几种。
①在该溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③向淀粉溶液中滴加橙黄色溶液未变蓝色。
根据上述实验事实推断,在该溶液中肯定存在的离子组是( )A.Na+、Br-、CO2-3 B.Na+、 I-、SO2-3C.Fe2+、I-、SO2-3 D.Fe2+、Br-、CO2-35.[2011·浙江镇海中学高三化学模拟]下表是元素周期表的一部分,有关说法不正确...的是( )A.元素b的单质不能与酸性氧化物发生化学反应B.a、b、d、f四种元素的离子半径:f>d>a>bC .元素c 的氧化物既能与酸反应又能与碱反应D .a 、c 、e 的最高价氧化物对应水化物之间能够相互反应6.下列关系图中,A 是一种正盐,D 的相对分子质量比C 的相对分子质量大16,E 是酸。
当X 无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已删去) A X,B Y,C Y,D Z,E下列推断的结论和叙述中错误的是( )A .A 是(NH 4)2SO 4B .当X 是强酸时,A 、B 、C 、D 、E 均含同一种元素,E 是H 2SO 4C .当X 是强碱时,A 、B 、C 、D 、E 均含同一种元素,E 是HNO 3D .由B→C 可能发生的反应为:4NH 3+5O 2=====催化剂△4NO +6H 2O7.下列表述Ⅰ和Ⅱ都正确,且存在因果关系的是( )8.(14分)我国是氧化铝生产大国,工业上每生产1 t 氧化铝将排出1~2 t 赤泥,赤泥大量堆积会对环境造成严重污染。
高优指导高三化学一轮复习 第2单元 化学物质及其变化单元质检卷 鲁科版-鲁科版高三全册化学试题

化学物质及其变化(时间:45分钟满分:100分)一、选择题(本题共10小题,每小题5分,共50分,每小题只有一个选项符合题目要求)1.垃圾分类有利于资源回收利用。
下列垃圾归类不合理的是( )A B C D废荧光灯垃圾废易拉罐废塑料瓶不可再生废纸管垃圾分类答案:B解析:易拉罐大多是铝合金或铁合金制品,铝、铁等金属可回收重新利用,为可回收物,A项正确;塑料瓶大部分是聚对苯二甲酸乙二酯(聚酯)(PET)或聚乙烯(PE)制品,回收可用于再生造粒、重新制造PET瓶或纺丝制造纤维等,故为可回收物,B项错误;荧光灯管中含有微量汞,如果处理不当,会危害人体健康,若渗入地下水,对土壤、水源等造成危害,因此属于有害垃圾,C项正确;纸张的主要成分为植物纤维素,故不可再生,废纸是可燃垃圾,D项正确。
2.(2015济南质检)用下图表示的一些物质或概念间的从属关系中不正确的是( )X Y ZA 氧化物化合物纯净物B 胶体分散系混合物C 金属氧化物碱性氧化物氧化物D 离子化合物电解质化合物答案:C解析:从题图中可看出,Z包含Y,Y包含X。
纯净物可以分为单质和化合物,化合物又可以分为酸、碱、盐、氧化物等,A项正确;分散系是一种混合物,它可以分为溶液、胶体和浊液,B项正确;氧化物从性质上可以分为酸性氧化物和碱性氧化物,碱性氧化物包括大多数金属氧化物,但是有部分金属氧化物不属于碱性氧化物,如Al2O3属于两性氧化物,Mn2O7属于酸性氧化物,C项不正确;化合物可分为电解质和非电解质,离子化合物一定属于电解质,D项正确。
3.(2015重庆理综)中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是( )A.用胆矾炼铜B.用铁矿石炼铁C.烧结黏土制陶瓷D.打磨磁石制指南针〚导学号95380307〛答案:D解析:胆矾为CuSO4·5H2O,冶炼得到Cu的过程中发生氧化还原反应,A项错误;铁矿石为铁的化合物,炼铁也需要发生氧化还原反应,B项错误;烧制陶瓷过程中发生复杂的物理和化学变化,C项错误;打磨磁石制指南针的过程中没有化学变化,D项正确。
2021版高考化学一轮复习阶段滚动检测一含解析鲁科版

高考化学一轮复习:阶段滚动检测(一)(第1、2章)(90分钟100分)一、选择题(本题包括16小题,每小题3分,共48分)1.中国不少古诗词清晰地描绘了当时人民的生活和社会的发展,如刘禹锡的《浪淘沙》:“日照澄洲江雾开,淘金女伴满江隈。
美人首饰侯王印,尽是沙中浪底来。
”下列有关本诗中蕴含的化学知识正确的是( )A.“沙中浪底来”指的是金的氧化物B.淘金原理与化学上的萃取一致C.雾的分散质粒子直径范围是10-9~10-7cmD.由沙子到计算机芯片发生了还原反应【解析】选D。
金的化学性质稳定,可以以单质的形式存在于自然界中,“沙中浪底来”指的是金单质,故A 错误;沙里淘金的原理是金子的密度比沙子的密度大得多,在水的冲击下沙粒被水流带走,而金就留在容器里,不是萃取原理,故B错误;雾属于胶体,分散质粒子的直径范围应该是1~100 nm(10-9~10-7m),故C错误;沙子的主要成分为二氧化硅,计算机芯片为硅单质,硅的化合价从+4价变为0价,化合价降低,发生了还原反应,故D正确。
2.(2020·石家庄模拟)下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是 ( )【解析】选C。
铜既不是电解质,也不是非电解质,A项错误;SO3是非电解质,BaSO4是强电解质,B项错误;碳酸钙是盐,为强电解质,亚硝酸是中强酸,是弱电解质,乙醇是非电解质,C项正确;Ba(OH)2是强电解质,H2O是弱电解质,D项错误。
3.设N A为阿伏加德罗常数的值,下列说法正确的是( )A.1 mol C4H8中含有π键的数目一定为N AB.1 mol C(金刚石)中含有C—C键的数目为4N AC.C3H8分子中,s-p σ键与p-p σ键数目之比为3∶8D.46 g C2H6O中,C—H σ键的数目可能是6 N A或5 N A【解析】选D。
1 mol C4H8中含有π键的数目,若为烯烃,π键的数目为1 N A,若为环烷烃,则不含有π键,A 错误;金刚石中,每个C形成的共价键为×4=2,则1 mol金刚石形成的共价键为1 mol×2=2 mol,所以1 mol金刚石中含有C—C键的数目为2 N A,B错误;C3H8分子中,s-p σ键为碳氢键,与p-p σ键为碳碳键数目之比为8∶2,C错误;46 g C2H6O物质的量为1 mol,若为CH3—O—CH3,C—H σ键的数目为6 N A;若为CH3CH2OH,则C—H σ键的数目为5 N A,D正确。
2021版高考化学一轮复习 全册练习(含解析,付,683)鲁科版

钠及其化合物过氧化钠能与CO2作用,放出O2,可将它用作供氧剂,用于矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用。
过氧化钠还可以用于消毒、杀菌和漂白等,在工业上常用作漂白剂、杀菌剂、消毒剂、去臭剂、氧化剂等。
比较下列四组反应,回答下列问题:一组:①Na2O2+CO2;②Na2O2+SO2二组:③Na2O2+FeCl3(溶液);④Na2O2+FeCl2(溶液)三组:⑤SO2通入品红溶液中,加热;⑥Na2O2通入品红溶液中,加热四组:⑦NaOH溶液滴入紫色石蕊试液中;⑧Na2O2固体加入紫色石蕊试液中问题1.写出①反应的化学方程式,有同学类比①的反应写出②的反应方程式为2Na2O2+ 2SO2 2Na2SO3+O2,你认为是否合理?(素养角度——变化观念与平衡思想)提示:①的化学方程式为2Na2O2+2CO22Na2CO3+O2。
②不合理。
Na2O2具有强氧化性,发生Na2O2+ SO2Na2SO4。
问题2.比较分析③④反应中可能发生的现象,预测有什么相同点和不同点。
(素养角度——科学探究与创新意识)提示:③FeCl3与NaOH反应生成Fe(OH)3,Fe(OH)3是不溶性的红褐色沉淀;④中Fe2+具有强还原性,易被Na2O2氧化并生成Fe(OH)3,Na2O2与溶液中的水剧烈反应会有O2产生。
所以相同点为均会有红褐色沉淀生成并有气体逸出;不同点为④中气体明显少于③中气体。
问题3.预测⑤、⑥可能的现象是什么?(素养角度——宏观辨识与微观探析)提示:⑤溶液红色褪去,加热后又恢复红色;⑥溶液红色褪去,加热后不能恢复红色。
问题4.判断⑦⑧反应中可能发生的现象?(素养角度——宏观辨识与微观探析)提示:⑦溶液变蓝,⑧溶液先变蓝后褪色。
(2020·郑州模拟)钙和钠相似,也能形成过氧化物,则下列叙述正确的是( )A.过氧化钙的化学式是Ca2O2B.1 mol过氧化钠或过氧化钙跟足量水反应都生成0.5 mol氧气C.过氧化钙中阴阳离子数之比为2∶1D.过氧化钙中只含离子键【解析】选B。
【高考推荐】2020-2021届高考化学一轮复习第2章元素与物质世界第3节氧化剂和还原剂课后达标检测鲁科版

第3节氧化剂和还原剂[课后达标检测]一、选择题1.下列应用不涉及氧化还原反应的是( )A.Na2O2用作呼吸面具的供氧剂B.工业上电解熔融状态的Al2O3制备AlC.工业上利用合成氨实现人工固氮D.实验室用NH4Cl和Ca(OH)2制备NH3解析:选D。
NH4Cl与Ca(OH)2反应制取NH3属于复分解反应,是非氧化还原反应。
2.某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4===3N2+4H2O,反应温度可高达2 700 ℃,对于该反应,下列说法正确的是( )A.该反应属于置换反应B.N2H4是氧化剂C.N2O4是还原剂D.N2既是氧化产物又是还原产物解析:选D。
根据反应方程式分析该反应不属于置换反应,N2H4中N元素由-2价升高到0价,作还原剂;N2O4中N元素由+4价降低到0价,作氧化剂;N2既是氧化产物又是还原产物。
3.一种海水电池的反应原理可表示为5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl,下列有关该反应的说法正确的是( )A.反应中MnO2是还原剂B.Ag的还原性比Na2Mn5O10的强C.该反应中MnO2具有催化作用D.每生成1 mol Na2Mn5O10转移1 mol电子解析:选B。
根据反应方程式可知,Mn的化合价降低,所以MnO2是氧化剂,选项A、C错误;在氧化还原反应中还原剂(Ag)的还原性强于还原产物(Na2Mn5O10)的还原性,选项B正确;每生成1 mol Na2Mn5O10转移2 mol电子,选项D错误。
4.如图为二氧化锰的转化关系图,下列有关说法中不正确的是( )A.反应①~⑥均属于氧化还原反应B.反应⑤中氧化剂与还原剂的物质的量之比为3∶4C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1D.反应①生成的Cl2经干燥后,可用钢瓶贮运解析:选C。
每生成1 mol O2,反应③中转移2 mol电子,反应④中转移4 mol电子,则相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶2,故C错误。
近年年高考化学一轮复习课时分层训练2氯及其化合物鲁科版(2021学年)

2019年高考化学一轮复习课时分层训练2 氯及其化合物鲁科版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019年高考化学一轮复习课时分层训练2 氯及其化合物鲁科版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019年高考化学一轮复习课时分层训练2 氯及其化合物鲁科版的全部内容。
课时分层训练(二) 氯及其化合物(建议用时:45分钟)A级基础达标1.某地化工厂的贮氯罐意外发生泄漏,下列关于安全处理措施不正确的是 ( )A.紧急组织群众沿逆风方向疏散B.消防队员向贮氯罐周围空气中喷洒稀NaOH溶液C.处在该环境中的群众,应用浸有稀氨水的毛巾捂住鼻子,趴在低洼处等待救援D.处在该环境中的群众,应用浸有一定浓度NaHCO3的毛巾捂住鼻子,向高处转移C[稀氨水挥发出的NH3具有强烈的刺激性气味,氯气的密度比空气的密度大,应往高处转移。
]2.(2018·宁德模拟)某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是( )A.该实验说明Cl2具有漂白性B.该实验说明H+扩散速度比HClO快C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色D.若用久置的氯水进行实验,现象相同B[HClO具有漂白性,Cl2无漂白性,A项错误;HClO的漂白持久、稳定,实验后的pH试纸加热不会恢复原来的颜色,C项错误;久置的氯水主要成分为稀盐酸,无漂白性,D项错误。
] 3.水处理包括水的净化、杀菌消毒、蒸馏等.其中常见的杀菌消毒剂包括氯气、臭氧、漂白粉等。
游泳场馆往往用臭氧、活性炭对游泳池进行消毒和净化。
高三化学一轮复习45分钟滚动基础训练卷2含解析鲁科版
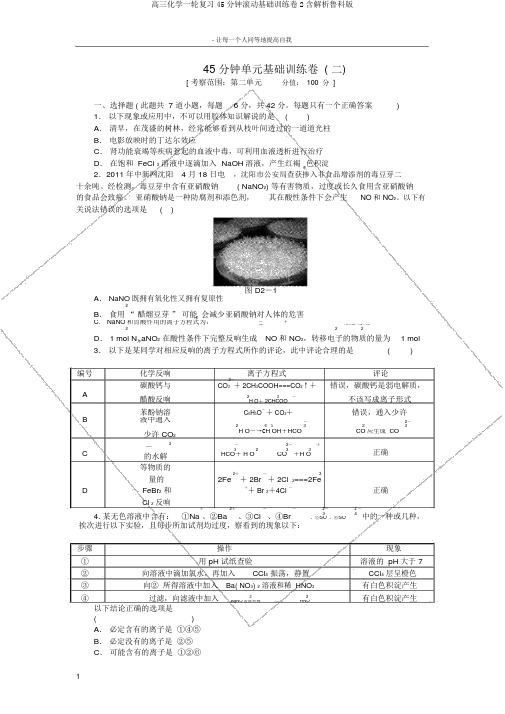
45 分钟单元基础训练卷 ( 二)[ 考察范围:第二单元分值: 100 分 ]一、选择题 ( 此题共 7 道小题,每题 6 分,共 42 分。
每题只有一个正确答案 ) 1. 以下现象或应用中,不可以用胶体知识解说的是 ( )A . 清早,在茂盛的树林,经常能够看到从枝叶间透过的一道道光柱B . 电影放映时的丁达尔效应C . 肾功能衰竭等疾病惹起的血液中毒,可利用血液透析进行治疗D . 在饱和 FeCl 3 溶液中逐滴加入 NaOH 溶液,产生红褐 色积淀2.2011 年中新网沈阳 4 月 18 日电 ,沈阳市公安局查获掺入非食品增添剂的毒豆芽二十余吨。
经检测,毒豆芽中含有亚硝酸钠 ( NaNO 2) 等有害物质,过度或长久食用含亚硝酸钠 的食品会致癌。
亚硝酸钠是一种防腐剂和添色剂, 其在酸性条件下会产生 NO 和 NO 2。
以下有 关说法错误的选项是( )图 D2-1A . NaNO 既拥有氧化性又拥有复原性2B . 食用 “ 醋熘豆芽 ” 可能 会减少亚硝酸钠对人体的危害C . NaNO 和胃酸作用的离子方程式为:-+2NO+ 2H ===NO ↑ + NO ↑+ H O222D . 1 mol N aNO 2 在酸性条件下完整反响生成 NO 和 NO 2,转移电子的物质的量为1 mol3. 以下是某同学对相应反响的离子方程式所作的评论,此中评论合理的是()编号 化学反响2- 离子方程式评论碳酸钙与错误,碳酸钙是弱电解质,ACO 3 + 2CH 3COOH===CO 2↑+醋酸反响23-不该写成离子形式H O + 2CHCOOB苯酚钠溶 C 6H 5O -+ CO 2+错误,通入少许液中通入-2-26 5323少许 CO 2H O ―→C H OH +HCOCO 应生成 CO3-2- +CNaHCO正确3233的水解HCO + H OCO +H O等物质的2+3量的+ 2Br -+ 2ClD2Fe 2===2Fe正确FeBr 2 和++ Br 2+4Cl -Cl 2 反响2+2- 2 -+--4. 某无色溶液中含有: ①Na 、②Ba 、③Cl、④Br34中的一种或几种,、⑤SO 、⑥SO挨次进行以下实验,且每步所加试剂均过度,察看到的现象以下:步骤 操作现象①用 pH 试纸查验溶液的 pH 大于 7 ② 向溶液中滴加氯水,再加入CCl 4 振荡,静置 CCl 4 层呈橙色 ③ 向② 所得溶液中加入 Ba( NO 3) 2 溶液和稀 HNO 3有白色积淀产生 ④过滤,向滤液中加入33有白色积淀产生AgNO 溶液和稀 HNO以下结论正确的选项是 ( ) A . 必定含有的离子是 ①④⑤B . 必定没有的离子是 ②⑤C . 可能含有的离子是 ①②⑥1D.不可以确立的离子是①③⑥500 mL 稀 H SO 中,发现固体完整溶解,并放5. 27.2 g铁粉和氧化铁的混淆物,放入24出 4.48 L H2( 标况 ) ,加入 NH4SCN溶液后,无颜色变化,而后向溶液中加入 2 mol·L-1 NaOH 溶液,当溶液呈中性时,用掉NaOH溶液 500 mL,则原硫酸溶液的物质的量浓度为() A.4 mol ·L-1B. 3 mol ·L-1C.2 mol ·L-1 D .1 m ol ·L-1FeCl 3溶液中,发生反响: 2Fe3++ S2-2Fe2 6.将 Na2S 溶液逐滴加入等物质的量浓度的++ S↓;将 FeCl3溶液逐滴加入等物质的量浓度的2溶液中,发生反响:3+2-Na S2Fe+ 3S Fe2S3↓ 。
2021版高考化学一轮复习 阶段滚动检测(二)(含解析)新人教版

阶段滚动检测(二)(90分钟100分)一、选择题(本题包括16小题,每小题3分,共48分。
)1.(2020·蚌埠模拟)化学与生活、社会发展息息相关,下列有关说法不正确的是()A.将海水中的镁转化为氯化镁,再电解熔融氯化镁可制得金属镁B.稻草秸秆和甘蔗渣中富含纤维素,可以用它来制造纸张C。
芯片制造中的“光刻技术"是利用光敏树脂在曝光条件下成像,该过程涉及化学变化D.《新修本草》中有关“青矾”的描述为“本来绿色,新出窟未见风者,正如瑠璃……烧之赤色……"这里的赤色是析出了Cu单质【解析】选D。
海水中的Mg2+经一系列反应转化为MgCl2,然后电解熔融MgCl2得到Mg,A正确;植物的叶茎的主要成分是纤维素,纸的主要成分也是纤维素,B 正确;光敏树脂遇光会导致分子结构发生变化,C正确;青矾是硫酸亚铁晶体,灼烧时生成的红棕色物质是Fe2O3,D错误。
【加固训练】(2020·哈尔滨模拟)化学已深入我们的生活。
下列有关说法不正确的是( )A.PM2。
5含有的铅、镉、铬、钒等对人体有害的元素是金属元素B。
铝与Fe2O3发生铝热反应,反应后固体物质增重C。
“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应D.古剑“沈卢"“以剂钢为刃,柔铁为茎干,不尔则多断折”,“剂钢”指的是铁的合金【解析】选B。
铝与氧化铁发生铝热反应,由质量守恒定律知,反应前后固体质量不变(因为反应物、产物均为固体)。
2。
(2020·泰安模拟)N、O、Si、S是重要的非金属元素。
下列说法正确的是( ) A。
N、O、S、Si的原子半径逐渐增大,非金属性逐渐减弱B.氮的氧化物和硫的氧化物既是形成光化学烟雾的主要物质,又是形成酸雨的主要物质C.四种元素的基态原子中有三种原子的核外单电子数一样多D。
N、Si、S的单质均能和氧气反应,生成的产物分别是NO2、SiO2和SO2【解析】选C.同周期元素自左向右原子半径逐渐减小,非金属性逐渐增强。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阶段滚动检测(二)(第3~5章)(90分钟100分)一、选择题(本题包括16小题,每小题3分,共48分。
)1.(2020·蚌埠模拟)化学与生活、社会发展息息相关,下列有关说法不正确的是( )A.将海水中的镁转化为氯化镁,再电解熔融氯化镁可制得金属镁B.稻草秸秆和甘蔗渣中富含纤维素,可以用它来制造纸张C.芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下成像,该过程涉及化学变化D.《新修本草》中有关“青矾”的描述为“本来绿色,新出窟未见风者,正如瑠璃……烧之赤色……”这里的赤色是析出了Cu单质【解析】选D。
海水中的Mg2+经一系列反应转化为MgCl2,然后电解熔融MgCl2得到Mg,A正确;植物的叶茎的主要成分是纤维素,纸的主要成分也是纤维素,B正确;光敏树脂遇光会导致分子结构发生变化,C正确;青矾是硫酸亚铁晶体,灼烧时生成的红棕色物质是Fe2O3,D错误。
【加固训练】(2020·哈尔滨模拟)化学已深入我们的生活。
下列有关说法不正确的是( )A.PM2.5含有的铅、镉、铬、钒等对人体有害的元素是金属元素B.铝与Fe2O3发生铝热反应,反应后固体物质增重C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应D.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,“剂钢”指的是铁的合金【解析】选B。
铝与氧化铁发生铝热反应,由质量守恒定律知,反应前后固体质量不变(因为反应物、产物均为固体)。
2.(2020·泰安模拟)N、O、Si、S是重要的非金属元素。
下列说法正确的是( )A.N、O、S、Si的原子半径逐渐增大,非金属性逐渐减弱B.氮的氧化物和硫的氧化物既是形成光化学烟雾的主要物质,又是形成酸雨的主要物质C.四种元素的基态原子中有三种原子的核外单电子数一样多D.N、Si、S的单质均能和氧气反应,生成的产物分别是NO2、SiO2和SO2【解析】选C。
同周期元素自左向右原子半径逐渐减小,非金属性逐渐增强。
同主族元素自上而下原子半径逐渐增大,则O、N、S、Si的原子半径逐渐增大,非金属性逐渐减弱,A错误;硫的氧化物不能形成光化学烟雾,B错误;O、N、S、Si的原子核外单电子数分别为2、3、2、2,C正确;N2和O2反应生成NO,得不到NO2,D 错误。
3.(双选)(2020·西城区模拟改编)美国科学家用有机分子和球形笼状分子C60,首次制成了“纳米车”(如图),每辆“纳米车”是用一个有机分子和四个球形笼状分子“组装”而成。
下列说法正确的是( )A.我们不可能直接用肉眼清晰地看到这种“纳米车”的运动B.“纳米车”的诞生,说明人类操纵分子的技术进入一个新阶段C.“纳米车”是一种分子晶体D.C60熔点比金刚石熔点高【解析】选A、B。
根据题意,“纳米车”是肉眼看不见的,A项正确;“纳米车”只是几个分子的“组装”体,并非晶体,C项错误;C60属于分子晶体,熔点要比金刚石低得多,D项错误。
4.(2020·安庆模拟)观察下列模型并结合有关信息进行判断,下列说法错误的是( )B12结HCN S8SF6构单元结构模型示意图熔点备注—易溶于CS2—1 873 KA.HCN的结构式为H—C≡N,分子中“C≡N”键含有1个σ键和2个π键B.固态硫S8属于原子晶体,分子中S原子采用sp3杂化C.SF6是由极性键构成的非极性分子,分子构型为八面体形D.单质硼属于原子晶体【解析】选B。
由比例模型可以看出分子中有1个碳原子、1个氮原子和1个氢原子,原子半径:C>N>H,所以该比例模型中最左端的是氢原子,中间的是碳原子,最右边的是氮原子,其结构式为H—C≡N,分子中“C ≡N”键含有1个σ键和2个π键,故A正确;固态S是由S8构成的,根据其溶解性可知,该晶体中存在的微粒是分子,属于分子晶体,故B错误;SF6空间构型为对称结构,分子的极性抵消,正负电荷的重心重合,电荷分布均匀,SF6为非极性分子,根据图示,分子构型为八面体形,故C正确;根据B12的熔点1 873 K,该晶体熔点较高,属于原子晶体,故D正确。
5.(2020·安顺模拟)在NH3和NH4Cl存在条件下,以活性炭为催化剂,用H2O2氧化CoCl2溶液来制备化工产品[Co(NH3)6]Cl3,下列表述正确的是( )A.中子数为32,质子数为27的钴原子CoB.H2O2的电子式:C.NH3和NH4Cl化学键类型相同D.1 mol[Co(NH3)6]Cl3中含有的σ键数为24N A【解析】选D。
中子数为32,质子数为27的钴原子,应该表示为Co,A错误;H2O2为共价化合物,没有电子的得失,B错误;NH3存在氮氢共价键,NH4Cl存在铵根离子和氯离子间的离子键,氮氢原子间的共价键,C错误;[Co(NH3)6]Cl3中[Co(NH3)6]3+与Cl-之间是离子键,其中1个NH3分子中含有3个σ键,Co3+与6个NH3之间形成6个配位键,也均为σ键,因此1个[Co(NH3)6]3+中含有的σ键为6+3×6=24,D正确。
【加固训练】(2020·温州模拟)氢化铵(NH4H)与氯化铵的结构相似,它与水反应有气体生成。
下列关于氢化铵的叙述正确的是( )A.是离子化合物,含有离子键和共价键B.电子式是C.与水反应时,NH4H是氧化剂D.固体投入少量的水中,只产生一种气体【解析】选A。
NH4H与氯化铵的结构相似,是由N和H-构成的离子化合物,故A正确;NH4H是离子化合物,由铵根离子与氢负离子构成,电子式为,故B错误;NH4H中含有H-,与水反应时发生氧化还原反应生成氢气,NH4H为还原剂,发生氧化反应,故C错误;NH4H固体投入少量水中,NH4H有很强的还原性,可与H2O发生反应:NH4H+H2O NH3·H2O+H2↑,生成的气体为NH3和H2,故D错误。
6.(2020·保山模拟)下列对一些实验事实的理论解释正确的是( )选项实验事实理论解释A 碘单质在CCl4中溶解度比在水中大CCl4和I2都是非极性分子,而H2O是极性分子B CO2为直线形分子CO2分子中C═O是极性键C 金刚石的熔点低于石墨金刚石是分子晶体,石墨是原子晶体D HF的沸点高于HCl HF的相对分子质量小于HCl【解析】选A。
CCl4和I2都是非极性分子,而H2O是极性分子,根据相似相溶原理可知碘单质在水溶液中的溶解度很小,但在CCl4中溶解度很大,故A正确;理论解释不对,CO2分子是直线形,中心C原子杂化类型为sp 杂化,分子构型与键的极性无关,故B错误;金刚石是原子晶体,故C错误;理论解释不对,HF分子间含有氢键,故HF的沸点高于HCl,故D错误。
7.(双选)(2020·贵阳模拟改编)下列有关SO2与SiO2的比较,正确的是( )A.它们均为酸性氧化物B.二者化学键类型相同,晶体类型也相同C.S元素和Si元素化合价都为+4价,因此从氧化还原角度考虑它们具有一样的性质D.1 mol SiO2晶体中含4 mol Si—O键【解析】选A、D。
SO2和SiO2均能和碱反应生成盐和水,属于酸性氧化物,故A正确;二氧化硅属于原子晶体,二氧化硫属于分子晶体,故B错误;SO2具有强还原性,SiO2没有,故C错误;1 mol SiO2晶体中含4 mol Si—O键,故D正确。
8. (2020·济南模拟)如图为碘晶体晶胞结构。
有关说法中正确的是( )A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构B.用均摊法可知平均每个晶胞中有4个碘原子C.碘晶体为无限延伸的空间结构,是原子晶体D.碘晶体中的碘原子间存在非极性键和范德华力【解析】选A。
在立方体的顶面上,有5个I2,4个方向相同,结合其他面考虑可知,A项正确;每个晶胞中有4个碘分子,B项错误;此晶体是分子晶体,C项错误;碘原子间只存在非极性共价键,范德华力存在于分子与分子之间,D项错误。
9.(2020·驻马店模拟)短周期主族元素 W、X、Y、Z的原子序数依次增大。
X和Z形成的化合物的水溶液呈中性,W和 X的最外层电子数之和等于Z的最外层电子数,Y的原子序数是W的2倍。
YWZ2滴入水中,可观察剧烈反应,液面上有雾生成,并有带刺激性气味的气体逸出。
下列说法正确的是( )A.原子半径:W<X<Y<ZB.W分别与 X、Z均只能形成一种二元化合物C.W、Y、Z的最简单氢化物中,Z的氢化物沸点最高D.YWZ2滴入水中时,逸出的气体能使品红褪色【解析】选D。
短周期主族元素 W、X、Y、Z的原子序数依次增大。
X和Z形成的化合物的水溶液呈中性,该化合物为NaCl,则X为Na、Z为Cl元素;W和X的最外层电子数之和等于Z的最外层电子数,W的最外层电子数为7-1=6,W的原子序数小于Na,则W为O元素;Y的原子序数是W的2倍,则Y的原子序数为16,为S 元素;YWZ2为SOCl2,SOCl2滴入水中发生水解反应生成二氧化硫、HCl,液面上有雾生成,并有带刺激性气味的气体逸出,满足条件。
根据分析可知:W为O,X为Na,Y为S,Z为Cl元素。
同一周期从左向右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,则原子半径W<Z<Y<X,故A错误;O与Na可以形成氧化钠和过氧化钠,与Cl可以形成ClO2、Cl2O7等多种化合物,故B错误;O、S、Cl的氢化物分别为水、硫化氢和HCl,由于水分子间存在氢键,导致水的沸点较高,即W的氢化物沸点最高,故C错误;SOCl2滴入水中生成的二氧化硫具有漂白性,能够使品红溶液褪色,故D正确。
【加固训练】(2020·衡阳模拟)短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。
X与Y位于不同周期,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,元素Z的单质是目前使用量最大的主族金属元素单质。
下列说法中正确的是( )A.化合物YX4W属于离子晶体,溶于水后得到的溶液呈碱性B. 化合物YW3为平面三角形的非极性分子C. Y、Z形成的一种化合物,强度高、热膨胀系数小,是良好的耐热冲击材料D.工业上常用电解Z与W形成的化合物的方法制取单质Z【解析】选C。
元素Z的单质是目前使用量最大的主族金属元素单质,Z为铝元素。
X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,则X与W的最外层电子数之和为8,Y 最外层电子数为5,为N元素,短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。
X与Y位于不同周期,X为H元素,W为氯元素。
