第九单元溶液思维导图
初中化学思维导图

第一单元走进化学世界思维导图
资料.
第二单元我们周围的空气思维导图
资料.
第三单元物质构成的奥秘思维导图
资料.
资料.
第四单元自然界的水思维导图
资料.
第五单元化学方程式思维导图
资料.
第六单元碳与碳的氧化物思维导图
资料.
第七单元燃料及其利用思维导图
资料.
第八单元金属和金属材料思维导图
资料.
第九单元溶液思维导图
资料.
资料.
第十单元酸和碱思维导图
资料.
第十一单元盐化肥思维导图
资料.
资料.
第十二单元化学与生活思维导图
资料.
资料.
资料.
1、征服畏惧、建立自信的最快最确实的方法,就是去做你害怕的事,直到你获得成功的经验。
2、忍别人所不能忍的痛,吃别人所别人所不能吃的苦,是为了收获得不到的收获。
就像驴子面前吊着个萝卜就会往前走。
正因为有那个目标,你才有劲儿往前走。
资料.
资料.。
初中化学思维导图

第一单元走进化学世界思维导图
编辑版word
第二单元我们周围的空气思维导图
编辑版word
第三单元物质构成的奥秘思维导图
编辑版word
编辑版word
第四单元自然界的水思维导图
编辑版word
第五单元化学方程式思维导图
编辑版word
第六单元碳与碳的氧化物思维导图
编辑版word
第七单元燃料及其利用思维导图
编辑版word
第八单元金属和金属材料思维导图
编辑版word
第九单元溶液思维导图
编辑版word
编辑版word
第十单元酸和碱思维导图
编辑版word
第十一单元盐化肥思维导图
编辑版word
编辑版word
第十二单元化学与生活思维导图
编辑版word
编辑版word
编辑版word
1、征服畏惧、建立自信的最快最确实的方法,就是去做你害怕的事,直到你获得成功的经验。
2、忍别人所不能忍的痛,吃别人所别人所不能吃的苦,是为了收获得不到的收获。
就像驴子面前吊着个萝卜就会往前走。
正因为有那个目标,你才有劲儿往前走。
编辑版word
编辑版word
(此文档部分内容来源于网络,如有侵权请告知删除,文档可自行编辑修改内容,供参考,感谢您的配合和支持)
编辑版word。
名校版初三化学全册考点汇总 12个单元的思维导图

名校版初三化学全册考点汇总12个单元的思维导图第一单元-走进化学世界-思维导图第二单元-我们周围的空气-思维导图思维导图运用图文并重的技巧,把各级主题的关系用相互隶属与相关的层级图表现出来,把主题关键词与图像、颜色等建立记忆链接。
思维导图充分运用左右脑的机能,利用记忆、阅读、思维的规律,协助人们在科学与艺术、逻辑与想象之间平衡发展,从而开启人类大脑的无限潜能。
思维导图因此具有人类思维的强大功能。
第三单元-物质构成的奥秘-思维导图第四单元-自然界的水-思维导图第五单元-化学方程式-思维导图思维导图是一种将思维形象化的方法。
我们知道放射性思考是人类大脑的自然思考方式,每一种进入大脑的资料,不论是感觉、记忆或是想法——包括文字、数字、符码、香气、食物、线条、颜色、意象、节奏、音符等,都可以成为一个思考中心,并由此中心向外发散出成千上万的关节点。
每一个关节点代表与中心主题的一个连结,而每一个连结又可以成为另一个中心主题,再向外发散出成千上万的关节点,呈现出放射性立体结构,而这些关节的连结可以视为您的记忆,就如同大脑中的神经元一样互相连接,也就是您的个人数据库。
第六单元-碳和碳的化合物-思维导图第七单元-燃料及其利用-思维导图第八单元-金属和金属材料-思维导图思维导图是有效的思维模式,应用于记忆、学习、思考等的思维“地图”,有利于人脑的扩散思维的展开。
思维导图已经在全球范围得到广泛应用,新加坡教育部将思维导图列为小学必修科目,大量的500强企业也在学习思维导图,中国应用思维导图也有20多年时间了。
第九单元-溶液-思维导图第十单元-酸和碱-思维导图第十一单元-盐化肥-思维导图自上世纪八十年代思维导图传入中国内地。
最初是用来帮助“学习困难学生”克服学习障碍的,但后来主要被工商界(特别是企业培训领域)用来提升个人及组织的学习效能及创新思维能力。
在学科教学方面,历经52年的发展,也没在学校广泛应用,后经华东师大刘濯源带领的思维可视化研究团队十五年的研究及实践,得出的结论是“思维导图”并不适合直接应用于学科教学,因为“思维导图”过于强调“图像记忆”和“自由发散联想”而非“理解性记忆”和“结构化思考”。
第九单元《溶液》思维导图

第九单元《溶液》思维导图一、溶液的概念2. 溶液的特性:均一性、稳定性、可逆性。
二、溶液的分类1. 按溶质的状态分类:气体溶液:如空气、软饮料等。
液体溶液:如盐水、糖水等。
固体溶液:如合金、盐水冰等。
2. 按溶剂的状态分类:气体溶剂溶液:如空气中的水蒸气。
液体溶剂溶液:如糖水、盐水等。
固体溶剂溶液:如合金。
三、溶液的组成1. 溶质:溶液中被溶解的物质。
2. 溶剂:溶液中能溶解其他物质的物质。
3. 溶解度:在一定温度下,单位溶剂中能溶解的最大溶质量。
四、溶液的浓度1. 质量分数:溶质质量与溶液总质量之比。
2. 体积分数:溶质体积与溶液总体积之比。
3. 质量浓度:溶质质量与溶液体积之比。
4. 摩尔浓度:溶质的物质的量与溶液体积之比。
五、溶液的性质1. 溶液的密度:溶液单位体积的质量。
2. 溶液的沸点:溶液的沸点通常高于纯溶剂的沸点。
3. 溶液的凝固点:溶液的凝固点通常低于纯溶剂的凝固点。
4. 溶液的渗透压:溶液对半透膜的渗透作用产生的压力。
六、溶液的制备1. 溶解法:将溶质加入溶剂中,搅拌均匀,使溶质完全溶解。
2. 稀释法:将浓溶液加入适量的溶剂中,搅拌均匀,降低溶液的浓度。
3. 蒸馏法:利用溶液中各组分的沸点差异,通过蒸馏分离溶液中的组分。
七、溶液的应用1. 化学实验:制备标准溶液、反应介质等。
2. 日常生活:饮料、清洁剂、药物等。
3. 工业生产:金属冶炼、化工产品等。
八、溶液的稳定性1. 溶液的稳定性取决于溶质与溶剂之间的相互作用力,如氢键、离子键、范德华力等。
2. 溶液的稳定性还受到温度、压力、pH值等因素的影响。
3. 溶液的稳定性可分为三类:稳定溶液、介稳溶液和不稳定溶液。
九、溶液的相变1. 溶液的相变包括溶解、结晶、蒸发、凝固等过程。
2. 溶液的相变过程遵循相变热力学和动力学规律。
3. 溶液的相变过程可应用于物质的分离和纯化。
十、溶液的热力学性质1. 溶液的热力学性质包括溶液的焓变、熵变、自由能变等。
初中化学思维导图
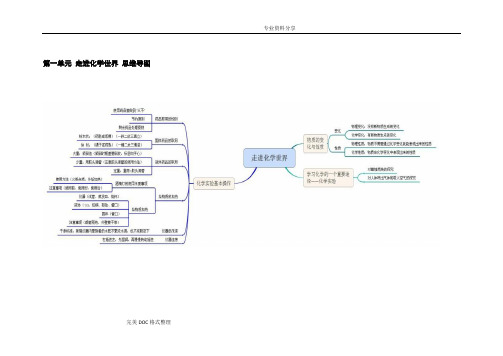
第一单元走进化学世界思维导图
完美DOC格式整理
第二单元我们周围的空气思维导图
完美DOC格式整理
第三单元物质构成的奥秘思维导图
完美DOC格式整理
完美DOC格式整理
第四单元自然界的水思维导图
完美DOC格式整理
第五单元化学方程式思维导图
完美DOC格式整理
第六单元碳与碳的氧化物思维导图
完美DOC格式整理
第七单元燃料及其利用思维导图
完美DOC格式整理
第八单元金属和金属材料思维导图
完美DOC格式整理
第九单元溶液思维导图
完美DOC格式整理
完美DOC格式整理
完美DOC 格式整理
第十单元 酸和碱 思维导图
第十一单元盐化肥思维导图
完美DOC格式整理
完美DOC格式整理
第十二单元化学与生活思维导图
完美DOC格式整理
完美DOC格式整理。
第九单元 课题2 溶解度 知识归纳(含思维导图)课件 初中化学人教版九年级下册

知识归纳
3.饱和溶液与不饱和溶液的判断 (1)观察法:如果溶液中有未溶解的物质,说明该温度下该溶液不能继续溶解这种物质了。 该溶液一定是该物质的饱和溶液。 (2)实验法:在一定温度时如果溶液中没有未溶解的物质,可以向原溶液中加入少量原溶 质,如果不再溶解,说明原溶液是饱和溶液;如果继续溶解,说明原溶液是不饱和溶液。 温馨提示 析出晶体后所得的溶液,一定是该温度下该溶质的饱和溶液。 4.饱和溶液、不饱和溶液与溶液浓稀的关系 (1)溶液的饱和与不饱和与溶液的浓和稀是从不同角度对溶液进行分类的,两者没有必然 联系;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。 (2)在一定温度下,在同种溶剂的条件下,同种溶质的饱和溶液要比不饱和溶液浓
(2)由于熟石灰在一定量水中溶解的最大量随温度的升高而降低,故Ca(OH)2饱和溶液与 不饱和溶液存在如下转化关系: 饱和溶液 蒸发溶增剂加、溶升剂高或温降度低或温增度加溶质 不饱和溶液
知识归纳
3.解答有关溶解度曲线的习题关键是熟悉点、线、面的意义 (1)点:曲线上的点叫饱和点。曲线上任一点表示对应温度下(横坐标)该物质的溶解度(纵 坐标);两曲线的交点表示两物质在交点的温度下溶解度相等。 (2)线:溶解度曲线表示物质的溶解度随温度变化的趋势。根据溶解度随温度变化的趋势 确定分离混合物的方法: ①陡升型:从溶液中析出该物质时,可采用降温结晶。 ②缓升型:从溶液中析出该物质,可采用蒸发结晶的方法。 ③陡升型的物质中混有少量缓升型的物质时,可采用降温结晶的方法进行提纯;缓升型的 物质中含有少量陡升型物质时,可采用蒸发结晶的方法进行提纯。 (3)面: ①溶解度曲线下方的面表示不同温度下该物质的不饱和溶液。 ②溶解度曲线上方的面表示相应温度下的饱和溶液且有未溶解的溶质。
知识归纳
人教版九年级化学第九单元“溶液”考点与知识点归纳整理(附专项练习及解析)
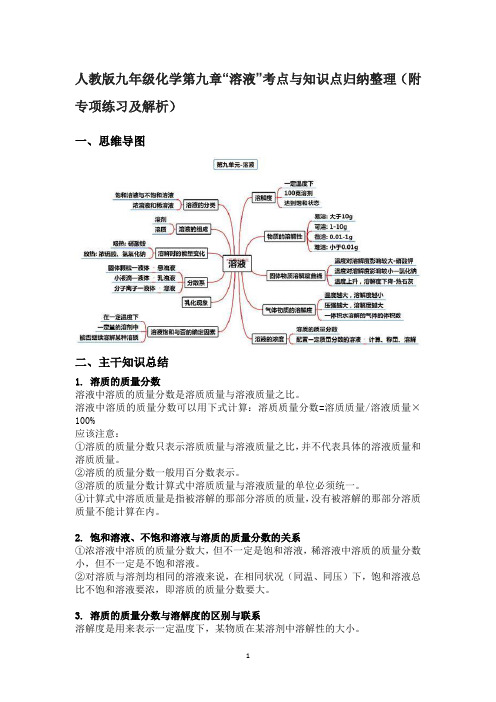
人教版九年级化学第九章“溶液”考点与知识点归纳整理(附专项练习及解析)一、思维导图二、主干知识总结1. 溶质的质量分数溶液中溶质的质量分数是溶质质量与溶液质量之比。
溶液中溶质的质量分数可以用下式计算:溶质质量分数=溶质质量/溶液质量×100%应该注意:①溶质的质量分数只表示溶质质量与溶液质量之比,并不代表具体的溶液质量和溶质质量。
②溶质的质量分数一般用百分数表示。
③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。
④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
2. 饱和溶液、不饱和溶液与溶质的质量分数的关系①浓溶液中溶质的质量分数大,但不一定是饱和溶液,稀溶液中溶质的质量分数小,但不一定是不饱和溶液。
②对溶质与溶剂均相同的溶液来说,在相同状况(同温、同压)下,饱和溶液总比不饱和溶液要浓,即溶质的质量分数要大。
3. 溶质的质量分数与溶解度的区别与联系溶解度是用来表示一定温度下,某物质在某溶剂中溶解性的大小。
溶质的质量分数用来表示溶液组成。
4. (实验)一定溶质质量分数氯化钠溶液的配制(1)实验回顾实验用品:托盘天平、烧杯、玻璃棒、药匙、量筒(10mL、100mL)、食盐。
实验步骤:①计算根据溶质质量分数的公式,计算配制一定溶质质量分数的氯化钠溶液所需要氯化钠质量及水的质量。
②称量(量取)用托盘天平称量氯化钠倒入烧杯中,把水的密度近似地看作1g/cm3,用量筒量取相应体积的水。
③溶解把量好的水倒入盛有氯化钠的烧杯中,用玻琉棒搅拌,加速氯化钠溶解。
④贮存把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签,放到试剂柜中。
(2)例题解析:配制溶质质量分数一定的氯化钠溶液常按如图操作顺序进行.请回答下列问题:(1)实验室配制溶质质量分数一定的溶液时,可能涉及以下操作:A.称量B.计算C.溶解D.装瓶贴标签.回答下列问题:用氯化钠固体和蒸馏水配制100g 5%的氯化钠溶液时,其操作顺序是______(填序号).(2)计算配制100g溶质质量分数为5%的氯化钠溶液所需:氯化钠______g,水______g.(3)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应______.A.增加适量氯化钠固体B.减少适量氯化钠固体C.调节平衡螺母(4)配制上述溶液需要用到的玻璃仪器有量筒、烧杯、玻璃棒和______,其中玻璃棒在该实验中所起的作用是______.【解析】:(1)实验室配制溶质质量分数一定的溶液时,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、装瓶贴标签.(2)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠的质量=100g×5%=5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-5g=95g.(3)用托盘天平称量5g固体药品NaCl时,步骤是:调节天平平衡,在右盘上加砝码和拨动游码,然后向左边托盘添加药品直至天平平衡;称量过程中他发现指针偏左了,说明NaCl的质量大于砝码质量,应减少NaCl.(4)配制100g溶质质量分数为5%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解;在这些操作中需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,其中属于玻璃仪器的是玻璃棒、烧杯、胶头滴管、量筒,玻璃棒在该实验中所起的作用是搅拌,加速固体溶解.故答案为:(1)BACD;(2)5;95;(3)B;(4)胶头滴管;搅拌,加速固体溶解.5. 关于溶液稀释或增浓的计算(1)思路:溶液稀释定律(守恒观点)溶质的质量在稀释前后保持不变,即m1w1=m2w2。
初中化学《溶液》单元教学设计以及思维导图

初中化学《溶液》单元教学设计以及思维导图溶液单元设计及思维导图适用年级九年级所需时间课内共用6课时,每周3课时;课外共用3课时主题单元学习概述本单元的教学核心内容,隶属于课程标准中第二个“一级主题”------“身边的化学物质”中主要内容之一。
本主题单元所学知识内容在日常生活和生产中具有极为广泛的应用,与生命活动息息相关,有生命体中营养的输送和新陈代谢都离不开溶液,在生产中更是应用广泛,如化工产品的生产、农药和化肥肥料的使用大多在溶液中进行,是在日常生活中见得最多应用最广的一类分散体系。
其内容突出了化学在科技、社会、生活中的作用,体现化学的应用价值;对于学生认识化学的重要性,体会化学与人类的关系,增强化学观念具有重要作用,另一方面使学生在面临与化学有关的生活问题的挑战时,能做出更理智、更科学的决策。
本主题单元内容来源于人教版教材九年级下册课本第九单元。
该主题单元共分为以下三个专题:专题一:溶液的形成。
让学生认识溶解现象,知道水是最重要的溶剂,通过实验探究认识水溶液的一些性质,能说出一些日常生活中的常见的乳化现象,了解溶液在生产生活中的重要应用价值,学习科学探究的一些基本方法。
专题二:溶解度。
会用实验探究的方法确定影响物质溶解性的因素,了解饱和、不饱和溶液的涵义,了解结晶现象及其在生产生活中的应用,知道影响固体物质溶解度的因素,能正确使用、分析溶解度曲线。
通过实验探究,学习控制变量的思想与方法;学会观察图像、表格,运用比较、归纳的方法,培养分析数据、处理数据的能力。
认识事物内因与外因之间的辩证关系,理解化学在认识、改造和应用物质方面的重要价值。
专题三:溶液的浓度。
掌握一种溶液浓度的表示方法——溶质的质量分数,并能进行溶质质量分数的有关计算;初步学会配制一定溶质质量分数的溶液,学会辩证地看问题的思维方法,培养学生独立思考和合作学习能力。
本主题单元的教学重点:从宏观上和微观上认识溶液的本质特征,会读、识、用溶解度曲线图,会分析配制溶液的步骤、实验仪器,玻璃棒在操作中的作用和实验误操作的后果,会进行在溶液中有关化学方程式的综合计算。
