络合滴定终点误差计算
第六节 终点误差和准确滴定的条件.

pMSP
1 2
(
pCM
,SP
lg
K
MY
)
pMep lg K'MInlgM lg KMIn lgIn(H) lgM
从公式可见:K'MY ,CM,SP , Et ; pM', Et
4
若金属离子不发生副反应,则:
Et
10pM 10pM CM ,SP K 'MY
100%
(林邦公式)
式中 ΔpM=pMep-pMsp
解:查表得lgKCaY=10.7,lgKZnY=16.50。pH=5.0 时, lgαY(H) =6.45, lgαZn(OH) =0。pH=10.0 时,lgαY(H) =0.45, lgαCa(OH) =0。cCa,SP=cZn,Sp=10-2.00mol•L-1, Ca2+、Zn2+均无络
合效应,αY =αY(H) 。 根据 lgKMY´= lgKMY-lgαY
pH=5.0 时, lgKCaY´= 10.7-6.45=4.25,lg cCa,SP KCaY´=2.25<6
lgKZnY´= 16.5-6.45=10.05,lg cZn,Sp KZnY´=8.05>6
pH=10.0 时,lgKCaY´= 10.7-0.45=10.25,lg cCa,SP KCaY´=8.25>6 结果表明,在pH=5.0 时,可以准确滴定Zn2+;在pH=10.0 时,
100%
100.6 100.6 100% 0.01% 102.00 1010.95
6
二、直接准确滴定金属离子的条件
在络合滴定中,一般都采用In指示ep的到达,即使 ep与sp一致,人眼仍然有△pM′=0.2~0.5的出入。
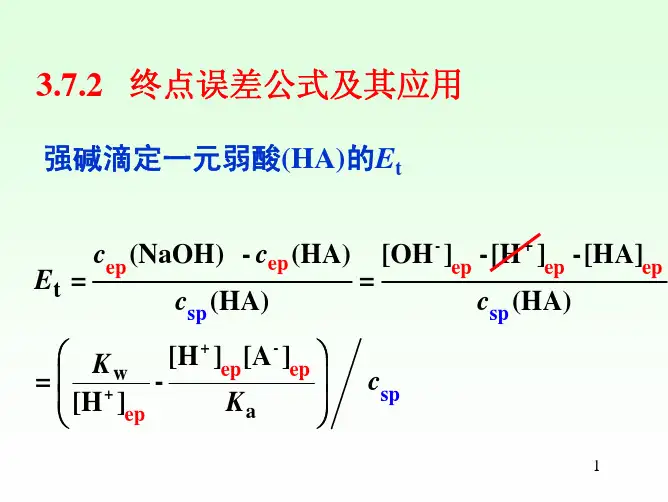
372终点误差公式及其应用
2. 蒸NH3
1.安全管 2.导管 3.汽水分离器 4.塞子
5.进样口 6.冷凝管 7.吸收瓶 8.隔热液套
9.反应管 10.蒸汽发生器
25
4. 磷的测定
P P2O5 H3PO4
MgNH4PO4
NaOH
HCl 标液 c1V1
H3PO4 + HCl H2PO4-, MO (4.4)
17
2. NaOH标准溶液在保存过程中吸收CO2
2NaOH + CO2
Na2CO3
MO,MR:Na2CO3 + 2H+ H2CO3
PP:Na2CO3 + H+
对结果无影 HC响O!3-
测得的c(HCl) 偏高
c(HCl)⋅V (HCl) = c(NaOH)⋅V (NaOH)
18
3. CO2对反应速度的影响
pH
Ka=10-7
Ka=10-9 Kb=10-5
O NIII O NII O NI
为界
MIII O MII O MI O
Ka=10-7 Kb=10-7
Ka=10-5 Kb=10-9
(c =0.10mol·L-1)
K<10-7 时返滴 定可以 吗?
7
T/%
多元酸能分步滴定的条件:
1. 被滴定的酸足够强, c·Ka1≥10-8 2. ΔlgKa足够大,
n(P)∶n(HCl) = 1∶2
26
微量磷的测定
1P
1 2
P2O5
(NH4 )2HPO4 ⋅12MoO3 ⋅ H2O
标HNO3
24OH−
NaOH(过) + 12MoO42− + 2NH4+ + 13H2O + HPO42−
络合滴定法学习要点

络合滴定法学习要点1、络合滴定ABC2、络合滴定的条件是什么?3、络合滴定曲线是怎样绘制的?4、络合滴定曲线有什么意义和用途?5、络合滴定突跃如何计算?6、络合滴定误差如何计算?1、络合滴定ABC络合滴定法又叫配位滴定法,是以生成金属络合物为滴定反应基础的容量分析,通常教材中介绍的络合滴定是指以EDTA滴定M(或M滴定EDTA)的反应体系。
络合滴定受到pH值(EDTA酸效应和M的水解效应)、共存的其他络合剂L(M的络合效应)、共存的其他金属离子N(争夺EDTA,对EDTA 的共存离子效应)的四重影响。
分析化学中将各种影响用副反应系数α来表示,计算出各自的α值,再与绝对稳定常数K合并,构成条件稳定常数K’MY,或lgK’MY。
引入条件稳定常数后,原来简单溶液的EDTA-M络合平衡的平衡定律表达式就可替换成用M总浓度M’和EDTA总浓度Y’及MY总浓度MY’(一般情况下忽略MY的副反应)表示的化学平衡定律。
各项副反应系数的定义式和计算式如下:(1)酸效应系数(影响EDTA,使EDTA质子化,降低[Y]浓度):6Y(H)1[Y']1[H ][Y]H ii i αβ+===+∑其中:6EDTA [Y']=[Y]+[HY]+......[H Y]=c(M ’中不含MY 项,络合滴定中必须考虑,可以查表)(2)络合效应系数(影响M ,L 与M 络合,降低[M]浓度):M(L)1[M']1[L][M]n ii i αβ===+∑ 其中:n [M']=[M]+[ML]+......[M L](Y ’中不含MY 项,络合滴定中比较常见的影响,重点)(3)水解效应系数(影响M ,生成羟基络离子,降低[M]浓度):M(OH)1[M']1[OH][M]n ii i αβ===+∑ 其中:n [M']=[M]+[MOH]+......[M OH](不含MY 项,该效应相当于OH 对M 的络合效应,滴定条件下一般可以忽略)(4)共存离子效应系数(对EDTA ):''Y(H)NY NY [Y']1[N]1[N ][Y]K K α==+=+ 其中:[Y']=[Y]+[NY](Y ’中不含MY 项,络合滴定中考虑共存金属离子干扰及消除时要用到,通过加入一种掩蔽剂进去,使干扰的N 生成稳定络离子,就不再干扰M 的滴定了。
酸碱滴定中林邦误差公式的推导

1.强碱(或强酸)的滴定终点误差
Et =(终点时滴定剂过量或不足的量/化学计量点时应加
入的量)× 100%
…………(1)
以cb (mol/L) Vb (mL) NaOH 滴定ca(mol/L) Va(mL) HCl 为例,若终点在sp后,设过量的NaOH 的浓度cb'
上述体系的质子条件为:[H+]ep+cb'=[OH-]ep
Δ pOH =pOHep - pOHsp=( pKw - pHep) - ( pKw- pHsp ) = - Δ pH- lg[OH - ]
ep + lg[OH -]sp= - lg[OH - ]ep /[OH -]sp[OH -]ep /[
OH -]sp=10Δ pH[OH -] = ep 10Δ pH[OH -]sp
( 2) 沉淀滴定的终点误差与强酸强碱的终点误差公式相同。
( 3) 最简单的对称和可逆氧化还原滴定的终点误差公式为:
TE= (10△pE- 10- △pE )/10△pE ( 2× 0. 059)
和强碱滴定多元酸的误差公式相类似, 有:
TE=(10△pH- 10△pH) /(Ka1 Ka2)1/2
cb '=[OH-]ep -[H+]ep
…………(2)
将(2)带入(1)式
则有Et=cb 'Vep/caVa×100%=([OH-]ep -[H+]) Vep /caVa×100%
Et =[OH-]ep -[H+]/epcaVa /Vep×100%=[OH-]ep [H+]/epcaep×100%
Et =[OH-]ep -[H+]/epc HClep × 100%
络合滴定法的基本原理

1、 最高酸度(或最小pH)
设不存在其他副反应,只考虑酸效应;
当cMsp 0.01mol / L,Et 0.1%时,准确滴定条件为:
lg cMsp KM Y lg cMsp lg KMY lg Y (H ) 6 lg Y (H ) lg KMY 8
[Zn'] (20.00 19.98) 0.020 1.010 5 mol.L1 (20.00 19.98)
pZn′=5.00
3. 化学计量点时
由于滴定反应已经按计量关系完成,溶液中[Zn’]来自 络合物ZnY的解离,所以根据化学计量点时的平衡关系:
Zn2 Y ZnY
由lgY(H)值,再查出相应的pH值——即为滴定某一金属 离子的最低pH值。
因此,溶液酸度高于这个限度就不能准确进行滴定,这 一限度就是络合滴定所允许的最高酸度 (最低pH值)。
2、最低酸度或最大pH
根据产生氢氧化物沉淀计算:
M + n OH-
M(OH)n
要使 M(OH)n 沉淀,须满足[M][OH]n≥KSP
从而求出[OH-] → 准确滴定该金属离子的最大pH。
[OH ]
n
K sp [M n ]
n
K sp cM
3、适宜酸度范围
最高酸度和最低酸度之间的酸度范围称为滴定的 “适宜酸度范围”。
如果滴定在此范围内进行就有可能达到一定的完全 程度,至于在实际操作中能否达到预期的准确度,还需 结合指示剂的变色点来考虑。
2、金属离子的浓度cM的影响
三、直接准确滴定金属离子的条件ቤተ መጻሕፍቲ ባይዱ
由于人眼对颜色分辨能力的局限性,络合滴定的目测终 点一般会有±0.2~0.5pM单位的不确定性,设为±0.2,若 要求滴定误差在±0.1%内,设金属离子的分析浓度为cM , 根据终点误差公式,可得金属离子准确滴定判别式:
5.2 络合滴定法

尽量使: pM’ep=pMsp
三、金属指示剂在使用中存在的问题
(一)指示剂的封闭现象
有时某些指示剂能与某些金属离子生成极 为稳定的络合物,但这些络合物较对应的 MY 络合物更稳定,以致到达计量点时滴入 过量EDTA,也不能夺取指示剂络合物(MIn) 中的金属离子,指示剂不能释放出来,看不 到颜色的变化,这种现象叫指示剂的封闭现 象。
目前,合成金属指示剂达300种以上,经 常有新的金属指示剂问世。
(一)铬黑T
铬 黑 T 属 O,O’- 二 羟 基 偶 氮 类 染 料 , 简 称 EBT 或 BT ,其化学名称是: 1-(1- 羟基 -2- 萘偶 氮)-6-硝基-2-萘酚-4-磺酸钠。
铬黑 T 的钠盐为黑褐色粉末,带有金属光泽, 使用时最适宜的 pH范围是9—11,在此条件下, 可用EDTA直接滴定Mg2+、Zn2+、Cd2+、Pb2+、 Hg2+ 等 离 子 。 对 Ca2+ 不 够 灵 敏 , 必 须 有 MgEDTA 或 Zn-EDTA 存在时,才能改善滴定终点。 一般滴定Ca2+和Mg2+的总量时常用铬黑T作指示 剂。
金属指示剂大多数是具有许多双
键的有色化合物易被日光氧化、空气
和氧化剂所分解。有些指示剂在水溶 液中不稳定,日久会变质。
举
例
如铬黑T、钙指示剂的水溶液均易氧化变质,所
以常配成固体混合物或用具有还原性的溶液来配
制溶液。
分解变质的速度与试剂的纯度也有关。一般纯度
较高时,保存时间长一些。
四、常用金属指示剂简介
(2) 酸度减小,对滴定有利,但酸度 太小,金属离子可能水解,影响滴 定,所以要控制溶液酸度。
02第6章-络合滴定法-滴定曲线
[M' ]sp
C M , sp K MY
化学计量点后
[MY] CM MY + Y′ [M' ] [Y]K MY [Y]K MY
EDTA滴定同浓度的Zn2+的滴定曲线
12 10 8
pM'
6 4 2 0 0 50 100 150 200
pM= ‒lg[M]
T/ %
化学计量点计算
Et . ( 查表(pMg)t=5.4 )
解: lgKMgY=lgKMgY -lgY(H) = 8.7- 0.5 = 8.2
(pMg)sp=
1 (lgK' MgY 2
+pcsp)= (8.2+2.0)/2=5.1
pMg = 5.4- 5.1= 0.3
Et =
100.3 - 10-0.3 (10
2' [Zn ] 2 [Zn ] αZn
lg Zn (7.0 3.2) 10.2 pZnsp pZnsp
[Y ] [Y ] Y
得
lg Y pYsp =pYsp (7.0 1.4) 8.3
pYsp pZn sp
滴定突跃计算
sp前, 按剩余M 浓度计. sp后, 按过量Y 浓度计.
黄绿
红 Bi3+ Pb2+ Zn2+ Fe3+ 紫红 红 Ca2+
[1-(2-吡啶偶氮)2-萘酚] (PAN)
(CuY-PAN)
紫红
紫红
Cu2+
Co2+ Ni2+
2. 指示剂的变色点:(pM)t
指示剂一般为有机弱酸
M + In K MIn K MIn MIn K MIn K' MIn M In In H 当[MIn]=[In]时, K'MIn=
络合滴定计算公式
络合滴定计算公式络合滴定是一种常用的化学分析方法,通过形成络合物来测定溶液中金属离子的浓度。
在这个过程中,涉及到一些重要的计算公式,咱们今天就来好好唠唠。
我记得有一次在实验室里,我带着一群学生做络合滴定的实验。
那场景,可真是热闹非凡。
学生们一个个既兴奋又紧张,都想把实验做好。
其中有个叫小李的同学,特别积极,一双大眼睛紧紧盯着滴定管,手里还不停地记录着数据。
咱们先来说说络合滴定中的一个关键公式——条件稳定常数(K')的计算公式。
这公式是K' = K / αM(αY) 。
其中 K 是稳定常数,αM是金属离子的副反应系数,αY 是 EDTA 的副反应系数。
这个公式就像是一把钥匙,能帮咱们打开准确测定金属离子浓度的大门。
比如说,在测定钙离子浓度的时候,如果溶液中有其他离子会与钙离子发生反应,影响测定结果,这时候就要通过计算副反应系数来修正,从而得到更准确的条件稳定常数。
再来讲讲络合滴定的终点误差计算公式。
这可是判断咱们实验结果准不准的重要依据。
终点误差(TE)的计算公式是TE = [ 10^ΔpM' -10^(-ΔpM') ] / √(cMsp·K') 。
这里的ΔpM' 是终点时金属离子浓度的对数差值,cMsp 是计量点时金属离子的浓度。
举个例子,如果在滴定锌离子时,终点时的ΔpM' 计算有误,那最终得出的终点误差就会偏差很大,可能导致整个实验结果都不靠谱。
还有一个很重要的公式,就是金属离子能被准确滴定的判别式。
当cM·K' ≥ 10^6 时,金属离子才能被准确滴定。
这个判别式就像是一个门槛,达不到的话,实验结果的准确性可就没保障啦。
就像那次实验中的小王同学,因为没搞清楚这个判别式,着急忙慌地就开始实验,结果可想而知,数据乱七八糟,还得重新来过。
在实际应用中,咱们要根据具体的实验条件和要求,灵活运用这些公式。
可别死记硬背,得理解其中的原理。
从一道分析化学经典习题谈谈络合滴定终点误差的计算
分析化 学 是 高校化 学专 业 本科 生 的一 门基 础课 程 , 合 滴定 法 在此 条件下 , 络 滴定 前溶液 中的 【 =1O lL~, I】 . mo ・ 游离 C 2的浓 度则 为 d+ 是该课 程 的重要 内容之 一 。 定终 点误 差是 络合 滴 定法 教学 中 的重 滴 点和难 点 , 涉及 到许 多基 本 概念 和原 理 , 计算 十分 烦 琐 , 多学生 感 很 到枯燥难懂 , 束手无 策 。 有些 教材和 学 习参考 书的 习题解 答又概 念 而 不清, 错误 百 出 , 加深 了一 些学 生 的畏 难情 绪 , 更 致使 教学 效果 大打 1AI+7 一 + i + []11】 2 1 [ 一 I =0 oL 了 1vm1- - . 折 扣。 为此 , 文从一 道经典 习题 的解 答出发 , 本 指出 一些常 见的错 误 , 可见C 的副反应相当严重,C 1<l_ d [ d < o mo・~, lL 所以C 会 d不 总 结一 些解 题的 方法 和规 律 , 望对 读者 有所 帮 助 。 希 与二 甲酚橙 络 合显 色 , 滴定 根本 无法 进 行 , 误差 计算 已毫 无意 义 。 为便于 对 照说 明 , 以下给 出教材 或学 习参 考书的 错误 解答过 程 : 1问题 引入 若终 点时 [ 】 0 2 o ・ 一, : I =l - lL 则 一 o t 武汉 大学 主编 的《 分析 化学 》 第五 版上 册第2 6 1 页习题 1 如下…: l l gK c l c1 l 、 H =1 46— 4. 5 1 81 gK g ( 1 6. 1 6 = 1. 浓度 均为0 0 0 lL .2 mo ・ 的 C 、 混 合溶液 , d Hg 欲在 p 6. 时 , hi 0 用等 浓 度 的E TA滴定 其 中的 C , 问 : D d 试 化学计 时 pd = ( d p )÷18+)60 量点 C {1 Y c = (. 2=.5 g + 11 9 () 1 用KI 掩蔽其 中的Hg 使终 点时I的游离浓 度为 1 o ・ , , 0 t lL o 终点 时pC =l K . . d g 5 =5 能否 完全掩 蔽 ? K l 为多 大 ? g 所 以 A Cd=p d p C 一p =55 .0 =- .0 Cd。 .—69 5 1 5 4 ( ) 二 甲酚橙 与C 、 显色 , H 6 0 , K 2 已知 d Hg 都 在p = .时 l g = 5 5 l = . , ., K g 9 0 能否用二 甲酚橙做C d 的指示剂? E: x0 = 三 _ l % _o % 1% : l o :J 3 0 o 02 . () 3滴定 C 。时 若用 二 甲酚橙 做 指 示剂 , 点误 差 为 多大 ? d 终 ,4 / 4 “ x.0 1 o1 o 0 () 4若终 点时 ,一 离浓 度为0 5 o・ , 第 三种方 式 进行 , I游 .t lL 按 o 终 若 终 点 时 [ 二0 5 lL i则 I】 . mo ・ , 点误 差 又 为 多 大 ? O d =lb l 】 B【 3 j 4 { ( -p 『 + 2 +B【 1 1 CI ) I I】 I +0 I】 这 是 一 道 络合 滴 定 法 的 经 典 习 题 , 教 材 从 l 9 年第 三 版 到 该 9 5 l 1 l + 0 o×0. 5+ 1 ” x 0 5 0 . 2+ l X 0. 3+ 1 54 ×0. 4= 1 43 0 5 0 .1 5 0 .2 2 0 年 第 五版 都 一直 在 选 用13 习题 后 附 出的 答 案是 : 06 21 .。 l c cj_ 4 ・ 2 g  ̄[l 【 3 () 】=l mo ・ 一, 1[ Hg 0 lL 可以 完全掩蔽 ,g l K , . 1 =l 8 ; i l K 0c Y l c g 【d gK l gac ( —l t ( ) 6. 6— 4. 2— 4. 7. 9 d1 gOy n =1 4 I 3 65 4 (Y 1 () ]p 2[ Hg s <<1 O lL , 不会与二 甲酚橙 显色 , 0 mo ・ Hg 能作C d
络合滴定指示剂选择及对终点误差影响
3.金属指示剂必备条件
(1)终点时颜色变化明显,对比度要大; (2)显色反应要快,可逆性良好(防止僵化); (3)KMIn´ 要适当(>104), KMIn´ < KMY´(lg KMY´-lg KMIn´>2 ) (4)稳定易溶于水(便于储存、使用,杜绝氧 化变质)
二、In的选择
1.In选择原则:In在pM突跃范围内色变,尽量 使变色点pMt(pMep)=pMsp 2.pMep的求算:
M + In + Y MY
MIn
分别处理,不能看成是相互竞争的副反应
M + In = MIn (1)仅考虑酸效应: H HIn In´ MIn MIn H 2In K 'MIn lg K 'MIn pM lg
M In'
1
K MIn
MIn 变色点时: 1 此即终点。 In' pMep pMt lg K 'MIn lg K MIn lg In( H )
(3)、消除指示剂封闭的方法
① 被测离子的封闭指示剂时,不宜采用直接滴定。如Al3+的测定 要采用返滴定法 (加入过量EDTA,反应完全后再加入EBT,用标 液Zn2+滴定) ② 共存离子封闭指示剂时,常采用掩蔽的方法消除封闭。如:Al3+、 Fe3+对EBT的封闭可用三乙醇胺(在酸性溶液中加入0来掩蔽; Cu2+、Co2+可用KCN或Na2S(在碱性溶液中加入)来掩蔽。 ③ 若是变色反应的可逆性差造成的,则应更换指示剂。
(3)消除: (1)加热——加快速度
(2)振荡——接近终点时放慢滴定速 度并剧烈振荡
(3)有机溶剂—— 相似相溶
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Et= —— K’MY10--PM’ep
10-PM’ep CMsp
例题
• 在游离氨浓度为0.10mol/L (PH=10.0)的溶液中, 以铬黑T(EBT)为指示剂,用0.020mol/LEDTA滴定 同浓度的Zn2+计算终点误差。 (lgKZnY=16.5,,lgaY(H)=0.45,lgaZn(NH3)=5.49), lgaZn(OH) =2.4,pZnep(EBT) =12.2)
100.43-10-0.43
= * Et1
1010.56 10-2.00
=0.012%
Et = 10-6.28*2-10-6.71*2
2
10-6.71*10-2.00
=0.012%
Et3=
1 1010.56*10-6.71
10-6.71 =0.012%
10-2.00
三种方法计算所得结果一致!
我们完全可以遵循一定的原则,推导出 更多的计算方法。总之,络合滴定终点误 差的计算并不神秘!
解:aZn=aZn(NH3)+aZn(OH)-1
=105.49+102.4-1=105.49 pZn’ep=pZnep-lgaZn=12.2-5.49=6.71 lgK’ZnY=16.5-0.45-5.49=10.56 pZn’sp=1/2(10.56+2.00)=6.28
pZn’=6.71-6.28=0.43
络合滴定的终点 误差计算
宋亚亭 02081106
在 化学分析测试领域,络合滴定法具有特殊的意义.ห้องสมุดไป่ตู้
利用络合滴定法可以直接或间接测定大多数金属 元素.在一般科技书籍中介绍络合滴定终点误差的 计算采用 PM计算公式:
Et= 10 pM-10- pM
(K’MYCMSP)1/2
这种计算法推导过程繁琐,计算中容易出错不 易掌握。
计算络合滴定终点误差,实际上就是计算 络合滴定剂(本文以EDTA 为例)与待测 金属离子M之间在滴定终点时二者物质的 量的差异,即
Et=
nY _ nM nM
上式可近似表达为
Et= [Y’]ep — [M’]ep
CMSP
(1)
PM’计算法
[Y’] ep=
CMSP K’MY10-PM’ep
代入(1)整理得
Goodbye!!
