原子结构与性质知识点归纳
原子结构与性质相关知识点(答案)

原子结构与性质相关知识点1.能层:多电子原子的核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层,并用符号K、L、M、N、O、P、Q…表示相应的第一、二、三、四、五、六、七…能层。
2.能级:多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级。
3.各能层所包含的能级类型及各能层、能级最多容纳的电子数:4.构造原理:核外电子按照能级顺序填充,填满一个能级再填一个新能级的规律称为构造原理。
5.电子填入能级的顺序:1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d,7p…6.能量最低原理:原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
7.电子云:电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。
8.原子轨道:量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
9.泡利原理:在一个原子轨道里,最多只能容纳两个电子,而且它们的自旋状态相反,这个原理称为泡利原理。
10.洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同,这个规则称为洪特规则。
11.基态原子的电子排布遵循能量最低原理、泡利原理和洪特规则。
12.元素周期律:(分周期和族进行比较、不考虑稀有气体元素)原子半径:同周期元素从左到右逐渐减小,同主族元素从上到下逐渐增大。
得失电子能力:同周期元素从左到右得电子能力逐渐增强,同主族元素从上到下得电子能力逐渐减弱。
氧化性:同周期元素从左到右氧化性逐渐增强,同主族元素从上到下氧化性逐渐减弱。
还原性:同周期元素从左到右还原性逐渐减弱,同主族元素从上到下还原性逐渐增强。
化合价:同周期元素从左到右最高正价逐渐增大(除O和F)。
金属性:同周期元素从左到右金属性逐渐减弱,同主族元素从上到下金属性逐渐增强。
非金属性:同周期元素从左到右非金属性逐渐增强,同主族元素从上到下非金属性逐渐减弱。
原子构成知识点总结

原子构成知识点总结1. 原子的结构原子由质子、中子和电子三种基本粒子组成。
质子和中子组成了原子核,而电子则绕着原子核运动。
原子的质子数和电子数相同,因此原子是电中性的。
2. 原子核的性质原子核由质子和中子组成,其中质子的电荷为正,中子是中性的。
原子核的直径约为万分之一到十万分之一的原子直径,但它含有原子的绝大部分质量。
3. 质子质子是原子核中的一种基本粒子,它的质量为1.6726×10^-27千克,电荷为基本电荷的正一(即1.6×10^-19库仑)。
4. 中子中子是原子核中的一种基本粒子,它的质量稍大于质子,电荷为零。
5. 电子电子是原子中的一种基本粒子,它的质量远小于质子和中子,为9.11×10^-31千克,电荷为基本电荷的负一。
电子在原子外部绕原子核运动,形成电子云。
6. 原子的量子化原子的能级是量子化的,即它只能具有确定的能量值。
电子的轨道也是量子化的,它只能出现在一定的能级上,不可能出现在介于两个能级之间的状态。
7. 原子的组成原子由质子、中子和电子组成。
质子和中子的质量和电子质量之比约为1836:1。
因此,原子的质量主要来自于质子和中子,而电子的贡献可以忽略不计。
8. 原子的核电荷数原子核的电荷数等于其中的质子数,它决定了原子的化学性质。
在相同元素的不同同位素中,原子核的电荷数不同,但它们的化学性质相同。
9. 原子的大小原子的大小约为0.1纳米到0.5纳米。
原子的大小由电子云的尺寸决定,它与原子核的大小关系不大。
10. 原子的质量数原子的质量数等于其中的质子数和中子数之和。
在不同元素的同位素中,原子的质量数不同,但它们的化学性质相同。
11. 原子的元素符号原子的元素符号由元素的化学符号与原子的质量数组成。
例如,氧的元素符号是O,氧-16的元素符号是O-16。
12. 原子的化学键原子通过共价键、离子键和金属键等化学键相互结合形成化合物。
共价键是由电子的共享形成的,离子键是由正负离子的相互吸引形成的,金属键是由金属离子的自由电子形成的。
高中化学: 原子结构与性质知识归纳

高中化学:原子结构与性质知识归纳
原子的结构和性质是关于原子的核心概念。
原子是微小的,不可分解的物质组成单位,它是一切物质的基本单位。
原子内部以电子为主要结构物。
电子位于原子核以外在显影期间环绕原子核往复运动着,各种元素的原子通过差异的电子构成,而形成了物质的不同性质。
原子的内部构造也影响着其外在的性质。
在原子核内,核子和中子构成了原子核,它
们就犹如原子小宇宙的基本因素。
核子质量质子用来表示物质化学性质,随着原子引力而
紧紧地结合,这也决定了一种物质的形剂及其在物理性质上的表现。
原子性质可以分为理论性质和实验性质。
理论性质包括原子结构、原子直径、原子电
荷和原子时间等;实验性质包括原子的光谱和吸收光谱、元素的结核量和同位素离子化等。
实际上,性质的研究是在研究原子的内部结构的基础上进行的,研究原子结构有助于
了解原子各种性质,比如化学反应、化学溶解等都与原子结构有关,从而明确了原子各种
性质从而影响物质的行为。
总之,原子的结构和性质对探究物质的本质和应用具有重要意义,因此研究原子的构
造及其性质是物理、化学研究的基础。
只有通过对原子的性质有深入的研究,才能更好地
理解物质的本质,从而发现物质的新的应用,发展包括物理、化学等各个领域。
原子结构与性质

原子结构与性质一、原子核外电子排布原理1.能层、能级与原子轨道(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。
通常用K、L、M、N……表示,能量依次升高。
(2)能级:同一能层里电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f 等表示,同一能层里,各能级的能量按s、p、d、f的顺序升高,即:E(s)<E(p)<E(d)<E(f)。
(3)原子轨道:电子云轮廓图给出了电子在核外经常出现的区域。
这种电子云轮廓图称为原子轨道。
s、p、d、f能级的原子轨道数分别为1、3、5、7,同一能层的相同能级的不同原子轨道方向不一样,但能量相等。
2.基态原子的核外电子排布(1)能量最低原理:即电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
(2)泡利原理每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
(3)洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。
洪特规则特例高考题型归纳(1)----电子排布原子结构示意图、电子排布式、电子排布图(轨道式)全部的、价电子的限定条件的:如多少种运动状态不同的电子、多少种能量不同的电子、最高能层的、最高能级的、有多少成对电子、多少不成对电子、某能级的电子云形状(球形、哑铃纺锤)等等注意:熟悉前四周期各种元素的原子、离子的电子排布,特别注意铬、铁、铜原子和离子。
(离子是在原子电子排布式的基础上从右往左失去电子)例题:1.按要求完成以下试题(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)。
答案D C(2)基态Fe原子价层电子的电子排布图(轨道表达式)为___________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
答案哑铃(纺锤)(3) Zn原子核外电子排布式为________________________________。
原子结构与性质知识点归纳
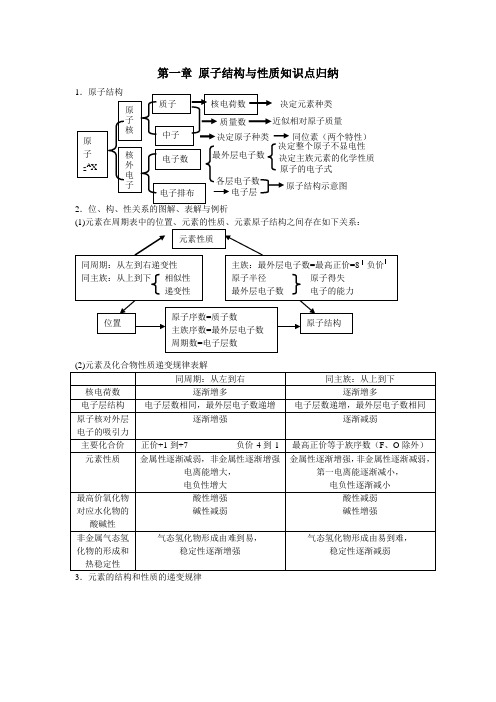
第一章 原子结构与性质知识点归纳2.位、构、性关系的图解、表解与例析3.元素的结构和性质的递变规律同位素(两个特性)4.核外电子构成原理(1)核外电子是分能层排布的,每个能层又分为不同的能级。
(2)核外电子排布遵循的三个原理:a .能量最低原理b .泡利原理c .洪特规则及洪特规则特例(3)原子核外电子排布表示式:a .原子结构简图 b .电子排布式 c .轨道表示式 5.原子核外电子运动状态的描述:电子云 6.确定元素性质的方法1.先推断元素在周期表中的位置。
2.一般说,族序数—2=本族非金属元素的种数(1 A 族 除外)。
3.若主族元素族序数为m ,周期数为n ,则: (1)m/n<1时为金属,m/n 值越小,金属性越强:(2)m/n>1时是非金属,m/n 越大,非金属性越强;(3)m/n=1时是两性元素。
随着原子序数递增① 原子结构呈周期性变化② 原子半径呈周期性变化③ 元素主要化合价呈周期性变化④ 元素的金属性与非金属形呈周期性变化⑤ 元素原子的第一电离能呈周期性变化⑥ 元素的电负性呈周期性变化元素周期律 排列原则① 按原子序数递增的顺序从左到右排列 ② 将电子层数相同的元素排成一个横行 ③ 把最外层电子数相同的元素(个别除外),排成一个纵行周期 (7个 横行) ① 短周期(第一、二、三周期)② 长周期(第四、五、六周期)③ 不完全周期(第七周期)性质递变 原子半径主要化合价元 素 周期表族(18 个纵行) ① 主族(第ⅠA 族—第ⅦA 族共七个) ② 副族(第ⅠB 族—第ⅦB 族共七个) ③ 第Ⅷ族(第8—10纵行) ④结构第二章 分子结构与性质复习1.微粒间的相互作用(2)共价键的知识结构2.分子构型与物质性质(1)微粒间的相互作用σ键π键 按成键电子云 的重叠方式极性键 非极性键一般共价键 配位键离子键 共价键 金属键 按成键原子的电子转移方式 化学键 范德华力氢键 分子间作用力本质:原子之间形成共用电子对(或电子云重叠) 特征:具有方向性和饱和性σ键特征 电子云呈轴对称(如s —s σ键、 s —p σ键、p —p σ键)π键 特征电子云分布的界面对通过键轴的一个平面对称(如p —p π键)成键方式共价单键—σ键共价双键—1个σ键、1个π键共价叁键—1个σ键、2个π键 规律 键能:键能越大,共价键越稳定键长:键长越短,共价键越稳定键角:描述分子空间结构的重要参数用于衡量共价键的稳定性 键参数 共 价 键定义:原子形成分子时,能量相近的轨道混合重新组合成一组新轨道sp 杂化 sp 2杂化sp 3杂化 分类 构型解释: 杂化理论sp 杂化:直线型sp 2杂化:平面三角形sp 3杂化:四面体型杂化轨道理论 价电子理论 实验测定 理论推测 构型判断 分 子 构 型共价键的极性 分子空间构型决定因素由非极性键结合而成的分子时非极性分子(O 3除外),由极性键组成的非对称型分子一般是极性分子,由极性键组成的完全对称型分子为非极性分子。
原子核结构与性质知识点总结

原子核结构与性质知识点总结原子核,这个微小却又极其重要的物质核心,承载着物质世界的基础性质和规律。
让我们一同深入探索原子核的结构与性质,揭开其神秘的面纱。
一、原子核的组成原子核由质子和中子组成。
质子带一个单位的正电荷,而中子呈电中性。
质子数决定了元素的种类,被称为原子序数。
质子和中子的质量相近,约为 167×10⁻²⁷千克。
将质子和中子的质量相加,得到的近似值称为原子的质量数。
质量数等于质子数与中子数之和。
例如,氢原子的原子核只有一个质子,没有中子,其质量数为 1;而碳原子常见的有碳-12 和碳-14 两种同位素,碳-12 的原子核中有 6 个质子和 6 个中子,质量数为 12,碳-14 则有 6 个质子和 8 个中子,质量数为 14。
二、原子核的大小和密度原子核的半径非常小,约为 10⁻¹⁵米到 10⁻¹⁴米的量级。
尽管原子核体积很小,但它却集中了原子几乎全部的质量。
原子核的密度极大,约为 10¹⁷千克/立方米。
这意味着原子核内的物质紧密堆积,其密度远远超过我们日常生活中所接触到的任何物质。
打个比方,如果把原子核比作一颗绿豆,那么整个原子就像一个足球场,可见原子核在原子中所占的体积是极小的。
三、原子核的稳定性原子核的稳定性取决于质子数和中子数的比例以及两者的数量。
一般来说,质子数和中子数相等或接近时,原子核比较稳定。
但对于轻元素,质子数与中子数之比约为 1:1 时稳定;而对于重元素,中子数相对较多时原子核更稳定。
当原子核内的质子数或中子数过多或过少时,原子核就会变得不稳定,可能会发生放射性衰变,释放出粒子或射线,以达到更稳定的状态。
四、原子核的结合能原子核的结合能是指将原子核中的质子和中子完全分开所需要的能量,或者是将分散的质子和中子结合成原子核所释放出的能量。
结合能的大小反映了原子核的稳定性。
结合能越大,原子核越稳定。
例如,铁元素的原子核具有较大的结合能,因此在原子核的形成和变化过程中,趋向于生成更接近铁元素的原子核。
原子结构与性质高考知识点

原子结构与性质高考知识点一、引言原子结构与性质是化学科学的基础。
了解原子结构与性质的知识点,不仅对高中化学的学习有重要意义,也为将来深入学习化学或相关学科打下坚实的基础。
本文将从原子结构与性质的基本概念、电子结构、元素周期表等方面进行论述。
二、原子结构的基本概念原子是构成物质的最小单位,由原子核和围绕核运动的电子构成。
原子核由质子和中子组成,电子带有负电荷,质子带有正电荷,中子则是不带电荷。
原子的质子数等于其原子序数,质子数和中子数之和则等于其质量数。
该结构是由尝试通过实验证据建立的,著名的阴极射线实验(J.J.汤姆逊实验)揭示了原子的基本结构。
三、电子结构电子结构是原子结构与性质中的重要内容。
电子的运动轨道被量子力学描述为能量的程量。
一个电子的运动轨道可以分解为不同的能级,每个能级下有一定数量的子能级,而每个子能级最多容纳一定数量的电子。
表征电子结构的方式是电子排布方式,即由能级、子能级和轨道描述的。
知道了电子结构,我们可以推断出元素的离子价态、元素电子亲和能等重要性质。
四、量子力学与原子结构原子结构与性质不仅与经典物理学有关,量子力学也是解释原子结构与性质的重要理论。
量子力学认为粒子的运动不再是连续的,而是由离散的量子数来决定。
根据不确定性原理,我们无法同时确定位置和动量,这种不确定性在原子尺度下尤其明显。
量子力学为我们提供了更全面、准确的原子结构与性质的解释,并解决了一些经典物理学解释无法解释的现象。
五、元素周期表与原子结构元素周期表是描述化学元素性质的基本工具,它是根据元素的原子序数和元素周期定律所构建的。
元素周期表按照原子结构和性质将所有已知元素进行了系统的分类与整理。
元素周期表以横、竖两个方向分类元素。
纵向按照原子序数排列,横向按照元素周期定律中的元素周期数排列。
元素周期表中的主要分类有金属性与非金属性、金属与非金属、半金属等。
元素周期表的结构与元素性质之间有着密切的关系。
六、原子结构与物质性质原子结构决定了物质的性质。
高中化学选修三 原子结构与性质知识总结

原子结构与性质一 原子结构 1、原子的构成中子N(核素)原子核质子Z(带正电荷元素符号原子结构 决定原子呈电中性电子数(Z 个)体积小,运动速率高(近光速),无固定轨道核外电子 运动特征电子云(比喻) 小黑点的意义、小黑点密度的意义.排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图2、三个基本关系(1)数量关系:质子数 = 核电荷数 = 核外电子数(原子中) (2)电性关系:①原子中:质子数=核电荷数=核外电子数②阳离子中:质子数〉核外电子数 或 质子数=核外电子数+电荷数 ③阴离子中:质子数〈核外电子数 或 质子数=核外电子数-电荷数 (3)质量关系:质量数 = 质子数 + 中子数决定定义:以12C原子质量的1/12(约1.66×10-27kg)作为标准,其它原子的质量跟它比较所得的值。
其国际单位制(SI)单位为1,符号为1(单位1一般不写)原子质量:指原子的真实质量,也称绝对质量,是通过精密的实验测得的.如:一个氯原子的m(35Cl)=5.81×10-26kg。
核素的相对原子质量:各核素的质量与12C的质量的1/12的比值.一种元素有几种同位素,就应有几种不同的核素的相对原子质量,相对诸量如35Cl为34.969,37Cl为36。
966。
原子比较核素的近似相对原子质量:是对核素的相对原子质量取近似整数值,数值上与该质量核素的质量数相等。
如:35Cl为35,37Cl为37。
元素的相对原子质量:是按该元素各种天然同位素原子所占的原子个数百分比算出的平均值。
如:Ar(Cl)=Ar(35Cl)×a%+ Ar(37Cl)×b%元素的近似相对原子质量:用元素同位素的质量数代替同位素相对原子质量与其原子个数百分比的乘积之和.注意①、核素相对原子质量不是元素的相对原子质量.②、通常可以用元素近似相对原子质量代替元素相对原子质量进行必要的计算。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章原子结构与性质知识点归纳
山东临沂市莒南三中(276600) 张琛 山东省烟台市蓬莱四中(265602)
马彩红
1原子结构
电子的吸引
外)
电负性逐渐减小
电负性增大
主要化合价
正价+1到+7
负价-4到 最高正价等于族序数(F 、O 除
元素性质 金属性逐渐减弱,非金属性逐
金属性逐渐增强,非金属性逐 渐增强
渐减弱,第一电离能逐渐减小,
原
2•位、构、性
质子
核电荷
决定元素种
系的图解、表解与例析_►近似相对原子
(1原元素持中中子置、元素的性质子种素原子位原子不特下关系:
子决定主族元素的化学
原子的电子式 子结构最高正价=8-
F 原子纟逐渐增多
电子层数递增,最外层电子数
相同 原子核对外
逐渐增强
逐渐减弱
-1
电离能增大, 层
:电子排
同主族:从上到下
同主族:从上 位置
电子层结构
电子层数主族序数最=
递增
外 电 T *子 及化左
核电荷数
」到下一同周期::从左至负价
核外电
1族(18〈
个)
非金属性
②副族(第I B 族一第% B 族共七 子是分能层排
3.元素的结构和性质的递变规律
随着原子序数递增
①原子结构呈周期性变化序数递增的顺序从左到右排列
排②原则子半径呈周期性变化层数相同的元素排成一个横行
个横行)②长周期(第四、五、六周期)
厂金属性强
元素性质
Y
主要化主族(第I A 族—第% A 族共七验标志
元素周
、-③元素主要化合价 周期,7①外层变化第同的元三周别别)除外)
性质递变^原子半径 弱判断实
电子排布表示式:a .原子结构简图 b •电子排布式c •轨道表示式
5.原子核外电子运动状态的描述:电子云 6 .确定元素性质的方法
1 .先推断元素在周期表中的位置。
2 .一般说,族序数一2二本族非金属元素的种数(1 A 族 除外)
3 .若主族元素族序数为 m 周期数为n 贝y : (1)m/n<1 时为金属,m/n 值越小,金属性越强: ⑵m/n>1
时是非金属,m/n 越大,非金属性越强; ⑶m/n=1时是两性元素
⑵核外电子 排布遵循的三 个原理:
a .能量最低 原
理 b .泡 利 原 理 c .洪特规则及 洪特规则特例
(3)原子核外
布的,每个能层又分为不同的能级。
