胎鼠脑组织 病理切片 步骤
大脑切片图(特选资料)
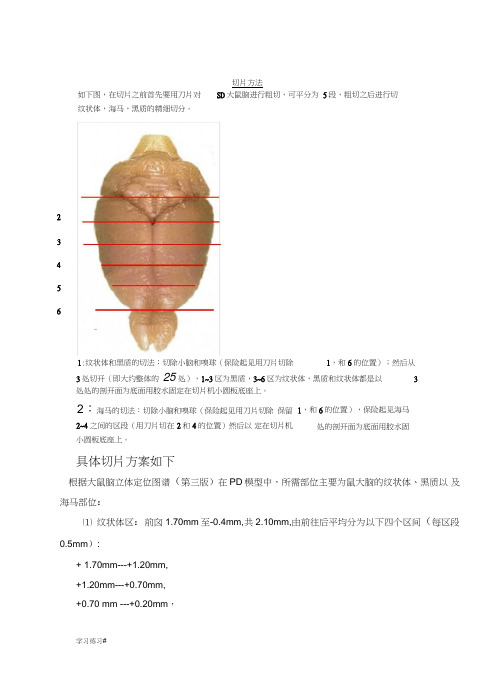
切片方法如下图,在切片之前首先要用刀片对 SD 大鼠脑进行粗切,可平分为 5段,粗切之后进行切纹状体,海马,黑质的精细切分。
3处切开(即大约整体的 25处),1~3区为黑质,3~6区为纹状体,黑质和纹状体都是以 3处处的剖开面为底面用胶水固定在切片机小圆板底座上。
2:海马的切法:切除小脑和嗅球(保险起见用刀片切除 保留2~4之间的区段(用刀片切在 2和4的位置)然后以 定在切片机小圆板底座上。
具体切片方案如下根据大鼠脑立体定位图谱(第三版)在PD 模型中,所需部位主要为鼠大脑的纹状体、黑质以 及海马部位:⑴ 纹状体区:前囟1.70mm 至-0.4mm,共2.10mm,由前往后平均分为以下四个区间(每区段 0.5mm ):+ 1.70mm---+1.20mm, +1.20mm---+0.70mm, +0.70 mm ---+0.20mm ,学习练习#1,和6的位置);然后从1,和6的位置),保险起见海马处的剖开面为底面用胶水固2 3 4 5 61:纹状体和黑质的切法:切除小脑和嗅球(保险起见用刀片切除蕊丸1乂供参肴,豆僭旋脚可测除+0.20mm ——0.40mm ,可分为四个小瓶来装片,于10ml 的棕色玻璃瓶中(内盛6ml 的0.01mM PBS,pH7.4配制 的5%多聚甲醛溶液),每个区段长度为0.50mm ,理论上可切30卩m 的脑片16张,实际保留 时至少保证12张脑片。
并从前到后标明区段1(+1.70mm-+1.20mm),区段2(+1.20mm-+0.70mm), 区段 3(+0.70mm-+0.2mm),区段 4(+0.2mm-- -0.4mm ).⑵ 黑质区:前囟-4.52mm 至-6.04mm,共1.52mm,理论上一共可切 56张30卩m 的脑片。
进入 脑区-4.16mm 后先连续切100卩m 的脑片共3片,接着切30卩m 的脑片共2张,均不保存,理论 上此时已到-4.52mm 的脑区位置。
病理组织切片的制作过程

病理组织切片的制作过程1.取材组织取材的方法是制作切片的一个重要程序,根据教学、科研及外检的具体要求取自人体(外科手术切除标本、活检标本、尸检标本)或动物,并确定取材的部位和方法。
取材者需要掌握解剖学、组织学、病理学的基本理论知识,还要掌握实际操作技术,每个组织器官的取材都有一定的部位和方法,不能任意切取组织作为制片材料,不然,无法达到教学、科研和临床诊断的目的,具体要求如下:(1)材料新鲜:取材组织愈新鲜愈好,人体组织一般在离体后,动物组织在处死后迅速固定,以保证原有的形态学结构。
(2)组织块的大小:所取组织块较理想的体积为2.0cm×2.0cm×0.3cm,以使固定液能迅速而均匀地渗入组织内部,但根据制片材料和目的不同,组织块的较理想体积也不同,如制作病理外检、科研切片,其组织块可以薄取0.1~0.2cm 即可,这样可以缩短固定脱水透明的时间,若制作教学切片厚取0.3 ~0.5cm,这样可以同一蜡块制作出较多的教学切片。
(3)勿挤压组织块: 切取组织块用的刀剪要锋利,切割时不可来回锉动。
夹取组织时切勿过紧,以免因挤压而使组织、细胞变形。
(4)规范取材部位: 要准确地按解剖部位取材,病理标本取材按照各病变部位、性质的不同,根据要求规范化取材。
(5)选好组织块的切面:根据各器官的组织结构,决定其切面的走向。
纵切或横切往往是显示组织形态结构的关键,如长管状器官以横切为好。
(6)保持材料的清洁:组织块上如有血液、污物、粘液、食物、粪便等,可用水冲洗干净后再放入固定液中。
(7)保持组织的原有形态:新鲜组织固定后,或多或少会产生收缩现象,有时甚至完全变形。
为此可将组织展平,以尽可能维持原形。
2.固定(1)小块组织固定法:这是最常用的方法,从人体或动物体取下的小块组织,须立即置入液态固定剂中进行固定,通常,标本与固定液的比例为1:4~20,但组织块不宜过大过厚,否则固定液不能迅速渗透。
鼠类标本制作参考

鼠类标本制作参考一、工具及材料:乙醚、塑料袋:用于捕获的野外鼠体表寄生虫处理。
直尺、标签、采集本、电子天平:测量及记录动物标本的名称、身体特征、性别、采集地点等。
解剖刀、解剖剪、骨剪、长镊子、小镊子、解剖盘、滑石粉:用于标本的剥皮、解剖。
针、线:用于标本皮毛的缝合。
不同粗细铁丝(或竹筷)、钢丝钳、尖嘴钳、棉花(脱脂棉和普通棉花各半):用于标本内部填充及造型。
大头针、木板(硬纸板或泡沫板):用于标本制作后的固定。
取脑勺(取铁丝一段,前端砸扁弯成勺状)、黄粉虫(面包虫)、84消毒液、烧杯、记号笔(也可用锅煮沸头骨剔除肉质):用于头骨清理。
防腐剂(砒霜防腐粉:砒霜、明矾、樟脑按2∶7∶1研成粉末混匀;硼酸防腐粉:硼酸粉、明矾粉、樟脑粉按5∶3∶2混匀即可,可代替砒霜防腐粉,较砒霜防腐粉差,但使用较安全。
)二、操作步骤:1.标本处死:对实验室饲养鼠类标本一般采用断颈处死,对于反抗比较激烈的可以先用乙醚麻醉后再进行断颈处死。
2.体表寄生虫处理:野外捕获的鼠类连同鼠布袋放入塑料袋内并倒入适量乙醚扎紧袋口,密闭十分钟后取出,收集鼠布袋上面的体表寄生虫。
3.记录:辨别鼠种类和性别,测量其体重、体长、耳长、后足长、尾长,做好记录。
按照标签内容填写采集和测量信息备用。
4.剥皮:将鼠体仰放在解剖盘上用解剖刀沿腹部正中肛门前部开始向胸骨后端切开皮肤,开口大小为略大于鼠头为宜,操作时用力不要太猛,以免将腹腔切破而污染皮毛,然后用刀背或小镊子将切口与后肢相连的皮肤与肌肉分离,将后肢分别往切口处推出,剪断膝关节并除去小腿上的肌肉,剥离背部等周围的肌肉,再把生殖器、直肠与皮肤联接处剪断,清理好尾基部周围的结缔组织,用左手捏紧尾基部,右手捏住尾椎骨缓慢往上拉,直至完全抽出,若出现体液渗出可撒上滑石粉避免污染毛皮,继续剥至前肢,在肘关节处剪断,清除肌肉再剥至头部,用解剖刀紧贴头骨至耳部,剪或切断耳根至眼部时,可看到一层白色网膜状的眼睑缘,细心切开网膜的下端后,即露出眼球了。
动物病理玻片制作方法

动物病理玻片制作方法一、引言动物病理学是研究动物疾病病因、发病机制和病理变化的学科。
在动物病理学研究中,制作病理玻片是非常重要的步骤之一。
本文将介绍动物病理玻片的制作方法。
二、材料准备制作动物病理玻片所需的材料包括:1. 动物组织标本:包括取自动物器官的组织块或细胞涂片等。
2. 石蜡:用于包埋组织标本。
3. 切片机:用于切割组织标本的切片机器。
4. 玻片:用于固定切割好的组织标本。
5. 碱性溶液:用于去除石蜡。
6. 脱水溶液:用于去除水分。
7. 染色剂:用于染色组织切片。
8. 封片剂:用于封闭组织切片。
三、制作步骤1. 组织标本固定:将取自动物器官的组织块或细胞涂片等进行固定,常用的固定剂有福尔马林和缓冲形式的乙醛等。
2. 组织标本包埋:将固定好的组织标本放入石蜡中,经过一系列的处理,使其逐渐渗透并替代组织中的水分,最终形成石蜡包埋的组织标本。
3. 组织切片:将包埋好的组织标本放入切片机中,用刀片切割成薄片,通常为4-6微米。
4. 切片处理:将切好的组织标本片放入碱性溶液中,去除石蜡。
5. 脱水处理:将去除石蜡的组织标本片放入脱水溶液中,逐渐去除水分。
6. 染色:将脱水处理后的组织标本片放入染色剂中,使其染色,常用的染色剂有血液学常用的伊红染色和组织学常用的苏木精-伊红染色等。
7. 清洗:将染色好的组织标本片放入清水中洗涤,去除多余的染色剂。
8. 封片:将清洗干净的组织标本片放入封片剂中,再放入加热的平台上,使其干燥并形成封闭的玻片。
四、注意事项1. 在制作病理玻片的过程中,要保持操作环境的清洁和无尘。
2. 切片机的刀片要保持锋利,以确保切割出的组织标本片薄而均匀。
3. 染色剂的选择要根据研究目的来确定,不同的染色剂可以突出不同组织结构和病理变化。
4. 制作玻片时,要注意标本的编号和记录,以免混淆和丢失。
5. 制作好的病理玻片要妥善保存,避免受潮和损坏。
五、结论动物病理玻片的制作是动物病理学研究中不可或缺的一环。
脑组织采集操作流程

脑组织采集操作流程概述本文档旨在提供脑组织采集的操作流程,确保实验的顺利进行。
准备工作1. 确保实验室环境整洁、无菌。
2. 准备好以下工具和材料:- 手套- 外科刀具- 确保脑组织完整的冰冻- 乙醚或异氟醚的麻醉药物操作步骤1. 麻醉动物:- 将动物置于适当的麻醉设备中。
- 使用乙醚或异氟醚等麻醉药物使动物失去知觉。
2. 杀死动物:- 确保动物已经完全麻醉。
- 使用合适的方式将动物安全地杀死。
3. 切割头皮:- 用外科刀具将动物的头部皮肤切开,暴露出颅骨。
4. 打开颅骨:- 使用外科刀具小心地在颅骨上切开一个小孔。
- 用鹦鹉嘴钳将颅骨完全开放,暴露出脑组织。
5. 采集脑组织:- 使用手套小心地将脑组织取出,并放入冰冻中。
- 确保脑组织完整,并尽量避免污染。
6. 处理采集的脑组织:- 将采集的脑组织储存到合适的中,确保冷冻保存。
- 根据后续实验的需求,可以进行进一步处理,如切片等。
清理工作1. 将使用过的刀具和其他工具进行高温高压灭菌处理。
2. 清理实验室环境,保持整洁和无菌。
注意事项:- 在进行脑组织采集实验前,需要得到合适的伦理审批,并遵守相关的法律法规。
- 操作过程中要保证自身和他人的安全,注意使用麻醉药物时的剂量和注意事项。
- 在进行切割和操作时,要小心谨慎,避免对动物和人员造成伤害。
- 采集和处理脑组织时要保持无菌条件,避免可能的污染。
以上为脑组织采集的操作流程,希望能对您有所帮助。
小鼠脑组织病理总结

冰冻切片的制作
• 取材和固定: 灌注后立即切取组织块,并 快速投入固定液中,或者处死后直接冷冻。
• 脱水和透明:梯度蔗糖 • 包埋:OCT,3%聚乙烯醇。 • 切片制作:切片 • 贴片:直接贴 • 固定:冰冻丙酮3-5分 • 保存:-20°C
灌注
0.5%戊巴比妥钠100mg/Kg麻醉小鼠,5分钟 左右小鼠麻醉好,仰卧位固定四肢,用酒 精棉球擦胸腹部毛,前开皮肤暴露胸部肌 肉层,剑突上成V型剪开胸廓,暴露心脏, 剪掉右心耳(即视野下心脏上色暗红组 织),与心尖处30°角刺入左心室,37° 左右生理盐水约10ml缓慢注入,冲净血液 止,换4%多聚甲醛溶液(4°预冷),1020分钟,鼠僵硬为好。
切片
• 石蜡:冷水——温水(54°-56°)—— 烤片(80°) 切好烤片后可以室温保存。
• 冰冻:切片温度-18°—-20° 直接贴 切好于冰冻丙酮中固定5分后-20° 保存。
固定方法注意事项
1.组织块大小2cmx2cmx0.5cm 2.组织标本应及时放入固定液中,切忌干涸 3.组织固定后必须冲洗,除去多余的固定液 4.一般固定剂温度以室温,某些病毒则须低温
• 苏木素:
• 100g硫酸铝钾加热溶于1250ml水中 • 5g苏木素精粉末溶于100ml无水乙醇中
• 溶解后硫酸铝钾稍凉,加入醇溶苏木素煮沸 20-30分,加入g氧化汞煮沸2分钟,
注意事项
• 安全 • 解剖位置 • 液体配制 • 染色时间 • 原因查找
Thank you!
脱水和透明,浸蜡
• 石蜡切片:75%,80%,85%,90%,95% (2个),无水乙醇(2)中每个4小时-过夜, 正丁醇1-2天。二甲苯(2个)20-30分钟。 三个蜡,每个大于2小时。
动物病理解剖学实验教程

动物病理解剖学实验教程动物病理解剖学实验教程是动物医学专业中一门重要的实践课程,旨在通过实验操作,加深学生对动物病理学的理解,提高其病理诊断能力。
以下是一些常见的动物病理解剖学实验教程:1. 实验一:动物病理切片的制作与观察实验目的:通过制作动物病理切片,观察病变部位的组织学变化,学习病理学的基本概念和诊断方法。
实验材料:动物病理组织块、显微镜、切片刀、染色剂等。
实验步骤:(1)将病理组织块放入包埋盒中,用石蜡或树脂等材料进行包埋。
(2)将包埋好的组织块进行切片,制作成病理切片。
(3)将切片放在显微镜下观察,记录病变部位的组织学变化。
(4)对病变部位进行病理诊断,并与正常组织进行对比分析。
2. 实验二:动物尸体剖检与病理诊断实验目的:通过动物尸体剖检,观察动物内脏器官的病理变化,学习病理诊断的方法和技巧。
实验材料:动物尸体、手术刀、手套、器官固定液等。
实验步骤:(1)进行动物尸体剖检前的准备工作,如穿戴手套等。
(2)按照规定的剖检程序,对动物内脏器官进行观察和检查。
(3)记录内脏器官的病理变化,并进行病理诊断。
(4)对病变器官进行组织取样,制作成病理切片,进一步观察病变。
3. 实验三:肿瘤的病理诊断与鉴别实验目的:通过观察动物肿瘤的病理切片,学习肿瘤的分类、分级和鉴别诊断方法。
实验材料:动物肿瘤病理切片、显微镜、染色剂等。
实验步骤:(1)将肿瘤病理切片放在显微镜下观察,记录肿瘤的组织学特征。
(2)根据肿瘤的组织学特征,对肿瘤进行分类和分级。
(3)学习不同类型肿瘤的鉴别诊断方法,对比正常组织与肿瘤组织的差异。
4. 实验四:呼吸系统病理诊断实验目的:通过观察动物呼吸系统的病理变化,学习呼吸系统疾病的诊断方法和技巧。
实验材料:动物呼吸系统病理切片、显微镜、染色剂等。
实验步骤:(1)将呼吸系统病理切片放在显微镜下观察,记录病变部位的组织学变化。
(2)学习呼吸系统疾病的诊断标准和方法,如肺炎、支气管炎等。
取小鼠脑组织

丁香园上面总结的方法,排版有点乱。
其实过程与大鼠近似,我的经验是:1.?材料准备;大剪刀、眼科剪、眼科镊、大镊子、滤纸、竹签等;2.?步骤:处死小鼠,取头颅;剪开皮肤,漏出颅骨;用大尖镊子夹住两侧眼眶,用眼科剪稍剪除颅骨中线;再用眼科镊夹住颅骨从内向外夹,从下向上逐步去除颅骨;当全脑露出时,再用眼科镊去除脑膜和血管;然后用竹签从嗅球处向下取出全脑,即可。
3.?注意事项:用力轻柔,否则容易弄破脑部;用剪刀剪颅骨时,一定要贴壁向上剪,否则容易剪破脑部;去除脑膜时,不能硬拉,否则容易弄破大脑;取出全脑时应把头顶朝下,用竹签轻轻取出,离桌面也不要太远、高;若留病理,建议一定要取完整无损的大脑。
做免疫组化的话,稍微麻烦一点儿,因为脑组织含水量多,要固定的好,就需要先灌注。
先麻醉小鼠剪开胸腔,找到心脏,从心尖入针,剪开右心耳先用生理盐水灌注直到从心耳流出来的水清亮了再改用固定液(一般是4%多聚甲醛)灌注至小鼠四肢僵硬小鼠只需要用注射器就行了,我做的25~35g的小鼠一般用50mLNS+30mL多聚甲醛。
具体步骤:常规麻醉小鼠,将其固定,用剪刀剪开胸部皮肤,暴露出皮下组织,剪开时注意钝性分离,以免误伤。
然后用镊子提起剑突,用剪刀剪开胸腔,剪断两侧肋骨,暴露整个胸腔,小心误伤肺及心脏、大血管。
用镊子撕开心包膜,暴露心脏,用眼科剪剪开右心耳,然后提起心尖将准备好的生理盐水注射器插入左心室,注射,注射时小心针头滑脱。
生理盐水灌流至肺和肝的颜色都变成灰白色即可。
然后用多聚甲醛灌流,针孔最好是同一个,多聚灌流时小鼠四肢会抽搐,待抽搐结束,小鼠僵硬即可。
取下小鼠,用剪刀在颈部离断头颅,用剪刀在小鼠头颅中间皮肤剪一刀,将两边皮肤向下翻用手捏住,暴露整个颅骨,用眼科剪从脊髓端插入椎孔,沿着颅正中线剪开颅骨,注意剪刀向上翘一些,以免误伤脑组织,剪开后用弯眼科镊分离颅骨,小心分离,直至暴露整个大脑,然后用弯镊伸入颅底离断颅底神经,就可以取出整个脑子了。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胎鼠脑组织病理切片步骤引言概述:
胎鼠脑组织病理切片是一项重要的实验技术,用于研究胎儿发育过程中的神经系统疾病。
通过对胎鼠脑组织进行病理切片,可以观察和分析组织的形态结构、细胞组织学和病理学变化,为研究胎儿神经系统疾病提供重要的依据。
本文将从胎鼠脑组织病理切片的步骤、技术要点、切片染色、显微镜观察和结果分析等方面进行详细阐述。
正文内容:
1. 步骤
1.1. 选取合适的胎鼠
在进行胎鼠脑组织病理切片前,首先需要选择合适的胎鼠。
一般选择胎龄较大的胎鼠,以确保其神经系统已经发育到一定程度。
1.2. 组织固定
将选取的胎鼠脑组织进行固定处理,常用的固定剂包括10%的中性缓冲福尔马林和4%的聚乙烯醇。
固定时间一般为24-48小时,以确保组织充分固定。
1.3. 组织处理
固定后的胎鼠脑组织需要进行脱水、透明化和浸渍等处理。
脱水处理常用乙醇梯度浓度,透明化处理常用甘油和二甲苯等溶剂。
1.4. 切片制备
将经过处理的胎鼠脑组织进行切片制备。
常用的方法有冰冻切片和石蜡包埋切片两种,选择合适的方法根据实验需要和设备条件来决定。
1.5. 切片染色
制备好的切片需要进行染色处理,以增强组织结构的对比度。
常用的染色方法有血液学染色、组织学染色和免疫组织化学染色等。
2. 技术要点
2.1. 切片厚度
胎鼠脑组织切片的厚度一般为4-6μm,厚度的选择需要根据实验需求和显微镜的分辨率来决定。
2.2. 切片方向
切片方向的选择也十分重要,一般选择垂直于组织结构的方向进行切片,以获得更准确的组织形态信息。
2.3. 切片保存
制备好的切片需要进行保存,常用的方法是将切片放置在玻片上,用封片剂密封,然后存放在干燥、阴凉的地方。
3. 切片染色
3.1. 血液学染色
血液学染色常用于观察胎鼠脑组织中的血管结构和血细胞情况,常用的染色剂有伊红染色和苏木精染色。
3.2. 组织学染色
组织学染色可以观察组织细胞的形态和结构,常用的染色剂有苏木精-伊红染色和伊红-胚胎红染色。
3.3. 免疫组织化学染色
免疫组织化学染色可以检测特定蛋白质的表达情况,常用的染色方法有免疫组织化学染色和免疫荧光染色。
4. 显微镜观察
制备好的切片需要使用显微镜进行观察和拍摄。
通过显微镜观察,可以获得切片中组织结构和细胞学变化的详细信息。
5. 结果分析
在观察和拍摄完胎鼠脑组织切片后,需要对结果进行分析。
根据切片染色的结果,可以进一步研究胎儿神经系统疾病的发生机制和病理变化。
总结:
胎鼠脑组织病理切片是研究胎儿神经系统疾病的重要手段。
通过严格的步骤和技术要点,结合适当的切片染色和显微镜观察,可以获得准确的组织学和病理学信息。
对于研究胎儿神经系统疾病的机制和治疗方法具有重要的意义。
