第六节_α_β-_不饱和醛、酮.
不饱和醛酮及取代醛酮

CN -
C CH
二苯羟乙酮 (安息香)
22
注意:安息香缩合反应的原子利用率高达 100% , 但其使用的催化剂 KCN 有剧毒,催化剂改成维生素
B1后,这个反应更符合绿色化学的要求。
机理:
O C6H5
CN CH +
O
-
C6 H5 C H CN
O
H + 转移
OH C6 H5 C CN
C6H5 CH
N H
O
RCH
N
CH2 C
H(R,)
O
例: C6H5 CH
CHC C6H5
KCN , CH3COOH C2H5OH
6
O
C6H5CH CH2 C CN
C6H5
93~96%
例:
O
+
HCN
(C2H5)3Al
O CN
85% 2. 加RMgX
O
OH
C6H5CH
CH
C CH3
1. C2H5MgBr 2. H3O
1. LiAlH4 2. H2O
CH2
CH C CH3
CH3CH CHCH 2OH
CH3CH2CH2CHO
17
H2 , Ni 室温
CH3CH CHCHO
O
H2 , Ni 高温
CH3CH2CH2CH2OH
O
例:
CH3 O
+
H2
Pa C
100%
1.Et2O 2.H2O
CH3
OH
例:
CH3
+
CHO
LiAlH4
摩尔消光系数
ε
例: 对甲苯乙酮:
醛和酮基本概念和反应机理

① M g,T H F
B r(C H 2)3C O C H 3 ② H 2O ,H +
难点
亲核加成反应的立体化学、羟醛缩合反应等
本章提纲
第一节 醛、酮的命名和结构 第二节 醛、酮的物理性质和光谱性质 第三节 醛、酮的化学性质 第四节 亲核加成反应历程 第五节 醛、酮的制法 第六节 重要的醛、酮 第七节 不饱和羰基化合物
❖醛和酮分子中都含有羰基。
O (H)
RCH
醛
O R C R'
酮
❖醛基的C—H键在2750 cm-1附近有一个非常特征的吸 收峰。
❖乙醛的红外光谱:
1727 cm-1为C=O键的伸缩振动,2846 cm-1和2733 cm-1 为醛基C—H键的伸缩振动; 3001 cm-1为甲基C—H键的伸缩振动,1350 cm-1为甲基 C—H键的弯曲振动。
❖苯乙酮的红外光谱:
CH2
CH3 CH2
CO
(CH2)12
3-甲基环十五酮(麝香酮) 3-methylcyclopentadcanone
CHO CHO
1,2-萘二甲醛 1,2-naphthalene dicarbaldehyde
O CCH(CH3)2
2-甲基-1-环己基-1-丙酮 1-cyclohexyl-2-methyl-1-propanone
C O+H HCCNH
CN C
O H
❖由于HCN的亲核性较弱,反应要在碱催化下进行。
H C N + O H -
H 2 O + C N -
CO + C N - CO - H C NCO H + C N -
第六章 加成反应(完)

H H CH3 H
CH3 H H
H C(CH3)3 HX H
C(CH3)3 H (CH3)3C
烯烃的氧化
硼氢化
δ C
+
δ C H
H BH2
+ δ δ + H BH2 -
C C H
π -络合物
H BH2 C C H
H C C H B
3
H BH2 C C H
H2O2 OH-
H OH C C H
反式加成(anti addition)
H ArHC CHR + HX X ArHC CHR X ArHC H CHR
“离子对”,碳正离子中心的稳定性较高,碳氢键 的形成不需要卤离子的协同进攻。 由于中间体为碳正离子,因此易被具有亲核性的溶 剂捕获,发生重排等作用。
加成方式 顺式加成:
Nu-
E+ 顺式加成 Nu
E
碳碳双键与苯基共轭的烯烃和HX的加成反 应主要给出顺式加成产物
H3C ( CH 2 )5 CH
.
H3C ( CH 2 )5 CH
.
多卤代烷的活性顺序: (1)CBr4>CBrCl3>CCl4>CH2Cl2>CH3Cl (2)烃基对反应的影响:稀键在末端,CX3—加在末 端碳上,如果烃基是推电子的或有动态+C效应者, 加成速率加快: Ph,CH3>H>PhCH2>CH2Cl>CH2CN 说明:链式自由基加成是亲电性的
CH3CHCH2Br
+
CH3CHCH2Br
CH3CHCH2Br
CH2Br CH2Br
链引发阶段,游离基引发剂——过氧化苯甲酰分子 中的 —— O-O 键发生均裂,生成苯甲酰氧游离 基;后者接着与溴化氢作用,生成溴游离基。链 传递阶段,在每消耗一个溴游离基生成产物—— 1-溴丙烷的同时,生成一个供下一步反应的溴游 离基,直至链终止。因此反应总的结果,得到了 形式上“反马氏定则”的产物。
有机合成化学:第六章 缩合反应
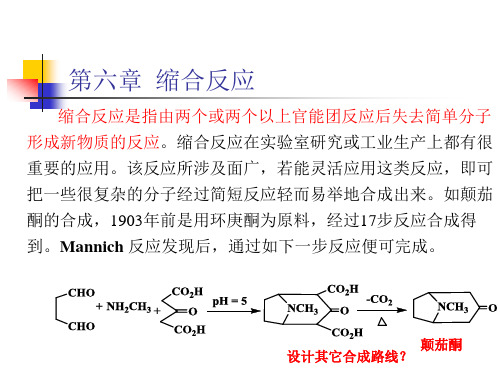
第六章 缩合反应
上例是由于选择不同的起始原料,而选择不同的合成路线,使 产品成本大大降低。如果没有很好的路线选择时,可以通过优化 反应条件,提高产物的收率,降低成本。从产品收率上讲,能提 高1-5%。我们可能认为没什么意义,可对企业讲,产品成本会降 低2-8%左右。如果一个产品产值上亿时,可估算一下其价值了。 所以,一个化工产品刚上市时价格较高,随着生产时间延长,价 格逐渐降低,很大可能是由于生产工艺和生产条件的改变所致。
-CO2
CH3CH CH2CO2H
H3C
O O O
60~76%
CH3NO2 + H3CCH
C H
CO2C2H5
NaOC2H5 CH3CH CH2CO2C2H5
55%
CH2NO2
第六章 缩合反应 CH3
CN
PhCH CO2C2H5 + H2C
C H
CN
KOH 83%
CN
PhC CH2CH2CN CO2C2H5
LDA
H3C
CH3
第六章 缩合反应
羰基化合物烷基化最大负反应是O-烷基化产物。如:
副产物
第六章 缩合反应
LDA CH3(CH2)3CO2CH3 BrCH2CH
CH2
CH3CH2CH2CH CO2CH3 CH2CH CH2
LDA
CH2CH3
C2H5Br CH3CH2Байду номын сангаас CO2CH3
可以分步引入
90%
5. Knoevenagel反应:
这类反应的特点是一个亚甲基上连接两个吸电子基团,使
得其氢活性明显提高,反应较易进行。一般使用弱碱 (有机胺)
不饱和醛酮

2.β-羟基醛酮
易脱水而一般的醇在碱性溶液中是稳定的. 酸催化:通过烯醇脱水 碱催化:通过烯醇盐进行
3. γ-和δ -羟基醛酮
与环状半缩醛形成动态平衡, 既有羟基醛酮的性质,又有环状半缩醛的反应.
CH3CH(OH)CH2COCH3
H2SO4
OH-
CH3CH=CH-COCH3 (比一元醇快)
CH3CH=CHCOCH3
1) RMgX
1,2-加 成 产 物 为 主 不 饱 和 醛 (1,2-加 成 产 物 为 主 )
2)H2O
不 饱 和 酮 甲 基 酮 (1,2-加 成 为 主 )
其 他 酮 (1,4-加 成 为 主 )
例:
KCN ,HOAc
C6H5CH=CHCOC6H5
EtOH
C6H5CH(CN)CH2COC6H5 (93-96%)
反应特点
亲核加成 亲电加成
1,2-加 成 和 1,4-加 成 ( 共 轭 加 成 )
二 反应(Reactions)
通式 C=C C=O + HNu 43 21
1,2-加 成
Nu
C=C CHOH
1,4-加成 [C-C=C-OH]
H
Nu
重排 C-C-C=O 羰基化合物
( 表 现 上 3,4-加 成 )
练习:完成下列转变:
O KOH
+ CH2=CHCOCH3
O
O CH2CH2COCH3
O
O CH2CH2COCH3
NH C6H6
O
分子内缩合
O
+ H2O
O
O
OH-
OH-
or
+
O
[理学]第六章 羰基化合物的反应
![[理学]第六章 羰基化合物的反应](https://img.taocdn.com/s3/m/f28edb13f111f18583d05a59.png)
sp3杂化 四面体
产物中基团拥挤程度增大。
R 越大,妨碍Nu:从背后进攻C原子。
6.2 羰基加成反应及产物
a. 与水加成
O
H+或OH-
OH R' + H2O R C OH R'
R
C
除甲醛、多卤代醛外,其它醛的水合反应平衡偏向 左边。
(2)与ROH的加成
H+
OCH2CH3 CH3CH OH
CH3CH=O + CH3CH2OH
H
O
C2H5
PhH
Ph H H C2H5 O
R H H Ph C2H5 OH
+
H
O
C2H5
1 RMgX 2 H2O
PhH
OH H H Ph C2H5 R
35oC R CH3 C6H5 (CH3)2CH (CH3)3C -70oC R (CH3)3C CH3
主 2.5 > 4 5 49
: : : :
H O O
L
R
S
Nu-
C2H5 H C6H5
O C C CH3
C 2 H5 H C6H5
LiAlH4 乙醚
OH H CH3
H2 O
C
C
+
C2H5 H C6H5
C
C
H OH CH3
75%
25%
当羰基和一个手性中心连接时,反应符合 克莱姆规则一。
6.5 碳负离子
O R C CH3
-
OH
O R C
CH2
第六章 羰基化合物的反应
6.1 羰基化合物的反应机理 6.2 羰基加成反应及产物 6.3 加成-消除反应 6.4 羰基化合物的反应活性和加成的立体选择性 6.5 碳负离子 6.6 各种重要的缩合反应 6.7 羰基与叶子立德的反应 6.8 羧酸衍生物的亲核加成 6.9 亲核性碳 6.10 分子内催化作用
【有机化学】α, β-不饱和醛酮 、 醌、羟基醛酮 、酚醛和酚酮、紫外光谱
+ HCN(CH3)2 2) H2O
DMF
CHO 主要产物
反应机理:
POCl3 +
O
O H C N(CH3)2 Cl
: :
Cl2PH-O-CH-N(CH3)2
O
Cl2P O C=N+(CH3)2Cl-
H
H Cl
C=N+ (CH3)2Cl2PHO2-
OH
+
H
+
Cl C=N(CH3)2
OH
H2O
Cl C N(CH3)2 H
一 反应
1. 1-羟基酮的反应
(1) 银镜反应
(2) 与苯肼作用生成脎(osazones)(成脎反应).
CH2OH
OH-
R-C=O
1-羟基酮
CHOH OH-
R-C-OH 烯二醇
CHO
R-CH-OH a-羟基醛
C6H5COCH2OH + 3 C6H5NHNH2
N
H3C C
N
HC H N
C6H5
+
C6H5NH2
ArCHO
CN-
O-
Ar-C-H
H2O
OH-
OH
Ar-C-H
CN
CN
OH-
OH
Ar-C-
H2O
CN
ArCHO OHO-
O- OH
Ar-C-C-Ar
H2O
OH-
H CN
OHOH OH-
Ar-C-C-Ar
H2O H CN
-CN-
OHO
Ar-C-C-Ar +CN+ Ar-C-C-Ar
H CN
H
α, β不饱和醛酮
查耳酮类
rt 30min
饱和酮
6.Diels-Alder反应 Diels-Alder反应
+
CHO
α,β−不饱和醛酮是很好的亲二烯体
CHO
7.插烯作用 7.插烯作用
CH3CHO +
CH3CHO
1. OH CH3CH CHCHO CH3CHO 2. △
在共轭体系中电子的流动性较大,羰基的电子效应可通过共轭体系系传递到碳上 插烯规则:在A-B化合物的A和B之间,插入一个或多个-CH=CH-,生成A(CH=CH)-nB型化合物后,原来A和B之间的相互影响仍然存在的规律
1,2-加成产物为主 不饱和醛(1,2-加成产物为主) 不饱和酮 甲基酮(1,2-加成为主) 其他酮(1,4-加成为主)
1) RMgX
2)H 2 O
(1)与HCN,氨和氨的衍生物,H2SO4, RNH2等质子酸,H2O,ROH在酸催化下的1, 1, 4–加成反应
O C
O
R CH CH
H(R,)
HCN
C6H5
C6H5
1, 2–加成 88% 加成
1, 4–加成 12% 加成
5.如果的羰基和一个很大的基团如三级丁基相连, 无论哪一种格式试剂都得到1,4-加成产物
6.为得到1,4-加成产物,有一种常用方法是加入 0.05mol的卤化亚铜或者用二烃基铜锂进行反应
CH3MgBr CH C CH3 Et2O
Et2O
(2)只还原C=C 用 H2/Pd-C )只还原
O
O
H2/Pd-C
or 1)Li,NH3(l),-33℃
2) H3O+
(95%)
(3) C=C和C=O 同时还原 ) 和
有机化学课件--不饱和醛酮 共32页
C H 3 C H = C H C H = O
2-丁烯醛
O
C H 3 C H = C H C C H 3
3-戊烯-2-酮
O
O
C H 3C C H =C H C 6H 5
4-苯基-3-丁烯-2-酮
甲基-2-环己烯-1-酮
15.07.2019
课件
3
一 特性 体系稳定 C=C与 C=O 组成共轭体系
OH- CH3CH=CHCH=O
1,4-加成产物为主
1) RMgX,CuCl 2)H3O+
1,4-加成产物为主
1) RLi 2) H2O
1) RMgX
1,2-加成产物为主 不饱和醛(1,2-加成产物为主)
2)H2O
不饱和酮 甲基酮(1,2-加成为主)
其他酮(1,4-加成为主)
15.07.2019
课件
6
例:
KCN,HOAc
C6H5CH=CHCOC6H5
CN-
ArCHO
O-
Ar-C-H
CN
H2O
OH-
OH
Ar-C-H
CN
OH-
OH
Ar-C-
H2O
CN
ArCHOH-
H CN
OHOH OH-
Ar-C-C-Ar
H2O H CN
-CN-
OHO
Ar-C-C-Ar +CN+ Ar-C-C-Ar
H CN
H
15.07.2019
15.07.2019
课件
16
一. 反应
二. 1. 1-羟基酮的反应
(1) 银镜反应 (2)与苯肼作用生成脎(osazones)(成脎反应).
醛酮的分类和命名
第十一章醛和酮第一节醛、酮的分类和命名一、分类二、命名1.醛、酮的系统命名以包含羰基的最长碳链为主链,看作母体。
从靠近羰基的一端开始,依次标明碳原子的位次。
在醛分子中,醛基总是处于第一位,命名时可不加以标明。
酮分子中羰基的位次(除丙酮、丁酮外)必须标明,因为它有位置异构体。
醛、酮碳原子的位次,除用1,2,3,4,…表示外,有时也用α,β,γ…希腊字母表示。
α是指官能团羰基旁第一个位置,β是指第二个位置…。
酮中一边用α,β,γ…,另一边用α’ β’ γ’…。
ⅰ含醛基、酮基的碳链上的氢被芳环或环烷基取代,就把芳环或环烷基当作主链上的取代基看待:ⅱ醛基与芳环、脂环或杂环上的碳原子直接相连时,它们的命名可在相应的环系名称之后加-“醛”字。
ⅲ当芳环上不但连有醛基,而且连有其它优先主官能团时,则醛基可视作取代基,用甲酰基做词头来命名。
2. 酮还有另一种命名法根据羰基所连的两个烃基名来命名,把较简单的烃基名称放在前面,较复杂的烃基名称放在后面,最后加“酮”字。
后面是母体如含有两个以上羰基的化合物,可用二醛、二酮等,醛作取代基时,可用词头“甲酰基”或“氧代”表示;酮作取代时,用词头“氧代”表示。
英文羰基做取代基时用“oxo”(氧代)表示不饱和醛、酮的命名是从靠近羰基一端给主链编号。
第二节醛、酮的物理性质和光谱性质一、物理性质除甲醛是气体外,十二个碳原子以下的醛、酮都是液体,高级的醛、酮是固体。
低级醛常带有刺鼻的气味,中级醛则有花果香,所以C8~C13的醛常用于香料工业。
低级酮有清爽味,中级酮也有香味。
羰基中,碳和氧以双键相结合,碳原子用三个sp2杂化轨道形成三个σ键,其中一个是和氧形成一个σ键,这三个键在同一个平面上。
碳原子剩下来的一个p轨道和氧的一个p轨道与这三个σ键所形成的平面垂直,彼此重叠形成一个π键由于氧的电负性吸引电子的能力很强,所以羰基是一个极性基团,具有一个偶极矩,负极向氧一面,正极朝向碳的一面。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Nu -
+
C=C C=O
Nu C C=C O -
C=O Nu C C _
H+
Nu C C=C OH
互变异构
Nu C C C=O
H
在酸性条件下加成反应的机制
C C=C OH
C=C C=O
+ H+
+
C=C C OH
+
Z-
C C=C OH Z
互变异构
C C C=O Z
H
共轭加成的立体化学——反型加成
Ph
第六节 α,β- 不饱和醛、酮
一、亲电加成 二、亲核加成 三、插烯反应(羟醛缩合) 四、乙烯酮(自学)
C=C=O CH2=C=O 乙烯酮 不 烯酮 饱 C=C-C=O CH2=CH-C=O 和 α ,β 不饱和醛、酮 醛 C=C与 C=O 组成共轭体系 丙烯醛 H 、 C=C-(CH2)nC=O 酮 孤立不饱和醛、酮 n≥ 1
醌类化合物具有颜色,蒽醌类染料的重要组成部分。
O
OH
OH
O 茜素--1,2二羟基蒽醌(红色) (以糖苷的形式存在于茜草根中)
H+ OH甲基橙
NaO3S-
-N=N黄色
-N(CH3)2
NaO3S-
-NH-N= 红色
=N+(CH3)2
一、醌的化学性质
醌为非芳性的环烯酮,相当于α,β-不饱和酮。
O
◎与NH2OH加成
+
NH2O H
H+
N
OH
互变异构
H
N
பைடு நூலகம்
O
互变异构
NO
O
O 对苯醌单肟
O
OH 对亚硝基苯酚
O
N-OH
N-OH
H2N-OH
O
O
H2N-OH
N-OH
(2)羰基的还原
O
H O
OH
OH
O
O
OH 氧化还原偶对
OH
O 氢醌 暗绿色
醌用作氧化脱氢剂
2、C=C双键的反应
(1)与溴加成 O
Br O
Br O Br Br O
即乙醛的CH3与CHO相互关系仍然存在,甲基上
的氢仍然活泼,称为“插烯规律”。
从结构上对比:
+ H C CH O H H + - + H C CH CH CH O H H
实际上,共轭效应沿链传递不减弱
5.Diels-Alder反应
,不饱和醛酮是很好的亲二烯体
+
CHO
CHO
四、乙烯酮(自学)
越大越不利于1,4-加成 1,4-加成 O –CH=CH–C–R ① C2H5MgX 1,2-加成
② H2O
OH –CH=CH–C–R C2H5 1,2-加成产物 C2H5 O –CH–CH2–C–R 1,4-加成产物
越大越不利于1,2-加成
三、插烯反应(羟醛缩合)
CH3CHO + H-CH2CH=CH-CHO
烯醇式重排
CH2-CH 2-C-CH 3 CN
1,2加成 C C C O + Nu 1,4-加成
C C C O Nu C C C O Nu
H
C C C OH Nu C C C OH Nu
H
反应为1,2-加成还是1,4-加成决定于三个方面: 成,强的主要进行1,2-加成。
不稳定(互变) H C C C O Nu
_稀 OH -H2O
CH3CH=CH-CH=CHCHO
-H2O
CH3CH=CHCH=O +H-CH2CH=CHCHO
稀-OH
CH3CH=CHCH=CHCH=CHCHO
2 CH3-CH=CH-CHO
OH- H2O /
-
CH3-CH=CH-CH=CH-CH=CH-CHO CH2-CH=CH-CHO
OHCH3-CH=CH-CHO - H2O
所以,醛基比酮 基更容易被进攻。
2. 强碱性亲核试剂(如RMgX、LiAlH4)主要进 攻羰基(1,2-加成) 。
CH2 O CH C CH3
O CH C CH3
LiAlH4
H+ H2O
H+ H2O
CH2
OH CH C CH3 H
CH2
CH3MgI
CH2
OH CH C CH3 CH3
3.弱碱性亲核试剂(如CN-或RNH2)主要进攻 碳碳双键(1,4-加成) 。
O
OH
O
CH 2 CH-C-CH 3 + CN
- HCN
CH 2 CH-C-CH 3 + CH 2-CH 2-C-CH 3 CN CN
羰基上的亲 核加成产物 OH
CH2-CH C-CH 3 CN
O
CH2 CH-C-CH 3
HCN 1,4-加成
1,4-加成的历程, 碳碳双键上的加成产物 O
,-不饱和醛酮的加成反应
一般发生1,4-共轭加成,得3,4-产物,H加在-C上。
OH CH2=CH–C–R p-共轭 +
X-
X OH CH2–CH=C–R (烯醇式)
-1 O CH2=CH–C–R 2 4 -3 + + H–CN 1,4-加成 1,2-加成 CN O H+ CH2–CH–C–R p-共轭
δ+ δ+ C=C-C=O
共轭分子,极性交替分布
一、亲电加成(主要为 1,4-加成反应 )
反应速率比单烯烃及共轭二烯烃慢。(为什么?) 羰基降低了C=C的亲电反应活性。 O
Cl O + HBr Br O
δ+ CH2=CH-C-H + HCl
O
CH2-CH2-C-H
总的结果是 1,4-加成的历 程,碳-碳双 键上1,2-加成 的产物。
O
C-CH2-C=CH2
C-CH2-C-CH3
CH2-C=O
傅-克酰基化反应
(3)与格氏试剂反应 (羰基性质)
O CH2=C=O + RMgX H2O CH2=C-O H R CH3-C-R 甲基酮
(4)与卤素加成(碳碳双键性质)
CH2=C=O + X-X
CH 2-C=O X X
3、制 备
(1) 热 解 CH3COCH3 CH3COOH
1,2-加成产物为主 不饱和醛(1,2-加成产物为主) 不饱和酮 甲基酮(1,2-加成为主) 其他酮(1,4-加成为主)
1) RMgX
2)H2O
,-不饱和醛酮发生加成反应时的选择规律 *1 卤素、HOX不发生共轭加成,只在碳碳双键上 发生1,2-亲电加成。 *2 HX, H2SO4等质子酸以及H2O、ROH在酸催化 下与,-不饱和醛酮的加成为1,4-共轭加成。 *3 HCN、NH3及NH3的衍生物等与,-不饱和醛 酮的加成也以发生1,4-共轭加成为主。 *4 醛与RLi, RMgX反应时以1,2-亲核加成为主。 与R2CuLi反应,以1,4加成为主。 *5 酮与金属有机物加成时,使用RLi,主要得C=O 的1,2-加成产物,使用R2CuLi,主要得1,4-加成产物, 使用RMgX,如有亚铜盐如CuX做催化剂,主要得 1,4-加成产物,如无亚铜盐做催化剂,发生1,2加 成还是1,4-加成,与反应物的空间结构有关,空阻 小的地方易发生反应。
O CC6H5 O + PhMgBr
C6H5 OMgBr
(1)
Ph
H2O
C6H5
Ph
(3)
互变异构
COC 6H5
C6H5 O-H
H
O C6H5
(4)
原料应该有一对构象异构体,例如: (1)和(2)。 所以产物应为一对光活异构体,例如: (3)和(4) 。
(2)
2 共轭不饱和醛酮的还原
情况一:只与C=O发生反应,不与C=C发生反应。
X H O H–X CH2–CH–C–R CN H O CH2–CH–C–R
烯醇式重排
CN OH CH2–CH=C–R(烯醇式)
影响,-不饱和醛酮1,2-和1,4-亲核加成的因素
——羰基端基团、烯基端基团、试剂的体积
–R 1,4-(%)
H 0
Me 60
Et 71
i-Pr 100
t-Bu 100
CH2=C=O 乙酰基化试剂 O CH3–C–OH 乙酸 O CH3–C–Cl 乙酰氯 O CH3–C–OOCCH3 乙酐 O CH3–C–OC2H5 乙酸乙酯 O CH3–C–NH2 乙酰胺 O CH3–C–R 甲基酮
第七节 醌类化合物
在醌型结构中存在-共轭体系,但不是闭 合的共轭体系,因此,醌没有芳香性,它是 一种特殊的不饱和二酮。一般情况下,邻苯 醌为红色,对苯醌为黄色。
CH2=C O
CH2=C
O
CH2-C=O
CH2=C OH
二乙烯酮
CH3-C =O CH2-C=O Y O O
CH2-C=O
+ H-Y
CH2-C=O Y
H-OH
CH3-C- CH2-C- OH 丁酮酸 O O CH3-C- CH2-C- OR 丁酮酸酯
H-OR
O CH2=C O + AlCl3
OH
O
CH2 O CH C CH3 CH3NH2
O CH2 CH C CH3 NHCH3
CH2
O CH C CH3
HCN CN
CH2 CN
O CH C CH3
HCN NH
1,4-加成产物为主 1,4-加成产物为主
C=C-C=O
