凝胶成像及Quantity One中文操作说明
凝胶成像仪操作说明

伯乐凝胶成像仪操作指南1、翻开仪器电源开关〔在该仪器的左后侧〕2、翻开电脑开关3、根据所需要分析的凝胶的性质,选择适宜的滤光片:a.分析中需要用紫外光时〔如核酸类物质的紫外观测分析〕,将滤光片拨至CCD镜头前。
b.分析中不需要用紫外光时〔如蛋白质类物质的分析〕,将没有滤光片的一档拨至CCD镜头前,或拨至空挡。
4、根据所需要分析的凝胶的性质,选择适宜的凝胶放置方式:a、采用紫外光分析模式时,直接将所需观测的凝胶直接放在观测台上〔小心移至观测台上,注意不要产生气泡,以免影响观测〕。
b、采用透射白光观测模式时,需将白光板放至紫外观测板上,再将凝胶放在白光板上。
5、双击电脑桌面“Quantity One〞软件的快捷方式翻开软件,弹出界面〔未注册软件点击“run〞进入界面或点击“basic〞进入basic模式〕。
单击“File〞,在下拉菜单中选择“Gel Doc〞栏,弹出仪器的图像采集界面。
6、将观测板小心拉出,小心放入凝胶,注意板与胶之间不要产生气泡;如有气泡产生,那么需赶去气泡,以免影响检测结果。
选择仪器右侧的光源模式,分别为:trans UV :透射紫外光;epi WHITE:侧面〔反射〕白光PREP UV:紫外光准备〔低光照紫外〕;trans WHITE:透射白光;备注:假设用户采用的是白光转换板,需用白光源透射时,仍采用trans UV栏。
7、按照图像采集界面的步骤〔STEP Ⅰ— STEPⅪ〕,a、STEP Ⅰ:单击“live/Focus〞模式,调节“IRIS〞、“ZOOM〞和“FOCUS〞等“↑〞“↓〞调节图像,直到适合自己的要求。
b、STEP Ⅱ:选择光照模式〔UV或White〕。
c、STEP Ⅲ:获取图像,采用自动或手动模式获取图像。
d、STEP Ⅳ:图像优化设置,通过调节按纽,获取最正确图像。
e、STEP Ⅴ:分析。
分析获取的图像或保存后再分析。
f、STEP Ⅵ:保存图像。
将获取的图像保存在电脑硬盘中,作为备案或稍后分析。
凝胶成像系统简易操作说明

凝胶成像系统简易操作说明
∙打开机箱背后下边电源开关,触屏进入初始化界面,点击界面中“”键,界面进入操作界面。
∙①是用来调节工作台的光强,调节范围是:75%—100%。
②是时间设定键,用来设定运行时间的。
注:点击此键从弹出的子菜单中进行运行时间设置,系统工作时间到达此设定值时系统将自动关闭所有的灯管和CAMERA。
③界面中的键是仪器已运行的时间。
④是工作模式选择键,依次点击可以出现四种工作模式(也可按屏幕右边
的F1-F4来选择)。
⑤是复位(Reset)、恢复键。
⑥是运行键。
界面第三排为各个灯和相机的开关和相应状态的指示灯。
其中“light”为上侧单色白光灯(顶灯),“254nm”为波长254纳米的侧灯紫外灯管。
“312nm/white” 为波长312纳米的紫外工作台或白光工作台。
“365nm” 为波长365纳米的侧灯紫外灯管。
“camera”为相机。
“ON”为打开键,OFF为关闭键。
3)四种模式分别为:
①点时,仪器锁定透射台(312nm紫外工作台或白光工作台)和相机camera
两个灯处于工作状态;
②点时,仪器锁定254nm 、365nm两个侧灯和相机camera处于工作状态;
③点时,仪器锁定light灯处于工作状态;
④点时,仪器处于用户自选模式。
用户可以通过用手按住ON或OFF来控制
各个灯或CAMERA的开关。
BIO-RAD凝胶电泳成像系统的操作方法

BIO-RAD凝胶电泳成像系统的操作方法BIO-RAD凝胶电泳成像系统的操作方法
1.接通电源和照相机电源
2.打开开关,预热30分钟
3.打开软件,文件菜单中gel-doc.xr
4.按live/focus,30s后按autoexpose or manualexpose
5.调iris,zoom ,focus调节图像清晰度,之后按freeze拍照,保存。
BIO-RAD 凝胶成像系统Universal Hood Ⅱ
仪器性能:
拍摄对象:核酸琼脂糖凝胶电泳
X光胶片
软件功能:获取并处理图像
测定图像光密度
操作步骤:
1. 开启成像系统,电脑电源
2. 打开Quality One软件,调整光源所示图像
3. 观察并调整曝光时间,获得图像并保存
4. 调整图像,并对图像进行光密度分析
5. 关闭所有电源。
BIO-RAD凝胶成像仪简明操作程序

BIO-RAD凝胶成像仪简明操作程序
BIO-RAD凝胶成像仪简明操作程序
一、打开电源(仪器左侧靠后)。
二、将胶放在台面上,点亮Tran UV键。
三、双击电脑桌面上Quantity One图标,启动成像软件,按Fil e→
Gel Doc的流程进入成像界面
四、成像和保存。
调节以下功能键使图像清晰:
Iris:调节光圈(亮度)
Zoom:放大和缩小图像
Focus:聚焦使图像清晰
Auto expose/Manual expose:自动/手动曝光
分析软件还可以进行分子量计算,相对定量等工作,具体操作详见说明书
成像完毕后,Save 保存文件在“常规用户”各自的文件夹下,如需要拷贝文件,则选择Fil e→Export将文件转换后再拷贝,否则文件拷贝后将无法打开
五、关闭电源、清洁台面
注意:
●每次使用要登记,使用完毕后应关闭电源并清洁台面。
●严禁将图像存在桌面上,一经发现,立即删除
●严禁在本仪器计算机上做与成像和分析无关的事情
●未经允许,不得带本实验室以外的人员使用本仪器。
quantity_one_软件使用说明
quantity one 软件使用说明
quantity one软件,对于熟悉分子生物学实验技术凝胶成像操作的各位大侠一定都不陌生,可是这个软件功能非常全面,对于每一个功能不知大家是不是一样的熟悉,我目前正在使用它的一项功能,稍稍了解了一点,希望能讲给大家,不到之处,还请各位指点!
我想向大家介绍band analysis功能:
1. 首先打开*.lsc或*.tif等格式的图像文件
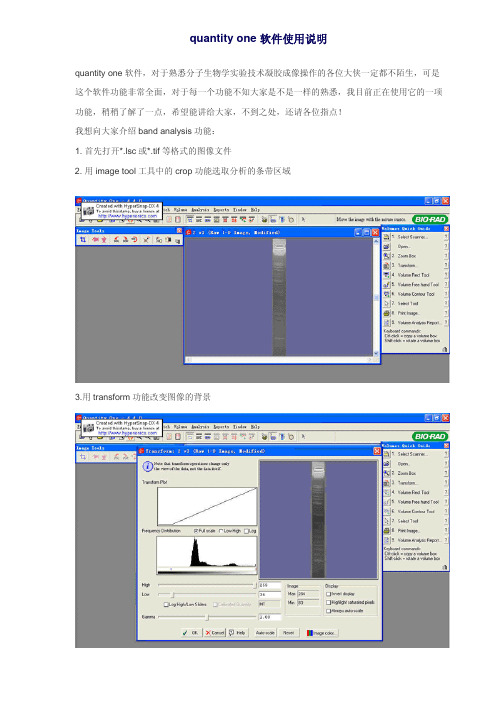
2. 用image tool工具中的crop功能选取分析的条带区域
3.用transform功能改变图像的背景
4. 选frame lanes功能,确定分析区域,一条带对应于选择的数字为1
5. 用stretch lanes及add/adjust anchors进行区域的调整,点击每个框架四周的4个小圆圈待光标有变化时,即可拖动调节区域的范围
6. 用lane background substraction功能进行本底剪影
7. 用detect band 功能进行条带的标记,可以通过调节敏感度来使标记的条带认为受到控制,利于对一些结果准确和客观的判读,band 工具栏中有编辑,去除及调整band的工具进行band 的修改
8. 用standards功能,选择合适的standards
9. band attributes 功能了解band 信息描述
10. all lanes report给出关于每一条band的分析结果,可以保存为*. txt文件,常选的指标有峰值,域值,相对量等,条带分析即可完成。
PCR仪 凝胶成像仪使用说明

ABI Veriti 梯度PCR仪使用说明(简版)操作步骤:1、打开PCR仪的热盖,放入0.2ml的样品管(热盖平稳),盖好热盖。
2、打开PCR仪的电源,仪器程序开始初始化,需等待几分钟(此步可提前)。
3、初始化完成后,显示主菜单。
4、点“Browse/New Methods”,进入PCR程序列表:5、可以直接点一个PCR程序,选择“Start Run”运行;点右边的“文件夹”符号,可以选择不同的文件夹。
如要新建一个PCR程序,点“New”,出现PCR程序。
6、添加一段程序:点上方的“Stage”,该位置变红;再点“Add”,软件将加入一段新的程序。
7、修改循环数、温度、时间:点中循环次数、温度或时间位置,下方出现数字键。
依次点数字键,出现合适数字后,点“Done”确定。
8、增加一个步骤:点“Step”位置,该位置变红;再点“Add”,软件将加入一个新的步骤。
9、删除一个步骤:点“Step”位置,在点“Delete”,软件将该步骤删除。
8、建立梯度模式:点中一个步骤,再点“Option”键,出现选项。
点“VeriFlex step”,出现梯度创建窗口:输入6个梯度温度,温度下方的“1-2”是指对应的1、2两行加热孔,全部输好后,点“Done”确定。
注意:相邻的两个梯度温度之差最大不能超过5℃!11、建立渐变模式(如需要请参考使用说明详版)。
12、增加暂停步骤(如需要请参考使用说明详版)。
13、编辑PCR程序完成后,点“Save”保存。
14、回到PCR程序列表界面,选择新建的PCR程序。
15、点“Start Run”,设置参数(反应体积和热盖温度),点“Start Run Now”运行PCR程序。
16、仪器运行选中的PCR程序,显示运行监视窗口。
17、暂停运行:点“Pause Run”,仪器暂停,出现暂停选项栏。
18、终止运行:点“Stop”可以终止整个PCR程序。
19、反应报告:PCR程序结束后,仪器会自动生成反应报告,显示当次反应的各项指数。
凝胶成像及quantityone中文操作说明

第一章简介凝胶电泳是每个做分子生物学的研究者天天都要打交道的基本技术。
电泳之后的信息处理与电泳本身同样重要。
目前有大量软件可以用于分析电泳结果,要向大家介绍的是Bio-Rad公司的1D凝胶分析软件Quantity One(Bio-Rad还有一个做2D凝胶分析的软件PDQuest)。
Quantity One软件是常用1D凝胶分析软件中功能最强大,自动化程度最高的软件。
这个软件的最新版本可以在Bio-Rad的网()免费下载,以供试用或用户升级之用。
Quantity One软件的主要功能包括定量分析(Volumes Quick Guide),电泳条带分析(Band Analysis),差显分析(Differential Display Analysis),克隆计数(Colony Counting Analysis)等,此外,还可以直接控制Bio-Rad公司的各类图像仪和ExQuest自动切胶仪,使您的凝胶分析工作变得极为轻松。
Quantity One软件拥有与windows操作系统下绝大多数应用软件相同的友好界面。
插入密码狗,打开Quantity One软件,可以看到最上缘蓝色横条幅是标题栏,往下依次是菜单栏和工具栏。
File图像打开、保存、引入、打印等操作Match分子量估算、条带匹配分析Edit图像普通编辑操作Volumn定量分析每个菜单的主要功能如下: 往下一行是工具栏,上面每个按钮的功能见下表:Quantity One 软件Help àQuick Guide 快捷指南提示如何实现一个功能,如定量分析(Volumes Quick Guide),电泳条带分析(Band Analysis),差显分析(Differential Display Analysis),克隆计数(Colony Counting Analysis)等。
快捷指南下有1,2,3…步骤,根据提示完成。
使用Quantity One 软件进行电泳结果分析,通常包括图像获取、图像预处理、分析、结果输出四部分。
凝胶定量软件QuantityOne使用

凝胶定量软件Quantity One使用简介1 内容简介凝胶电泳是每个做分子生物学的同学天天都要打交道的基本技术。
电泳之后的信息处理与电泳本身同样重要。
目前有大量软件可以用于分析电泳结果,比较有名的比如BandScan、BandLeader、Sigma Gel等等。
今天要向大家介绍的是来自Bio-Rad的1D凝胶定量软件Quantity One(Bio-Rad还有一个做2D凝胶分析的软件PDQuest)。
这个软件的最新版本可以在Bio-Rad的主页免费下载。
目前的最新版本是4.52版2 Quantity One的定量方法Quantity One的分析功能顾名思义主要用来进行凝胶或者培养皿的荧光定量分析。
它的分析功能或者说分析方式主要有4种:泳道/条带轨迹定量法;等高线直接定量法;菌落计数;分子量测定这三种方法中使用最为方便也是最为广泛的应该是等高线定量法(V olumn Contour)。
它通过半自动描绘电泳条带的等高线边缘来得到等高线区域内部面积,再将该面积乘以区域内平均光密度值得到条带内部总的信号量。
当然这种分析方法的弊病显而易见:无法同等得排除不同泳道的背景亮度;等高线的绘制处于“半自动”状态,即需要人为判断作为等高线标准的电泳条带的边缘;最致命的是在几个电泳条带距离十分接近的时候几乎无法绘制单一条带的轮廓(常出现连续的几个条带等高线相连而无法分离出单独条带的轮廓)。
三种方法中个人感觉最为科学和严谨的应该是泳道/条带轨迹定量法(Trace Tracking)。
这种方法使用起来步骤较为繁琐,必须通过泳道识别---电泳条带识别两个连续的步骤才能进行定量。
然而这种方式的最大优点在于它可以完全抛弃人为主观因素进行全自动定量。
他的定量方式为:首先根据不同电泳条带的光密度值绘制光密度曲线,然后计算光密度曲线下面积作为电泳条带的定量根据。
大家可能会问他能不能排除泳道背景?答案是肯定的,它能够最大程度的排除不同泳道之间的背景差异,让各个泳道上的不同电泳条带在一条几乎相同的起跑线上进行对比。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章简介凝胶电泳是每个做分子生物学的研究者天天都要打交道的基本技术。
电泳之后的信息处理与电泳本身同样重要。
目前有大量软件可以用于分析电泳结果,要向大家介绍的是Bio-Rad公司的1D凝胶分析软件Quantity One(Bio-Rad还有一个做2D凝胶分析的软件PDQuest)。
Quantity One软件是常用1D凝胶分析软件中功能最强大,自动化程度最高的软件。
这个软件的最新版本可以在Bio-Rad的网()免费下载,以供试用或用户升级之用。
Quantity One软件的主要功能包括定量分析(Volumes Quick Guide),电泳条带分析(Band Analysis),差显分析(Differential Display Analysis),克隆计数(Colony Counting Analysis)等,此外,还可以直接控制Bio-Rad公司的各类图像仪和ExQuest自动切胶仪,使您的凝胶分析工作变得极为轻松。
Quantity One软件拥有与windows操作系统下绝大多数应用软件相同的友好界面。
插入密码狗,打开Quantity One软件,可以看到最上缘蓝色横条幅是标题栏,往下依次是菜单栏和工具栏。
File 图像打开、保存、引入、打印等操作Match分子量估算、条带匹配分析Edit 图像普通编辑操作Volumn定量分析View 图像缩放、三维视图、看光密度值等操作Analysis浓度估算、克隆计数等分析每个菜单的主要功能如下:往下一行是工具栏,上面每个按钮的功能见下表:Quantity One 软件Help àQuick Guide 快捷指南提示如何实现一个功能,如定量分析(Volumes Quick Guide),电泳条带分析(Band Analysis),差显分析(Differential Display Analysis),克隆计数(Colony Counting Analysis)等。
快捷指南下有1,2,3…步骤,根据提示完成。
使用Quantity One 软件进行电泳结果分析,通常包括图像获取、图像预处理、分析、结果输出四部分。
图像获取就是通过软件控制扫描仪(GS-800、PharosFX 等)或凝胶成像系统(GelDoc 、ChemiDoc 、VersaDoc 等),图像预处理就是将扫描或拍照获得的原始图像进行初步处理,以便更好地进行后续分析。
接下来是分析过程,根据分析的方法和目的不同,又可以分为定量分析、条带分析、克隆计数、差异(聚类)分析等等。
不管如何分析,最终我们都必须通过软件的输出功能,得到我们想要的结果。
Quantity One 软件提供了多种结果输出方式。
在接下来的几章里,我们将按照这个思路,一步步引导您使用这一软件。
Image图像旋转、翻转、裁切等操作 Re ports 分析结果输出 Lane 泳道分析Wi ndow窗口分析 Band 条带分析He lp 帮助、快捷菜单、软件注册等第二章图像获取Quantity One 4.4-4.6版本可以控制Bio-Rad目前几乎所有的图像仪,如GelDoc XR、ChemiDoc XRS 等。
这些图像仪采集到的图像,可以直接保存成软件可直接分析的图像,即扩展名1sc的原始图像文件。
下面将具体介绍如何通过Quantity One软件从GelDoc XR获取图像。
GelDoc XR是Bio-Rad凝胶成像系统中最常用,操作最简便的仪器,它可以用来拍摄EB、SYBR Green 等染料染的核酸电泳凝胶;Sypro Ruby、银染、考马斯亮蓝等方法染的蛋白电泳凝胶;以及化学显色的印记膜等。
使用GelDoc XR之前,先接通电源,打开位于仪器背面右下角的电源开关;然后根据具体的应用选择合适的照明和滤光片位置。
原则如下:表格形式模式1. 如果样品是通过EB、SYBR Green、Sypro Ruby等染料通过紫外激发来显色,就先将样品置于紫外透射平台(UV Transilluminator)的中间,关上暗箱门,然后按下面板上的“Trans UV”按钮,并将滤光片选择杆置于位置“I”处。
模式2. 如果样品是通过金属银、考马斯亮蓝等染料染色,就先将白光转换屏 (White Light Conversion Screen)取下,打开下部的开关,放在紫外透射平台上,样品置于白光转换屏中间。
关上暗箱门,然后按下面板上的“Trans White”按钮,并将滤光片选择杆置于位置“I”处。
模式3. 如果是化学显色等非透明可见样品,则用模式2中所示方法,将样品置于白光转换屏中间。
关上暗箱门,然后按下面板上的“Epi White按钮”,并将滤光片选择杆置于位置“O”处。
接下来打开Quantity One软件,选择File》GelDoc XR,按以下顺序操作:①按下Live/Focus,成像仪进入实时成像;②选择照明模式,一般核酸胶用UV,蛋白胶用White模式;注意,选择完成后,要按下成像仪面板上相应的光源按钮③此功能有三个上下键按钮:IRIS(光圈),ZOOM(缩放),FOCUS(聚焦),您可在软件上直接调节或在仪器面板上手工调节调节步骤:a 调大IRIS,以看到图像b 点ZOOM,将胶适当放大c 调节IRIS至合适大小(一般情况下尽量选择小光圈,因为小光圈景深大,图像更清晰)d 调节FOCUS,至图像最清晰按④按“Auto Expose”;如是,单击Auto Expose,系统将自动选择曝光时间成像,如不满意,单击Manual Expose,并输入曝光时间(秒),图像满意后保存,在自动曝光期间,图象会持续的输入到CCD中,直到达到一定比例的饱和象素值,此比例在Options dialog box 中设定 (默认值 = 0.15%)。
一旦图象质量达到要求,点击Freeze button 来终止曝光。
⑤如是蛋白凝胶,接第6步直接将清晰的图像保存即可⑦按下“Analyze”;这将会打开一个新的窗口来显示捕获的图象,该图象具有默认名称,具有日期、时间及用户名(如果已知的话)等信息。
⑧按下“Save”键,保存图像。
第三章图像分析Quantity One的图像分析功能相当强大,根据不同的需要,可以分为定量分析、条带分析、相似性分析以及克隆计数(用于蓝白斑筛选)等等,而且每种分析法都有独特的优点和输出方式。
本章重点介绍常用的定量分析和条带分析方法,其余更细更深的功能请参考软件自带的用户手册。
一.定量分析(Volumn Analysis)定量分析是计算选定区域内信号强度的总和,是Quantity One最方便的定量工具。
这种分析方式考虑选定区域的真实形状,可用于电泳条带、斑点、大型芯片等图像的定量。
这种定量的方法可以扣除背景,可以按照用户的标准曲线计算出条带或斑点的浓度,但它不能计算分子量,也不能进行条带匹配和相似性分析。
Quantity One软件称这类定量的结果为Volume。
Volume=选定区域内所有像素信号强度的总和×像素面积Volume的单位:int×mm2快捷指南Volumes Quick Guide,能够指导您对任意所选区域进行定量分析,此分析可以报告多种结果,常用的结果是相对浓度和绝对浓度(须提供标准品)。
具体的操作方法如下:1.选择成像系统或打开已保存的文件(软件可以控制Bio-Rad所有的成像系统如GelDoc,ChemiDoc,VersaDoc,GS-800,FX,如不是Bio-Rad成像系统所摄取的图象,将图象保存为Tiff [1]文件格式,软件也可进行分析处理)2.Zoom Box,缩放,对图象进行放大观察3.Transform转化,调节图象的对比度黑白4.选择待分析区域:Volumn Contour Tool等高线勾勒区域,自动连接浓度相同的点,如U1Volume Free hand Tool自由画笔选择区域,可以勾勒出无规则形状,如U2Volume Rect Tool 矩形区域选择,如U3Volumn Circle Tool圆形选择区域,如U4按上面4种方法选择需要定量的区域。
5.双击所选区域,出现如下窗口,定义样品类型,如未知样品Unkonwn(U1,U2…即待计算样品),背景Background(B1,B2…,软件在算浓度时会将此区域的浓度自动扣除) 或标准样品Standard(Std1,Std2, 如果该样品是浓度标准样品,即定量标准,需在浓度concentration一栏输入该样品的浓度)。
6.Select Tool选择不同区域7.Print Image打印图像8.Volume Analysis Report 定量报告结果,打开出现如下窗口,选择要报告的参数,主要有2个参数Volume、adj. Vol. (即adjusted volume) 和Concentration。
Volume为定量值,adj. Vol. 为扣除背景后的定量值,如有浓度标准样品(Std),软件可报告Concentration绝对浓度。
参数选好后,按下按钮“done”。
9.软件报告如下图所示:按右侧输出按钮,可将表格保存成txt文件,按左侧打印按钮,可将报告打印出来。
二.条带分析(Band Analysis)条带分析是Quantity One最基本的分析工具,它可以自动识别电泳泳道和识别条带,依据泳道的平均光密度和条带宽度对每个条带进行模式化定量。
这种分析方式虽然不如定量分析来得方便,但这样可以实现非常复杂的电泳分析,满足各种不同的结果需要。
这种方式的最大优点在于它可以完全抛弃人为主观因素而进行全自动定量。
用条带分析的方法进行定量的结果叫Trace Quantity(Trace Qty),计算方法是:首先软件自动计算条带上每一横排像素的平均光密度和平均光密度分布曲线,然后每个具体条带的定量值是平均光密度曲线的线下面积的积分,即:Trace Quantity=平均光密度×条带上下边界的距离Trace Quantity的单位:OD*mm下面介绍用此功能对泳道内的所有条带进行分子量确定,相对浓度分析1.打开已保存的文件(如不是Bio-Rad成像系统所摄取的图象,将图象保存为Tiff [1]文件格式,软件也可进行分析处理)2.Zoom Box,缩放,对图象进行放大观察3.Transform转化,调节图象的对比度黑白4.确定泳道(lane),并对泳道进行各种调整(实际实验中泳道往往不是垂直的而出现各种变形)。
按下图所示在软件的工具栏中有一Lane Tool图标,包含有更多泳道编辑工具。
5.选择Frame Lanes,输入图像实际泳道(lane)数并确认。
此时图像上泳道的位置上会出现一条条红线,每条红线就代表一根泳道。
