初中化学化学除杂分离和提纯练习题
初中化学化学除杂分离和提纯练习题
一、中考化学除杂分离和提纯
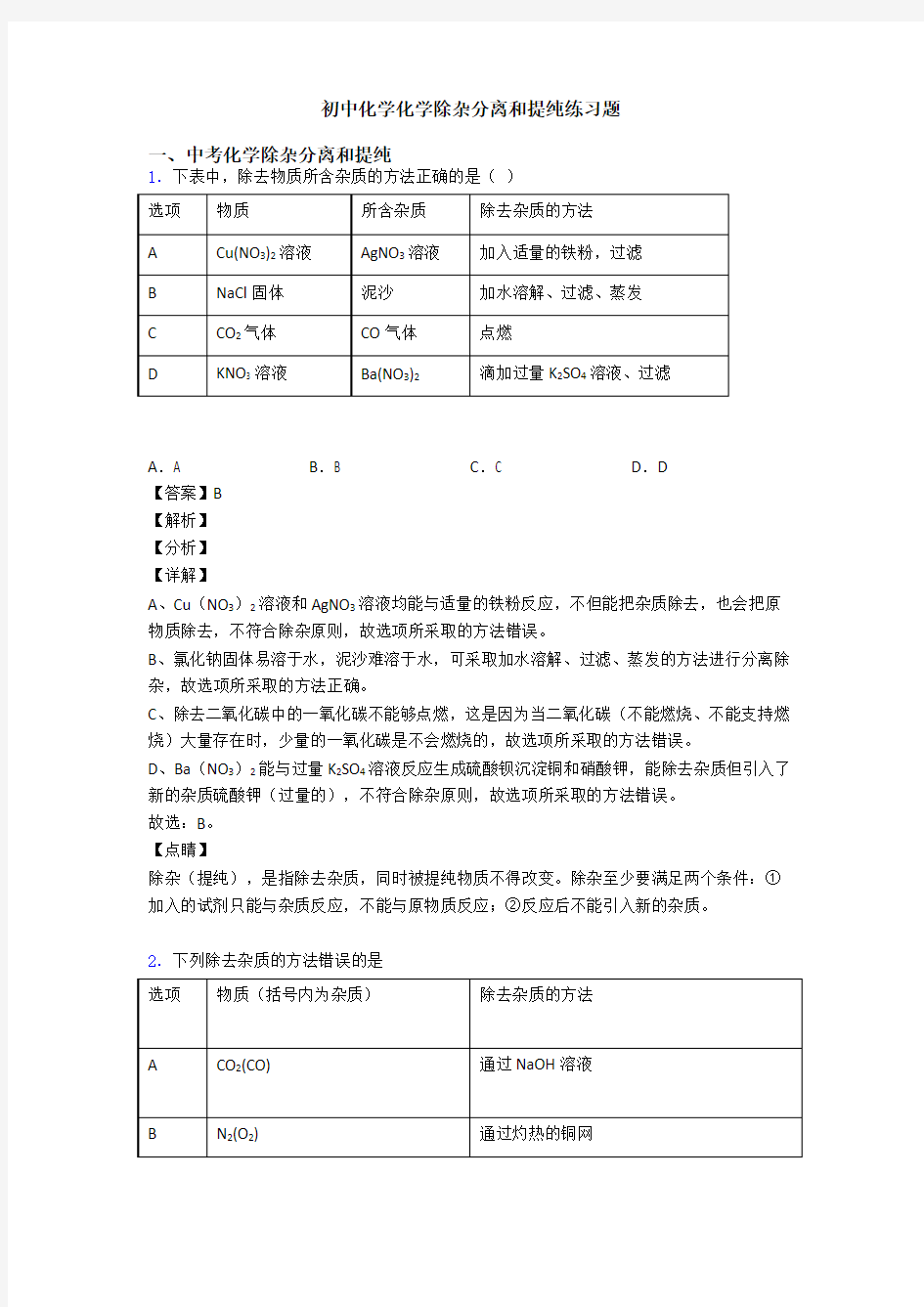
1.下表中,除去物质所含杂质的方法正确的是()
A.A B.B C.C D.D
【答案】B
【解析】
【分析】
【详解】
A、Cu(NO3)2溶液和AgNO3溶液均能与适量的铁粉反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
B、氯化钠固体易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,故选项所采取的方法正确。
C、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的,故选项所采取的方法错误。
D、Ba(NO3)2能与过量K2SO4溶液反应生成硫酸钡沉淀铜和硝酸钾,能除去杂质但引入了新的杂质硫酸钾(过量的),不符合除杂原则,故选项所采取的方法错误。
故选:B。
【点睛】
除杂(提纯),是指除去杂质,同时被提纯物质不得改变。除杂至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
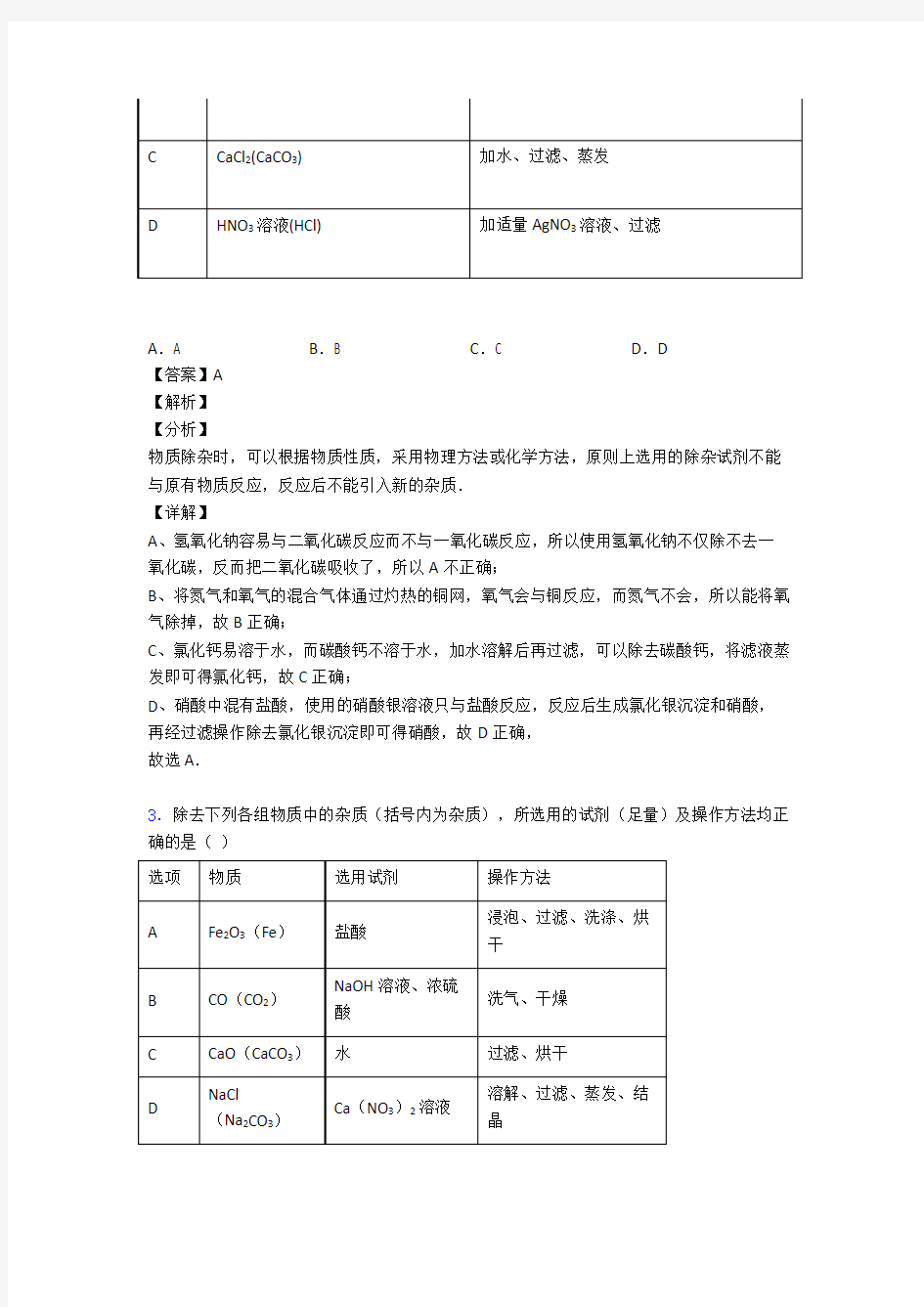
2.下列除去杂质的方法错误的是
A.A B.B C.C D.D
【答案】A
【解析】
【分析】
物质除杂时,可以根据物质性质,采用物理方法或化学方法,原则上选用的除杂试剂不能与原有物质反应,反应后不能引入新的杂质.
【详解】
A、氢氧化钠容易与二氧化碳反应而不与一氧化碳反应,所以使用氢氧化钠不仅除不去一氧化碳,反而把二氧化碳吸收了,所以A不正确;
B、将氮气和氧气的混合气体通过灼热的铜网,氧气会与铜反应,而氮气不会,所以能将氧气除掉,故B正确;
C、氯化钙易溶于水,而碳酸钙不溶于水,加水溶解后再过滤,可以除去碳酸钙,将滤液蒸发即可得氯化钙,故C正确;
D、硝酸中混有盐酸,使用的硝酸银溶液只与盐酸反应,反应后生成氯化银沉淀和硝酸,再经过滤操作除去氯化银沉淀即可得硝酸,故D正确,
故选A.
3.除去下列各组物质中的杂质(括号内为杂质),所选用的试剂(足量)及操作方法均正确的是()
A.A B.B C.C D.D
【答案】B
【解析】
【详解】
A、Fe和Fe2O3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,采取的方法错误,故不符合题意;
B、CO2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,再通过浓硫酸进行干燥,能除去杂质且没有引入新的杂质,符合除杂原则,采取的方法正确,故符合题意;
C、CaO能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则,采取的方法错误,故不符合题意;
D、Na2CO3能与Ca(NO3)2溶液反应生成碳酸钙沉淀和硝酸钠,能除去杂质但引入了新的杂质硝酸钠,不符合除杂原则,采取的方法错误,故不符合题意;
故选B。
【点睛】
物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键。
4.下列四个实验方案设计合理的是。
A.A B.B C.C D.D
【答案】B
【解析】
【分析】
【详解】
A、羊毛和化学合成纤维的气味区别不大,不能用闻气味的方法来鉴别,可用灼烧闻气味的方法鉴别,羊毛的主要成分是蛋白质,灼烧有烧焦羽毛的气味,化学合成纤维灼烧无此气味,不符合题意;
B、除去粗盐中的难溶性杂质,可采取溶解、过滤(除去难溶性杂质)、蒸发得到提纯后
的氯化钠,符合题意;
C、将混合物置于足量稀盐酸中,氧化铜与稀盐酸反应生成氯化铜和水,铁与稀盐酸反应生成氯化亚铁和氢气,虽然除去了杂质,但是也除去了原物质,不符合题意;
D、将两根光亮的镁条分别伸入CuSO4溶液和AgNO3溶液中,镁能与硫酸铜反应生成硫酸镁和铜,有红色固体析出,说明在金属活动性顺序里,镁位于铜之前,镁能与硝酸银反应生成硝酸镁和银,有银白色固体析出,说明在金属活动性顺序里,镁位于银之前,但是无法探究铜、银的金属活动性顺序,不符合题意。
故选B。
【点睛】
除杂选择试剂的原则是:不增(不引入新的杂质)、不减(不能将原物质反应掉)、不繁(整个过程不繁琐)。
5.除去下列物质中的杂质(括号内物质为杂质)的方法错误的是 ( )
A.N2(O2)——通过灼热的铜网
B.Fe(Fe2O3)——过量稀盐酸、过滤
C.H2(水蒸气)——通过浓硫酸的洗气瓶
D.NaOH溶液(Na2CO3)——适量Ca(OH)2溶液,过滤
【答案】B
【解析】
【分析】
根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
【详解】
A、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,而氮气不与铜反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确,但不符合题意。
B、Fe2O3和Fe均能与过量稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误,符合题意。
C、浓硫酸具有吸水性,且不与氢气反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确,但不符合题意。
D、Na2CO3能与适量Ca(OH)2溶液反应生成碳酸钙沉淀和氢氧化钠,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确,但不符合题意。
故选:B。
6.除去下列物质中的少量杂质,所选用的试剂和操作方法均正确的是()
A.A B.B C.C D.D
【答案】C
【解析】
【分析】
【详解】
A、氢氧化钠会与氯化铁反应生成氢氧化铁沉淀和氯化钠,不能把杂质除去,反而把氯化铁除去了,故错误;
B、氯化氢会与硝酸银溶液反应生成氯化银沉淀和硝酸,但会引入新的杂质水蒸气,故错误;
C、加入饱和的氯化钠溶液,氯化钠不能溶解,而硝酸钾会溶解在饱和氯化钠溶液中,过滤,洗涤干燥,可以得到氯化钠固体,故正确;
D、足量的铁粉能与硫酸铜反应生成硫酸亚铁溶液和铜,再过滤即可,故选项所采取的方法错误。
故选:C。
【点睛】
除杂(提纯),是指除去杂质,同时被提纯物质不得改变。除杂至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
7.除去下列各物质中的少量杂质,所选用的试剂、方法均正确的是()
A.A B.B C.C D.D
【答案】A
【解析】
【详解】
A、浓硫酸有吸水性,将H2通入足量的浓硫酸中,可以除掉其中的水蒸气,选项正确;
B、CaO和水反应生成氢氧化钙,不符合除杂要求,选项错误;
C、Na2CO3和适量CaCl2溶液反应生成碳酸钙沉淀和氯化钠,过滤,所得NaNO3溶液中会有氯化钠杂质,选项错误;
D、铁粉和盐酸反应,铜不反应,加过量盐酸,过滤、洗涤、干燥后,固体只有铜,选项错误。
故选A。
8.除去下列物质中的少量杂质(括号内为杂质),拟定的实验方案可行的是
A.MnO2固体(KC1):加入适量水溶解,过滤,蒸发
B.氧气(水蒸气):通过装有足量无水氯化钙的干燥管
C.二氧化碳(氯化氢气体):依次通过足量的氢氧化钠溶液和浓硫酸
D.NaOH溶液(Na2CO3):加入适量的BaCl2溶液至恰好完全反应,过滤
【答案】B
【解析】
【分析】
根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
【详解】
A、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,选项所采取的方法错误,不符合题意;
B、无水氯化钙具有吸水性,且不与氧气反应,能除去杂质且没有引入新的杂质,符合除杂原则,选项所采取的方法正确,符合题意;
C、CO2和HCl气体均能与NaOH溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,选项所采取的方法错误,不符合题意;
D、Na2CO3能与适量的BaC12溶液反应生成碳酸钡沉淀和氯化钠,能除去杂质但引入了新的杂质氯化钠,不符合除杂原则,选项所采取的方法错误,不符合题意。
故选:B。
9.除去下列物质中的杂质(括号内是杂质),下列操作方法正确的是
A.A B.B C.C D.D
【答案】D
【解析】
【详解】
A、向混合固体中加入稀盐酸,三氧化二铁和稀盐酸反应生成氯化铁和水,但是铁也能和稀盐酸反应生成氯化亚铁和氢气,虽然除去了三氧化二铁,同时也除去了原物质,不符合题意;
B、二氧化锰不溶于水,氯化钾易溶于水,将混合固体加水溶解、过滤即可除去二氧化锰中混有的氯化钾,需洗涤干燥,无需蒸发结晶,不符合题意;
C、向混合溶液中加入过量的氢氧化钙,氢氧化钙能和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,虽然除去了碳酸钠,但是引入了新的杂质氢氧化钙,不符合题意;
D、向混合溶液中加入氧化铜,氧化铜能与稀硫酸反应生成硫酸铜沉淀和水,过滤即可将硫酸铜溶液中的硫酸除去,符合题意。
故选D。
【点睛】
除杂选择试剂的原则是:不增(不引入新的杂质)、不减(不能将原物质反应掉)、不繁(整个过程不繁琐)。
10.下表列出了除去物质中少量杂质的试剂或方法,其中错误的是
A.A B.B C.C D.D
【答案】B
【解析】
【详解】
A、CaO中混有少量CaCO3,采用高温煅烧的方法将碳酸钙转化为氧化钙,不符合题意;
B、O2中混有少量CO2,将混合气体通过灼热的铜网,氧气会与铜反应而二氧化碳不反应,将要保留的物质除去了,符合题意;
C、加入过量的稀盐酸,碳不与稀盐酸反应,氧化铜与稀盐酸反应,经过滤、洗涤、干燥后,最终得到碳,不符合题意;
D、FeCl2溶液中混有少量CuCl2,加入过量的铁粉,铁与氯化铜溶液反应生成氯化亚铁和铜,过滤除去铜和过量的铁粉,得到氯化亚铁溶液,不符合题意。故选B。
初中化学除杂专题(可直接打印)
初中化学除杂专题(可直接打印) 一、解除杂题的原则、要领、方法三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。六种常用方法:方法适用范围或原理举例化学方法化气法与杂质反应生成气体而除去除NaCl中Na2CO3,可加适量稀HCl:Na2CO3+2HCl=2NaCl+ CO2↑+ H2O沉淀法将杂质转化为沉淀过滤除去除去NaOH中的Na2CO3,可加适量的Ca(OH)2:Na2CO3+ Ca(OH)2==CaCO3↓+2NaOH置换法将杂质通过置换反应而除去除Fe SO4中的Cu SO4,可加过量的铁粉,再过滤:CuSO4+Fe==Cu+Fe SO4溶解法将杂质溶于某种试剂而除去除C粉中的CuO粉,可加适量稀硫酸,再过滤:CuO+ H2SO4==CuSO4+ H2O加热法杂质受热易分解,通过加热将杂质除去除CaO中的CaCO3可加热:CaCO3CaO+ CO2↑转化法将杂质通过化学反应转化为主要成分除CO2中的CO,可将气体通过灼热的CuO:CO+CuOCu+CO2 二、常见物质的除杂 一、气体除杂:(括号中为杂质) 1、CO2(含O2):将气体通过灼热的铜网。 2、 CO2(含H2或CO):将气体通过灼热的氧化铜。 3、 O2或CO2或H2(含H2O):将气体通过浓硫酸或氧化钙或氯化钙等干燥剂。
4、 O2或H2或CO(含CO2或SO2):将气体通入氢氧化钠溶液中 二、固体除杂: 1、Cu(含Fe或Mg或Zn):加入足量的稀盐酸或稀硫酸,过滤。(将活泼金属用酸溶解) 2、 Fe(含Cu):用磁铁将铁粉吸引出来。 3、 Cu(含CuO)、Fe(含Fe2O3):高温下与H2或CO反应。(将金属氧化物还原成金属) 4、 CuO(含Cu或C):在空气中灼烧。 5、 CaO(含CaCO3):高温煅烧(CaCO3分解成CaO和CO2) 6、 CaCO3(含CaO):加足量水溶解,过滤,取滤渣。(CaO 与水反应溶于水) 7、 CaCO3(含CaCl2):加足量水溶解,过滤,取滤渣。(CaCl2溶于水,CaCO3不溶于水) 8、 CaCl2(含CaCO3):加足量水溶解,过滤,取滤液蒸发。 9、 Ca(OH)2(含CaO):加足量水。(CaO与水反应生成氢氧化钙) 三、溶液除杂: 1、FeSO4溶液(含H2SO4或CuSO4)、FeCl2溶液(含盐酸或CuCl2):过量铁粉,过滤,取滤液。有关反应:
初中化学物质鉴别与除杂专题及典型例题
一对一个性化辅导教案 教师科目化学时间2014 年 5月 17 日学生年级初三学校 重难点常见物质的鉴别和分离 难度星级☆☆☆☆☆校区 教学内容 上堂课知识回顾(教师安排): 1.化学推断题的方法 2.化学推断题的技巧和突破口 本次课教学安排: 1.掌握常见物质的鉴别 2.掌握常见物质的分离
常见物质的鉴别和分离 一、复习内容和要求: 1.掌握常见气体:O 2、H 2、CO 2、CO 和水蒸气等气体的鉴别和分离; 2.掌握常见物质盐酸、硫酸、氢氧化钠、氢氧化钙、碳酸钠、硫酸铜等物质的鉴别; 3.在混合物分离和提纯中,记住常见物质的溶解性,强化溶解、过滤、蒸发等操作。 二、物质检验的试剂和装置 (一)常见气体的检验和吸收 1、常用的气体检验和吸收试剂:(验气先验水,除杂后除水) 气体 验证试剂 吸收试剂 氧气 带火星的木条 灼热的铜 二氧化碳 石灰水 氢氧化钠溶液 二氧化硫 氢氧化钠溶液 水蒸气 无水硫酸铜 浓硫酸或氢氧化钠固体 氯化氢气体 硝酸银溶液 硝酸银或氢氧化钠溶液 2、 检验和吸收上述气体的一般装置: 图1为多功能瓶(盛放液体) 图2为U 型管 洗气(除杂):长进短出 (盛放固体) 验气: 长进短出 3、CO 、H 2的检验 常常先通过 灼热的氧化铜 看见 固体由黑色变成红色,再通过证明其另一生成物 CO 2和H 2O ,以达到检验这两种气体的目的。 右图3为检验和吸收上述气体的一般装置: 例1.某无色气体可能含有H 2、CO 、CO 2中的一种或多种。现将该气体依次经过下列装置处理后(假设每步作用均完全)。有关的实验事实是:①A 装置质量增重;②B 装置中的固体由黑变红;③C 装置中无水硫酸铜变蓝;④D 装置中石灰水变浑浊。请回答下列问题: (1)原混合气体中肯定含 ,可能含有 。为确认可能含有的气体是否存在,请在 和 之 间(填装置编号)添加框图中的装置,装置中试剂名称是 。 (2)B 装置中的固体由黑变红说明氧化铜发生了__________(填“氧化”、“还原”)反应,写出B 处硬质玻璃管中肯 定发生反应的化学方程式: 。 无水CuSO 4 Ca(OH)2溶液 NaOH 溶液 图3 图2 图1
初三化学除杂问题模拟考试
2018-2019 除杂问题模拟考试 一、单选题 ]除去下列物质中的少量杂质,所用试剂和操作方法都正确的是 2. [2017·齐齐哈尔市中考]下表中除去物质中少量杂质的方法错误的是 3. [2017·南京市中考]除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是 A. FeCl 2溶液(CuCl 2 )——加入过量的铁粉,过滤 B. KCl固体(KClO 3 )——加入少量的二氧化锰,并加热 C. CO气体(CO 2 )——通过足量的氢氧化钠溶液,并干燥 D. NaCl溶液(MgCl 2 )——加入过量的氢氧化钠溶液,过滤,滤液中加稀盐酸至中性 4. [2017·山西省中考]提纯是化实验常用的一种方法。除去下表混合物中的杂质,所选除杂试剂错误的是
5. [2017·长春市中考]下列实验中,能够达到实验目的的是 6. [2017?长沙中考]除去下列物质中含有的少量杂质,所用试剂或方法正确的是( ) 7. 下表是各物质所含的少量杂质以及除去这些杂质所选用的试剂或操作方法,其中正确的是 8. 下列除杂(括号内为杂质)选用的试剂或方法正确的是 A. CuO(C):隔绝空气高温加热 B. Na 2SO 4 溶液(NaOH):加适量稀盐酸 C. CO 2 (HCl):将气体通入足量的氢氧化钠溶液 D. CaCl 2 溶液(HCl):加入过量碳酸钙,充分反应后过滤 9. 除去下列物质中的少量杂质,所选试剂及操作都比较合理的是
10. 为除去下列物质中混有的少量杂质,所选试剂正确的是 11. [2017·南充市]下列实验操作不能达到实验目的的是( ) 12. [2017·兰州市]除去下列物质中的杂质,所用试剂和方法均正确的是( ) 13. 除去下列各物质中少量杂质,所选用的试剂和操作方法均正确的是
关于初中化学中物质的除杂与分离
关于初中化学中物质的除杂与分离 物质的除杂就是除去种物质中混有的其他质。除杂方法有物理方法如洗涤、解、过滤、蒸发、吸附等;学方法如一定条件下加入某种学试剂,通过化学应将杂质反应掉或杂质转化成所要保留物质。除杂要求是能除去杂质,但混入新杂质,并且不坏要保留的物质。在实际操作,物理方法和化学法常常是联合使用。 例如要除去固体NaOH中有的Na2CO3,操作方法:将混合物加水溶解后并加入适量石灰水充反应后,过滤,再将滤液干便得到所需要的固体NaOH: Na2CO3+Ca2===2NaOH+CaCO3↓ 题中选择除杂试剂是键。 如果选择盐酸做除杂剂,就会在除去Na2CO3同时破坏了要保留的物质NaOH: Na2CO3+2HCl===2NaCl+CO2↑+H2O,NaOH+HCl===NaCl+H2O 如选择CaCl2做除试剂,虽然可除去Na2CO3,但混入新杂质NaCl:Na2CO3+CaCl2===CaCO3↓+2NaCl 所以本题不能选用盐酸或CaCl2做除杂试剂。另外加石水必须适量,加少了质除不净,加多了剩余的灰水又作为新杂质混入其中。 最后要将滤液蒸干,因为我需要的是固体NaOH,而不是它溶液。 物质的除杂与离很相似,但又有所不同。除杂是要将杂质除去就行;而分离将几种物质分开,几物质都需要,且都不能破坏。
现有一氧化碳和二氧碳组成的混合气体,若将二化碳当杂质除去,只保留一化碳,这就是一个除杂问题可以把混合气体通过NaOH溶液:2NaOH+CO2===Na2CO3+H2O 若一氧化碳和二氧化碳分开,既要一化碳又要二氧化碳,这是一个分离问题。其操方法是:先将混合气通过NaOH溶液,首先收集一氧化碳;再向刚才通过混合体的溶液中加入适盐酸,第二步收集到二氧化碳,从间接的将一氧化碳和氧化碳分离开来: CO2+2NaOH===Na2CO3+H2O,Na2CO3+2HCl===2NaCl+CO2↑+H2O 除去或化二氧化碳用NaOH溶液,因该反应进行彻底,转化快;验二氧化碳用澄清石水,因为该反应灵敏、现象明显且独立性。
(完整版)初中化学物质除杂(提纯)专题完整版
除杂(提纯)的原则:不增不减、易分离 除杂(提纯)的原则:三原则:①把杂质除掉、保留原物质,不引入新杂质; ②不减少被提纯物质的质量;③杂质便于分离。 四要领:①根据物理性质或化学性质的差异;②确定除杂质方法; ③选择适宜试剂(注意加入的试剂不能与原物质反应)。 ④如果在具体操作中还应注意所加试剂的量和操作语言的描述。 一.物理方法 1.过滤法:用来除去可溶物和不溶物 常见不溶于水的沉淀有:AgCl、BaCO3、BaSO4、大多数的碳酸盐、以及Cu(OH)2、Fe(OH)3、Al(OH)3等氢氧化物、MnO2等。 例:KCl(AgCl): Na2SO4 (BaSO4): KCl(MnO2): 2、结晶法: 大多数固体物质的溶解度随温度升高而增大,曲线为"陡升型",如KNO3 少数固体物质的溶解度受湿度的影响很小,曲线为"缓升型",如NaCl 极少数固体物质的溶解度随湿度的升高而减小,曲线为"下降型",Ca(OH)2 例:下列混合物适宜用结晶法分离的是( ) A. NaNO3 Na2CO3 B. NaNO3 NaCl C. NaOH Mg(OH)2 D. NaCl BaSO4 3. 磁铁吸引:分离有磁性和无磁性的: 铁粉和硫粉 铜粉和铁粉 4. 洗气法: H2(H2O) CO2(H2O) 二.化学方法:(沉淀法、气体法、置换法、吸收法、其它法) 1.沉淀法:使混合物中的杂质与适当试剂反应,生成沉淀通过过滤而除去。 例:.如何除去下列物质中的杂质(括号内为杂质),用化学方程式表示 NaCl( Na2SO4 )_____________________________________ HCl ( H2SO4 )_____________________________________ HNO3 (HCl ) _____________________________________ NaCl(MgCl2) ____________________________________ 2.气体法:将混合物中的杂质与适当试剂反应变成气体而除去。 一般规律为:CO32-+ 强酸= CO2;NH4+ + OH- = NH3 例:如何除去下列物质中的杂质(括号内为杂质),用化学方程式表示 NaCl( Na2CO3 )____________________________________ Na2SO4(Na2CO3)____________________________________ CaCl2溶液(盐酸) KCl (NH4Cl) ______________________________________ KNO3(KOH) ______________________________________ Na2SO4(NaOH) ___________________________________
初中化学常用的除杂方法
初中化学除杂常用的方法 一、物理方法 物理方法是根据被提纯物质和杂质之间物理性的差异而除去杂质的方法,初中化学有过滤和结晶两种。 1. 过滤法:是把难溶性物质跟易溶性物质分离的一种方法。 例1. 如何除去食盐中混有的少量泥沙。 简析:将含有泥沙的食盐溶于水,利用食盐溶于水而泥沙不溶,通过过滤,把泥沙从食盐中除去,再把滤液蒸干即得纯净的食盐。 2. 结晶法:是根据几种固体物质的溶解度受温度变化影响的不同,通过冷却或升温的方法使其中的一种物质先结晶出来,然后过滤使结晶出来的晶体与母液分离的一种方法。 例2. 如何除去KNO 3中混有的少量NaCl 。 简析:将含有少量NaCl 的KNO 3配成热的饱和溶液,利用KNO 3的溶解度受温度变化影响大的性质,采用降温冷却的方法,使KNO 3结晶析出,而NaCl 则留在母液里,再过滤即可得纯净的KNO 3晶体。 二、化学方法 化学方法是根据被提纯物质和杂质之间的化学性质差异,选择不与被提纯物反应而与杂质反应的试剂把杂质除杂的同时,不能给被提纯物带来新的杂质。常用的方法有以下五种: 1. 沉淀法:即将杂质转变为沉淀而除去。常用的沉淀剂为:Mg Fe Cu 232+++ 、、等阳离子,一般用可溶性碱,Cl - 用Ag +,SO 42-用Ba CO 232+-,用Ca 2+ 。 例3. 如何除去NaCl 中混有的少量Na SO 24。 简析:把混合物溶于水,得到含Na Cl SO +--、、42的溶液,其中SO 42- 为杂质离子,可加Ba 2+ 使SO 42- 转变为BaSO 4沉淀而除去,加入的试剂不能带来新的杂质,故试剂的阴 离子为Cl - ,即向混合溶液中加入BaCl 2溶液至不再产生沉淀为止,过滤、蒸发滤液即得纯净的氯化钠。 Na SO BaCl BaSO NaCl 24242+=↓+ 2. 气化法:即将杂质转变为气体而除去 例4. 如何除去Na SO 24中混有的少量Na CO 23
初中化学除杂问题与练习题
初中化学除杂问题与练习题
初中化学除杂专题 一、明确目的 物质除杂又叫物质提纯,即把混合物中少量的杂质出去,得到较纯净物质 的过程。明确要得到的是什么物质,除了此物质之外,其它的都不能存在。 二、除杂原则与技巧 简单概括为:不增,不减,易分, 最佳,重在积累。 (1)不增:提纯过程中不能引入新的杂质。 (2)不减:被提纯物质不能减少,如加入试剂只能与杂质反应,不能 与被提纯物反应。 (3)易分:操作简单,容易分离。 (4)最佳:最好在除去杂质的同时能增加被提纯物质的量。 (5)知识重在积累,熟练贯通,灵活运用。尊重事实,合理应用。 三、常用除杂方法: 1、物理方法:过滤法、降温结晶法、蒸发结晶法、利用物质的磁性等。 2、化学方法:沉淀法、气化法、置换法、中和法、吸收法。 三、初中常见物质提纯方法总结 物质杂质除杂方法 CO2O2通过灼热的铜网 CO2CO通过灼热的氧化铜 H2、CO2、O2H2O通过浓硫酸或氯化钙等干燥剂 O2、H2、CO CO2、SO2通入氢氧化钠溶液中洗气CO2HCl通入碳酸氢钠钠溶液中洗气 Cu Fe、Zn加入足量的稀盐酸或稀硫酸,过滤 Fe Cu用磁铁将铁粉吸引出来 Cu CuO加入足量的稀盐酸或稀硫酸,过滤 CuO Cu或C在空气中灼烧 CaO CaCO3高温煅烧 CaCO3CaO加足量水溶解,过滤,取滤渣 CaCO3CaCl2加足量水溶解,过滤,取滤渣 CaCl2 CaCO3加足量水溶解,过滤,取滤液蒸发 NaCl NaHCO 加入足量盐酸,蒸发 3 KNO3 NaCl冷却热饱和溶液 NaCl KNO3蒸发结晶;降温结晶(硝酸钾在水中溶解度随着温度变化 大) NaNO3NaCl加入适量AgNO3过滤 NaCl CuSO4加入适量Ba(OH)2,过滤 NaOH NaCO3加入适量Ca(OH)2,过滤 NaCl Na2SO4加入适量BaCl2溶液,过滤 Na2SO4CuSO4加适量NaOH溶液
初中化学除杂题型解题技巧总结
初中化学除杂题型解题技巧总结 1. 除杂题: 解答除杂质一类的题目时,要注意三原则;三要领;六种常用的方法。 三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。 在掌握了以上除杂质的原则、要领、方法后,解答题目时要审清题目要求,分析理顺思路且与题目要求吻合,才能准确解题。 ( )例1. (07昆明)除去KCl溶液中混有的少量K2CO3,选用的试剂是 A.H2SO4溶液 B.稀盐酸 C.K2SO4溶液 D. AgNO3溶液 ( )例2. (08哈尔滨)除去下列各物质中的少量杂质所选用的试剂及操作方法均正确的是 ( )例3. (08黄石)下列除杂方法正确的是 A.用NaOH除去CO2中混有的HCl B.用点燃的方法除去CO2中混有少量的CO C.用水除去MnO2中混有的KCl D.用硝酸除去NaCl中混有的Na2CO3
( )例4. (08盐城)下表列出了除去物质中所含少量杂质的方法,其中错误的是 ( )例5. (08南通)除去下列物质中所含少量杂质的方法正确的是 ... 中考链接 ( )1.(08大庆)下表中,除去物质所含杂质的方法正确的是 ( )2.(07雅安)除去下列各组物质中的杂质,所用试剂和方法均正确的是 ()3.(11扬州)下列除杂选用试剂正确的是
A.用过量的O2除去CO2中CO B.用过量的FeSO4溶液除去Zn中的Fe C.用过量的NaOH除去CaCl2溶液中HCl D.用过量HCl溶液除去Cu中CuO ()4.(11无锡)除去下表所列物质中含有的杂质,所用试剂和操作方法均正确的是 ()5.(11泰州)除去下列物质中括号内少量杂质的方法,合理的是 A. CaO(CaCO3):加入足量的稀盐酸 B. CO2 (CO ):在氧气中点燃 C. H2 (HCl 、 H2O):把混合气体通过盛有足量生石灰和烧碱混合固体的干燥管 D.KNO3(K2SO4):溶解,加入过量的硝酸钡溶液、过滤 ()6.(09南通)下列选用的除杂试剂和实验操作都正确的是(括号内为杂质) A. NaCl( Na2CO3 ):加入足量稀盐酸、蒸发、结晶 B. CaCl2 ( CaCO3 ) :加入足量稀硫酸、蒸发、结晶 C. Fe (Cu) :加入足量稀盐酸、过滤、洗涤、干燥 D. MnO2 (KCl):加入足量的水溶解、过滤、洗涤、干燥 ()7.(09扬州)下列除杂试剂选用正确的是 ()8.(09连云港)除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是
初中化学除杂专题可直接打印
初中化学除杂题型解题技巧总结 一、解除杂题的原则、要领、方法 三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。 三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。 二、常见物质的除杂 一、气体除杂:(括号中为杂质) 1.CO2(含O2):将气体通过灼热的铜网。 2.CO2(含H2或CO):将气体通过灼热的氧化铜。 3.O2或CO2或H2(含H2O):将气体通过浓硫酸或氧化钙或氯化钙等干燥剂。 4.O2或H2或CO(含CO2或SO2):将气体通入氢氧化钠溶液中 二、固体除杂: 1.Cu(含Fe或Mg或Zn):加入足量的稀盐酸或稀硫酸,过滤。(将活泼金属用酸溶解)2.Fe(含Cu):用磁铁将铁粉吸引出来。 3.Cu(含CuO)、Fe(含Fe2O3):高温下与H2或CO反应。(将金属氧化物还原成金属)4.CuO(含Cu或C):在空气中灼烧。 5.CaO(含CaCO3):高温煅烧(CaCO3分解成CaO和CO2) 6.CaCO3(含CaO):加足量水溶解,过滤,取滤渣。(CaO与水反应溶于水) 7.CaCO3(含CaCl2):加足量水溶解,过滤,取滤渣。(CaCl2溶于水,CaCO3不溶于水)8.CaCl2(含CaCO3):加足量水溶解,过滤,取滤液蒸发。 9.Ca(OH)2(含CaO):加足量水。(CaO与水反应生成氢氧化钙) 三、溶液除杂: 1.FeSO4溶液(含H2SO4或CuSO4)、FeCl2溶液(含盐酸或CuCl2):过量铁粉,过滤,取滤液。 有关反应:Fe+H2SO4=FeSO4+H2↑;Fe+CuSO4=Cu+ FeSO4
人教版九年级化学下册初中物质除杂(提纯)专题
除杂(提纯)的原则:不增不减、易分离 一.物理方法 1.过滤法:用来除去可溶物和不溶物 常见不溶于水的沉淀有:AgCl、PbSO4、BaSO4、大多数的碳酸盐、以及Cu(OH)2、Fe(OH)3、Al(OH)3等氢氧化物、MnO2等。 例:KCl(AgCl): Na2SO4 (BaSO4): NaCl(MnO2): 2、结晶法: 大多数固体物质的溶解度随温度升高而增大,曲线为"陡升型",如KNO3 少数固体物质的溶解度受湿度的影响很小,曲线为"缓升型",如NaCl 极少数固体物质的溶解度随湿度的升高而减小,曲线为"下降型",Ca(OH)2 例:下列混合物适宜用结晶法分离的是( ) A. NaNO3 Na2CO3 B. NaNO3 NaCl C. NaOH Mg(OH)2 D. NaCl BaSO4 3. 磁铁吸引:分离有磁性和无磁性的: 铁粉和硫粉 铜粉和铁粉 4. 洗气法: H2(H2O) CO2(H2O) 二.化学方法:(沉淀法、气体法、置换法、吸收法、其它法) 1.沉淀法:使混合物中的杂质与适当试剂反应,生成沉淀通过过滤而除去。 例:.如何除去下列物质中的杂质(括号内为杂质),用化学方程式表示 NaCl( Na2SO4 )_____________________________________ HCl ( H2SO4 )_____________________________________ HNO3 (HCl ) _____________________________________ NaCl(MgCl2) ____________________________________ 2.气体法:将混合物中的杂质与适当试剂反应变成气体而除去。 一般规律为:CO32-+ 强酸= CO2;NH4+ + OH- = NH3 例:如何除去下列物质中的杂质(括号内为杂质),用化学方程式表示 NaCl( Na2CO3 )____________________________________ Na2SO4(Na2CO3)____________________________________ CaCl2溶液(盐酸) KCl (NH4Cl) ______________________________________ KNO3(KOH) ______________________________________ Na2SO4(NaOH) ___________________________________ 3.置换法:将混合物中的杂质与适量试剂通过发生置换反应而除去。 FeSO4(CuSO4) 4.吸收法 CO(CO2)_______________________________________ H2(HCI)_____________________________________ H2(CO2) N2(O2) 5.加热法:
初中化学除杂专题含答案
) (2012.宁波市)为提纯下列物质,所选用的除杂试剂和分离方法都正确的是( 4.初中化学除杂专题分离方法除杂试剂序号物质(括号内为杂质) A 蒸发结晶稀盐酸氯化钠固体(碳酸钠))德阳)下列除去混合物中少量杂质的方法或加入试剂合理的是(1.(2012· B 金属铜过滤氯化铜溶液(氯化锌)所含杂质除去杂质的方法或加入试剂选项物质 C 二氧化碳(一氧化碳)氢氧化钠溶液洗气)A KCl KSOBa(NO 2 4 32D 二氧化锰粉末(碳粉)水过滤Cu CuO B 空气中灼烧5.(2012.株洲市)下列选项中括号内物质为杂质,右边为除杂试剂,其中不合理的是...NC CO 澄清石灰水2 2 A.氯化钠固体(碳酸钙)水 D Ca(OH)CaCO 盐酸32 B.氧气(水蒸气)浓硫酸)淮安市)下列实验操作中,不能达到实验目的是((2.2012.C.硫酸亚铁溶液(硫酸铜)铁粉 ,所选试剂及操作方法均泰州市)为除去下表样品中的少量杂质(括号内为杂质)6.(2012. )正确的是( 操作方法样品成分所选试剂序 A 溶解、过滤、洗涤干燥水)KCl(MnO2 3.的一组是菏泽市)除去下列物质中含有的杂质所选用试剂或操作方法不正确(2012.... B 加热至质量不再减少)(NaCONH HCO 3234 C NaCl(KNO)水溶解、降温结晶、过滤3D NaCl(MgCl)过量NaOH溶液过滤、蒸发结晶2
7.(2012?绍兴)为除去下列物质中的杂质(括号内是杂质),下列操作方法正确的是()11.(2012.鸡西市)除去下列物质中所含的少量杂质,下表中除杂方法正确的是
)苏州)除去下列物质中的少量杂质(括号内为杂质)的方法错误的是()8.(2012?...)﹣降温结晶B.NaCl溶液(KNO )﹣用生石灰(A.OHO322除去杂质的方法选项物质杂质 COCaCOC.粉末(Na)﹣加水过滤D.COK)﹣加适量盐酸KCl溶液(32233NaCl A 加入水溶解,过滤,蒸发泥沙 ) (2012.眉山市)除去下列物质中的杂质,选用试剂或操作方法不正确是( 9 OB 水蒸气通过足量的浓硫酸2
初中化学除杂问题总结
初中化学常见物质的除杂总结 一、概念理解 首先明白物质除杂是干什么,物质除杂又叫物质提纯,即把混合物中少量的杂质出去,得到较纯净物质的过程。 二、除杂原则 简单概括为:不增,不减,易分。 (1)不增:提纯过程中不能引入新的杂质。 (2)不减:被提纯物质不能减少,如加入试剂只能与杂质反应,不能与被提纯物反应。 (3)易分:操作简单,容易分离。 三、解题要领 三要领:找差异,定方法,选试剂。 (1)找差异:根据混合物各物质特征,物理性质或者化学性质,找到突破口。 (2)定方法:找到突破口之后,根据物质特征,确定除杂方法。 (3)选试剂:根据物质特征和所选方法选择合适的试剂。 四、常用除杂方法: 1、物理方法:过滤法、结晶法、蒸发法。 2、化学方法:沉淀法、气化法、转化法、中和法、吸收法。 五、初中常见物质提纯方法总结
六、理解与提高 这种题型常常结合物质的共存、溶解性、酸碱性等知识考查,只要对除杂混合物中各物质的物理性质、化学性质比较了解,那么做这类试题就不会太难,要求基础知识掌握比较扎实。如果,某些杂质不能通过一种方法除去,可以结合几种方法,前提是方法可行,操作简单易行。 1.气体除杂原理: 转化法:杂质五某种物质反应,生成被提纯物,如编号2、10。 吸收法:气体除杂常用吸收法。 吸收H2O:浓H2SO4、GaCl2等干燥剂 吸收CO2、SO2:NaHO等碱性溶液 2.固体除杂原理: 过滤法:适用对象为提纯物不溶解,杂质溶解类型,如编号11、12 3. 液体除杂原理: 沉淀法:杂质中含不溶性物质的离子,如编号17、19、20、21。要求对物质的溶解性比较熟悉,并能够熟练应用。 气化发:将杂质转化成气体,从混合物中除去,如编号22。
初中化学除杂问题总结
初中化学常见物质的除杂总结一、概念理解 首先明白物质除杂是干什么,物质除杂又叫物质提纯,即把混合物中少量的杂质出去,得到较纯净物质的过程。 二、除杂原则 简单概括为:不增,不减,易分。 (1)不增:提纯过程中不能引入新的杂质。 (2)不减:被提纯物质不能减少,如加入试剂只能与杂质反应,不能与被提纯物反应。 (3)易分:操作简单,容易分离。 三、解题要领 三要领:找差异,定方法,选试剂。 (1)找差异:根据混合物各物质特征,物理性质或者化学性质,找到突破口。 (2)定方法:找到突破口之后,根据物质特征,确定除杂方法。 (3)选试剂:根据物质特征和所选方法选择合适的试剂。
四、常用除杂方法: 1、物理方法:过滤法、结晶法、蒸发法。 2、化学方法:沉淀法、气化法、转化法、中和法、吸收法。 五、初中常见物质提纯方法总结 物质 杂质 除杂方法 编号 CO 2 O 2 通过灼热的铜网 1 CO 2 CO 通过灼热的氧化铜 2 H 2、CO 2、O 2 H 2O 通过浓硫酸或氯化钙等干燥剂 3 O 2、H 2、CO CO 2、SO 2 通入氢氧化钠溶液中洗气 4 CO 2 HCl 通入碳酸氢钠钠溶液中洗气 5 Cu Fe 、Zn 加入足量的稀盐酸或稀硫酸,过滤 6 Fe Cu 用磁铁将铁粉吸引出来 7 Cu CuO 加入足量的稀盐酸或稀硫酸,过滤 8 CuO Cu 或C 在空气中灼烧 9 CaO CaCO3 高温煅烧 10 CaCO3 CaO 加足量水溶解,过滤,取滤渣 11 CaCO3 CaCl2 加足量水溶解,过滤,取滤渣 12 CaCl2 CaCO3 加足量水溶解,过滤,取滤液蒸发 13
初中化学常见物质的除杂
初中化学常见物质的除杂 一、方法指导: 解答除杂质一类的题目时,要注意三原则;三要领;五种常用的方法。 三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。 三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。 二、除杂是有一些原则的: 1、添加的药品不能与要保留的物质反应 2、生成物必须是沉淀或气体或与要保留的物质相同的物质 3、溶液除杂生成物不能是除了要保留溶液的其他溶液,气体除杂也一样 三、除杂质思路分析方法: (1)沉淀法:加入一种试剂将被除去的杂质变为沉淀,再用过滤法除去。 (2)化气法:加热或加入一种试剂将杂质变为气体逸出。 (3)置换法:利用置换反应的原理将杂质除去。 (4)转纯法:将被除去的杂质变为提纯的物质。 (5)吸收法:常用于气体的提纯。 在掌握了以上除杂质的原则、要领、方法后,解答题目时要审清题目要求,分析理顺思路且与题目要求吻合,才能准确解题。 四、常见物质的除杂 (一)、气体除杂:(括号中为杂质) 1. CO2(含O2):将气体通过灼热的铜网。 2. CO2(含H2或CO):将气体通过灼热的氧化铜。 3. O2或CO2或H2(含H2O):将气体通过浓硫酸或氧化钙或氯化钙等干燥剂。 4. O2或H2或CO(含CO2或SO2):将气体通入氢氧化钠溶液中 (二)、固体除杂: 1. Cu(含Fe或Mg或Zn):加入足量的稀盐酸或稀硫酸,过滤。(将活泼金属用酸溶解)2. Fe(含Cu):用磁铁将铁粉吸引出来。 3. Cu(含CuO)、Fe(含Fe2O3):高温下与H2或CO反应。(将金属氧化物还原成金属)4. CuO(含Cu或C):在空气中灼烧。 5. CaO(含CaCO3):高温煅烧(CaCO3分解成CaO和CO2) 6. CaCO3(含CaO):加足量水溶解,过滤,取滤渣。(CaO与水反应溶于水) 7. CaCO3(含CaCl2):加足量水溶解,过滤,取滤渣。(CaCl2溶于水,CaCO3不溶于水)8. CaCl2(含CaCO3):加足量水溶解,过滤,取滤液蒸发。 9. Ca(OH)2(含CaO):加足量水。(CaO与水反应生成氢氧化钙) (三)、溶液除杂: 1. FeSO4溶液(含H2SO4或CuSO4)、FeCl2溶液(含盐酸或CuCl2):加过量铁粉,过滤,取滤液。 有关反应:Fe+H2SO4=FeSO4+H2↑; Fe+CuSO4=Cu+ FeSO4 Fe+2HCl=FeCl2+H2↑; Fe+CuCl2=Cu+ FeCl2 2. NaCl溶液(含Na2CO3):加适量..稀盐酸。 Na2CO3+2HCl=2NaCl+H2O+CO2↑
(完整版)初三化学-物质的鉴别与除杂专题练习
物质的鉴别与除杂专题复习
7、区分下列各组物质,所加试剂或操作方法错误的是() 选项待区分的物质所加试剂或操作方法 A 合成纤维和纯羊毛取少量灼烧,并闻气味 B Na2SO4溶液和NaCl溶液取少量加BaCl2,观察有无沉淀 C 黄金和黄铜观察颜色 D 白醋和水闻气味 8、下表中除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)() 9、下表中,除去物质中所含少量杂质的方法错误的是() 选项物质所含杂质除去杂质的方法 A N2气体O2 将气体缓缓通过灼热的铜网 B MnO2粉末KCl 加水溶解,过滤、洗涤、烘干 C CO2 HCl 将气体通入饱和碳酸氢钠溶液 D KCl溶液CaCl2加入适量碳酸钠,充分反应后过滤 10、若N2中混有少量的H2、CO2和水蒸气,欲将这些杂质完全除去,要用下列操作:①通过浓硫酸②通过灼热的氧化铜③通过NaOH溶液④通过浓盐酸。以下操作组合,哪一种组合最好() A、①③④ B、③②① C、③①④ D、④②③ 11、下列各组混合物中,用一种试剂不能将括号内的杂质除去的是…() A.CuSO4 (Na2SO4) B.C (CuO) C.CO2 (CO) D.NaCl (MgCl2) 12、某电池厂排放的污水pH=4,并含有重金属离子Pb2+,下列合理的治理方案是向污水中加入…………………………………………………………() A.石灰石和铜粉 B.生石灰和铁粉 C.纯碱和木炭粉 D.烧碱和铝粉 13、某溶液中含有 AgNO3、Ba(NO3)2、Cu(NO3)2三种物质,要使溶液中的Ag+、Ba2+ 和Cu2+分别生成沉淀并加以分离,可使用的试剂有:① NaCl 溶液,② Na2CO3溶液,③ NaOH 溶液,则加入试剂的顺序是……………()。 A、①②③ B、③②① C、②③① D、①③②
初中化学除杂专题(含答案)
初中化学除杂专题 1.(2012·德阳)下列除去混合物中少量杂质的方法或加入试剂合理的是()选项物质所含杂质除去杂质的方法或加入试剂 A KCl K2SO4 Ba(NO3) 2 B CuO Cu 空气中灼烧 C CO2 N2 澄清石灰水 D Ca(OH)2 CaCO3盐酸 2.(2012.淮安市)下列实验操作中,不能达到实验目的是() 3.(2012.菏泽市)除去下列物质中含有的杂质所选用试剂或操作方法不正确 ...的一组是 4.(2012.宁波市)为提纯下列物质,所选用的除杂试剂和分离方法都正确的是( ) 序号物质(括号内为杂质)除杂试剂分离方法 A 氯化钠固体(碳酸钠)稀盐酸蒸发结晶 B 氯化铜溶液(氯化锌)金属铜过滤 C 二氧化碳(一氧化碳)氢氧化钠溶液洗气 D 二氧化锰粉末(碳粉)水过滤 5.(2012.株洲市)下列选项中括号内物质为杂质,右边为除杂试剂,其中不合理 ...的是A.氯化钠固体(碳酸钙)水 B.氧气(水蒸气)浓硫酸 C.硫酸亚铁溶液(硫酸铜)铁粉 D.一氧化碳(二氧化碳)灼热的氧化铜 6.(2012.泰州市)为除去下表样品中的少量杂质(括号内为杂质),所选试剂及操作方法均正确的是() 序号样品成分所选试剂操作方法 A KCl(MnO2)水溶解、过滤、洗涤干燥 B Na2CO3(NH4 HCO3)加热至质量不再减少 C NaCl(KNO3)水溶解、降温结晶、过滤 D NaCl(MgCl2)过量NaOH溶液过滤、蒸发结晶
7.(2012?绍兴)为除去下列物质中的杂质(括号内是杂质),下列操作方法正确的是( ) 8.(2012?苏州)除去下列物质中的少量杂质(括号内为杂质)的方法错误的是( ) A .O 2(H 2O )﹣用生石灰 B .NaCl 溶液(KNO 3)﹣降温结晶 C .CaCO 3粉末(Na 2CO 3)﹣加水过滤 D .KCl 溶液(K 2CO 3)﹣加适量盐酸 9(2012.眉山市)除去下列物质中的杂质,选用试剂或操作方法不正确是( ) 10.(2012.日照市)为除去物质中的杂质(括号内为杂质),所选试剂(过量)及操作方法均正确的是 ( ) 11.(2012.鸡西市)除去下列物质中所含的少量杂质,下表中除杂方法正确的是 12.(2012.娄底市)除去下列各组物质中的少量杂质,所用方法不正确...的是 ( ) 选项 物质 杂质 除去杂质的方法 A NaCl 泥沙 加入水溶解,过滤,蒸发 B O 2 水蒸气 通过足量的浓硫酸 C NaOH 溶液 Na 2CO 3 滴入足量稀盐酸至不再产生气体 D H 2 HCl 气体 先通过NaOH 溶液,再通过浓硫酸 13.(2012.兰州市) 下列除去杂质的方法中正确的是 ( ) 选项 物质 杂质 除杂质的方法 A CaCl 2溶液 稀盐酸 过量碳酸钙、过滤 B KOH 溶液 KCl 适量稀盐酸 C NaCl 溶液 Na 2CO 3 适量硝酸钙溶液、过滤 D O 2 CO 通过灼热的氧化铜
初中化学除杂质试题
初中化学除杂质试题 例1粗盐中混有Mg2+、Cu2+、SO42—和泥沙,为了除去杂质在实验室中可将粗盐溶于水然后进行下列操作:⑴过滤;⑵加入过量的氢氧化钠溶液;⑶加入适量的盐酸;⑷加过量Na2CO3溶液;⑸加过量的BaCl2溶液;正确的操作顺序是() A ⑸⑷⑵⑴⑶B⑴⑵⑶⑷⑸C⑸⑷⑶⑵⑴D⑴⑸⑷⑵⑶ 例2用Na2CO3、BaCl2(Ba2+有毒)、盐酸三种药品除去食盐中含有的Na2CO3、Na2SO4,得到纯净的NaCl溶液,则加入药品的合理顺序是。 例3现有一包NaCl固体其中混有少量硫酸钠和氯化镁,可通过以下实验除去杂质得到纯净的NaCl请将正确合理的操作顺序填入括号中,并简要回答 ⑴~⑶题 ()在溶液里加入稍过量的Na2CO3溶液,然后过滤 ()加入稍过量的BaCl2溶液,然后过滤。 ()将混有杂质的NaCl完全溶解于水。 ()在滤溶液中加入稀盐酸至溶液的P H值等于7 ()蒸发结晶 ()在滤液中加入稍过量的NaOH溶液,然后过滤 ⑴为什么要加入稍过量的Na2CO3 ⑵为什么要加入稀盐酸至溶液的7 。 ⑶写出上述两步骤的有关的化学方程式。 例4某粗盐溶液中含有少量的CaCl2、MgCl2、Na2SO4和泥沙,进行以下操作可将杂质除去,⑴过滤;⑵加适量盐酸;⑶加过量的氢氧化钠溶液;⑷加过量碳酸钠溶液;⑸加适量氯化钡溶液;正确操作顺序是() A⑸⑷⑶⑴⑵B⑴⑵⑶⑷⑸C⑴⑸⑷⑵⑵D⑸⑷⑶⑵⑴ 例5要除掉粗盐中含有的氯化镁、硫酸镁等杂质。现设计一个除杂质的方案:把盐溶液 溶于水,过滤成澄清溶液,再进行下列各步骤的处理:①加入氯化钡溶液至沉淀完全;②用盐酸调节PH值至溶液呈微酸性;③加入NaOH溶液至沉淀完全;④过滤废弃滤出的沉淀;⑤加入碳酸钠溶液至沉淀完全;最后蒸发浓缩使NaOH晶体析出,对上述各处理步骤的顺序安排合理的是() A ①②③④⑤ B ③①⑤④② C ②①③④⑤D②③⑤④① 例6为了除粗盐中的氯化钙、硫酸镁及泥沙,可将粗盐溶于水,然后进行下列四项操作(同时过滤操作) ⑴加过量的BaCl2溶液⑵加加适量的盐酸⑶加过量Na2CO3 ⑷加过量NaOH溶液下列操作的顺序属于正确的是() A⑴⑵⑶⑷B⑶⑷⑴⑵C⑴⑶⑷⑵D⑷⑴⑵⑶ 例7欲用含有少量氯化钙的氯化钠固体,配制溶质的质量分数为a%的氯化钠溶液,设计了下面所示的操作方案。根据方案中所示回答下列各问:
(完整版)初中化学常见物质的除杂总结
初中化学常见物质的除杂总结 概念理解 首先明白物质除杂是干什么,物质除杂又叫物质提纯,即把混合物中少量的杂质出去,得到较纯净物质的过程。 初中化学除杂、提纯方法及例题 将混合物中的几种物质分开而分别得到较纯净的物质,这种方法叫做混合物的分离。将物质中混有的杂质除去而获得纯净物质,叫提纯或除杂。 1 物理方法 1.l 过滤法.原理:把不溶于液体的固体与液体通过过滤而分开的方法称为过滤法。 如:氯化钙(CaCl2)中含有少量碳酸钙(CaCO3)杂质,先将混合物加水(H2O)溶解,由于氯化钙(CaCl2)溶于水,而碳酸钙(CaCO3)难溶于水,过滤除去杂质碳酸钙(CaCO3),然后蒸发滤液,得到固体氯化钙(CaCl2)。如果要获得杂质碳酸钙(CaCO3),可洗涤烘干。 练习1 下列混合物可以用溶解、过滤、蒸发操作来分离的是:() A.CaCO3 CaO B.NaCl KNO3C.NaNO3 BaSO4D.KCl KClO3 1.2 结晶法.原理:几种可溶性固态物质的混合物,根据它们在同一溶剂中的溶解度或溶解度随温度的变化趋势不同,可用结晶的方法分离。 eg:除去固体硝酸钾(KNO3)中混有的氯化钠(NaCl)杂质,先在较高温度下制成硝酸钾的饱和溶液,然后逐步冷却,由于硝酸钾(KNO3)的溶解度随温度的升高而显著增大,温度降低,大部分硝酸钾成为晶体析出,而氯化钠的溶解度随温度的升高而增大得不显著,所以大部分氯化钠仍留在母液中,通过过滤把硝酸钾和氨化钠溶液分开。为进一步提纯硝酸钾,可再重复操作一次,叫重结晶或再结晶。 练习2 下列混合物适宜用结晶法分离的是:() A.NaNO3 Na2CO3B.NaNO3 NaCl C.NaOH Mg(OH)2D.NaCl BaSO4 2 化学方法:原理 (一)、加入的试剂只与杂质反应,不与原物反应。 (二)、反应后不能带入新的杂质。 (三)、反应后恢复原物状态。
初中化学常见物质的除杂12692
初中化学常见物质的除杂 一、方法指导: 解答除杂质一类的题目时,要注意三原则;三要领;五种常用的方法。 三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。 三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。 二、除杂就是有一些原则的: 1、添加的药品不能与要保留的物质反应 2、生成物必须就是沉淀或气体或与要保留的物质相同的物质 3、溶液除杂生成物不能就是除了要保留溶液的其她溶液,气体除杂也一样 三、除杂质思路分析方法: (1)沉淀法:加入一种试剂将被除去的杂质变为沉淀,再用过滤法除去。 (2)化气法:加热或加入一种试剂将杂质变为气体逸出。 (3)置换法:利用置换反应的原理将杂质除去。 (4)转纯法:将被除去的杂质变为提纯的物质。 (5)吸收法:常用于气体的提纯。 在掌握了以上除杂质的原则、要领、方法后,解答题目时要审清题目要求,分析理顺思路且与题目要求吻合,才能准确解题。 四、常见物质的除杂 (一)、气体除杂:(括号中为杂质) 1. CO 2(含O 2 ):将气体通过灼热的铜网。 2. CO 2(含H 2 或CO):将气体通过灼热的氧化铜。 3. O 2或CO 2 或H 2 (含H 2 O):将气体通过浓硫酸或氧化钙或氯化钙等干燥剂。 4. O 2或H 2 或CO(含CO 2 或SO 2 ):将气体通入氢氧化钠溶液中 (二)、固体除杂: 1. Cu(含Fe或Mg或Zn):加入足量的稀盐酸或稀硫酸,过滤。(将活泼金属用 酸溶解) 2. Fe(含Cu):用磁铁将铁粉吸引出来。 3. Cu(含CuO)、Fe(含Fe 2O 3 ):高温下与H 2 或CO反应。(将金属氧化物还原成 金属) 4. CuO(含Cu或C):在空气中灼烧。 5. CaO(含CaCO 3):高温煅烧(CaCO 3 分解成CaO与CO 2 ) 6. CaCO 3 (含CaO):加足量水溶解,过滤,取滤渣。(CaO与水反应溶于水) 7. CaCO 3(含CaCl 2 ):加足量水溶解,过滤,取滤渣。(CaCl 2 溶于水,CaCO 3 不溶于 水) 8. CaCl 2(含CaCO 3 ):加足量水溶解,过滤,取滤液蒸发。 9. Ca(OH) 2 (含CaO):加足量水。(CaO与水反应生成氢氧化钙) (三)、溶液除杂: 1. FeSO4溶液(含H2SO4或CuSO4)、FeCl2溶液(含盐酸或CuCl2): 加过量铁粉,过滤,取 滤液。
