第3节热力学第一定律
3热力学第一定律

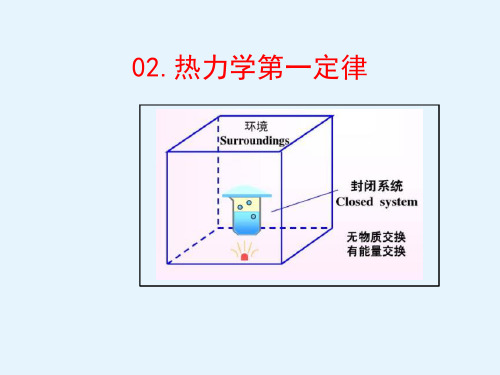
§3.热力学第一定律 / 一、内能增量、功、热量正负规定
或外界对系统作功。 3.热量 系统吸热 系统放热
m Q Cm(T2 T1 ) M
Q吸 0
Q放 0
二、热力学第一定律
设一热力学系统,初始时内能为E1, 如果系统吸热,使系统内能增加到E2,系 统对外作功W。
§3.热力学第一定律 / 二、热力学第一定律
2 1
3.明确几点
①.注意内能增量、功、热量的正负规定。
第一定律的符号规定
Q
E2 E1
内能增加
W
系统对外界做功
+
系统吸热
系统放热
内能减少
外界对系统做功
§3.热力学第一定律 / 二、热力学第一定律
设计制作
干耀国
山东科技大学济南校区
§3.热力学第一定律
由能量守恒与转换定律
Q ( E2 E1 ) W Q E W
W
1.热力学第一定律 系统吸收的热量, 转变成系统的内能和 系统对外做的功。
系 E 统
Q吸
2.热力学第一定律对微小过程的应用
dQ dE dW
§3.热力学第一定律 / 二、热力学第一定律
符号 d 表示“元”,因为Q、W不是状 态 函数,不能写成微分。 V 由 W V PdV , dQ dE PdV
第三节 热力学第一 定律
热力学第一定律实际上是包括热现象 在内的能量守恒与转换定律。 一、规定内能增量、功、热量的正负 1.内能增量
m i E RT M2
E 0 系统温度升高 T 0, E 0 系统温度降低 T 0, V W V PdV 2.功 体积膨胀V 0, W 0 系统对外界做正功。 体积收缩V 0, W 0 系统对外界做负功,
6-9第三章能量与热力学第一定律

第三章 能量与热力学第一定律 (6)基本要求深入理解热力学第一定律的实质,熟练掌握热力学第一定律及其表达式。
能够正确、灵活地应用热力学第一定律表达式来分析计算工程实际中的有关问题。
掌握稳态稳流能量方程的应用 本章重点熟练应用热力学第一定律解决具体问题3.1 热力学第一定律的实质3.1.1热力学第一定律产生概述19世纪30-40年代,迈尔·焦耳(德国医生)发现并确定了能量转换与守恒定律。
恩格斯将这列为19世纪三大发现之一(细胞学说、达尔文进化论)。
能量守恒定律:一切物质都具有能量。
能量不能被创造,也不能被消灭,它只能由一种形式转变为另外一种形式,或者由一个系统传递给另外一个系统,在转换和传递的过程中,能量的总和不变。
至今为止,没有一个人提出一个事实不符合这条自然规律的,相反,在各个领域:天文、地理、生物、化学、电磁光、宏观、微观各领域都遵循 这条规律。
热力学是研究能量及其特性的科学,它必然要遵循这条规律。
热力学第一定律是能量守恒与转换定律在热力学中的应用,它确定了热力过程中各种能量在数量上的相互关系。
3.1.2热力学第一定律的实质实质: 能量守恒与转换定律在热力学中的应用。
收入-支出=系统储能的变化 或 =+sur sys E E 常数 对孤立系统:0=∆isol E 或 0=∆+∆sur sys E E 3.1.3 热力学第一定律的三种表述热力学第一定律实质就是热力过程中的能量守恒和转换定律,它建立了热力过程中的能量平衡关系,是热力学宏观分析方法的主要依据之一。
热力学第一定律可表述为:热和功可以互相转换,为了获得一定量的功必须消耗一定量的热。
根据热力学第一定律,要想得到机械能就必须花费热能或其它能量,那种幻想创造一种不花费能量就可以产生动力的机器的企图是徒劳的。
因此,热力学第一定律也可以表述为:不花费能量就可以产生功的第一类永动机是不可能制造成功的。
热力学第一定律适用于一切热力系统和热力过程,不论是开口系统还是闭口系统,热力学第一定律均可表达为:进入系统的能量一离开系统的能量 = 系统储存能量的变化3.1.4闭口系统能量方程式闭口系统与外界没有物质交换,传递能量只有热量和功量两种形式。
03 热力学第一定律

u cv T v
对于理想气体:
第三节
采用定值比热容计算: 采用平均比热容计算:
闭口系统能量方程式
由理想气体组成的混合气体的内能等于组成气体内能之和: U U1 U 2 U n U i
i 1 n
mu mi ui
Q1 2 (U 2 U1 ) W1 2
对1kg工质,有:
Q dU pdV
Q12 (U 2 U1 ) pdV
1 2
q du w
q1 2 (u2 u1 ) w1 2
q du pdv
q12 (u2 u1 ) pdv
进入控制体的能量 1 2 Q (h1 c1 gz1 ) m1 离开控制体的能量
1 2 Ws (h2 c2 gz2 ) m2 2
2
控制体储存能变化:
dEcv ( E dE)cv Ecv
根据热力学第一定律建立能量方程
1 2 1 2 Q (h1 c1 gz1 ) m1 (h2 c2 gz2 ) m2 Ws dEcv 2 2 1 2 1 2 Q (h2 c2 gz2 ) m2 (h1 c1 gz1 ) m1 Ws dEcv 2 2
各种“功”的关系与区别
1.膨胀功(容积功):压力作用下,工质的容积发生变化而传递的机械功
w pdv
2.流动功:推动流体通过控制界面而传递的机械功 流动净功:推动1kg工质进、出控制体所必须的功
w f p2 v2 p1v1
3.轴功:系统通过机械轴与外界传递的机械功
wf p v
ws
3.技术功:热力过程中可被直接利用来作功的能量,统称为技术功
物理化学热力学第一定律

物理化学热力学第一定律
热力学第一定律就是不同形式的能量在传递与转换过程中守恒的定律,表达式为△U=Q+W。
表述形式:热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持不变。
该定律经过迈耳、焦耳等多位物理学家验证。
热力学第一定律就是涉及热现象领域内的能量守恒和转化定律。
十九世纪中期,在长期生产实践和大量科学实验的基础上,它才以科学定律的形式被确立起来。
埃瓦特对煤的燃烧所产生的热量和由此提供的“机械动力”之间的关系作了研究,建立了定量联系。
03第一定律

B 2 v
Q1A2 50kJ
U 2 U1 10kJ
W2 B1 5kJ
解:
W1A2 Q1A2 (U 2 U1 ) 50 10 40kJ
是膨胀过程
p
1
dU 0
Q W
W W
v
A
B 2
1A2
W2 B1 40 5 35kJ
可逆过程 积分形式
q dh vdp
q h2 h1 ( vdp )
1 2
第五节 稳定流动能量方程的应用
开口系统的典型设备:
1.换热器:如锅炉、冷凝器等
2.喷管和扩压管
3.产生功的装置:如蒸汽轮机、燃气轮机
4.消耗功的装置:如泵、压缩机 5.节流装置:如膨胀阀
1 2 2 q h2 h1 ( wg 2 wg ) g ( z2 z1 ) ws 1 2
示热图
标志
dv﹥0 膨胀功 dv =0 无功 dv﹤0 压缩功
示功图
1.熵是状态参数,是尺度量。 四、熵的性质 p 可 1 T q 逆 2 过 图示 p 程 1 2 2 q中 2.T-s(温-熵)图上可逆过程曲 Td? w pdv 容 v 1 ? 线下的面积等于过程热量。 积 图 v 上 功 3.熵产是过程不可逆性的度 2 可逆过程 *强调:1. p v 图上曲线下面的面积代表容积功 的 在 w pdv 量。 1 表 ds>0 吸热 2. dv 0 有 w 0 w 称为膨胀功 称为膨胀功 示 可逆的绝热过程为等熵过程
Q U pdV
1 2
q u pdv
1
2
任意工质、可逆过程
q du pdv
热力学第一定律(高中物理教学课件)完整版
2.应用热力学第一定律解题的一般步骤: ①根据符号法则列出各已知量(W、Q、ΔU)的正 负; ②根据方程ΔU=W+Q求出未知量; ③再根据未知量结果的正负来确定吸放热情况、 做功情况或内能变化情况
二.热力学第一定律的应用
3. 气体状态变化的几种特殊情况:
①绝热过程:Q=0,则ΔU=W,不发生热传递,系统内 能的变化只与做功有关(分绝热膨胀和绝热压缩) ②等温过程: ΔU=0,则W=-Q,气体内能不变,外 界对气体做的功与气体吸收的热量等值异号(分等温膨 胀和等温压缩) ③等容过程:W=0,则ΔU=Q,气体不做功,系统内能 的变化只与热传递有关(分升温升压和降温降压) ④等压过程:等压膨胀,温度升高,内能增加,对外做 功,气体吸热;等压压缩,温度降低,内能减少,对内 做功,气体放热
解:根据热力学第一定律:U W Q 2.5105 J 1.2105 J Q
Q 1.3105 J, 气体向外界放热1.3105 J的功
二.热力学第一定律的应用
1.判断气体是否做功的方法: 一般情况下看气体的体积是否变化. ①若气体体积增大,表明气体对外界做功,W<0 ②若气体体积减小,表明外界对气体做功,W>0
例13. (多选)如图是某喷水壶。未喷水时阀门闭合,压 下压杆可向瓶内储气室充气;多次充气后按下按柄打开
阀门,水会自动经导管从喷嘴处喷出。储气室内气体可
第三章热力学第一定律

• 气缸内空气质量: • 终态吸收的热量:
• 提示:
(1)计算功时如果无法判断工质进行的过程 性质,此时用系统内部参数难以分析,可 直接用外部效果来求解。
(2)注意系统内能和比内能的区别。必须乘 上质量。
量称为热量。
2
q Tds
1
2、特点: (1)热量是过程量,与初、终状态和过程特
性有关。
(2)热量一旦通过界面传入(或传出)系统, 就变成系统(或外界)储存能的一部分, 即内能。有时习惯上称为热能。
从微观角度看:
• 热量——所起的作用是无规热运动能量 的传递。
二、功量 • 系统通过界面和外界进行的机械能的交换
Wre pdV
相同点:功和热量都是过程量。只有在系 统和外界通过边界传递能量时才有意义, 一旦它们越过界面,便转化为系统或外界 的能量。
不能说在某状态下,系统或外界有多少功 或热。
不同点:
(1)功是热力系与外界之间在压差的推动下, 通过宏观有序的运动(有规律的运动)的 方式进行传递能量。换而言之,借作功来 传递能量总是和物体的宏观位移有关。
• 焦耳设计了实验测定了电热当量和热功当 量,用实验确定了热力学第一定律,补充 了迈尔的论证。
• 热力学第一定律是能量转换和守恒定律在 热现象上的应用。
能量守恒定律反映了自然界中物质所具有 的能量既不能创生,也不能消失,而只能 从一种能量形态转换为另一种能量形态, 转换中能量的总量在数量上守恒。
• 热力学第一定律阐明: 1、功与热量在能量方面的等效性; 2、功与热量相互转化的可能性。
注意:流动功不象其它功,流动功是以状 态参数来表示(两状态参数p, v的乘积), 流动功是状态量。
3-热力学第一定律(学案)

3 热力学第一定律能量守恒定律编写:孙高飞汪世环 2012-3-23 班级:_____ 姓名:___ _____一.教学目标(我们要学什么?)(一) 知识与技能1.理解热力学第一定律2.能运用热力学第一定律解释自然界能量的转化、转移问题3.理解能量守恒定律,知道能量守恒定律是自然界普遍遵从的基本规律4.通过能量守恒定律的学习,认识自然规律的多样性和统一性5.知道第一类永动机是不能实现的(二)过程与方法促进学生自主学习,让学生积极参与、乐于探究、勇于实验、勤于思考,培养学生的科学探究能力(三)情感态度与价值观注重激发学生学习物理的情趣和振兴中华的使命感和责任感.二.课前导读(带着问题读书吧!读后,你能解决这些问题吗?)1.焦耳的实验表明什么问题?2.写出热力学第一定律的文字表述和的数学表达式?3.△U,Q,W几个量中的正、负的所代表的意义?4.认真阅读教材后,写出能量守恒定律的内容。
5.什么是第一类永动机?第一类永动机为什么不能制成?三.典例精析(认真分析知识.规律在实际应用中的方法。
)1.一定量的气体在某一过程中,外界对气体做了8×104J的功,气体的内能减少了1.2×105J,则下列各式中正确的是()A.W=8×104J,ΔU =1.2×105J ,Q=4×104JB.W=8×104J,ΔU =-1.2×105J ,Q=-2×105JC.W=-8×104J,ΔU =1.2×105J ,Q=2×104JD.W=-8×104J,ΔU =-1.2×105J ,Q=-4×104J2. 一定质量的气体从外界吸收了4.2×105J的热量,同时气体对外做了6×105J的功,问:(1)物体的内能是增加还是减少?变化量是多少?(2)分子势能是增加还是减少?(3)分子的平均动能是增加还是减少?3.物体从外界吸收热量时,内能()A一定增加B.可能不变C.可能减小D.可能增大4.理想气体在等压变化中()A.一定对外做正功B.外界一定对气体做正功C.若温度升高,一定对外做正功D.可能既不对外做功,外界也不对气体做功5.关于物体内能的变化情况,下列说法中正确的是()A.吸热的物体,其内能一定增加B.体积膨胀的物体,其内能一定减少C.放热的物体,其内能也可能增加D.理想气体等温膨胀,其内能不变6.下列有关内能的说法正确的是()A.质量和温度相同的物体,内能一定相同B.一定质量的理想气体的内能只与温度有关C.一定质量的理想气体在等容变化过程中若吸了热,内能一定增加D.理想气体等温变化,内能可能减少四.课后达标检测(加深知识、规律理解,检测学习、掌握程度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第3节热力学第一定律目标导航1•知道热力学第一定律的内容及其表达式2•理解能量守恒定律的内容3•了解第一类永动机不可能制成的原因诱思导学1.热力学第一定律(1).一个热力学系统的内能增量等于外界向它传递的热量与外界对它所做的功的和。
这个关系叫做热力学第一定律。
其数学表达式为:A U=W+Q(2).与热力学第一定律相匹配的符号法则(3)热力学第一定律说明了做功和热传递是系统内能改变的量度,没有做功和热传递就不可能实现能量的转化或转移,同时也进一步揭示了能量守恒定律。
(4)应用热力学第一定律解题的一般步骤:①根据符号法则写出各已知量( W、Q、A U)的正、负;②根据方程A U=W+Q求出未知量;③再根据未知量结果的正、负来确定吸热、放热情况或做功情况。
2.能量守恒定律⑴自然界存在着多种不同形式的运动,每种运动对应着一种形式的能量。
如机械运动对应机械能 ;分子热运动对应内能;电磁运动对应电磁能。
⑵.不同形式的能量之间可以相互转化。
摩擦可以将机械能转化为内能;炽热电灯发光可以将电能转化为光能。
⑶.能量既不会凭空产生,也不会凭空消失,它只能从一种形式转化为另一种形式,或者从一个物体转移到别的物体,在转化或转移的过程中其总量不变。
这就是能量守恒定律。
(4).热力学第一定律、机械能守恒定律都是能量守恒定律的具体体现。
(5).能量守恒定律适用于任何物理现象和物理过程。
(6).能量守恒定律的重要意义第一,能量守恒定律是支配整个自然界运动、发展、变化的普遍规律,学习这个定律,不能满足一般理解其内容,更重要的是,从能量形式的多样化及其相互联系,互相转化的事实岀发去认识物质世界的多样性及其普遍联系,并切实树立能量既不会凭空产生,也不会凭空消失的观点,作为以后学习和生产实践中处理一切实际问题的基本指导思想之一。
第二,宣告了第一类永动机的失败。
3.第一类永动机不可能制成任何机器运动时只能将能量从一种形式转化为另一种形式,而不可能无中生有地创造能量,即第一类永动机是不可能制造出来的。
典例探究例1一定量的气体在某一过程中,外界对气体做了8X104尚功,气体的内能减少了1.2杓勺,则下列各式中正确的是 ( )4 5 4A.W=8X 104J, A U =1.2 1OJ , Q=4X104J4 5 5B.W=8X104J, A U =— 1.2 105J , Q=—2X105J4 5 4C.W= —8X104J, A U =1.2 105J , Q=2X104J4 5 4D.W= —8X104J, A U =— 1.2 X05J , Q=—4X104J解析:本题主要考查热力学第一定律的应用。
因为外界对气体做功,W取正值,即W=8< 104J;内能减少,A J取负值,即A J= —1.2 R0J;根据A U=W+Q,可知Q= A U —W= —1.2 为05—8X104=_ 2X105J, 即B选项正确。
答案:B友情提示:注意热力学第一定律关系式中各物理量的符号法则。
例2 一定质量的气体,在压缩过程中外界对气体做功300J,但这一过程中气体的内能减少了300J,问气体在此过程中是吸热还是放热?吸收(或放出)多少热量?解析:由题意可知,W=300J, A U= —300J,根据热力学第一定律可得Q= A U—W= —300J—300J=—600JQ为负值表示气体放热,因此气体放出600J的热量。
友情提示:注意热力学第一定律关系式中各物理量的符号法则及其物理意义。
例3. 一定质量的气体从外界吸收了4.2为05J的热量,同时气体对外做了6X105J的功,问:(1)物体的内能是增加还是减少?变化量是多少?(2)分子势能是增加还是减少?(3)分子的平均动能是增加还是减少?解析:(1)气体从外界吸热为:Q=4.2X105J气体对外做功:W= — 6X105J由热力学第一定律:AJ=W+Q= (—6X105) + (4.2 >105J) =—1.8 105JA U为负,说明气体的内能减少了。
所以,气体内能减少了 1.8 >105Jo( 2)因为气体对外做功,所以气体的体积膨胀,分子间的距离增大了,分子力做负功,气体分子势能增加了。
(3)因为气体内能减少,同时气体分子势能增加,说明气体分子的平均动能一定减少了。
友情提示:本题以热力学第一定律关系式为起点,结合分子动理论中内能的定义,分析得出:①气体对外做功,体积膨胀,分子间的距离增大了,分子力做负功,气体分子势能增加了②气体内能减少,同时气体分子势能增加,说明气体分子的平均动能一定减少了。
课后问题与练习点击1.解析:由热力学第一定律A U=W+Q有A U=900J-210J=690J2.解析:(1)一定质量的封闭气体可以看作是理想气体,由理想气体的状态方程和热力学第一定律可知:两种情况下内能的变化A U是相同的,即A U=Q,但A U=QW,所以Q>Q。
(2)比热容是指单位质量的某种物质温度每升高1摄氏度所吸收的热量。
由于等容过程中,温度升高,系统所吸收的热全部用来增加内能,而等压过程中,所吸收的热除增加内能外,还要多吸收一点热用来对外膨胀做功,所以气体等压下的比热容恒大于等容下的比热容。
3.解:设在阳光直射时地面上每平方米每分钟接受的太阳能量为Qcm^t则Q=-St代入数值得:Q=4.2 X 104J 4•解:由能量守恒定律得: mgh=cm &gh2 3 △t= 代入 g=10m/s ,h=3 X 0m=60m,c= 4.2 X 0 J/kg Gc△t=0.14 G5•解:要使奶牛的内能不变,1h 提供的热量 E= cm △= 4.2 X 3X 400X 3.5J=5.88 1X 6J故每天提供的热量E'=24E=1.4 X108J6.解:物体吸收的能量一部分转化为物体的内能,使物体的内能增加,同时另一部分因物体膨胀要对 外界做功。
基础训练1 •关于物体内能的变化,以下说法正确的是() A. 物体吸热,内能一定增大B. 物体对外做功,内能可能增大C. 物体吸收热量,同时对外做功,内能可能不变D. 物体放出热量,同时对外做功,内能可能不变2•自由摆动的秋千摆动幅度越来越小,下列说法正确的是() A.秋千的机械能守恒 B.秋千的能量正在消失 C.只有动能和重力势能的相互转化 D.减少的机械能转化为内能,但总能量守恒3.下列各物体在所经历的过程中,内能增加的有 ()A. 在光滑斜面上由静止释放而下滑的物体B. 水平飞行并射穿木块的子弹C. 在绝热的条件下被压缩的气体D.在光滑水平面上运动的两个小球,碰撞后以共同的速度运动 5.对于在一个大气压下100G 的水变成100G 的水蒸气的过程中,下列说法正确的是A. 水的内能增加,对外界做功,一定是吸热B. 水的内能不变,对外界做功,从外界吸热C. 水的内能减少,对外界不做功,向外界放热4 •在热力学第一定律的表达式 的是 () △U=W+Q 中关于 A U 、W 、 Q 各个物理量的正、负,下列说法中正确A.外界对物体做功时W 为正, 吸热时 Q 为负, 内能增加时 △U 为正 B.物体对外界做功时C.物体对外界做功时D.外界对物体做功时 W 为负, W 为负, W 为负, 吸热时 吸热时 吸热时 Q 为正, Q 为正, Q 为负, 内能增加时 内能增加时 内能增加时 △U 为负 △U 为正 △U 为负D.水的内能增加,对外界做功,向外界放热6•为使一个与外界保持良好热交换状态的物体的内能能够明显变化,以下方法可行的是(7•图10.3-1所示是一定质量的理想气体从状态A 经B 至C 的P —- A. 气体的内能改变B. 气体的体积增大C. 气体向外界放热D. 气体对外界做功8从10m 高空由静止开始下落的水滴,在下落的过程中,1水滴重力势能的40%转化为水的内能使 水的温度升高,则水滴落下后温度升高多少? [水的比热容c=4.2 X103J / (kg -C)]9.一个透热良好的气缸,缸壁浸在盛水的容器中,迅速下压活塞,压缩中对气体做了 2000J 的功,稳定后使容器中2千克的水温度升高了 02C ,假设盛水容器绝热。
问:压缩前后缸内气体的内能变化了 多少?多维链接1 •有一种所谓 全自动”机械手表,既不需要上发条,也不用任何电源,却能不停地走下去。
这是 不是一种永动机?如果不是,你知道维持表针走动的能量是哪儿来的吗?提示:不是永动机。
能量是通过摆动手臂对表内的转轮做功而储存的。
2•在一间隔热很好的密闭房间里放一台电冰箱,如果把冰箱门打开,开动一段时间后,房内温度 是降低还是升高? 提示:升高了。
因为电冰箱消耗电能,产生电热,使密闭房间内的空气内能增加,房内温度升高。
3.能的转化和守恒定律的建立能的转化和守恒定律的建立,揭示了机械热、电、化学等各种运动形式之间相互联系并相互转化的统一 性,是物理学发展史上继牛顿学将天体运动与地面物体运动的大综合之后的第二次大综合,恩格斯将这 一伟大的运动基本定律称为19世纪自然科学的三大发现之一,它不仅是自然科学的基础,而且也给哲学 上的不灭运动原理和自然界运动形式的统一性提供了可靠的科学论据。
4.关于太阳能的转化 太阳能辐射到地球表面,产生热量和化学能,能量给地球以温暖,推动地表水的循环和空气的流动A.以较大的功率对物体做功C.该物体以较大的功率对外做功B. .以较小的功率对物体做功 D. 该物体以较小的功率对外做功图线,则在此过程中(。
化学能被植物经过化学作用所利用,产生糖类及其其它有机物,成为生命活动的能源,一个活的生命体可以看作是一个利用太阳能以维持自身生命,并延续下一代的化学系统。
太阳能有广泛的应用,其辐射的直接利用基本上有以下四种方式:(1).太阳能——内能转换这是目前技术最为成熟,成本最为低廉,因而应用最为广泛的形式,其基本原理是将太阳辐射能收集起来,利用温室效应来加热物体而获得内能,如地膜、大棚、温室等,目前使用较多的太阳能收集装置有两种,一种是平板式集热器,如太阳能热水器等,另一种是聚集型集热器,如反射式太阳灶、高温太阳炉等。
(2).太阳能——电能转换太阳能与电能转换有两种方式,一种是利用太阳辐射能发电,一般是由太阳能集热器将吸收的太阳能转换成蒸汽,再驱动汽轮机发电,但这一过程效率较低并且成本高,没有实用价值;另一种是太阳能与电能的转换,是利用光电效应,将太阳辐射能直接转化成电能。
(3).太阳能——化学能转换利用太阳辐射能可以转化为化学键中的化学能,进而生成新物质,或利用其分解化学物质生成新物质。
例如直接分解水制氢,是一种很有前途的光能与化学能的转化方式。
(4).太阳能——生物质能的转换主要是通过地球上众多的植物的光合作用,将太阳辐射能转化为生物质能。
