化学元素周期表
化学元素周期表

返回
英文名称Lithium
物理性质:状态:软的银白色金属,是最轻的金属。
铍
元素名称铍 元素符号Be 原子序数4 相对原子质量(12C = 12.0000)9.012182
返回
英文名称Beryllium
物理性质:状态:坚固,硬的灰白色金属,是最轻的硬质金属。
硼
元素名称硼 元素符号B 原子序数5 相对原子质量(12C = 12.0000)10.811
返回
英文名称Boron
物理性质:状态:黄棕色非金属晶体 。
碳
元素名称碳 元素符号C 原子序数6 相对原子质量(12C = 12.0000)12.011
返回
英文名称Carbon
物理性质:状态:纯品为石墨和金刚石 。
氮
元素名称氮 元素符号N 原子序数7 相对原子质量(12C =12.0000) 14.00674
返回
英文名称Nitrogen
物理性质:状态:无色、无味、无臭的气体。
氧
元素名称氧 元素符号O 原子序数8 相对原子质量(12C = 12.0000)15.9994
返回
英文名称Oxygen
物理性质:状态:无色、无臭、无味的气体。
氟
元素名称氟 元素符号F 原子序数9 相对原子质量(12C = 12.0000)18.9984
6碳
H
7氮
He 8氧
13 铝 N
9氟
Li O
10 氖
Be F
B Ne P
11 钠
C
12 镁
14 硅
15 磷
16 硫
Na S
17 氯
元素周期表元素名称+注音+元素符号(全套118种)

jiǎ
K
钙
gài
Ca
钪
kàng
Sc
钛
tài
Ti
钒
fán
V
铬
gè
Cr
锰
měng
Mn
铁
tiě
Fe
钴
gǔ
Co
镍
niè
Ni
铜
tóng
Cu
锌
xīn
Zn
镓
jiā
Ga
锗
zhě
Ge
砷
shēn
As
硒
xī
Se
溴
xiù
Br
氪
kè
Kr
第五周期
元素中文名称
拼音
元素符号
铷
rú
Rb
锶
sī
Sr
钇
yǐ
元素周期表注音
第一周期
元素中文名称
拼音
元素符号
氢
qīng
H
氦
hài
He
第二周期
元素中文名称
拼音
元素符号
锂
lǐ
Li
铍
pí
Be
硼
péng
B
碳
tàn
C
氮
dàn
N
氧
yǎng
O
氟
fú
F
氖
nǎi
Ne
第三周期
元素中文名称
拼音
元素符号
钠
nà
Na
镁
měi
Mg
铝
lǚ
Al
硅
guī
Si
磷
lín
P
硫
liú
S
氯
化学元素周期表

化学元素的读音及英文名称
第 01 号元素: 氢 [化学符号]H, 读“轻”, 第 02 号元素: 氦 [化学符号]He, 读“亥”, 第 03 号元素: 锂 [化学符号]Li, 读“里”, 第 04 号元素: 铍 [化学符号]Be, 读“皮”,第 05 号元素: 硼 [化学符号]B, 读“朋”, 第 06 号元素: 碳 [化学符号]C, 读“炭”, 第 07 号元素: 氮 [化学符号]N, 读“淡”, 第 08 号元素: 氧 [化学符号]O, 读“养”, 第 09 号元素: 氟 [化学符号]F, 读“弗”, 第 10 号元素: 氖 [化学符号]Ne, 读“乃”, 第 11 号元素: 钠 [化学符号]Na, 读“纳”, 第 号元素: 铝 [化学符号]Al, 读“吕”, 第 14 号元素: 硅 [化学符号]Si, 读“归”, 第 15 号元素: 磷 [化学符号]P, 读“邻”, 第 16 号元素: 硫 [化学符号]S, 读“流”, 第 17 号元素: 氯 [化学符号]Cl, 读“绿第 18 号元素: 氩 [化学符号]Ar,A, 读“亚”, 第 19 号元素: 钾 [化学符号]K, 读“甲”, 第 20 号元素: 钙 [化学符号]Ca, 读“丐”, 第 21 号元素: 钪 [化学符号]Sc, 读“亢”, 第 22 号元素: 钛 [化学符号]Ti, 读“太”, 第 23 号元素: 钒 [化学符号]V, 读“凡”, 第 24 号元素: 铬 [化学符号]Cr, 读“各”, 第 25 号元素: 锰 [化学符号]Mn, 读“猛”, 第 26 号元素: 铁 [化学符号]Fe, 读“铁”, 第 27 号元素: 钴 [化学符号]Co, 读“古”, 第 28 号元素: 镍 [化学符号]Ni, 读“臬”, 第 29 号元素: 铜 [化学符号]Cu, 读“同”, 第 30 号元素: 锌 [化学符号]Zn, 读“辛”,第 31 号元素: 镓 [化学符号]Ga, 读“家”, 第 32 号元素: 锗 [化学符号]Ge, 读“者”, 第 33 号元素: 砷 [化学符号]As, 读“申”, 第 34 号元素: 硒 [化学符号]Se, 读“西”, 第 35 号元素: 溴 [化学符号]Br, 读“秀”,第 36 号元素: 氪 [化学符号]Kr, 读“克”, 第 37 号元素: 铷 [化学符号]Rb, 读“如”, 第 38 号元素: 锶 [化学符号]Sr, 读“思”, 第 39 号元素: 钇 [化学符号]Y, 读“乙”, 第 40 号元素: 锆 [化学符号]Zr, 读“告”, 第 41 号元素: 铌 [化学符号]Nb, 读“尼”, 第 42 号元素: 钼 [化学符号]Mo, 读“目”, 第 43 号元素: 碍 [化学符号]Tc, 读“得”, 第 44 号元素: 钌 [化学符号]Ru, 读“了”, 第 45 号元素: 铑 [化学符号]Rh, 读“老”,第 46 号元素: 钯 [化学符号]Pd, 读“巴”, 第 47 号元素: 银 [化学符号]Ag, 读“银”, 第 48 号元素: 镉 [化学符号]Cd, 读“隔”, 第 49 号元素: 铟 [化学符号]In, 读“因”, 第 50 号元素: 锡 [化学符号]Sn, 读“西”, 第 51 号元素: 锑 [化学符号]Sb, 读“梯”, 第 52 号元素: 碲 [化学符号]Te, 读“帝”, 第 53 号元素: 碘 [化学符号]I, 读“典”,第 54 号元素: 氙 [化学符号]Xe, 读“仙”, 第 55 号元素: 铯 [化学符号]Cs, 读“色”, 第 56 号元素: 钡 [化学符号]Ba, 读“贝”, 第 58 号元素: 铈 [化学符号]Ce, 读“市”,第 59 号元素: 镨 [化学符号]Pr, 读“普”, 第 60 号元素: 钕 [化学符号]Nd, 读“女”,第 61 号元素: 钷 [化学符号]Pm, 读“颇”, 第 62 号元素: 钐 [化学符号]Sm, 读“衫”, 第 63 号元素: 铕 [化学符号]Eu, 读“有”, 第 64 号元素: 钆 [化学符号]Gd, 读“轧”, 第 65 号元素: 铽 [化学符号]Tb, 读“忒”, 第 66 号元素: 镝 [化学符号]Dy, 读“滴”, 第 67 号元素: 钬 [化学符号]Ho, 读“火”, 第 68 号元素: 铒 [化学符号]Er, 读“耳”, 第 69 号元素: 铥 [化学符号]Tm, 读“丢”, 第 70 号元素: 镱 [化学符号]Yb, 读“意”, 第 71 号元素: 镥 [化学符号]Lu, 读“鲁”, 第 72 号元素: 铪 [化学符号]Hf, 读“哈”, 第 73 号元素: 钽 [化学符号]Ta, 读“坦”, 第 74 号元素: 钨 [化学符号]W, 读“乌”, 第 75 号元素: 镧 [化学符号]La, 读“兰”, 第 75 号元素: 铼 [化学符号]Re, 读“来”, 第 76 号元素: 锇 [化学符号]Os, 读“鹅”, 第 77 号元素: 铱 [化学符号]Ir, 读“衣”, 第 78 号元素: 铂 [化学符号]Pt, 读““,第 79 号元素: 金 [化学符号]Au, 读“今”, 第 80 号元素: 汞 [化学符号]Hg, 读“拱”, 第 81 号元素: 铊 [化学符号]Tl, 读“他”, 第 82 号元素: 铅 [化学符号]Pb, 读“千”, 第 83 号元素: 铋 [化学符号]Bi, 读“必”, 第 84 号元素: 钋 [化学符号]Po, 读“泼”, 第 85 号元素: 砹 [化学符号]At, 读“艾”, 第 86 号元素: 氡 [化学符号]Rn, 读“冬”, 第 87 号元素: 钫 [化学符号]Fr, 读“方”, 第 88 号元素: 镭 [化学符号]Ra, 读“雷”, 第 89 号元素: 锕 [化学符号]Ac, 读“阿”, 第 90 号元素: 钍 [化学符号]Th, 读“土”, 第 91 号元素: 镤 [化学符号]Pa, 读“仆”, 第 92 号元素: 铀 [化学符号]U, 读“由”, 第 93 号元素: 镎 [化学符号]Np, 读“拿”, 第 94 号元素: 钚 [化学符号]Pu, 读“不”, 第 95 号元素: 镅 [化学符号]Am, 读“眉”, 第 96 号元素: 锔 [化学符号]Cm, 读“局”, 第 97 号元素: 锫 [化学符号]Bk, 读“陪”,第 98 号元素: 锎 [化学符号]Cf, 读“开”, 第 99 号元素: 锿 [化学符号]Es, 读“哀”, 第 100 号元素: 镄 [化学符号]Fm, 读“费”, 第 101 号元素: 钔 [化学符号]Md, 读“门”, 第 102 号元素: 锘 [化学符号]No, 读“诺”, 第 103 号元素: 铹 [化学符号]Lw, 读“劳”, 第 104 号元素: 鐪 [化学符号]Rf, 读“卢”, 第 105 号元素: [化学符号]Db, 读“杜”, 第 106 号元素: 钅喜 [化学符号]Sg , 读”喜“, 第 107 号元素: 钅波 [化学符号]Bh, 读"波“, 第 108 号元素: 钅黑 [化学符号]Hs, 读”黑“, 第 109 号元素: 钅麦 [化学符号]Mt, 读"麦",第 110 号元素: 鐽 [化学符号]Ds, 读”达“, [英文名称]第 111 号元素: [化学符号]Rg, , 读”伦“,
【化学知识点】元素周期表读音大全

【化学知识点】元素周期表读音大全化学元素周期表是根据原子序数从小至大排序的化学元素列表。
本文整理了元素周期表读音及口诀,供参考。
1氢(qīng)2氦(hài)3锂(lǐ)4铍(pí)5硼(péng)6碳(tàn)7氮(dàn)8氧(yǎng)9氟(fú)10氖(nǎi)11钠(nà)12镁(měi)13铝(lǚ)14硅(guī)15磷(lín)16硫(liú)17氯(lǜ)18氩(yà)19钾(jiǎ)20钙(gài)21钪(kàng)22钛(tài)23钒(fán)24铬(gè)25锰(měng)26铁(tiě)27钴(gǔ)28镍(niè)29铜(tóng)30锌(xīn)31镓(jiā)32锗(zhě)33砷(shēn)34硒(xī)35溴(xiù)36氪(kè)37铷(rú)38锶(sī)39钇(yǐ)40锆(gào)41铌(ní)42钼(mù)43锝(dé)44钌(liǎo)45铑(lǎo)46钯(bǎ)47银(yín)48镉(gé)49铟(yīn)50锡(xī)51锑(tī)52碲(dì)53碘(diǎn)54氙(xiān)55铯(sè)56钡(bèi)57镧(lán)58铈(shì)59镨(pǔ)60钕(nǚ)61钷(pǒ)62钐(shān)63铕(yǒu)64钆(gá)65铽(tè)66镝(dī)67钬(huǒ)68铒(ěr)69铥(diū)70镱(yì)71镥(lǔ)72铪(hā)73钽(tǎn)74钨(wū)75铼(lái)76锇(é)77铱(yī)78铂(bó)79金(jīn)80汞(gǒng)81铊(tā)82铅(qiān)83铋(bì)84钋(pō)85砹(ài)86氡(dōng)87钫(fāng)88镭(léi)89锕(ā)90钍(tǔ)91镤(pú)92铀(yóu)93镎(ná)94钚(bù)95镅(méi)96锔(jú)97锫(péi)98锎(kāi)99锿(āi)100镄(fèi)101钔(mén)102锘(nuò)103铹(láo)104鈩(lú)105 (dù)106 (xǐ)107 (bō)108 (hēi)109䥑(mài)110鐽(dá)111錀(lún) 112鎶gē113鉨nǐ114鈇fū115莫mò116鉝lì117田tián118奥ào 我是氢,我最轻,火箭靠我运卫星;我是氦,我无赖,得失电子我最菜;我是锂,密度低,遇水遇酸把泡起;我是铍,耍赖皮,虽是金属难电离;我是硼,黑银灰,论起电子我很穷;我是碳,反应慢,既能成链又成环;我是氮,我阻燃,加氢可以合成氨;我是氧,不用想,离开我就憋得慌;我是氟,最恶毒,抢个电子就满足;我是氖,也不赖,通电红光放出来;我是钠,脾气大,遇酸遇水就火大;我是镁,最爱美,摄影烟花放光辉;我是铝,常温里,浓硫酸里把澡洗;我是硅,色黑灰,信息元件把我堆;我是磷,害人精,剧毒列表有我名;我是硫,来历久,沉淀金属最拿手;我是氯,色黄绿,金属电子我抢去;我是氩,活性差,霓虹紫光我来发;我是钾,把火加,超氧化物来当家;我是钙,身体爱,骨头牙齿我都在;我是钛,过渡来,航天飞机我来盖;我是铬,正六铬,酒精过来变绿色;我是锰,价态多,七氧化物爆炸猛;我是铁,用途广,不锈钢喊我叫爷;我是铜,色紫红,投入硝酸气棕红;我是砷,颜色深,三价元素夺你魂;我是溴,挥发臭,液态非金我来秀;我是铷,碱金属,沾水烟花钾不如;我是碘,升华烟,遇到淀粉蓝点点;我是铯,金黄色,入水爆炸容器破;我是钨,高温度,其他金属早呜呼;我是金,很稳定,扔进王水影无形;我是汞,有剧毒,液态金属我为独;我是铀,浓缩后,造原子弹我最牛;我是镓,易融化,沸点很高难蒸发;我是铟,软如金,轻微放射宜小心;我是铊,能脱发,投毒出名看清华;我是锗,可晶格,红外窗口能当壳;我是硒,补人体,口服液中有玄机;我是铅,能储电,子弹头里也有我。
化学元素周期表及背诵方法

化学元素周期表及背诵方法1氢(qīng) 2氦(hài) 3锂(lǐ) 4铍(pí)5 硼(péng) 6碳(tàn) 7氮(dàn)8 氧(yǎng) 9氟(fú)10 氖(n ǎi)11钠(nà) 12镁(měi) 13铝(lǚ)14 硅(guī)15 磷(lín) 16硫(liú) 17氯(lǜ) 18氩(yà)19钾(jiǎ) 20钙(gài) 21钪(kàng) 22钛(tài)23 钒(fán) 24铬(gè) 25锰(měng) 26铁(tiě) 27钴(gǔ)28 镍(niè)29 铜(tóng)30 锌(xīn) 31镓(jiā) 32锗(zhě) 33砷(shēn) 34硒(xī) 35溴(xiù)36 氪(kè)37铷(rú) 38锶(sī) 39钇(yǐ) 40锆(gào) 41铌(ní)42 钼(mù) 43锝(dé) 44钌(liǎo) 45铑(lǎo) 46钯(bǎ) 47银(yín) 48镉(gé)49铟(yīn) 50锡(xī) 51锑(tī) 52碲(dì)53 碘(diǎn) 54氙(xiān)55铯(sè) 56钡(bèi) 57镧(lán) 58铈(shì) 59镨(pǔ)60 钕(nǚ)61 钷(pǒ) 62钐(shān) 63铕(yǒu)64 钆(gá) 65铽(tè) 66镝(dī) 67钬(huǒ)68 铒(ěr) 69铥(di ū)70 镱(yì) 71镥(lǔ) 72铪(hā)73 钽(tǎn) 74钨(wū) 75铼(lái) 76锇(é) 77铱(yī) 78铂(bó)79 金(jīn) 80汞(gǒng) 81铊(tā) 82铅(qiān)83 铋(bì) 84钋(pō)85砹(ài)86 氡(dōng)87钫(fāng) 88镭(léi)89 锕(ā) 90钍(tǔ)91 镤(pú) 92铀(yóu) 93镎(n á)94 钚(bù)95 镅(méi) 96锔(jú)97 锫(péi)98 锎(kāi) 99锿(āi) 100镄(fèi) 101钔(mén) 102锘(nuò)103 铹(láo)104 钅卢(lú) 105钅杜(dù)106钅喜(xǐ)107钅波(bō)108 钅黑(hēi)109 钅麦(mài)110 钅达(dá) 111钅仑(lún)五个字五个字背顺序名称字母是必背的初中只需背前20个相对质量不用背考试时卷子上会告诉你的前20号元素1 H 氢1.0079(相对原子质量)化学元素周期表2 He 氦4.00263 Li 锂6.9414 Be 铍9.01225 B 硼10.8116 C 碳12.0117 N 氮14.0078 O 氧15.999 4(3) 9 F 氟18.998 10 Ne 氖20.17 11 Na 钠22.9898 12 Mg 镁24.305 13 Al 铝26.982 14 Si 硅28.085 15 P 磷30.974 16 S 硫32.06 17 Cl 氯35.453 18 Ar 氩39.94 19 K 钾39.098 20 Ca 钙40.08其余需要背的就是金属活动顺序表K -jia Ca -gai Na- na Mg -mei Al -lv Zn - xin Fe- tie Sn -xi Pb- qian H -qing Cu -tong Hg- gong Ag- yin Pt- bo Au -jin价态表一价钾钠氯氢银二价氧钙钡镁锌三铝四硅五价磷二三铁二四碳二四六硫都齐全代数化合价和为零还有就是哪些盐可溶哪些盐不可溶自编的小故事口诀,10分钟全背在背诵之前先用2分钟时间看一个不伦不类的小故事:侵害从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。
化学元素周期表

第一周期元素:1 氢(qīng) 2 氦(hài)元素周期表正确金属汉字写法第二周期元素:3 锂(lǐ) 4 铍(pí) 5 硼(péng) 6 碳(tàn) 7 氮(dàn) 8 氧(yǎng) 9 氟(fú) 10 氖(nǎi) 第三周期元素:11 钠(nà) 12 镁(měi) 13 铝(lǚ) 14 硅(guī) 15 磷(lín) 16 硫(liú) 17 氯(lǜ) 18 氩(yà) 第四周期元素:19 钾(jiǎ) 20 钙(gài) 21 钪(kàng) 22 钛(tài) 23 钒(fán) 24 铬(gè) 25 锰(měng) 26 铁(tiě) 27 钴(gǔ) 28 镍(niè) 29 铜(tóng) 30 锌(xīn) 31 镓(jiā) 32 锗(zhě) 33 砷(shēn) 34 硒(xī) 35 溴(xiù) 36 氪(kè) 第五周期元素:37 铷(rú) 38 锶(sī) 39 钇(yǐ) 40 锆(gào) 41 铌(ní) 42 钼(mù) 43 锝(dé) 44 钌(liǎo) 45 铑(lǎo) 46 钯(bǎ) 47 银(yín) 48 镉(gé) 49 铟(yīn) 50 锡(xī) 51 锑(tī) 52 碲(dì) 53 碘(diǎn) 54 氙(xiān) 第六周期元素:55 铯(sè) 56 钡(bèi) 57 镧(lán) 58 铈(shì) 59 镨(pǔ) 60 钕(nǚ) 61 钷(pǒ) 62 钐(shān) 63 铕(yǒu) 64 钆(gá) 65 铽(tè) 66 镝(dī) 67 钬(huǒ) 68 铒(ěr) 69 铥(diū) 70 镱(yì) 71 镥(lǔ) 72 铪(hā) 73 钽(tǎn) 74 钨(wū) 75 铼(lái) 76 锇(é) 77 铱(yī) 78 铂(bó) 79 金(jīn) 80 汞(gǒng) 81 铊(tā) 82 铅(qiān) 83 铋(bì) 84 钋(pō) 85 砹(ài) 86 氡(dōng) 第七周期元素:87 钫(fāng) 88 镭(léi) 89 锕(ā) 90 钍(tǔ) 91 镤(pú) 92 铀(yóu) 93 镎(ná) 94 钚(bù) 95 镅(méi) 96 锔(jú) 97 锫(péi) 98 锎(kāi) 99 锿(āi) 100 镄(fèi) 101 钔(mén) 102 锘(nuò) 103 铹(láo) 104 鈩(lú) 105 (dù) 106 (xǐ) 107 (bō) 108 (hēi) 109 䥑(mài) 110 鐽(dá) 111 錀(lún) 112 鎶(gē)[暂定] 注:新元素汉字请使用Win7系统浏览,XP系统下无法显示。
(完整版)化学元素周期表(高清)
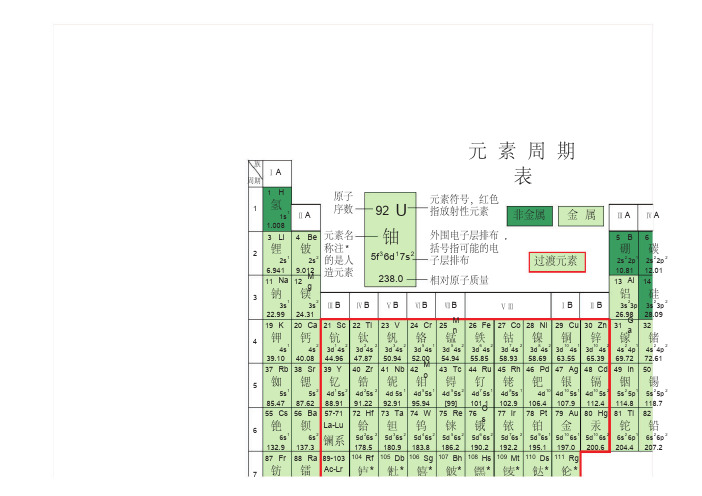
1H3Li4Be5B611Na 12Mg13Al 1419K 20Ca 21Sc 22Ti23V24Cr 25Mn26Fe 27Co 28Ni29Cu 30Zn 31Ga3237Rb 38Sr 39Y40Zr41Nb 42Mo43Tc44Ru 45Rh 46Pd 47Ag 48Cd 49In5055Cs 56Ba 72Hf 73Ta 74W75Re 76Os77Ir78Pt79Au 80Hg 81Tl8287Fr 88Ra 104Rf 105Db 106Sg 107Bh 108Hs 109Mt 110Ds 111Rg元素周期表氢1s11.008锂铍硼碳2s12s22s 22p12s 22p26.9419.01210.8112.01钠镁铝硅3s13s23s 23p3s 23p222.9924.3126.9828.09钾钙钪钛钒铬锰铁钴镍铜锌镓锗4s14s23d 14s23d 24s23d 34s23d 54s13d 54s23d 64s23d 74s23d 84s23d 104s13d 104s24s 24p14s 24p239.1040.0844.9647.8750.9452.0054.9455.8558.9358.6963.5565.3969.7272.61铷锶钇锆铌钼锝钌铑钯银镉铟锡5s15s24d 15s24d 25s24d 5s14d 55s14d 55s24d 75s14d 85s14d104d 105s14d 105s25s 25p15s 25p285.4787.6288.9191.2292.9195.94[99]101.1102.9106.4107.9112.4114.8118.757-71铯钡La-Lu铪钽钨铼锇铱铂金汞铊铅6s16s25d 26s25d 36s25d 46s25d 56s25d 66s25d 76s25d 96s15d 106s15d 106s26s 26p16s 26p2132.9137.3178.5180.9183.8186.2190.2192.2195.1197.0200.6204.4207.289-103钫镭Ac-Lr1234567镧系周期族ⅠAⅡA ⅢBⅣBⅤB ⅥBⅦBⅠB ⅡBⅤⅢⅢA ⅣA U92铀5f 36d 17s 2238.0相对原子质量元素符号,红色指放射性元素外围电子层排布,括号指可能的电子层排布原子序数元素名称注*的是人造元素非金属金属过渡元素杜钅钅卢钅喜钅波钅钅钅钅黑麦达仑********57La 58Ce 59Pr 60Nd 61Pm62S m63Eu 64G d65Tb 66Dy 67Ho 68Er69T m7089Ac 90Th 91Pa 92U93Np 94Pu 95Am96C m97Bk 98Cf99Es 100Fm101M d1027s17s2(6d 27s 2)(6d 37s 2)(6d 47s 2)(6d 57s 2)(6d 67s 2)[223]226.0[261][262][263][262][265][266][269][272]镧铈镨钕钷钐铕钆铽镝钬铒铥镱5d 16s24f 15d 16s4f 36s24f 46s24f 56s 24f 66s24f 76s24f 75d 16s4f 96s24f 106s24f 116s24f 126s24f 136s24f 146s2138.9140.1140.9144.2[147]150.4152.0157.3158.9162.5164.9167.3168.9173.0锕钍镤铀镎钚镅锔锫锎锿镄钔锘6d 17s26d 27s25f 26d 17s 5f 36d 17s 5f 46d 17s5f 67s25f 77s25f 76s 17s5f 97s25f 107s25f 117s25f 127s2(5f 137s2(5f 147s2227.0232.0231.0238.0237.0[244][243][247][247][251][252][257][258][259]7镧系锕系锕系杜钅钅卢钅喜钅波钅钅钅钅黑麦达仑****************电子层2HeC 7N8O9F10NeSi15P16S17Cl18ArG e33As 34Se 35Br36KrSn 51Sb 52Te 53I54Xe Pb 83Bi84Po 85At86Rn 0氦1s24.003碳氮氧氟氖2s 22p22s 22p32s 22p42s 22p52s 22p612.0114.0116.0019.0020.18硅磷硫氯氩3s 23p23s 23p33s 23p43s 23p53s 23p628.0930.9732.0735.4539.95锗砷硒溴氪4s 24p24s 24p34s 24p44s 24p54s 24p672.6174.9278.9679.9083.80锡锑碲碘氙5s 25p25s 25p35s 25p45s 25p55s 25p 6118.7121.8127.6126.9131.3铅铋钋砹氡6s 26p26s 26p36s 26p46s 26p56s 26p6207.2209.0[209][210][222]ⅣAⅤA ⅥA ⅦA 0族电子数KLM N O PK LM N OKL M N K L M K L K 281832188281818828188288282注:Yb 71LuNo 103Lr镱镥4f 146s 24f 145d 16173.0175.0锘铹5f 147s2(5f 146d 17s 2)[259][260]注:1.相对原子质量录自1995年国际原子量表,并全部取4位有效数字。
化学元素周期表读音

化学元素周期表读音 1氢(qīng) 2氦(hài) 3锂(lǐ) 4铍(pí) 5硼(pãng) 6碳(tàn) 7氮(dàn) 8氧(yǎng) 9氟(fú) 10氖(nǎi) 11钠(nà) 12镁(měi) 13铝(lǚ) 14硅(guī) 15磷(lín) 16硫(liú) 17氯(lǜ) 18氩(yà) 19钾(jiǎ) 20钙(gài) 21钪(kàng) 22钛(tài) 23钒(fán) 24铬(gâ) 25锰(měng) 26铁(tiě) 27钴(gǔ) 28镍(niâ) 29铜(tóng) 30锌(xīn) 31镓(jiā) 32锗(zhě) 33砷(shēn) 34硒(xī) 35溴(xiù) 36氪(kâ)37铷(rú) 38锶(sī) 39钇(yǐ) 40锆(gào) 41铌(ní) 42钼(mù) 43锝(dã) 44钌(liǎo) 45铑(lǎo) 46钯(b ǎ) 47银(yín) 48镉(gã)49铟(yīn) 50锡(xī) 51锑(tī) 52碲(dì) 53碘(di ǎn) 54氙(xiān) 55铯(sâ) 56钡(bâi) 57镧(lán) 58铈(shì) 59镨(pǔ) 60钕(nǚ)61钷(pǒ) 62钐(shān) 63铕(yǒu) 64钆(gá) 65铽(tâ) 66镝(dī) 67钬(huǒ) 68铒(ěr) 69铥(diū) 70镱(yì) 71镥(lǔ) 72铪(hā)73钽(tǎn) 74钨(wū) 75铼(lái) 76锇(ã) 77铱(yī) 78铂(bó) 79金(jīn) 80汞(gǒng) 81铊(tā) 82铅(qiān) 83铋(bì) 84钋(pō)86氡(dōng) 87钫(fāng) 88镭(lãi) 89锕(ā) 90钍(tǔ) 91镤(pú) 92铀(yóu) 93镎(ná) 94钚(bù) 95镅(mãi) 96锔(jú)、97 号元素: 锫[化学符号]Bk, 读“陪”、98 号元素: 锎[化学符号]Cf,读“开”第99 号元素: 锿[化学符号]Es, 读“哀”,第100 号元素: 镄[化学符号]Fm, 读“费”第101 号元素: 钔[化学符号]Md, 读“门”第102 号元素: 锘[化学符号]No, 读“诺”,第103 号元素: 铹[化学符号]Lw, 读“劳”第104 号元素: 鐪[化学符号]Rf, 读“卢”第105 号元素: [化学符号]Db, 读“杜”第106 号元素: 钅喜[化学符号]Sg , 读”喜“,第107 号元素: 钅波[化学符号]Bh, 读"波“第108 号元素: 钅黑[化学符号]Hs, 读”黑“,第109 号元素: 钅麦[化学符号]Mt, 读"麦",第110 号元素: 鐽[化学符号]Ds, 读”达“, 第111 号元素: 钅仑[化学符号]Rg, , 读”伦“,第112 号元素: uub 、113 号元素: uut 114 号元素: uuq 、 115 号元素: uup116 号元素: uuh 117 号元素: uus尚未发现、118 号元素: uuo。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钠、镁和水的反应
2Na + 2H2O = 2NaOH + H2 Mg + 2H2O = Mg(OH)2 + H2
失电子能力 Na>Mg
向盛有已擦去表面氧化膜的镁条和铝片 的试管中,各加入2mL 1mol/L的盐酸。
镁
铝
镁、铝和盐酸的反应
镁、铝和盐酸的反应
Mg + 2HCl = MgCl2 + H2 失电子能力 2Al + 6HCl = 2AlCl3 + 3H2 Mg > Al
非金属元素气态氢 化物的形成与稳定
性
最高正价+1→+7 负价-4→-1
碱性逐渐减弱 酸性逐渐增强 形成:难→易 稳定性:弱→强
最高正价=主族系数 最高正价、负价相同
碱性逐渐增强 酸性逐渐减弱
形成:易→难 稳定性:强→弱
三、元素“位—构—性”之间的关
系
结构
反映 决定
反映 决定
位置
判断元素,推出位置
通过位置,运用递 变规律推出
练习:
下列递变情况不正确 的是: C
A. Na、Mg、Al最外层电子数依次增多,其单 质的还原性依次减弱
B. P、S、Cl最高正价依次升高,对应气态氢化 物稳定性增强
C. C、N、O原子半径依次增大 D. Na、K、Rb氧化物的水化物碱性依次增强
同一横行X、Y、Z三种元素,已知最高价氧化物对 应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则
下列说法判断 错误的是 A
A. 阴离子半径 X > Y > Z
B. 气态氢化物稳定性 HX > H2Y > ZH3 C. 元素的非金属性 X > Y > Z
D. 单质的氧化性 X > Y > Z
二、同主族元素性质递变
1. 卤素(ⅦA族)
化合价
最 高
最低
最高价氧化 物对应水化
物的酸性
单质与氢气反应 情况
能生成类似明矾的矾类
能生成结晶很好的镓矾
可用分光镜发现其存在
镓是用分光镜发现的
最高价氧化物Ea2O3
最高价氧化物Ga2O3
门捷列夫的预言和以后的实验结果取得了惊人的一致
▪ 一、同周期元素性质的递变规律
课本P20活动探究认识第三周期 元素失电子或得电子能力的强弱。 (注意P21和P22的方法导引)
元素化学性质与原子结构的关系
稳定性越来越 ,非金属性越来越 。
钠、钾与水的反应
钠
钾
浮在水面上、
与 浮 在水面上、
__熔_ 成银白色、
水
在水面上四
熔 成银白色、在水 处游动、
反 应
面上四处游动、滴入 酚酞溶液呈 红 色
滴入酚酞溶液 呈红 色,有微弱
爆炸
碱金属元素单质
Rb
碱金属元素的原子结构
碱金属的物理性质的比较
Li Na K Rb Cs
的稳定性
P
磷蒸气 加热
PH3 不稳定
S
加热
Cl
光照或点燃 爆炸化合
Байду номын сангаас
H2S
HCl
不很稳定 稳定
最高价氧化
H4SiO4 极弱酸
物对应水化
物的得酸电性子能力
H3PO4 H2SO4 HClO4 中强酸 强酸 最强酸
Si < P < S < Cl
原子序数 11 12 13 14 15 16 17 18
元素符号 Na Mg Al Si P S Cl Ar
原子序数 元素符号
单质与水(或 酸)反应情况
氢氧化物 碱性强弱
11
Na
冷水 剧烈
NaOH 强碱
12
13
Mg
Al
热水较快 盐酸剧烈
盐酸 较快
Mg(OH)2 Al(OH)3
中强碱
两性氢氧
化物
失电子能力 Na > Mg > Al
原子序数 14
15
16
17
元素符号 Si
单质与H2 高温 化合的难易
SiH4 气态氢化物 很不稳定
第二节
元素周期表的应用 第一课时
根据元素周期表预言新元素的存在
类铝(Ea)
镓(Ga)
(1871年门捷列夫预言 (1875年布瓦发现镓后测定)
原子量约为69
原子量约为69.72
比重约为5.9~6.0
比重约为5.94
熔点应该很低
熔点为30.1℃
不受空气的侵蚀
灼热时略起氧化
灼热时能分解水气
灼热时确能分解水气
化物的水溶液呈碱性的元素是 氮
练习:
1. 下列物质中,酸性最弱的是 (C ) A. HClO4
B. H2SO4 C. H2TeO4 D. H2SeO4
2.镭是元素周期表中第ⅡA族元素,
下列关于镭的叙述中不正确的是(D)
A.镭比钙的金属性强 B. 在化合物中呈+2价 C. 镭是一种放射性元素 D. 氢氧化镭呈两性
四、同周期、同主族元素性质递变规律
同一周期元素,从左到右,电子层数 相同,核 电荷数 逐,增原子半径 逐,减失电子能 力 逐减 ,得电子能力 逐增。
同一主族元素,从上到下,最外层电子数 相同电 子层数 逐增,原子半径 逐,增失电子能 力 逐增 ,得电子能力 逐减。
得电子能力逐渐增强
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
(5)原子半径最小(大)的元素是氢 (铯) (稀有气体除外);
(6)所形成的气态氢化物最稳定的元素是 氟 (7)正负化合价的代数和为零,且气态氢化物
中含氢百分率最高的元素是 碳 (8)最高价氧化物对应的水化物酸性最强的是
氯
(9)所形成的化合物种类最多的是 碳
(10)只有负价并无正价的是 氟 (11)最轻的金属是 锂 (12)最轻的气体是 氢气 (13)空气中含量最多的元素,或气态氢
稳定性越来越 ,非金属性越来越 。
二、同主族元素性质递变 1. 卤素(ⅦA族)
化合价
最 高
最低
最高价氧化 物对应的水
化物
单质与氢气反应 气态氢化物
F 无 -1 Cl +7 -1 Br +7 -1 I +7 -1
无
F暗2+处H,2混=2合HF爆炸 HF 稳
HClO4 HBrO4 HIO4.
酸 性 减 弱
相
颜色 均为银白色(Cs略带金色)
硬度 似
柔软
密度
较小
点 熔沸点
较低
导电导热性
强
碱金属的化学性质
与O2反应
Li
Na
反应不如钠 点燃剧烈
剧烈,生成 燃烧,生
Li2O
成Na2O2
K
Rb Cs
燃烧更加剧 遇空气立即遇空气立即
烈生成比过 燃烧,生成燃烧,生成
氧化物复杂 更复杂的氧更复杂的氧
的氧化物 化物
化物
剧烈,生 更剧烈,生 轻微的爆炸,遇水立即燃遇水立即燃
与H2O反应 成H2
成H2
生成H2
烧,爆炸 烧,爆炸
金属性: > > > ___> ___ 结论 同主族元素,从上到下,单质与水或酸反应越来越
___,最高价氧化物对应水化物的碱性越来越 ___ ,金属性越来越 。
2. 碱金属(ⅠA族)
单质与水 反应情况
3. 已知硒是元素周期表中第4周期ⅥA族元素, 关于硒的性质判断肯定不正确的是(A )
A.硒的含氧化合物只能以SeO3形式存在 B. 硒的含氢化合物以H2Se形式存在 C. 硒的氢化物稳定性比硫化氢差
D. 硒的最高价氧化物对应的水化物的 化学式为H2SeO4
三、元素周期表的实际应用
在周期表中一定的区域内 寻找特定性质的物质
Cl光2+照H2,爆=2炸HCl B加r2热+H,化2=合2HBr 更I2高+H温2度=2,缓H慢I 化合
HCl HBr HI
定 性 减 弱
非金属性(得电子能力): > > >
结论
元同素主周族期元表素中,同从一上主到族下的,元最素高原价子氧的化_物最__对外__应层__水电__化子__物数__的相酸同, 因性此越同来主越族元,素单具质有与_氢_类_气_似_反_的应性越质来越 ,气态氢化物的
单质与氧气 反应情况
Li
最高价氧化物 对应
水化物的碱性
最高化合 价
Na
碱性:LiOH
NaOH
K
KOH
Rb
RbOH
CsOH
Cs
金属性: > >
>
结 同主族元素,从上到下,单质与水或酸反应越来越
论 ,最高价氧化物对应水化物的碱性越来越 ,金属性
越来越 。
总结:同主族元素,从上到 下,金属性越来越 强 ,非 金属性越来越 弱 。
判断元素原子失电子能力强弱的方法
1、单质跟水(或酸)反应置换出氢的难易 2、最高价氧化物的水化物—氢氧化物的碱
性强弱 3、还原性强的可以置换还原性弱的
判断元素原子得电子能力强弱的方法
1、单质与氢气生成气态氢化物的难易程度 以及氢化物的稳定性
2、最高价氧化物的水化物的酸性强弱
3、氧化性强的可以置换氧化性弱的
单质和水 (或酸)反
应情况
冷水 剧烈
热水 较快
盐酸 剧烈
盐酸 较快
稀
非金属单质 与氢气反应
高 温
磷蒸气 须 光照或 有
与H2能 反应
加 热
点燃爆 气 炸化合 体
最高价氧化 物对应水化 物的酸碱性
