长春市名校化学高考精选常考100实验题汇总word含答案
吉林市名校化学高考100题流程狂刷集锦word含答案

吉林市名校化学高考100题流程狂刷集锦word含答案一、实验题1.Ⅰ.Fe3+具有氧化性,实验室测定含碘废液中I-的含量的过程如下:量取25.00 mL废液于250 mL锥形瓶中,分别加入5 mL 2 mol·L-1H2SO4和10 mL 20% Fe2(SO4)3溶液,摇匀。
小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500 mol·L-1标准K2Cr2O7溶液进行滴定到终点。
重复3次,数据记录如下表:(1)在盛有废液的锥形瓶中先加入5 mL 2 mol·L-1H2SO4的目的是______________________________。
(用离子方程式和语言叙述解释)(2)上述过程中涉及的反应:①2Fe3++2I-===2Fe2++I2 ②______________________________。
(3)根据滴定有关数据,该废液中I-含量是_____g·L-1。
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是___________。
A.终点读数时俯视读数,滴定前平视读数B.锥形瓶水洗衣后未干燥C.滴定管未用标准K2Cr2O7溶液润洗D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点。
某学习小组同学设计如下实验:请回答:(5)设计实验①的目的是______________________________。
(6)实验③可得出结论是______________________________。
(7)写出实验②中反应的离子方程式______________________________。
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子____________________有关。
2.世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。
2022届吉林省长春市高考化学基础100题流程题狂练word含答案

2022届吉林省长春市高考化学基础100题流程题狂练word含答案一、实验题1.为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验装置如图所示:(固定装置已略去)(1)A中反应的化学方程式为。
(2)F烧杯中的溶液通常是。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。
实验方案为。
(6)将57.6g的Cu片加入50mL 18 mol/L的H2SO4溶液中并加热,被还原的H2SO4的物质的量为_________ A.小于0.45 molB.等于0.45 molC.在0.45 mol和0.90 mol之间D.等于0.90 mol2.(14分)某酸性工业废水中含有K2Cr2O7。
光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。
某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·4H2O]即可对该反应起催化作用。
为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
27(2)上述反应后草酸被氧化为(填化学式);(3)实验①和②的结果表明_______________________________;(4)该课题组对铁明矾[Al2Fe(SO4)4·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:假设一:Fe2+起催化作用;假设二:;假设三:;……(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。
吉林市名校化学高考100题实验题狂刷集锦word含答案

吉林市名校化学高考100题实验题狂刷集锦word含答案一、实验题1.I.实验室要用98%(ρ=1.84g·cm-3)的硫酸配制3.68mol·L-1的硫酸溶液500mL(1)需准确量取98%的硫酸 mL。
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol·L-1的硫酸溶液500mL,必须用到的实验仪器是(填写序号): .①500mL量筒②烧杯③1000mL容量瓶④500mL 容量瓶⑤天平⑥胶头滴管⑦锥形瓶⑧玻璃棒⑨酸式滴定管(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将使所配制的硫酸溶液浓度偏低的是。
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.烧杯内的稀硫酸未冷却至室温就转移至容量瓶中C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。
D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切。
II. 某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验:普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。
请回答以下问题:⑴.操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为(填化学式);(2)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:(答案写在答题卷上)2.一种用硫酸烧渣(主要成分Fe2O3、FeO、Fe3O4、FeS2、SiO2)制备铵黄铁矾[(NH4)x Fe y(SO4)z(OH)n,其中Fe为+3价]的工艺流程如下:回答下列问题:(1)焙烧前需进行“粉磨”的目的是_______________;硫酸烧渣加褐煤高温焙烧的主要目的是__________。
(2)“焙烧”的温度与“浸取”时浸出率的关系如下图1所示,超过800℃时,浸出率开始降低,其原因是缺少_____________________;(3)步骤④Fe2+的氧化率随控制条件及时间的变化关系如上图2所示,适宜的条件为 _________选填I、II、III、IV)。
2022届长春市高考化学精选流程题100题汇总word含答案

2022届长春市高考化学精选流程题100题汇总word含答案一、实验题1.[化学选修2化学与技术]某化工厂将钛、氯碱工业和甲醇联合生产,大大提高了原料的利用率,并减少环境污染。
流程如图1所示:图1 图2回答下列问题:(1)写出以石墨为电极电解饱和食盐水的离子方程式图2所示是典型氯碱工业的关键设备——离子交换膜电解槽,该电解槽的特点是用离子交换膜将槽分隔为左右两室,它能够阻止一些物质通过,也能允许一些物质通过。
下列有关说法正确的是(填字母代号).A.离子交换膜的特点是允许气体分子通过,而不允许阴离子通过B.图2中X是指氧气C.电解槽右室的电极反应式为2H++2e一=H2 ↑D.电解槽左室也称为阴极室(2)写出钛铁矿在高温下与焦炭经氯化得四氯化钛的化学反应方程式;生成2 mol四氯化钛时转移的电子的物质的量为 mol。
(3)利用生成的甲醉和NaOH溶液可以生产甲醇燃料电池,负极电极反应式为。
(4)钛广泛应用于航天领域。
氩气在冶炼钛的流程中所起的作用是。
(5)利用CO和H2制备甲醇①已知H2(g)、CO(g)和CH3OH(1)的燃料热分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.写出CO和H2制备液态甲醇的热化学方程。
②假设联合生产中各原料利用率为100%,若得到6mol甲醇,则需再补充标准状况下的H2 L。
2.高温下,粗硅与纯净的氯气反应,生成四氯化硅(SiCl4),再用氢气还原四氯化硅得到高纯硅。
某实验小组在实验室制备并收集四氯化硅,装置示意图如下:(查阅资料)四氯化硅极易与水反应,其熔点为-70.0℃,沸点为57.7℃。
回答下列问题:(1)①装置A用于制备氯气,应选用下列哪个装置___________(填序号)。
②装置A中反应的离子方程式为____________________________________。
(2)装置B中X试剂是_________(填名称)。
2022届吉林市高考化学实验题大全100题word含答案

2022届吉林市高考化学实验题大全100题word含答案一、实验题1.某研究性学习小组利用下图所示装置研究乙醇与氧化铁的反应,请回答下列问题:(1)装置中试管B的作用是____________________________。
(2)实验中可观察到石英管A中的现象为___________________________________。
(3)反应停止后,取出试管C在酒精灯上加热至沸腾,可观察到有红色沉淀产生。
写出该反应的化学方程式________________________________。
(4)为了测定反应后石英管A左侧固体中铁元素的含量,进行如下实验:(i)步骤③中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、__________________。
(ii)下列有关步骤④的操作中说法正确的是__________________________。
a.滴定过程中可利用淀粉溶液作为指示剂b.滴定管用蒸馏水洗涤后可以直接装液c.锥形瓶不需要用待测液润洗d.滴定过程中,眼睛注视滴定管中液面变化e.滴定结束后,30 s内溶液不恢复原来的颜色,再读数(iii)由框图中数据计算,可得石英管A左侧固体中铁元素的百分含量为_______。
2.己二酸是一种重要的有机二元酸,能够发生成盐反应、酯化反应、酰胺化反应等,并能与二元胺或二元醇缩聚成高分子聚合物等,是合成尼龙-66的原料,工业上环己醇用硝酸氧化可得到己二酸,是典型的氧化还原反应。
△H<0相关物理常数:I.己二酸粗产品的制备操作步骤:装置C中加入50mL中等浓度的硝酸(过量),投入沸石,并逐一安装装置A、装置B和温度计,磁力搅拌,将溶液混合均匀,并加热到80℃。
用装置A滴加2滴环己醇,反应立即开始,温度随即上升到85~90℃,从装置A中小心地逐滴加入环己醇,将混合物在85-90℃下加热2-3 分钟,共加入1.000g环己醇。
请回答下列问题:(1)反应需维持温度在85~90℃,最好采取______控温;试分析维持温度在85~90℃的原因:__________。
长春市名校化学高考精选常考100流程题汇总word含答案

长春市名校化学高考精选常考100流程题汇总word含答案一、实验题1.某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:根据以上信息,回答下列问题:(1)上述离子中,溶液X中除H+外还肯定含有的离子是____________________,不能确定是否含有的离子(Q)是_________,若要确定该Q(若不止一种,可任选一种)不存在,检验的最可靠的化学方法是_______________________。
(2)沉淀G的化学式为_____________。
(3)写出有关离子方程式:①中生成A_______________________。
②_____________________________。
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,当沉淀C物质的量___________,表明Q离子一定是________________2.铜及其化合物在工业上有许多用途。
回答下列问题:(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:①浸取反应中氧化剂的化学式为;滤渣Ⅰ的成分为MnO2和(写化学式)。
②“除铁”这一步反应在25℃进行,加入的试剂A为__________,若加A后溶液的PH调为4,溶液中Fe3+离子浓度为 mol/L。
(已知K sp[Fe(OH)3]= 4.0×10-38)③“沉锰”(除Mn2+)过程中反应的离子方程式。
④滤液Ⅱ经蒸发结晶得到的盐主要是(写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①下图1为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前电极质量相等,一段时间后,两电极质量相差25.8g,则导线中通过了_____ mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则乙池电解质溶液的质量与实验前的电解质溶液的质量差△m= g。
2020年吉林省长春市重点中学高考化学100题推断题狂刷集锦
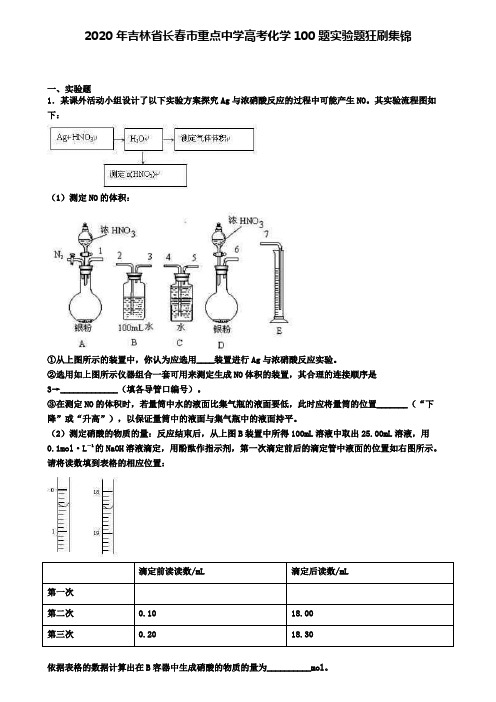
2020年吉林省长春市重点中学高考化学100题实验题狂刷集锦一、实验题1.某课外活动小组设计了以下实验方案探究Ag与浓硝酸反应的过程中可能产生NO。
其实验流程图如下:(1)测定NO的体积:①从上图所示的装置中,你认为应选用____装置进行Ag与浓硝酸反应实验。
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是3→_____________(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(2)测定硝酸的物质的量:反应结束后,从上图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,第一次滴定前后的滴定管中液面的位置如右图所示。
请将读数填到表格的相应位置:依据表格的数据计算出在B容器中生成硝酸的物质的量为__________mol。
(3)气体成份分析:若实验测得NO的体积为93.0mL(已折算到标准状况),则Ag与浓硝酸反应过程中_____(填“有”或“没有”)NO产生,作此判断的依据是__________________________________________________________________________。
2.工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:试回答下列问题:(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为______________(填化学式)。
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有______________;(3)检验步骤Ⅲ已经进行完全的试剂是______________。
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是____________________________。
2024届吉林省长春市实验中学高考化学必刷试卷含解析

2024届吉林省长春市实验中学高考化学必刷试卷注意事项1.考生要认真填写考场号和座位序号。
2.试题所有答案必须填涂或书写在答题卡上,在试卷上作答无效。
第一部分必须用2B 铅笔作答;第二部分必须用黑色字迹的签字笔作答。
3.考试结束后,考生须将试卷和答题卡放在桌面上,待监考员收回。
一、选择题(每题只有一个选项符合题意)1、下列实验操作能达到目的的是()选项实验目的实验操作A 配制100 g10%的NaOH溶液称取10 gNaOH溶于90 g蒸馏水中B 验证“84消毒液”呈碱性用pH试纸测量溶液的pHC 检验溶液中是否含有Na+用洁净的玻璃棒蘸取溶液灼烧,观察火焰颜色D 从溴水中获得溴单质利用SO2将Br2吹出后,富集、还原、分离A.A B.B C.C D.D2、25℃时,向20mL 0.1mol/L H2R(二元弱酸)溶液中滴加0.1mol/LNaOH溶液,溶液pH与加入Na O H溶液体积的关系如图所示。
下列有关说法正确的是A.a点所示溶液中:c (H2R) + c (HR-)+ c (R2-)=0.lmol/LB.b点所示溶液中:c (Na+) >c(HR-)> c (H2R)>c(R2-)C.对应溶液的导电性:b > cD.a、b、c、d中,d点所示溶液中水的电离程度最大3、高铁酸钾(K2FeO4)是一种兼具净水和消毒功能的可溶性盐,可发生如下反应:2K2FeO4+16HCl→4KCl+2FeCl3+8H2 O+3Q↑,下列说法不正确的是A.可用湿润的淀粉碘化钾试纸检验产物QB.K2FeO4在水中的电离方程式为K2FeO4→2K++Fe6++4O2一C.反应中氧化剂与还原剂的物质的量之比为1:3D.反应中涉及的物质中有5种为电解质4、利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。
下图为一套浓差电池和电解质溶液再生的配套装置示意图,闭合开关K之前,两个Cu电极的质量相等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
长春市名校化学高考精选常考100实验题汇总word含答案一、实验题1.亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:(一)鉴别NaCl和NaNO2甲同学用沉淀分析法经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10.分别向盛有5mL 0.0001 mol/L两种盐溶液的试合中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是装有溶液的试管。
乙同学侧定溶液pH用pH试纸分别测定0.1 mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性。
该溶液呈碱性的原因是(用离子方程式解释)。
(二)该小组用如下装置(略去夹持仪器)制备亚硝酸钠已知:①2NO+ Na2O2= 2NaNO2;②酸性条件下,NO和NO2都能与MnO4一反应生成NO3一和Mn2+·(1)使用铜丝的优点是。
(2)装置A中反应方程式为。
装置C 中盛放的药品是;(填字母代号)A.浓硫酸 B.NaOH 溶液 C.水 D.四氯化碳仪器F的作用。
(3)该小组称取5.000g制取的样品溶于水配成250.0 mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:①第一次实验数据出现异常,造成这种异常的原因可能是(填字母代号)。
A.锥形瓶洗净后未干燥B.酸式滴定管用蒸馏水洗净后未用标准液润洗C.滴定终点时仰视读数②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为。
③该样品中亚硝酸钠的质量分数为。
2.以下是25℃时几种难溶电解质的溶解度:在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子,例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,现将混合物溶于水,再加入足量的氢氧化镁,充分反应,过滤结晶即可;③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,再加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可;请回答下列问题:(1)上述三个除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为__________(填名称)而除去。
(2)①中加入的试剂应该选择__________为宜,其原因是___________________。
(3)②中除去Fe3+时所发生的总反应的离子方程式为________________________。
(4)下列与方案③相关的叙述中,正确的是(_______________)A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜D.Cu2+可以大量存在于pH=4的溶液中E.在pH>4的溶液中Fe3+—定不能大量存在3.某兴趣小组利用下列装置,进行与氯气相关的实验。
(1)装置④中NaOH溶液的作用是___________。
(2)实验结束后,取装置③中的溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到FeCl3·6H2O晶体。
在蒸发浓缩操作中,不需要...的仪器是___________。
A.蒸发皿 B.漏斗 C.玻璃棒 D.酒精灯(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2___________________,请说明理由_______________________________________。
4.下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。
A中一般要加入碎瓷片,其作用是__________________________。
下列关于以上实验操作说法一定正确的是_。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度D.图4实验中,当加热至有较多固体析出时,即停止加热(2)现有一瓶A和B的混合液,已知它们的性质如下表。
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。
(3)在图2所示实验中,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
____。
5.室温下.某同学进行CO2与Na2O2反应的探究实验(本实验所涉及气体休积均在相同状况下测定)。
请回答下列问题:(1)用下图装置制备纯净的CO2.①丙装置的名称是_______,乙装置中盛装的试剂是_______.②若CO2中混有HCl,则HCl与Na2O2发生反应的化学方程式为_________。
(2)按下图所示装置进行实验(夹持装置略)。
①先组装仪器.然后________.再用注射器1抽取100 mL纯净的CO2,将其连接在K1处,注射器2的活塞推到底后连接在K2处,具支U形管中装入足量的Na2O2粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞。
可观察到的现象是________。
③实验过程中.需缓慢推入CO2,其目的是__________.为达到相同目的,还可进行的操作是__________________________。
(3)实验结束后,当注射器1的活塞推到底时,测得注射器2中气体的体积为65 mL。
则CO2的转化率是_______________.6.化学是一门以实验为基础的学科,实验探究能激发学生学习化学的兴趣。
某化学兴趣小组设计如图实验装置(夹持设备已略)制备氯气并探究氯气及其卤族元素的性质。
回答下列问题:(1)仪器a的名称是______________。
(2)A装置中发生的化学反应方程式为_________________________________。
若将漂白粉换成KClO3,则反应中每生成21.3g Cl2时转移的电子数目为____N A。
(3)装置B可用于监测实验过程中C处是否堵塞,若C处发生了堵塞,则B中可观察到__________。
(4)装置C的实验目的是验证氯气是否具有漂白性,此时C中Ⅰ、Ⅱ、Ⅲ依次可放入____(填选项a或b 或c)。
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性。
当向D中缓缓通入足量氯气时,可观察到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴,打开活塞,将D中少量溶液加入E中,振荡E,观察到的现象是_______________________________,该现象_____(填“能”或“不能”)说明溴的非金属性强于碘,原因是_____________________。
7.硫酰氯(SO2Cl2)可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。
某化学学习小组拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。
反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =−97.3 kJ·mol−1,实验装置如图所示(部分夹持装置未画出)。
已知:硫酰氯通常条件下为无色液体,熔点−54.1℃,沸点69.1℃。
在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:(1)装置甲中作为反应容器的仪器的名称为________,装置己的作用是________;如何控制两种反应物体积相等:________。
(2)装置戊上方分液漏斗中最好选用下列试剂:(_______)(选填字母)。
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 mol·L−1盐酸(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫发生反应的化学方程式是________________________________________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H =SO2Cl2 + H2SO4,分离两种产物的方法是(_______) (选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取(5)长期储存的硫酰氯会发黄,可能的原因是________ (用化学方程式和必要的文字加以解释)。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为________。
为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________________ ________________________________________ (写两条即可)。
8.氧化镁在医药、建筑等行业应用广泛。
硫酸镁还原热解制备高纯氧化镁是一种新的探索。
以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为_____________________________。
(2)滤渣1的化学式为__________________。
(3)写出流程中“氧化”的离子方程式为______________________________________。
(4)调节pH时,使用pH试纸的具体操作是取一小块pH试纸放在洁净的玻璃片上,_______________________________________________________;滤渣2中除了过量的MgO外,还含有的物质是____________。
(5)高温煅烧过程中,同时存在以下反应:2MgSO4+C2MgO+2SO2↑+CO2↑;MgSO4+C MgO +SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。
利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
①D中收集的气体是_________________(填化学式)。
②B中盛放的溶液是__________________(填下列选项的字母编号)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.酸性KMnO4溶液9.为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案。
请回答每个方案中提出的问题。
(方案I)(1)称取碳酸钙样品Mg;(2)加入过量盐酸;(3)收集并测定生成的气体体积VmL。
问题1:反应结束后,量气管中的显示如右图所示,接下来的操作是:__________________,读出甲管中液面的读数。
(方案II)(1)称取碳酸钙样品Mg;(2)用cmol/L 盐酸VmL(过量)溶解样品;(3)取溶解后的溶液mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
