氨的物理性质
新版高中化学讲义:氨
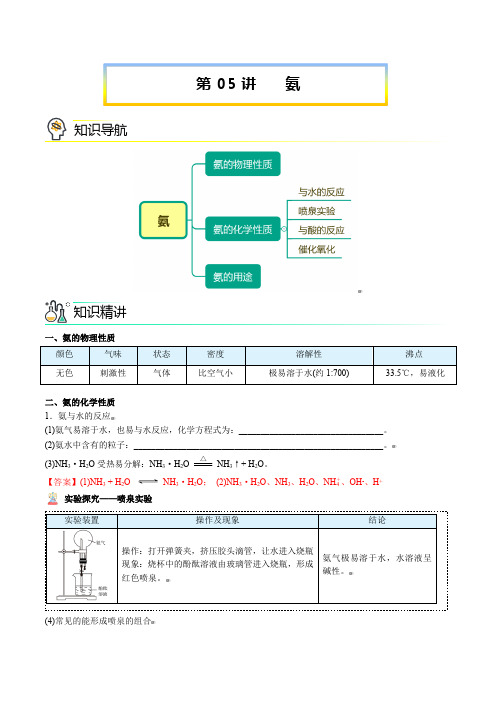
一、氨的物理性质 颜色 气味 状态 密度 溶解性沸点 无色 刺激性气体比空气小极易溶于水(约1:700)-33.5℃,易液化二、氨的化学性质 1.氨与水的反应(1)氨气易溶于水,也易与水反应,化学方程式为:_________________________________。
(2)氨水中含有的粒子:_________________________________________________________。
(3)NH 3·H 2O 受热易分解:NH 3·H 2O NH 3↑+ H 2O 。
【答案】(1)NH 3 + H 2ONH 3·H 2O ; (2)NH 3·H 2O 、NH 3、H 2O 、NH +4、OH -、H +实验探究——喷泉实验 (4)常见的能形成喷泉的组合△第05讲 氨知识导航知识精讲实验装置操作及现象结论操作:打开弹簧夹,,挤压胶头滴管,让水进入烧瓶 现象:烧杯中的酚酞溶液由玻璃管进入烧瓶,形成红色喷泉。
氨气极易溶于水,水溶液呈碱性。
气体 HCl NH 3 CO 2、Cl 2、H 2S 、SO 2NO 2 溶液 水或碱水或酸碱水或碱实验探究——NH 3与HCl 反应【答案】产生大量白烟2.氨与酸的反应氨几乎能与所有的酸(难溶性酸如H 2SiO 3除外)反应生成盐,如:NH 3 + HCl === NH 4Cl NH 3 + HNO 3 === NH 4NO 3 2NH 3 + H 2SO 4 === (NH 4)2SO 43.氨的催化氧化化学方程式:________________________________________。
【答案】4NH 3 + 5O 2 =======催化剂△4NO + 6H 2O 思考与交流:如何检验氨气?【答案】①将湿润的红色石蕊试纸靠近,试纸变蓝;②用蘸有浓盐酸的玻璃棒靠近,有白烟产生。
三、氨的用途1.氨易液化,当液氨汽化时要吸收大量的热,使周围温度急剧降低,因此液氨常用作__________。
氨的性质用途

一、物理性质
为什么会有浓烈的刺激性气味? 白色的气雾是怎么形成的?为什么会寒气逼人?
液氨易挥发,挥发时吸收大量的热。
一、物理性质
现象1、气氨管线内带有液氨时,管壁会挂冰或形成一 层白霜。
3NO2 + H2O = 2HNO3 + NO
二、化学性质
较之前面所讲化学性质,下面两个性质我们在初高中化 学中可能接触的不多,但对指导安全生产、材料选择意义重 大,它们是: 4、氨的自燃点为630℃。氨与空气或氧按一定比例混合后, 遇火发生爆炸。常温常压下,氨的爆炸极限在空气中为 15.5%~28%,在氧气中为13.5%~82%(均为体积分数)。 5、在有水汽和氧存在的条件下,氨对铜及其合金有腐蚀作 用。
性质小结
学习氨的性质有助于我们理解工艺流程、了解氨的用途、安 全清洁生产。通过本次课学习,应掌握:
氨的性质
物理性质
溶解性、密度、沸 点、挥发性、毒性 、临界温度、临界 压力等。
化学性质
氨与水、氧气、酸 等的反应,氨在空 气的爆炸极限,氨 的腐蚀性等。
氨的用途
性质
用途
我说性质
与酸(或酸酐) 反应生成铵盐
反应物相同,条件不同,产物不同 NH3在纯氧中燃烧
点 燃
4 N H 3 + 3 O 2 2 N 2 + 6 H 2 O
NH3的催化氧化
4NH3+5O2 P=△t 4NO+6H2O
二、化学性质
氨催化氧化是工业制硝酸的基础
4NH3 + 5O2
氨的物理化学性质

氨的物理化学性质氨(NH3)是一种无色气体,具有特殊的物理化学性质。
在这篇文章中,我们将探讨氨的物理化学性质,包括氨的熔点、沸点、溶解性、酸碱性以及重要的应用领域。
熔点和沸点氨的熔点为-77.7摄氏度,沸点为-33.3摄氏度。
这意味着在常温下,氨呈气态存在。
当氨被冷却至低于熔点时,它会转变为液态。
随着温度的降低,氨会继续凝固成固体状态。
而当氨被加热至高于沸点时,它会迅速蒸发成气态。
溶解性氨具有很高的溶解度。
它可以溶解在水中,形成氨水。
氨的溶解度随着温度的升高而增加,这意味着在高温下,溶解氨的能力更强。
溶解氨水可以产生一种碱性溶液,这种溶液常常用于实验室和工业应用中。
酸碱性尽管氨经常被称为氨水,但它实际上是一种碱性物质。
它具有强碱性,可以中和酸性物质。
氨在水中形成氢氧化铵(NH4OH),这是一种弱碱。
当氨与酸反应时,它可以接受酸中的氢离子,并形成相应的盐。
重要应用领域氨在工业及其他领域中有着广泛的应用。
以下是一些重要的应用领域:1. 化肥生产:氨是制造氮肥的重要原料。
它可以与二氧化碳反应形成尿素,成为一种重要的氮肥源。
2. 清洁剂和溶剂:氨水作为一种清洁剂和溶剂被广泛用于家庭和工业场所。
它可以去除油脂和污渍,并具有杀菌作用。
3. 制冷剂:氨被广泛用作制冷剂,尤其在大型冷库和工业冷却系统中。
由于其高热传导性和低环境影响,氨被认为是一种环保的制冷剂。
4. 医药和生物化学研究:氨在医药和生物化学研究中具有重要的应用。
它可以用作药物的催化剂和中间体,并用于DNA和RNA的萃取和纯化过程中。
总结氨是一种重要的化学物质,具有特殊的物理化学性质。
它具有较低的熔点和沸点,高溶解度以及强碱性。
氨在化肥生产、清洁剂和溶剂、制冷剂以及医药和生物化学研究中都有着重要的应用。
通过深入了解氨的物理化学性质,我们可以更好地理解和应用这种重要的化学物质。
氨的知识

氨轻度中毒的症状
• 出现流泪、咽痛、声音嘶哑、咳嗽、咯 痰等;眼结膜、鼻粘膜、咽部充血、水 肿;胸部X线征象符合支气管炎或支气管 周围炎。
氨中度中毒的症状
• 上述轻度中毒的症状加剧,出现呼吸困 难、紫绀;胸部X线征象符合肺炎或间质 性肺炎。
氨严重中毒的症状
• 发生中毒性肺水肿,或有呼吸窘迫综合 征,患者剧烈咳嗽、咯大量粉红色泡沫 痰、呼吸窘迫、谵妄、昏迷、休克等。 可发生喉头水肿或支气管粘膜坏死脱落 窒息。高浓度氨可引起反射性呼吸停止。 液氨或高浓度氨可致眼灼伤;液氨可致 皮肤灼伤。
氨的化学性质
• 氨的分子式:NH3,氨分子的空间结构是 三角锥形,三个氢原子处于锥底,氮原 子处在锥顶。每两个N—H键之间夹角为 107°18’,因此,氨分子属于极性分子 。
氨的化学性质
• 跟水(NH3•H2O), 一水合氨能小部分电离成铵离子和氢氧 根离子,所以氨水显弱碱性,能使酚酞 溶液变红色。
氨的泄漏事故案例
• 2006年11月1日7时50分,湖北省大悟县 城南端的黄麦岭磷化工(集团)公司氮 肥厂发生液氨泄漏事故,造成1人死亡, 6人受伤,城区2万居民紧急疏散。泄漏 原因是液氨输送管突然破裂,漏氨量约 10吨。
氨的泄漏事故案例
• 2009年6月5日晚8时55分,河池化工集团公司 发生氨气泄漏事故,致三名工人死伤,其中一 人死亡,一人重伤,一人轻伤。事故发生于该 公司的合成车间,当天该车间供气管道发生故 障,工人们在维修过程中,一条供气管道突然 破裂,氨气喷射而出,正在操作的那名男工瞬 间吸入大量氨气,摇摇晃晃走出几米后倒地昏 死过去。在他身旁协助操作的两名男工亦受伤。 他们身后的女工因距离破裂的管道稍远,且反 应敏捷逃生及时,所以没有受伤。
高中化学人教版 必修第2册第五章 第二节 氨和铵盐牛老师

判断该物质是铵盐。
深度思考
1.向盛有少量硫酸铵溶液(或氯化铵溶液、硝酸铵溶液)的试管中加入氢氧化钠 溶液并加热,用镊子夹住一片湿润的红色石蕊试纸放在试管口,观察到的现 象是 红色石蕊试纸变蓝 ,反应的离子方程式是 NH+ 4 +OH-==△===NH3↑+ H2O 。
2.铵盐溶液与碱溶液反应的离子方程式 (1)铵盐溶液与烧碱溶液混合后加热: NH+ 4 +OH-==△===NH3↑+H2O 。
跟踪强化
1.下列关于铵盐的说法中正确的是
A.所有铵盐受热均可以分解,其产物中都有氨
B.所有铵盐都易溶于水,所有铵盐中的N均呈-3价
√C.氯化铵溶液中加入烧碱浓溶液共热时反应的离子方程式为NH +4 +OH-
△ =====
NH3↑+H2O
D.氯化铵和氯化钠的固体混合物可用升华法分离
123
解析 A项,有的铵盐受热分解产生氨(如NH4Cl),有的铵盐受热分解最终 不产生氨(如硝酸铵); D项,可用加热法分离NH4Cl和某些固体(不分解、不升华的固体)的混合物, 但其过程为先受热分解,再降温化合,而不是升华。
123
解析 A项,该反应属于固体间的加热反应,不能写成离子形式,错误; B 项,加热条件下 NH3·H2O 应分解为 NH3 和 H2O,离子方程式应为 NH+ 4 +OH- ==△===NH3↑+H2O,错误; C项,符合反应原理及离子方程式书写要求,正确; D 项,一水合氨是弱碱,不能完全电离,向氨水中滴加氯化铝溶液应生成 Al(OH)3 沉淀,离子方程式应为 Al3++3NH3·H2O===Al(OH)3↓+3NH4+,错误。
(2)铵盐不稳定,受热易分解
△ NH4Cl =====
NH3↑+HCl↑,
氨气资料

一、氨的分子结构氮原子有5个价电子,其中有3个未成对,当它与氢原子化合时,每个氮原子可以和3个氢原子通过极性共价键结合成氨分子,氨分子里的氮原子还有一个孤对电子。
氨分子的空间结构是三角锥形,三个氢原子处于锥底,氮原子处在锥顶。
每两个N—H键之间夹角为107°18’,因此,氨分子属于极性分子。
H H.. |电子式: H:N:H 结构式: H-N-H..二、氨的性质化学式NH31、物理性质相对分子质量17.031氨气在标准状况下的密度为0.7081g/L氨气极易溶于水,溶解度1:7002、化学性质(1)跟水反应氨溶于水时,氨分子跟水分子通过*氢键结合成一水合氨(NH3•H2O),一水合氨能小部分电离成铵离子和氢氧根离子,所以氨水显弱碱性,能使酚酞溶液变红色。
氨在水中的反应可表示为:一水合氨不稳定受热分解生成氨和水氨水中存在三分子、三离子、三平衡分子:NH3、NH3•H2O、H2O;离子:NH4+、OH-、H+;三平衡:NH3+H2O NH3•H2O NH4++OH-H2O H++OH-氨水在中学化学实验中三应用①用蘸有浓氨水的玻璃棒检验HCl等气体的存在;②实验室用它与铝盐溶液反应制氢氧化铝;③配制银氨溶液检验有机物分子中醛基的存在。
(2)跟酸反应2NH3+H2SO4===(NH4)2SO43NH3+H3PO4===(NH4)3PO4NH3+CO2+H2O===NH4HCO3(反应实质是氨分子中氮原子的孤对电子跟溶液里具有空轨道的氢离子通过配位键而结合成离子晶体。
若在水溶液中反应,离子方程式为:8NH3+3Cl2===N2+6NH4Cl(黄绿色褪去,产生白烟)反应实质:2NH3+3Cl2===N2+6HClNH3+HCl===NH4Cl总反应式:8NH3+3Cl2===N2+6NH4Cl三、氨的制法1.工业制法:工业上氨是以哈伯法通过N2和H2在高温高压和催化剂存在下直接化合而制成:工业上制氨气高温高压N2(g)+3H2(g)========2NH3(g)(可逆反应)催化剂△rHθ =-92.4kJ/mol2. 实验室制备:实验室,氨常用铵盐与碱作用或利用氮化物易水解的特性制备:△2NH4Cl + Ca(OH)2===2NH3↑+ CaCl2 + 2H2O↑Li3N + 3H2O === LiOH + N H3↑四、铵盐铵盐是氨与酸作用得到铵盐,铵盐是由铵离子(NH4+)和酸根离子组成的化合物。
氨

△
OH-
== NH3↑+ H2O
△
与碱反应是一切铵盐的共同性质,实验室可利 用这个性质来检验NH4+的存在。湿润的红色石蕊试 纸检验生成 的气体,试纸变蓝(证明含NH4+)。
六、氮的固定
1、概念:把空气中游离态的氮转变为氮的 化合物的方法。 2、氮的固定的形式
人工固氮(合成氨反应):N2+3H2 催化剂 ⇌ 2NH3
氨水的成分与性质
成分:三种分子三种离子 NH3、H2O、NH3·H2O(主要);NH4+、OH-、H+ 性质: △ (1)不稳定性:NH3·H2O===NH3↑+H2O(棕色瓶密封) (2)碱性: NH3·H2O NH4++OH-
(2)与酸反应(生成铵盐) NH3 + HCl = NH4Cl(可用于氨气的检验) 现象:产生白烟
高温、高压
[例1]下列关于氨气的说法中,正确的是( D ) A.氨可以用浓硫酸干燥
B .氨溶于水显弱碱性,因此氨气可使湿润
的酚酞试纸变蓝
C .氨本身没有毒,故发生液氨大量泄漏时,
人们也不必采取任何防范措施 D.用水吸收NH3用如图所示的装置 可防止倒吸
[ 解析 ] 氨属于碱性气体,不能用酸性干燥剂 (如浓硫酸、五 氧化二磷固体 ) 干燥,也不能用无水 CaCl2 干燥,因为无水 CaCl2与氨气反应生成CaCl2·8NH3,故只能用碱性干燥剂(如 碱石灰、固体氢氧化钠等)干燥;湿润的酚酞试纸遇NH3会变 红,虽然氨气并不能称之为有毒气体,但由于氨气的溶解度 极高,且极易挥发,所以常被吸附在皮肤黏膜和眼黏膜上, 从而产生刺激和炎症,故发生液氨大量泄漏时,人们必须采 取一定的防范措施,例如根据氨的密度小的特征,可以向地 势低、逆风的方向远离事故区,故A 、 B、 C 三项都错误。四 氯化碳是一种油状液体,氨气不溶解于其中,这样就防止了 倒吸,D项正确。
氨性质总结

氨性质总结一、物理性质1. 外观与气味氨(NH3)是一种无色气体,散发着刺激性的刺鼻气味。
在常温常压下,氨呈现为无色透明的气体。
2. 氨的溶解性氨具有较高的水溶解度。
在常温常压下,约有700倍的氨气能够溶解于水中,形成氨水。
氨水呈碱性,可以与酸反应。
3. 沸点和熔点氨的沸点为-33.34°C,熔点为-77.73°C。
由于氨是无色气体,所以其存在于液态或固态时并不直观。
4. 密度氨的密度比空气小,大约为0.73 g/L。
这也是为什么氨气会上升的原因。
二、化学性质1. 稳定性氨是一种相对不稳定的物质,在高温或高压下容易分解。
此外,氨容易发生自燃并和氧气发生反应,产生氮气和水。
2. 与酸的反应氨具有碱性,可以和酸发生酸碱反应。
例如,氨和盐酸反应生成氯化铵(NH4Cl),氨和硫酸反应生成硫酸铵((NH4)2SO4)等。
3. 与金属的反应氨能够与金属发生反应,生成硝酸盐和铵盐。
例如,氨和银离子反应生成白色的银氨合物。
4. 与氧化剂的反应氨具有还原性,在存在氧化剂的条件下能够发生反应。
例如,氨与氯元素反应生成氯氨,氨与过氧化氢反应生成氮气和水。
三、应用1. 化学工业氨广泛用于化学工业的合成反应中。
例如,氨是合成尿素和硝酸等化肥的原料。
此外,氨还可用于制造合成纤维和合成树脂等。
2. 医药领域氨在医药领域也有一定的应用。
例如,氨能够用作制备某些药物的中间体,或用于药物的稀释剂。
3. 农业氨被广泛应用于农业领域。
氨作为氮源,可作为农田土壤的肥料,并且也用于动物饲料的添加剂。
4. 清洁剂和消毒剂由于氨具有杀菌和去除异味的特性,它常被用作清洁剂和消毒剂。
例如,在家庭中,氨可用于清洗玻璃、擦拭金属等。
综上所述,氨是一种具有刺激性气味的无色气体,具有较高的水溶解度和碱性。
在化学性质方面,氨具有不稳定性,可与酸、金属和氧化剂发生反应。
在应用方面,氨广泛用于化学工业、医药领域、农业以及作为清洁剂和消毒剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
问题2:选用下面的哪一组装置,会出
现喷泉现象,且烧瓶内的液体几乎 全充满?
A(气体) B(液体)
组1 NO2 组2 CO2 组3 Cl2 组4 NH3
水
4mol/L NaOH 饱和NaCl 溶液 1mol/L 盐酸
二、氨的化学性质 1、氨跟水的反应: NH3+H2O NH3·H2O NH3·H2O = NH3↑+H2O 2、氨跟酸的反应:
解:250ml烧瓶内的物质的量 = 0.250L / (22.4L/mol)
烧瓶中氨水的物质的量浓度 (0.25/22.4mol)/0.25L
=
= 1/ 22.4(mol/L)
= 0.045mol/L
NH3喷泉装置
NH3喷烟装置
3、多现象实验设计: NH3 的喷泉、喷烟实验。
组合设计法:将产生单一 现象的装置,通过改进组 合到同一演示实验装置中。
NH3 + HCl = NH4Cl
NH3 + HNO3 = NH4NO3 NH3 + H2SO4 = (NH4)2SO4 结论:氨与挥发性酸反应冒白 烟——可用于检验NH3的存在。
_
NH4++ OH
二、氨的化学性质 1、氨跟水的反应: NH3+H2O NH3·H2O NH3·H2O = NH3↑+H2O 2、氨跟酸的反应:
Hale Waihona Puke 2、氨的物理性质3、氨的化学性质
(1)与水反应;(2)与酸 反应;(3)与氧气反应
巩固练习:
1、不能用于检验NH3的化学药品( A ) A H2SO4 B HNO3 C HCl D润湿的红色石蕊试纸
2、标况下,250ml的烧瓶里充满氨气后,倒置于水槽中,假设溶解 后的溶质不向外扩散,水全充满。则求:烧瓶中氨水的物质的量浓 度是多少?
NH3 + HCl = NH4Cl
NH3 + HNO3 = NH4NO3 NH3 + H2SO4 = (NH4)2SO4 结论:氨与挥发性酸反应冒白 烟——可用于检验NH3的存在。
_
NH4++ OH
3、氨跟氧气反应 —氨的催化氧化
4
NH3
+
5
O2
催化剂
======
4
NO
+ 6H2O
小结:1、氨分子的结构:
