中考必备:初中化学元素周期表规律
元素周期表的构成和规律

元素周期表的构成和规律一、元素周期表的构成1.元素周期表是一个表格,其中横向称为周期,纵向称为族。
2.周期表中的元素按照原子序数递增排列,原子序数相同的元素位于同一周期。
3.周期表共有7个周期,从第1周期到第7周期,周期数越大,元素的原子序数越大。
4.周期表共有18个族,包括7个主族、7个副族、1个0族和1个第Ⅷ族。
5.主族元素包括第1A到第7A族,副族元素包括第1B到第7B族,0族元素为稀有气体,第Ⅷ族元素为过渡金属。
二、元素周期表的规律1.周期规律:同一周期内,元素的原子半径随着原子序数的增加而减小;元素的金属性随着原子序数的增加而减弱,非金属性随着原子序数的增加而增强。
2.族规律:同一族元素具有相似的化学性质,族数相同的元素具有相同的最外层电子数。
3.电子层数规律:元素周期表中,电子层数等于周期数。
4.价电子规律:元素的价电子数等于其族序数。
5.原子半径规律:同一主族元素,原子半径随着周期数的增加而增大;同一周期元素,原子半径随着族序数的增加而增大。
6.金属性和非金属性规律:同一周期内,金属性随着族序数的增加而减弱,非金属性随着族序数的增加而增强;同一族内,金属性随着周期数的增加而增强,非金属性随着周期数的增加而减弱。
7.化合价规律:主族元素的化合价等于其最外层电子数;副族元素的化合价较为复杂,具有一定的可变性。
三、重要概念1.原子序数:元素在周期表中的序号,等于其核内质子数。
2.电子层:原子中电子分布的层次,等于元素周期表中的周期数。
3.价电子:原子最外层参与化学反应的电子数,等于元素周期表中的族序数。
4.主族元素:周期表中第1A到第7A族和第1B到第7B族的元素。
5.副族元素:周期表中第1B到第7B族的元素(除主族元素外)。
6.过渡金属:周期表中第Ⅷ族的元素。
7.稀有气体:周期表中0族的元素,具有稳定的电子层结构。
元素周期表是化学中的重要工具,通过其构成和规律,我们可以了解元素的性质、预测化学反应等。
初中化学中六大元素周期表的记忆总结

初中化学中六大元素周期表的记忆总结
周期表是化学的基础知识之一,对于初中化学研究来说十分重要。
下面是对初中化学中六大元素周期表的记忆总结。
1. 原子序数:元素周期表中的每个元素都有一个唯一的原子序数,表示元素的核中所含有的质子数目。
原子序数通常以Z表示。
2. 原子量:元素周期表中的每个元素都有一个特定的原子量,
表示该元素一个原子的相对质量。
原子量通常以A表示。
3. 倒装线:元素周期表中的元素按照原子序数的增加顺序排列,其中的某些元素之间用倒装线表示。
在倒装线上方的元素为金属,
下方的元素为非金属。
4. 周期:元素周期表中的元素按照原子序数和原子结构的变化
规律分为七个周期。
每个周期的第一个元素是一种高活泼性金属,
而最后一个元素是一种高活泼性非金属。
5. 主族元素:元素周期表中的元素按照原子序数的增加顺序分为18个主族。
主族元素的外层电子层都有相同数量的电子。
6. 周期表的分组:元素周期表中的元素按照原子序数和原子结构的相似性分为18个分组。
同一分组中的元素具有相似的化学性质。
以上是初中化学中六大元素周期表的记忆总结。
通过深入了解这些知识,我们可以更好地理解元素的性质和化学反应的规律。
中考初中化学元素周期表和记忆口诀

中考初中化学元素周期表和记忆口诀1.碳是C、磷是P、铅的符号是Pb2.Cu铜、Ca钙、钨的符号W3.H氢、S硫、硅的符号Si4.金Au、银Ag、镁的符号Mg5.钠Na、氖Ne、汞的符号Hg6.硼是B、钡Ba、铁的符号Fe7.锌Zn、锰Mn、锡的符号Sn8.钾是K、碘是I、氟的符号是F9.氧是O、氮是N、溴的符号是Br10.Al铝、Cl氯、锑的符号Sb第一周期:氢氦 ---- 侵害第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁 钴 镍 铜 锌 镓 锗 ---- 铁姑捏痛新嫁者砷 硒 溴 氪 ---- 生气 休克第五周期:铷 锶 钇 锆 铌 ---- 如此一告你钼 锝 钌 ---- 不得了铑 钯 银 镉 铟 锡 锑 ---- 老把银哥印西堤碲 碘 氙 ---- 地点仙第六周期:铯 钡 镧 铪 ----(彩)色贝(壳)蓝(色)河钽 钨 铼 锇 ---- 但(见)乌(鸦)(引)来鹅铱 铂 金 汞 砣 铅 ---- 一白巾 供它牵铋 钋 砹 氡 ---- 必不爱冬(天)第七周期:钫 镭 锕 ---- 很简单了~就是---- 防雷啊!20个必记:氢氦锂铍硼 碳氮氧氟氖 钠镁铝硅磷 硫氯氩钾钙(5个一记会好记点)二、中考化学推断题2.已知A ~H 为初中化学中常见的物质,它们之间的关系如图所示,“→”表示转化关系,“−”表示相互之间能反应(部分反应物、生成物以及反应条件省略)。
其中A 是使用最广泛的金属; B 俗称烧碱,C 为人体胃液的主要成分,C 和E 所属类别相同,固态D 可用于人工降雨,F 的溶液呈蓝色,可用于配制波尔多液,G 常用于改良酸性土壤。
(1)A 的化学式为______;(2)写出H 与G 反应的化学方程式:____________。
【答案】Fe ()2332=Ca OH +Na CO CaCO +2NaOH ↓【解析】【分析】A 是使用最广泛的金属,则A 是铁,B 俗称烧碱,则B 是氢氧化钠,C 为人体胃液的主要成分,则C 是盐酸,C 和E 所属类别相同,固态D 可用于人工降雨,故D 是二氧化碳,D 生成H ,则H 是碳酸钠,F 的溶液呈蓝色,可用于配制波尔多液,F 是硫酸铜,G 常用于改良酸性土壤,则G 是氢氧化钙。
元素周期表规律总结

元素周期表规律总结元素周期表是由俄罗斯化学家门捷列夫·门捷列耶夫在 1869 年首次提出的,它是化学中最常用的工具之一。
元素周期表将所有已知元素按照原子序数的顺序排列,使得相似性质的元素能够放在一起。
这个表格也展示了元素的化学性质和一些其他的信息。
在元素周期表中,元素周期的重复性是其最显著和最重要的特征之一。
这是由于元素周期表中每一行被称为一个周期,每一列被称为一个族。
每一个周期都有相似的化学性质,而这种相似性质的变化又会在下一个周期中重复。
元素周期表的规律主要有以下几个方面:1. 原子序数:元素周期表按照原子序数的递增顺序排列,即从左到右,从上到下。
原子序数是指元素中原子核中质子的数量,也就是元素的标志性数字。
元素周期表的原子序数从 1 开始,依次增加。
这样的排列方式使得元素周期表更具有系统性,并且便于进行比较和分类。
2. 原子量:元素周期表中的元素按照原子量的递增顺序排列。
原子量是指元素一个原子中质子和中子的总质量。
原子量的增加与元素的原子序数相关。
原子量也是元素周期表中元素分类的重要依据之一。
3. 周期性规律:元素周期表的周期性规律是其最重要的特征之一。
每一个周期都有相似的化学性质,包括和其他元素的反应性、化合价的变化等。
这使得元素周期表成为预测和研究元素性质的重要工具。
其中,周期性规律最为明显的是周期表的主族元素和周期表的过渡元素。
4. 原子半径:元素周期表中,原子半径随着电子层的增加而增加。
这是由于原子核的吸引力减弱、电子云的层次结构变得更复杂而导致的。
原子半径的大小不仅与元素的位置有关,还与周期表中元素的族别、主族元素和过渡元素等有关。
5. 电子亲和能和电离能:元素周期表中,原子的电子亲和能和电离能通常随着元素的原子序数的增加而变化。
电子亲和能是指一个原子在气态中获得一个电子成为阴离子时所释放出的能量,而电离能是指一个原子失去一个电子成为阳离子时所需的能量。
这些性质的变化与元素的电子结构和原子核的吸引力有关。
化学元素周期表记忆规律

化学元素周期表记忆规律化学元素周期表记忆规律1、原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
2、元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同。
3、单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。
4、元素的金属性与非金属性(1)同一周期的元素从左到右金属性递减,非金属性递增;(2)同一主族元素从上到下金属性递增,非金属性递减。
5、最高价氧化物和水化物的酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
6、非金属气态氢化物元素非金属性越强,气态氢化物越稳定。
同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。
7、单质的氧化性、还原性一般元素的金属性越强,其单质的还原性越强,其氧化物的氧离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。
化学元素周期表记忆方法判断元素在周期表中位置应牢记的规律:1、元素周期数等于核外电子层数;2、主族元素的序数等于最外层电子数;3、确定族数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,即可由最后的差数来确定。
最后的差数就是族序数,差为8、9、10时为viii族,差数大于10时,则再减去10,最后结果为族序数。
高中化学知识点记忆技巧1理解记忆对所学知识进行分析、综合、比较、归纳总结,找出内在联系及规律,然后记忆这些带有规律性的知识。
中考初中化学元素周期表和记忆口诀
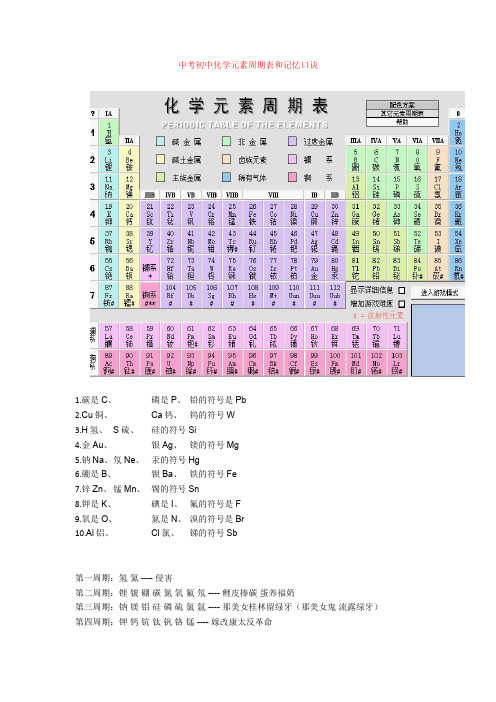
中考初中化学元素周期表和记忆口诀1.碳是C、磷是P、铅的符号是Pb2.Cu铜、Ca钙、钨的符号W3.H氢、S硫、硅的符号Si4.金Au、银Ag、镁的符号Mg5.钠Na、氖Ne、汞的符号Hg6.硼是B、钡Ba、铁的符号Fe7.锌Zn、锰Mn、锡的符号Sn8.钾是K、碘是I、氟的符号是F9.氧是O、氮是N、溴的符号是Br10.Al铝、Cl氯、锑的符号Sb第一周期:氢氦 ---- 侵害第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一告你钼锝钌 ---- 不得了铑钯银镉铟锡锑 ---- 老把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧铪 ----(彩)色贝(壳)蓝(色)河钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅 ---- 一白巾供它牵铋钋砹氡 ---- 必不爱冬(天)第七周期:钫镭锕 ---- 很简单了~就是---- 防雷啊!20个必记:氢氦锂铍硼碳氮氧氟氖钠镁铝硅磷硫氯氩钾钙(5个一记会好记点)二、中考化学推断题2.如图表示某些物质间转化关系。
A是大理石的主要成分,C是气体,D是一种黑色的固态非金属单质,E由两种元素组成,其中D元素的质量分数为37.5%,与另一种元素原子个数之比为2:1,F是一种碱,H是一种有刺激性气味的气体。
请回答下列问题。
(1)写出物质的化学式:D_____,G_____。
(2)写出下列反应的化学方程式:①_____,②_____。
(3)反应③能够发生的原因是_____。
(4)此种塑料_____ (填“能”或“不能”)用于食品包装。
【答案】C NH4Cl CaCO3 =CaO + CO2↑ CaC2+ 2H2O= C2H2↑+ Ca (OH)2常温下,NaHCO3的溶解度较小而析出不能【解析】A是大理石的主要成分,A是碳酸钙,B是氧化钙,C是气体,C是二氧化碳,D是一种黑色的固态非金属单质,D是碳,E由两种元素组成,其中D元素的质量分数为37.5%,E是碳化钙,与另一种元素原子个数之比为2:1,F是一种碱,F是氢氧化钙,H是一种有刺激性气味的气体,H是氨气,G是氯化铵。
中考初中化学元素周期表和记忆口诀
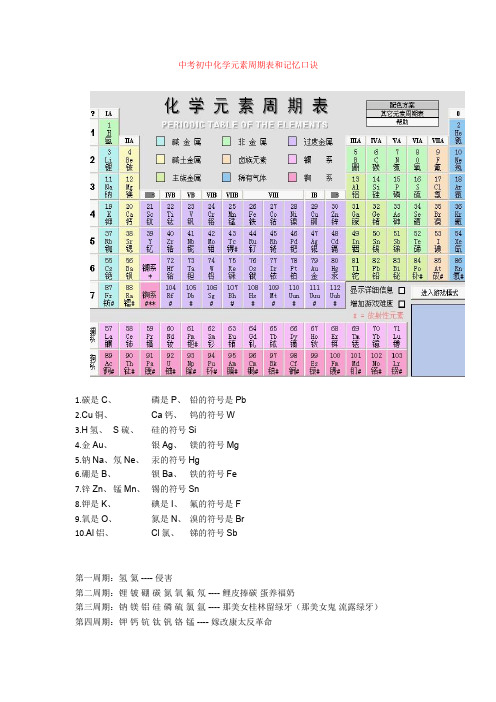
中考初中化学元素周期表和记忆口诀1.碳是C、磷是P、铅的符号是Pb2.Cu铜、Ca钙、钨的符号W3.H氢、S硫、硅的符号Si4.金Au、银Ag、镁的符号Mg5.钠Na、氖Ne、汞的符号Hg6.硼是B、钡Ba、铁的符号Fe7.锌Zn、锰Mn、锡的符号Sn8.钾是K、碘是I、氟的符号是F9.氧是O、氮是N、溴的符号是Br10.Al铝、Cl氯、锑的符号Sb第一周期:氢氦 ---- 侵害第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一告你钼锝钌 ---- 不得了铑钯银镉铟锡锑 ---- 老把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧铪 ----(彩)色贝(壳)蓝(色)河钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅 ---- 一白巾供它牵铋钋砹氡 ---- 必不爱冬(天)第七周期:钫镭锕 ---- 很简单了~就是---- 防雷啊!20个必记:氢氦锂铍硼碳氮氧氟氖钠镁铝硅磷硫氯氩钾钙(5个一记会好记点)二、中考化学推断题2.图中的A、B、C、D、E、F、G都是初中化学中的常见物质。
其中A是盐,常用做建筑材料,B是人体胃液中所含有的一种酸,C是植物光合作用的一种原料,E是盐,广泛用于玻璃、造纸、纺织和洗涤剂的生产等,F、G是碱。
它们之间存在以下转化关系(图中部分生成物已略去)。
(1)写出物质A、B的化学式:A_____ B_____;(2)写出反应的化学方程式:_____(3)写出物质G在实验室必需密封保存的原因:_____。
【答案】CaCO3 HCl Na2CO3+Ca(OH)2═CaCO3↓+2NaOH吸水潮解,与CO2反应【解析】【分析】根据A、B、C、D、E、F、G都是初中化学中的常见物质,A是一种盐,常用作建筑材料,所以A是碳酸钙,B是人体胃液中所含的一种酸,所以B是盐酸,C是植物光合作用的一种原料,碳酸钙和盐酸反应生成无色溶液D和C,C和碱F反应会生成碳酸钙,所以C是二氧化碳,E是盐,广泛用于玻璃、造纸、纺织和洗涤剂的生产等,所以E是碳酸钠,二氧化碳和G反应会生成碳酸钠,所以G是氢氧化钠,二氧化碳和碱F会生成碳酸钙,所以F是氢氧化钙。
中考初中化学元素周期表和记忆口诀
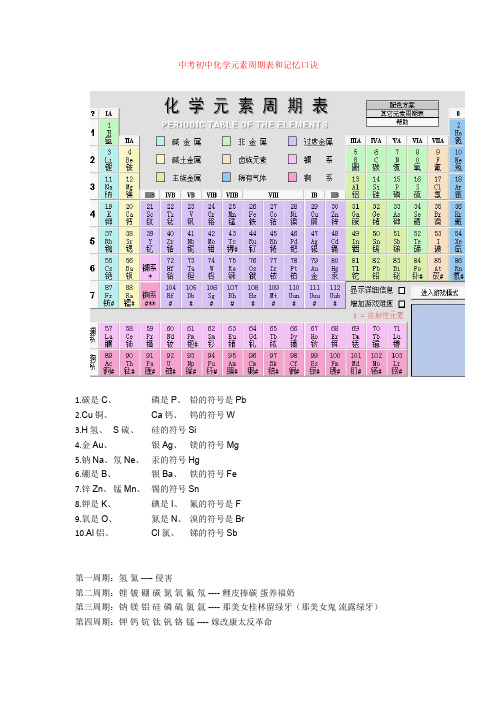
中考初中化学元素周期表和记忆口诀1.碳是C、磷是P、铅的符号是Pb2.Cu铜、Ca钙、钨的符号W3.H氢、S硫、硅的符号Si4.金Au、银Ag、镁的符号Mg5.钠Na、氖Ne、汞的符号Hg6.硼是B、钡Ba、铁的符号Fe7.锌Zn、锰Mn、锡的符号Sn8.钾是K、碘是I、氟的符号是F9.氧是O、氮是N、溴的符号是Br10.Al铝、Cl氯、锑的符号Sb第一周期:氢氦 ---- 侵害第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一告你钼锝钌 ---- 不得了铑钯银镉铟锡锑 ---- 老把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧铪 ----(彩)色贝(壳)蓝(色)河钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅 ---- 一白巾供它牵铋钋砹氡 ---- 必不爱冬(天)第七周期:钫镭锕 ---- 很简单了~就是---- 防雷啊!20个必记:氢氦锂铍硼碳氮氧氟氖钠镁铝硅磷硫氯氩钾钙(5个一记会好记点)二、中考化学推断题2.现有A、B、C、D四种失去标签的溶液,分别是Na2SO4溶液、NaOH溶液、MgSO4溶液、CuSO4溶液中的一种。
不使用任何其他试剂,只用这四种试剂相互反应就可以将它们鉴别出来。
(探究过程)(1)不用做任何实验直接就可以判断出A溶液,则A为_____溶液,你判断的依据是_____。
(2)分别取B、C、D溶液于试管中,向试管中滴加A溶液,C、D无现象,B有现象,则B为_____溶液,发生的反应方程式为_____。
(3)分别取C、D溶液于试管中,向试管中演加B溶液,D无现象,C中的现象为_____,则C为_____溶液。
(反思拓展)(4)以上能发生的反应都为_____(填基本反应类型),该反应类型的发生要一定的条件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019中考必备:初中化学元素周期表规律
一、元素周期表中元素及其化合物的递变性规律1、原子半径
(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;
(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
2、元素化合价
(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);
(2)同一主族的元素的最高正价、负价均相同。
3、单质的熔点
(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;
(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。
4、元素的金属性与非金属性
(1)同一周期的元素从左到右金属性递减,非金属性递增;
(2)同一主族元素从上到下金属性递增,非金属性递减。
5、最高价氧化物和水化物的酸碱性
元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
6、非金属气态氢化物
元素非金属性越强,气态氢化物越稳定。
同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。
7、单质的氧化性、还原性
一般元素的金属性越强,其单质的还原性越强,其氧化物的氧离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。
二、推断元素位置的规律
判断元素在周期表中位置应牢记的规律:
1、元素周期数等于核外电子层数;
2、主族元素的序数等于最外层电子数;。
