2011届北京市朝阳区高三第一学期期末统一考试(化学)答案
北京市朝阳区高三化学上学期期末统一考试试题(含解析)

北京市朝阳区2016届高三化学上学期期末统一考试试题(含解析)(考试时间:90分钟满分:100分)可能用到的相对原子质量:H 1 C 12第Ⅰ卷(选择题共42分)注意:Ⅰ卷共14道小题,每小题只有一个选项符合题意,每小题3分,共42分1.以下我国古代的制作或技术涉及到化学反应的是A.烧制陶罐B.雕刻石雕C.水车灌溉D.预报地震【答案】A【解析】试题分析:判断一个过程是否发生化学反应看其反应过程是否有新物质生成。
A、以粘土为原料烧制陶罐,有新物质生成,涉及化学反应,正确;B、雕刻石雕没有新物质生成,不涉及化学反应,错误;C、水车灌溉没有新物质生成,不涉及化学反应,错误;D、预报地震没有新物质生成,不涉及化学反应,错误。
考点:考查物理变化和化学变化的识别。
2.下图有关硫元素循环说法不合理...的是A.煤、石油中的硫元素燃烧时能生成SO2B.动物尸体腐败过程产生的H2S气体会进入大气C.循环过程中硫元素既发生氧化反应又发生还原反应D.大气中的硫元素会全部转化成H2SO4随雨水降到土壤里【答案】D【解析】试题分析:A、煤、石油中的硫元素燃烧时能生成SO2,正确;B、动物尸体腐败过程产生的H2S 气体会进入大气,正确;C、循环过程中硫元素既发生氧化反应又发生还原反应,正确;D、大气中的硫元素部分转化成亚硫酸,进一步转化为H2SO4随雨水降到土壤里,错误。
考点:考查硫的转化。
3.下列比较不能..用元素周期律解释的是A.稳定性:HI﹤HBr﹤HCl﹤HFB.元素非金属性:Si﹤P﹤S﹤ClC.沸点:正丁烷>异丁烷>丙烷D.碱性:NaOH >Mg(OH)2>Al(OH)3【答案】C【解析】试题分析:A、同主族元素由上到下元素的非金属性逐渐减弱,气态氢化物的稳定性逐渐减弱,则稳定性:HI﹤HBr﹤HCl﹤HF能用元素周期律解释,错误;B、同周期元素由左向右元素的非金属性逐渐减弱,则元素非金属性:Si﹤P﹤S﹤Cl能用元素周期律解释,错误;C、沸点:正丁烷>异丁烷>丙烷不能用元素周期律解释,正确;D、同周期元素由左向右元素的金属性逐渐减弱,最高价氧化物水化物的碱性逐渐减弱,则碱性:NaOH >Mg(OH)2>Al(OH)3能用元素周期律解释,错误。
-朝阳区高三上学期期末统一考试化学试卷及答案

北京市朝阳区2016~2017学年度高三年级第一学期期末统一考试化学试卷(满分:100分考试时间:90分钟) 2017.1可能用到的相对原子质量:H 1 C 12 O16 Cu 64第一部分(选择题共42分)每小题只有一个选项符合题意,每小题3分,共14道小题,共42分1.下列金属防护的方法中,应用了牺牲阳极的阴极保护法的是A. B. C. D.工具转动部位涂油脂钢铁船身嵌入锌车圈、车铃钢上镀铬健身器材刷油漆2.水中污染物不同,所采取的处理方法不同。
下列处理方法不正确...的是A.含Hg2+的废水——加入Na2S等沉淀剂B.钢铁厂的酸性废水——加入熟石灰等进行中和C.餐饮业厨房含油污水——加工为生物柴油进行利用D.被细菌、病毒污染的饮用水——加入明矾等进行消毒3.下列说法中,正确的是A.用灼烧的方法可以区分蚕丝和人造纤维B.鸡蛋清遇醋酸铅后产生的沉淀能重新溶于水C.麦芽糖水解生成互为同分异构体的葡萄糖和果糖D.α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,只生成2种二肽4.氯碱工业中电解饱和食盐水的原理示意图如右图所示(电极均为石墨电极)。
下列说法正确的是A.M为电子流出的一极B.通电使氯化钠发生电离C.电解一段时间后,阴极区pH降低D.电解时用盐酸调节阳极区的pH在2~3,有利于气体逸出5.工业上以铝土矿(主要成分Al2O3·3H2O)为原料生产铝,主要包括下列过程:ⅰ.将粉碎、筛选、湿磨后的铝土矿浸泡在氢氧化钠溶液中,过滤;ⅱ.通入过量二氧化碳使ⅰ所得滤液中析出氢氧化铝固体,过滤;ⅲ.使ⅱ中所得氢氧化铝脱水生成氧化铝;ⅳ.电解熔融氧化铝生成铝。
下列说法正确的是A.过程ⅰ说明氧化铝具有酸性氧化物的性质B.过程ⅱ说明碳酸的酸性比氢氧化铝的酸性弱C.过程ⅲ发生的反应类型属于氧化还原反应D.过程ⅳ也可以用加热法代替电解法冶炼铝6.根据元素周期律,由下列事实进行归纳推测,推测不合理...的是选项事实推测A. Na与冷水反应剧烈,K与冷水反应更剧烈Li与冷水反应缓慢B. 20Ca(OH)2碱性强于12Mg(OH)238Sr(OH)2碱性强于20Ca(OH)2C.Si是半导体材料,同主族的Ge也是半导体材料第ⅣA元素形成的单质都是半导体材料D. F2与H2在暗处剧烈化合,Cl2与H2光照或点燃时反应Br2与H2反应需要加热到一定温度7.某学习小组按如下实验过程(固定、加热及盛接仪器略)证明了海带中存在碘元素:下列说法不正确...的是A.步骤①需要将干海带放入坩埚中灼烧B.步骤②反应的离子方程式为:2I-+ 2H++H2O2=I2+2H2OC.步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素D.若步骤②仅滴加稀硫酸后放置一会儿,步骤③操作后,试管中溶液颜色无明显变化8.下列解释事实的反应方程式不正确...的是A.铜和浓硝酸反应生成红棕色气体:Cu +4H+ + 2NO3-=Cu2++ 2NO2↑+ 2H2OB.向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-===CaCO3↓+ CO32-+2H2O C.向漂白液中加入适量洁厕灵(含盐酸),产生氯气:ClO-+ Cl-+2H+===Cl2↑+ H2OD. 向澄清的苯酚钠溶液中通入CO2,变浑浊:9.下图是某种酶生物燃料电池的工作原理示意图。
2011年北京市朝阳区高三一模试题 化学部分

2011年北京市朝阳区高三一模试题 化学部分6.下列关于水处理的方法不正确...的是 A .向水中通入O 3,用以杀菌消毒 B .向酸性废水中加入生石灰,将其中和 C .向废水中加入Na 2CO 3,可将细小悬浮物凝聚 D .向废水中加入Na 2S ,可将其中的 Cu 2+、Hg 2+沉淀7.X 、Y 、Z 、W 均为短周期元素,在周期表中位置如图所示。
Y 原子的最外层电子数是电子层数的3倍。
下列说法中不.正确..的是 A .Y 、Z 的气态氢化物,前者更稳定B .Z 、W 的最高价氧化物对应水化物的酸性,前者强C .X 、W 的气态氢化物相互反应,生成物中既含离子键又含共价键D .Y 、W 的单质,均可通过电解的方法获得8.右图是探究铁发生腐蚀的装置图。
发现开始时U 型管左端红墨水水柱下降,一段时间后U 型管左端红墨水水柱又上升。
下列说法不正确...的是 A .开始时发生的是析氢腐蚀 B .一段时间后发生的是吸氧腐蚀C .两种腐蚀负极的电极反应均为:Fe - 2e - == Fe 2+D .析氢腐蚀的总反应为:2Fe + O 2 + 2H 2O == 2Fe(OH)29.双酚A 是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大。
下列有关双酚A 的叙述不正确...的是A .双酚A 的分子式是C 15H 16O 2B .双酚A 的核磁共振氢谱显示氢原子数之比是1:2:2:3C .反应①中,1 mol 双酚A 最多消耗2 mol Br 2D .反应②的产物中只有一种官能团HO C —OHCHCH 3饱和Br 2水 ②①足量H 2/Ni Δ双酚A红墨水pH=3的雨水浸 泡过的 铁钉10.下列解释过程或事实的方程式不.正确..的是A.熔融烧碱时,不能使用普通石英坩埚:SiO2 + 2NaOH △Na2SiO3 + H2OB.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I- + H2O2 + 2H+ == I2 + O2↑+ 2H2OC.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe + 4H2O △Fe3O4 + 4H2D.“84消毒液” (有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+Cl-+2H+== Cl2↑+H2O11下列说法正确的是A.由水电离出的c(H+):①>③B.③稀释到原来的100倍后,pH与④相同C.①与③混合,若溶液pH = 7,则V(NaOH)>V(CH3COOH)D.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)12.已知:2CH3OH(g) CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol某温度下的平衡常数为400。
011届上学期高三期末化学(附答案)

北京市石景山区2010—2011学年第一学期期末考试试卷 高三化学可能用到的相对原子质量:H —1 C —12 O —16 一、选择题(本题共20个小题,每小题2分,共40分)在每个小题给出的四个备选答案中,只有一个符合题目的要求。
1.化学与科学、技术、社会、环境密切相关,下列做法中不正确的是 A .回收废旧电池,主要目的是回收其中的金属B .减少燃煤使用,改用风能、太阳能等能源,符合“低碳生活”的理念C .在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质D .用浸泡过高锰酸钾溶液的硅藻土吸收水果中的乙烯,可以实现水果保鲜的目的 2.下列化学用语错误的是A .NaCl 的电子式Na +Cl []- B .甲烷的结构式 C HH HHC .氨分子的结构式D .羟基电子式3.下列有关物质分类或归类正确的一组是 ①液氨、液氯、干冰、碘化银均为化合物 ②氢氟酸、盐酸、水玻璃、氨水均为混合物 ③明矾、小苏打、醋酸、次氯酸均为电解质 ④碘酒、牛奶、豆浆、漂粉精均为胶体⑤Na2O2、Na2CO3、NaHCO3、Na2SiO3均为钠盐 A .①和② B .②和③ C .③和④ D .②③⑤ 4.已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H=+74.9kJ·mol —1,下列说法中正确的是 A .该反应中熵变、焓变皆大于0 B .该反应是吸热反应,因此一定不能自发进行 C .碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 D .能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应5.天然纤维的吸湿性优于合成纤维,合成纤维中吸湿性较好的是 A .聚酰胺纤维(锦纶) B .聚酯纤维(涤纶) C .聚乙烯醇纤维(维纶) D .聚丙烯纤维(丙纶)6.人体血红蛋白中应含Fe2+,若食用亚硝酸盐,则导致血红蛋白中的Fe2+转化为高铁血红蛋白而中毒。
北京市朝阳区高三一模化学试卷含答案

北京市朝阳区高三年级第一次综合练习理科综合测试化学部分2016.4.1 6.中国传统文化对人类文明贡献巨大,古化文献中充分记载了古代化学研究成果.下列关于KNO3的古代文献,对其说明不合理的是()7. N2(g)与H2(g)在铁催化剂表面经历如下过程生成NH3 (g):下列说法正确的是()A.Ⅰ中破坏的均为极性键B.Ⅳ中NH2 与H2 生成NH3C.Ⅱ、Ⅲ、Ⅳ均为放热过程D.8.下列检测方法不合理的是()9.某厂用Na 除掉苯中的水分。
某次生产误将甲苯当做苯投进反应釜中,由于甲苯中含水量少,最后反应釜还残留大量的Na 。
下列处理方法更合理、更安全的是()A.打开反应釜,将Na 暴露在空气中与氧气反应B.向反应釜通入Cl2 , Na 在Cl2 中燃烧生成NaClC.向反应釜加大量H2 O,通过化学反应“除掉”金属钠D.向反应釜滴加C2 H5 OH,并设置放气管,排出氢气和热量10.《常用危险化学用品贮存通则》规定:“遇火、遇热、遇潮能引起燃烧、爆炸或发生化学反应,产生有毒气体的化学危险品不得在露天或在潮湿、积水的建筑物中贮存”。
下列解释事实的方程式中,不合理的是()A.贮存液氮的钢瓶防止阳光直射:B.硝酸铵遇热爆炸:C.干燥的 AlCl3遇水产生气体:D.火灾现场存有电石,禁用水灭火:11.下列“试剂”和“试管中的物质”不能完成“实验目的”的是()12.某同学做如下实验:下列说法正确的是()A.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀B.用溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极C.铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,二者的腐蚀速率相等D.铁片Ⅳ的电极反应式为25.(17 分)有机物A 为缓释阿司匹林的主要成分。
用于内燃机润滑油的有机物Y 和用于制备水凝胶的聚合物P 的合成路线如下。
已知:(1)D 的分子式为C7H6O3,D 中所含的官能团是。
(2)D→Y的化学方程式是。
(3)反应Ⅰ的另一种产物是M ,其相对分子质量是60,B 、M 均能与NaHCO3反应产生 CO2。
2011届北京市朝阳区高三第一学期期末统一考试(化学)答案

北京市朝阳区2010-2011学年度高三年级第一学期期末每小题只有一个选项符合题意。
1~12小题每小题2分,13~18小题每小题3分,共42分。
[来源:学科网]第Ⅱ卷(非选择题共58分)19.(7分)(1)(2)b(3)NH3+H2O NH3·H2O NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小有白色沉淀生成Al3++3NH3·H2O =Al(OH)3↓+3NH4+(4)+320.(9分)(1)增大(2)c(CO2)〃c(H2)/ c(CO) 〃c(H2O) >(3)0.0075 mol/(L·min)减少 6.15(4)CO(g)+ 1/2 O2(g) = CO2(g) ΔH =-283 kJ/mol21.(8分)(1)①② HCO3-+OH-=H2O+CO32-③ 2NaCl+2H2O电解2NaOH+H2↑+Cl2↑3Cl2 + 6OH-+ I-=6Cl-+ IO3-+ 3H2O(2)① Cl2 +2Fe2+=2Cl-+2Fe3+[来源:学科网]② Fe3++3H2O Fe(OH)3+3H+酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体22.(8分)(1)浓硫酸具有强化性,在铁表面生成一层致密的氧化膜(2)①提供水蒸气3Fe + 4H2O(g)△ Fe3O4 + 4H2② b(3)①2Fe + 6H2SO4(浓)△ Fe2(SO4)3 + 3SO2↑+ 6H2O② C + 2H2SO4(浓)△ CO2↑+ 2SO2↑+ 2H2O③ 66.7%23.(10分)(1)Cu2++2H2O Cu(OH)2+2H+ ΔH>0,加热促进了Cu2+水解,生成了更多的难溶物Cu(OH)2H2SO4(2)① ZnSO 4Cu 2++2e -=Cu② O 2CH 4-8e -+10OH -=CO 32-+7H 2O(3)1︰324.(16分)(1)碳碳双键 羟基(2)消去反应 加聚反应(3)C H 2C HB rC H 3B r++22N aOC H 2O HC H C H 3O HN aB r(4)BrCH 2CH 2CH 2OH(5)(6)[++2C HO H C H 2H OC H 3C H 2CC O O HC H 3P O HH OO HO C H 2CC C H 3OO C H 2C H OC H 3P O O H O H+H 2O一定条件05-06学年度第二学期高一化学期末考试试题卷可能用到的相对原子质量:H—1;C—12;O—16;N—14;S—32;Si—28;Na—23;Mg—24;Al—27;Fe—56;Cu—64;Ag—108。
北京市朝阳区2007~2008学年度高三年级第一学期期末统一考试化学试题

北京市朝阳区2007~2008学年度高三年级第一学期期末统一考试化学试题2008.1(考试时间100分钟:满分100分)成绩注意事项:(1)请将学校、班级、姓名用钢笔或圆珠笔写在密封线内。
(2)请将选择题答案填写在答题卡上,必须用钢笔或圆珠笔做答。
第Ⅰ卷(机读卷,共48分)可能用到的相对原子质量H 1 C 12 N 14 O 16 S 321.下列方法不会对环境造成污染的是A.继续使用氯氟代烷作空调制冷剂B.用焚烧的方法来处理白色垃圾C.用煤代替日渐短缺的石油作燃料D.用氢氧燃料电池来驱动汽车2.下列各组分子均属于非极性分子的是① H2O ② CO2③ HCl ④CCl4⑤ NH3 ⑥ CO ⑦ CH4⑧HClOA.①④⑧B.②③⑥C.②④⑦D. ④⑤⑧3.已知溶解结晶平衡状态是一种动态平衡状态。
在一定温度时,往500 mL硫酸铜饱和溶液中加入一定量硫酸铜晶体(CuSO4·5H2O ),下列说法错误的是A. 溶液中溶质的质量分数不变B.溶液中溶质的物质的量浓度增大C.溶液的质量也不改变D. 溶液还是饱和溶液4.25℃时,在由水电离出来的c(H+)= 1×10-13mol / L的溶液中一定能大量存的离子是A. CO32-B. Al3+C. HCO3-D. NO3-5.在钢铁生锈的过程中有很多化学变化,下列变化不属于钢铁生锈过程的是A. 4OH- -4e- = 2H2O + O2↑B. Fe -2e- = Fe2+C. 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3D. 2H2O + O2 + 4e-= 4OH-6.下列叙述错误的是A. 胶体粒子的直径在1 ~ 100 nm 之间B. 氢氧化铁胶体带电C. 可用渗析的方法分离淀粉和氯化钠的混合溶液D. 配制氢氧化铁胶体时,可将FeCl3溶液滴入沸水中7. 下列离子方程式正确的是A. 碳酸氢钙溶液中加入少量的氢氧化钠溶液Ca2+ + 2HCO3- + 2OH- = CaCO3↓ + CO32- + 2H2OB. 将铜粉放入稀硝酸中Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑+ 2H2OC.将少量的钠放入氢氧化钠溶液中2Na + 2H2O = 2Na+ + 2OH- + H2↑D. 氯化铝溶液中加入过量的氨水Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O8.电子表所用的某种纽扣电池的电极材料为Zn和Ag2O,电解质溶液是KOH。
高中高考-朝阳外国语学校2010-2011学年度第一学期期末考试试卷答案-2011.1
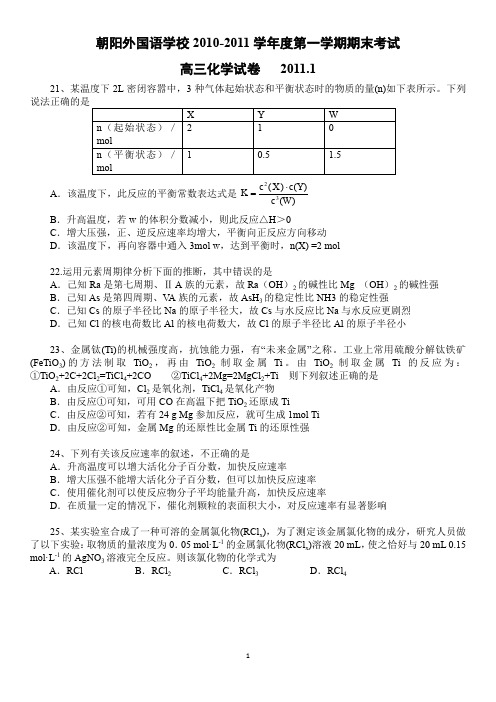
朝阳外国语学校2010-2011学年度第一学期期末考试高三化学试卷2011.121、某温度下2L密闭容嚣中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。
下列A.该温度下,此反应的平衡常数表达式是23()()()c X c Y Kc W⋅=B.升高温度,若w的体积分数减小,则此反应△H>0C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动D.该温度下,再向容器中通入3mol w,达到平衡时,n(X) =2 mol22.运用元素周期律分析下面的推断,其中错误的是A.己知Ra是第七周期、Ⅱ A族的元素,故Ra(OH)2的碱性比Mg (OH)2的碱性强B.己知As是第四周期、V A族的元素,故AsH3的稳定性比NH3的稳定性强C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应比Na与水反应更剧烈D.己知Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小23、金属钛(Ti)的机械强度高,抗蚀能力强,有“未来金属”之称。
工业上常用硫酸分解钛铁矿(FeTiO3)的方法制取TiO2,再由TiO2制取金属Ti。
由TiO2制取金属Ti的反应为:①TiO2+2C+2Cl2=TiCl4+2CO ②TiCl4+2Mg=2MgCl2+Ti 则下列叙述正确的是A.由反应①可知,Cl2是氧化剂,TiCl4是氧化产物B.由反应①可知,可用CO在高温下把TiO2还原成TiC.由反应②可知,若有24 g Mg参加反应,就可生成1mol TiD.由反应②可知,金属Mg的还原性比金属Ti的还原性强24、下列有关该反应速率的叙述,不正确的是A.升高温度可以增大活化分子百分数,加快反应速率B.增大压强不能增大活化分子百分数,但可以加快反应速率C.使用催化剂可以使反应物分子平均能量升高,加快反应速率D.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响25、某实验室合成了一种可溶的金属氯化物(RCl x),为了测定该金属氯化物的成分,研究人员做了以下实验:取物质的量浓度为0.05 mol·L-1的金属氯化物(RCl x)溶液20 mL,使之恰好与20 mL 0.15 mol·L-1的AgNO3溶液完全反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京市朝阳区2010-2011学年度高三年级第一学期期末每小题只有一个选项符合题意。
1~12小题每小题2分,13~18小题每小题3分,共42分。
[来源:学科网]第Ⅱ卷(非选择题共58分)19.(7分)(1)(2)b(3)NH3+H2O NH3·H2O NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小有白色沉淀生成Al3++3NH3·H2O =Al(OH)3↓+3NH4+(4)+320.(9分)(1)增大(2)c(CO2)〃c(H2)/ c(CO) 〃c(H2O) >(3)0.0075 mol/(L·min)减少 6.15(4)CO(g)+ 1/2 O2(g) = CO2(g) ΔH =-283 kJ/mol21.(8分)(1)①② HCO3-+OH-=H2O+CO32-③ 2NaCl+2H2O电解2NaOH+H2↑+Cl2↑3Cl2 + 6OH-+ I-=6Cl-+ IO3-+ 3H2O(2)① Cl2 +2Fe2+=2Cl-+2Fe3+[来源:学科网]② Fe3++3H2O Fe(OH)3+3H+酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体22.(8分)(1)浓硫酸具有强化性,在铁表面生成一层致密的氧化膜(2)①提供水蒸气3Fe + 4H2O(g)△ Fe3O4 + 4H2② b(3)①2Fe + 6H2SO4(浓)△ Fe2(SO4)3 + 3SO2↑+ 6H2O② C + 2H2SO4(浓)△ CO2↑+ 2SO2↑+ 2H2O③ 66.7%23.(10分)(1)Cu2++2H2O Cu(OH)2+2H+ ΔH>0,加热促进了Cu2+水解,生成了更多的难溶物Cu(OH)2H2SO4(2)① ZnSO 4Cu 2++2e -=Cu② O 2CH 4-8e -+10OH -=CO 32-+7H 2O(3)1︰324.(16分)(1)碳碳双键 羟基(2)消去反应 加聚反应(3)C H 2C HB rC H 3B r++22N aOC H 2O HC H C H 3O HN aB r(4)BrCH 2CH 2CH 2OH(5)(6)[++2C HO H C H 2H OC H 3C H 2CC O O HC H 3P O HH OO HO C H 2CC C H 3OO C H 2C H OC H 3P O O H O H+H 2O一定条件05-06学年度第二学期高一化学期末考试试题卷可能用到的相对原子质量:H—1;C—12;O—16;N—14;S—32;Si—28;Na—23;Mg—24;Al—27;Fe—56;Cu—64;Ag—108。
一、选择题:(每题只有一个选项符合题意,每小题1分,共10分)1.“飘尘”是物质燃烧时产生的粒状飘浮物,颗粒很小(直径一般小于10-7m),不易沉降(可飘浮数小时甚至数年)。
它与空气中的SO2、O2等接触时,SO2会部分转化成SO3 ,使空气中的酸度增加。
在这种变化过程中,飘尘所起的主要作用是()A.氧化剂 B.还原剂 C.吸附剂 D.催化剂2.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是()A.57 B.47 C.61 D.2933. 某元素的原子最外层只有一个电子,它跟卤素相结合时,可形成的化学键()A.一定是共价键 B.一定是离子键C.可能是共价键,也可能是离子键 D.上述说法都不正确4.下列元素中,一定是属于主族元素的是()A.最外层电子数为2的元素 B.最高正价为+7价的元素C.常温下单质为液态的元素 D.能形成气态氢化物的非金属元素5. 下列排列顺序正确的是()A.粒子半径:Al3+> Mg2+> F-B.热稳定性:HI > HBr > HCl > HFC.酸性: H2SiO3< H3PO4< H2SO4< HClO4D.碱性: Al(OH)3> Mg(OH)2> NaOH6. 储存浓H2SO4的铁罐外口出现严重的腐蚀现象,这体现了浓硫酸的A. 吸水性和酸性B. 脱水性和吸水性C. 强氧化性和吸水性 D . 不挥发性和酸性7.下列说法不正确...的是()A.硫是一种淡黄色的不能溶于水的晶体B.铁与硫在加热条件下的反应产物为硫化亚铁C.硫与氧属于同一主族D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫8.由于碘是卤素中原子半径较大的元素,可能呈现一定的金属性。
下列事实最能够说明这个结论的是()A.已经制得IBr、ICl等卤素互化物 B.已经制得I2O5等碘的氧化物C.已经制得I (NO 3 ) 3 、I (ClO 4 ) 3•2H2O等含I3+ 离子化合物D.碘(I2)易溶于KI等碘化物溶液,形成I3—离子9. 下列说法正确的是A. 难失电子的原子,得电子的能力一定强B. 易得电子的原子,失电子的能力一定弱C. 电子层结构相同的单核离了,阳离子半径一定比阴离子半径大D. 任何原子的原子核都是由质子和中子构成的10.A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构。
已知A的原子序数大于B的原子序数。
则根据元素周期律可知:A、B、C三种原子半径大小的顺序是()A.A>B>C B.B>A>C C.C>A>B D.C >B>A二、选择题:(每题只有一个选项符合题意,每小题2分,共28分)11.下列电子式或结构示意图表示合理的是:()A.CO2 B.MgCl2 C.HCl D.S2〄12.将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一气体,则有沉淀。
则通入的气体不可能...是()A.CO2 B.NH3 C.SO3D.Cl213.A、B两主族元素属于同一周期,它们的原子能以共价键结合成化学式为AB2型分子,A、B元素在周期表中的族序数可能为()A.ⅠA、ⅤA B.ⅠA、ⅦA C.ⅣA、ⅥA D.ⅡA、ⅦA14.X和Y属短周期元素,Y原子的最外层电子数是次外层电子数的3倍,X位于Y的后一周期,且最外层电子数是次外层电子数的一半,则X和Y形成的化合物的化学式可表示为()A.XY B.XY2 C.XY3D.X2Y315.下列反应中,二氧化硫既不作氧化剂,又不作还原剂的是()A.2SO2 +O2 = 2 SO3 B.SO2 +2H2S = 3 S↓+2 H2OC.SO2+ NaOH = NaHSO3 D.SO2+Cl2+2 H2O = H2SO4 + 2 HCl16.向50 mL 18 mol〃L-1 H2SO4溶液中加入足量的铜片并加热。
充分反应后的溶液中,加入BaCl2溶液,则反应后生成的白色沉淀的物质的量()A.小于0.45 mol B.等于0.45 molC.在0.45 mol和0.90 mol之间D.大于0.90 mol17.下列离子方程式中错误..的是()A.铁跟稀硫酸反应: 2 Fe + 6H+ = 2 Fe3++3H2↑B.在硫酸钠溶液中加入过量Ba(OH)2溶液: Ba2+ + SO42〄 = BaSO4↓C.碳酸氢钠溶液跟少量的4mol〃L-1H2SO4:HCO3〄+ H + ═ H2CO3D.把盐酸滴在石灰石上:CaCO3+2 H + ═Ca2++H2O+CO2↑18. 已知元素X、Y的核电荷数分别是a和b,它们的离子X m + 和Y n - 的核外电子排布相同,则下列关系式正确的是()A.a =b+m+n B.a=b–m+n C.a=b+m–n D.a=b–m-n19.一定量的CuO粉末与适量的硫酸(已知其密度ρ = 1.7 g ٠cm - 3)在微热下充分反应,冷却后恰好全部形成硫酸铜晶体CuSO4٠5H2O(设反应过程中无.......水份损失....)。
则此硫酸溶液的物质的量浓度(mol〃L-1)为()A.8.5 mol〃L-1 B.10 mol〃L-1 C.17 mol〃L -1 D.18.4 mol〃L-120.下列叙述正确的是()A.常温下,浓硫酸不与铜反应,是因为铜被钝化B.可用铁罐来进行贮存、运输冷的浓硫酸C.SO3具有氧化性,SO2只有还原性D.SO2和Cl2的漂白原理相同21.高岭土的组成可表示为Al 2 Si 2 O x(OH)y ,其中x、y 的数值分别为:()A.7、2 B.5、4 C.6、3 D.3、622.在强酸性的溶液中含有大量的Ba2+、Cu2+,则溶液中还可大量含有的阴离子是()A.HCO3〄 B.SO42〄 C.Cl〄D.SO32〄23. 如果只限用一种试剂鉴别Na2CO3、K2S、Na2SiO3和Na2SO3四瓶溶液时,则可选用的试剂是()A. KOH溶液 B.稀盐酸 C.石蕊试液 D. AgNO3溶液24 锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗(Ge ,第ⅣA族)元素处于最高价态,铋元素(Bi ,第ⅤA族)的价态与它跟氯形成的某种共价氯化物所呈的价态相同,且此氯化物中铋具有8电子稳定结构。
则BGO的化学式是()A.Bi3Ge3O15 B.Bi4Ge3O12 C.Bi4Ge3O16 D.Bi3Ge3O12三、填空题(共35分)25.现有A、B、C三种短周期元素,其在周期表中的位臵关系如图所示。
它们原子的最外层电子数之和为20。
写出它们的元素符号:A__________、B__________、C__________。
26(6分)(1)浓H2SO4能够用于干燥某些气体,是由于它具有性;如:下列气体能用浓硫酸来进行干燥的气体是(可多选,但只要有选错项,即得0分)① Cl2② H2S ③ NH3④ CO2(2)浓H2SO4能使纸片变黑,是由于它具有性;(3)浓H2SO4可以与Cu反应,是由于它具有性和酸性,其反应的化学方程式是:。
27、(9分)已知:氢氧化钙在水中存在下列溶解平衡Ca(OH)2 (s) Ca2+ (aq)+ 2 OH〄(aq)(1)、在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2 等,为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气。
由于H2SO3的酸性比H2CO3强,故H2SO3可以和CaCO3发生复分解反应生成CaSO3和CO2,CaSO3易被空气中的O2氧化为石膏(CaSO4•2H2O)。
SO2与Ca(OH)2的反应也是先生成CaSO3 ,而CaSO3又易被空气中的氧气氧化为石膏(CaSO4•2H2O)。
请写出上述二氧化硫与熟石灰的悬浊液反应的两个化学方程式:①。
②。
(2)、试说明用熟石灰的悬浊液,而不用澄清石灰水洗涤废气的理由:。
