吲哚的合成
一些常用的吲哚环合成方法

6
构;
1930年:由于在很多生物碱(如色氨酸、植物生长
7
素等)中发现吲哚结构,吲哚成为医药领域的重要
研究课题。(在此之前,吲哚类化合物一直被用来
作为染料)
基本化学性质: 1.稳定能略低于萘,但高于苯; 2.微弱的碱性:质子化的吲哚pKa=-2.4 3.极易被氧化(但环较稳定) 4.碳环不易发生官能化反应 5.C3位最容易发生亲电反应,其次是C2位 6.N1位最易发生亲核反应
2020/10/12 13
Confidential
3.各原料的投料顺序对收率无影响。
2020/10/12 7
Confidential
三、Fischer吲哚合成法
反应条件: HCl, H2SO4, PPA, BF3/AcOH, ZnCl2, FeCl3, AlCl3,CoCl2, NiCl2, TsOH 通常需加热
特点:通常只适合于合成C2或C3位有取代基的吲哚 优点:高底物容忍性;原料成本低廉 缺点:当不对称酮参与反应时,区域选择性不佳(与酸、温度、溶剂相关)
2020/10/12 12
Confidential
六、Larock吲哚合成法
反应条件: 底物一般为邻碘苯胺(N上有取代基为佳);碱一般为碳酸钾或碳酸 钠;配体一般为三苯基膦;卤源一般为氯化锂或TBAC 特点:可以合成N1、C2、C3均取代或不取代的吲哚 优点:一步到位,条件较温和 缺点:底物和催化剂都昂贵 反应机理:
2020/10/12 2
Confidential
3 2
1
可能的合成路线分析
2020/10/12 3
Confidential
较有名的合成方法
2020/10/12 4
Confidential
5 吲哚的合成解析
A. J. Peat and S. L. Buchwald, J. Am. Chem. Soc., 1996, 118, 1028.
K. Aoki, A. J. Peat and S. L. Buchwald, J. Am. Chem. Soc., 1998, 120, 3068.
2. Bartoli吲哚合成
4.Reissert吲哚合成
从邻硝基甲苯和草酸二乙酯合成吲哚及其衍生物。
用乙醇钾的反应效果较乙醇钠为好。 反应机理
首先邻硝基甲苯与草酸二乙酯反应生成邻硝基苯基丙酮酸乙酯,接下来用锌乙酸处理该产物,使之发生还原环化,得吲哚-2-羧酸。吲哚-2-羧酸还可脱羧产 生无取代的吲哚。
5.Bischler-Mohlau Indole Synthesis
三分子格氏试剂的作用:一 分子在第二步被消除,最终转化 为羰基化合物(6);一分子与氮上 的氢发生交换,生成烯烃 (11); 一分子成为吲哚环的C-2和C-3。
反应中的亚硝基芳烃中间体 (4)可以分离出来。它与两分子格 氏试剂反应,也可得到吲哚,说明它是反应的中间体。
Dobbs改进法
Adrian Dobbs 用邻位的溴作定位基成环,反应后再用偶氮二异丁腈和三丁 基锡烷将溴除去,生成 7-位无取代基的吲哚。
3.Leimgruber-Batcho吲哚合成
首先邻硝基甲苯与N,N-二甲基甲酰胺二甲缩醛和吡咯烷反应得到烯胺(2),然 后烯胺再发生还原环化,得到吲哚衍生物。
除上述提到的雷尼镍和肼外,钯碳加氢、氯化亚锡、连二亚硫酸钠以及铁-乙酸 都可用作还原一步的试剂。
反应机理
首先二甲基甲酰胺二甲缩醛受到吡咯烷的亲核进攻,二甲胺离去,产生一个活 性更强的试剂。它受到邻硝基甲苯甲基氢去质子化形成的碳负离子的进攻,失去甲 醇,得到上述烯胺。反应的此一步也可在无吡咯烷的条件下进行,这时反应经过 N,N-二甲基烯胺中间体,不过所需反应时间通常较长。这一步的产物烯胺类似于一 种分别在两侧连有吸电子和供电子取代基的烯烃,极性较强,而且常因分子中较大 的共轭范围而呈深红色。
吲哚类化合物的合成及其相关问题研究

吲哚类化合物的合成及其相关问题研究最近,吲哚类化合物在化学研究领域受到了越来越多的关注,成为了化学学术研究的热点。
吲哚类化合物是化学领域的重要研究对象,它具有特殊的光谱特性和高分子特性,在多个领域都有着广泛的应用,包括电子材料、涂料、高分子材料、药物、生物学、能源、光学领域等。
本文将从吲哚类化合物的结构、合成及其相关问题等几个方面入手,深入分析吲哚类化合物的合成原理、结构特点以及合成方法。
吲哚类化合物是一类具有共流体性质的化合物,包括吲哚类醇、酸、醚、酯等。
它们具有芳香性、稳定性强、密度小、折射率较低等特点。
这些特性使它们在众多领域都得到广泛应用,从几十年前就已经开始研究。
首先,吲哚类化合物的合成原理首先要从其结构出发。
一般来说,吲哚类化合物包含一个或多个二氧基芳烃分子,它们具有芳香性、热稳定性和密度小的特点。
并且,它们的折射率相对较低,使它们具有较低的自由能,因此具有较好的反应性,有利于其在各种应用领域得到广泛使用。
常用的合成方法有有机合成和全氟化合成,其中有机合成是指由二氧基芳烃一步合成,全氟化合成是指由三氟氯甲烷和芳烃经历氟离子芳环形成吲哚类化合物。
其次,合成的吲哚类化合物除了具有芳香性外,还具有一些特殊的结构特征。
例如,它们具有芳香环,芳香环是指相邻原子重新排列,形成了一个特殊的环状结构。
这种结构特征使它们有较高的热稳定性,具有与液态的稳定性更好的特征,使它们可以在多种应用领域得到广泛应用。
最后,介绍合成吲哚类化合物的一些方法。
目前,采用有机合成和全氟化合成等方法,可以获得较好的合成效果,其中有机合成可以获得高纯度的产物,而全氟化合成可以获得结构更丰富的产物。
此外,还可以采用热解法、聚合反应、光聚合反应等方法进行合成,但这些方法往往会产生低纯度的产物。
综上所述,吲哚类化合物是有机化学的重要研究对象,它们具有特殊的光谱特性和高分子特性,有着广泛的应用,包括电子材料、涂料、高分子材料、药物、生物学、能源、光学领域等。
吲哚的合成-060117

经典化学合成反应标准操作吲哚的合成目录2. Fischer 吲哚合成 (2)2.1 Fischer 吲哚合成反应示例 (2)3. 从硝基苯的衍生物出发合成吲哚 (3)3.1 邻甲基硝基苯衍生物合成吲哚 (4)3.1.1 邻甲基硝基苯衍生物合成吲哚示例 (4)3.2 邻甲酰基硝基苯衍生物合成吲哚 (4)3.1.2 邻甲酰基硝基苯衍生物合成吲哚示例 (5)3.3 邻氰甲酰基硝基苯衍生物合成吲哚示例 (5)3.4 邻乙烯基硝基苯衍生物合成吲哚示例 (6)3.5 邻位有氢的硝基苯衍生物直接用乙烯格氏试剂合成吲哚(Bartoli反应)示例74. 从苯胺的衍生物出发合成吲哚 (7)4.1苯胺经佛克烷基化再还原关环合成吲哚 (7)4.2 N-羟基苯胺DMAP催化下与丙炔酸酯缩合合成3-羧酸吲哚衍生物 (9)4.3 Nenitzescu吲哚合成 (9)5. 2-叠氮基-3-芳基丙烯酸酯环合合成2-羧酸吲哚衍生物 (10)5.1 2-叠氮基-3-芳基丙烯酸酯环合合成2-羧酸吲哚衍生物示例 (11)1. Introduction吲哚及其衍生物是一类非常有效的药物中间体。
已有不少相关综述报道其合成方法1。
我们将一些常用的合成方法简单的列举了出来,供大家在合成此类化合物的时候参考。
1 (a) G. W. Gribble, Contemp. Org. Synth., 1994, 145. (b) U. Pindur and R. Adam, J. Heterocycl. Chem., 1988, 25, 1. (c) C. J. Moody, Synlett , 1994, 681. (d) R. J. Sundberg, Indoles , Academic Press, San Diego, CA, 1996. (e) T. L. Gilchrist , J. Chem. Soc., Perkin Trans. 1, 1999, 2849. (f) G. W. Gribble, J. Chem. Soc ., Perkin Trans. 1, 2000, 1045.2. Fischer 吲哚合成Fischer 吲哚合成法是一个常见的吲哚合成方法。
吲哚的合成ppt课件

醛/酮必须是RCOCH2R'类型的,R/R'为烷基、芳基或氢。若醛酮的羰基有两个 α-氢,则反应后一般得到两种产物的混合物。
苯肼中的亚氨基氮原子(>NH)在反应后转化为吲哚环中的氮,这一点已经得 到同位素示踪实验的证实。
盐酸、硫酸、多聚磷酸、对甲苯磺酸等质子酸及氯化锌、氯化铁、氯化铝、 三氟化硼等路易斯酸是反应最常用的酸催化剂。若要制取没有取代的吲哚,可以 用丙酮酸作酮,发生环化后生成2-吲哚甲酸,再经脱羧即可。
Reaction mechanism 首先是醛酮与苯肼在酸催化下缩合生成苯腙,苯腙不需分离立即在酸催化下异
4.Reissert吲哚合成
从邻硝基甲苯和草酸二乙酯合成吲哚及其衍生物。
用乙醇钾的反应效果较乙醇钠为好。 反应机理
首先邻硝基甲苯与草酸二乙酯反应生成邻硝基苯基丙酮酸乙酯,接下来用锌乙酸处理该产物,使之发生还原环化,得吲哚-2-羧酸。吲哚-2-羧酸还可脱羧产 生无取代的吲哚。
5.Bischler-Mohlau Indole Synthesis
吲哚的合成reactionmechanism首先是醛酮与苯肼在酸催化下缩合生成苯腙苯腙不需分离立即在酸催化下异构化为烯胺并发生一个33迁移反应生成二亚胺
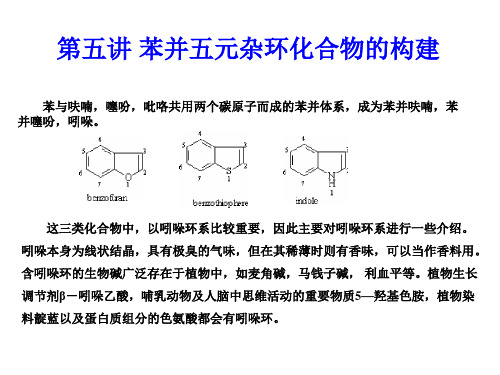
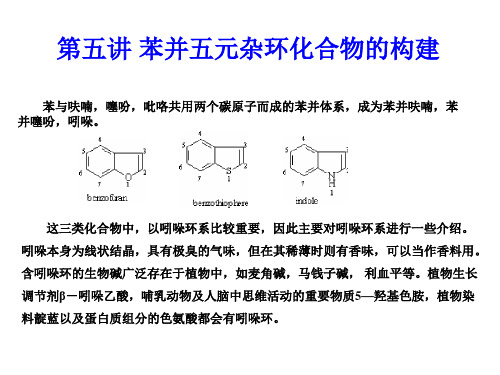
第五讲 苯并五元杂环化合物的构建
苯与呋喃,噻吩,吡咯共用两个碳原子而成的苯并体系,成为苯并呋喃,苯 并噻吩,吲哚。
这三类化合物中,以吲哚环系比较重要,因此主要对吲哚环系进行一些介绍。 吲哚本身为线状结晶,具有极臭的气味,但在其稀薄时则有香味,可以当作香料用。 含吲哚环的生物碱广泛存在于植物中,如麦角碱,马钱子碱, 利血平等。植物生长 调节剂β-吲哚乙酸,哺乳动物及人脑中思维活动的重要物质5—羟基色胺,植物染 料靛蓝以及蛋白质组分的色氨酸都会有吲哚环。
常见吲哚合成反应汇总

常见吲哚合成反应汇总旧文重发,温故知新一、2-叠氮基-3-芳基丙烯酸酯环合合成2-羧酸吲哚衍生物通过叠氮基乙酸酯与芳香醛缩合可以得到 2-叠氮基-3-芳基丙烯酸酯,其加热环合生成吲哚2-羧酸酯衍生物,一般而言只有富电子的芳环(带推电子苯环,呋喃,噻吩,吡咯)可通过该方法环合。
由于反应放出氮气,在环合时一定要严格控制2-叠氮基-3-芳基丙烯酸酯滴加速度及反应瓶敞口,否则很容易喷发出来。
(Hemetsberger indole synthesis)二、Bartoli吲哚合成反应1989年,意大利化学家G. Bartoli等人报道了取代硝基苯和过量的格氏试剂在低温下反应,然后在水溶液中后处理得到取代吲哚,邻取代的硝基苯产率很高。
由邻取代的硝基苯(或亚硝基苯)和烯基格氏试剂制备7-取代吲哚的反应被称为Bartoli吲哚合成法。
在这反应被开发之前,其实有很多用于合成吲哚骨架的类似反应,如Leimgruber-Batcho吲哚合成,在这些反应中,确唯独没有一种能够合成7位取代吲哚的反应,此反应是制备 7-取代吲哚的较好方法。
Bartoli 吲哚合成的优点在于这个反应可以在碳环和杂环上都引入取代基。
三、Batcho–Leimgruber吲哚合成反应邻硝基甲苯类化合物和甲酰胺缩醛(如DMFDMA)缩合得到trans-β-二烷基胺基-2-硝基苯乙烯,接着还原得到吲哚类化合物的反应。
此反应原料邻硝基甲苯(衍生物)易得,反应条件温和,产率较高,因此常用作Fischer吲哚合成的替代方法。
还原方法一般通过加氢,但当分子内有敏感官能团(比如:Br,I都可或烯烃等)存在时可通过化学还原如:NH2NH2-RaneyNi, 铁粉,TiCl3, 锌粉还原得到吲哚。
四、Bischler–Möhlau吲哚合成反应α-芳胺基酮和过量的芳香胺环化得到2-芳基吲哚的反应。
五、Cadogan–Sundberg吲哚合成Cadogan反应是指邻硝基苯乙烯1或邻硝基芪类化合物和亚磷酸三酯或三烷基膦反应生成氮宾2,接着环化生成吲哚3的反应。
吲哚合成方法

吲哚一词来源于印度的英文单词(India ):在十六世纪从印度进口的蓝色染料被称作靛篮。
将此染料化学降解可得到氧化的吲哚-吲哚酚和羟基吲哚。
吲哚在1866年通过在锌粉作用下蒸馏羟基吲哚第一次被制备出来。
吲哚可能是自然界中分布最广的杂环化合物。
色氨酸是必需的氨基酸,也是大多数蛋白质的组成部分。
它还可作为各种色胺、吲哚和2,3-二氢吲哚的生物合成前体。
2N H NH 2在动物中,存在于血液中的5-羟基色胺(5-HT )是中枢神经系统中非常重要的神经递质,在心血管和胃肠道中也起很大作用。
结构类似的激素褪黑素被认为能控制生理功能的昼夜节律。
NNH 2OH N H NHAcCH 3O植物王国中色胺酸衍生物包括3-吲哚基乙酸,它是一种有效的植物生长调节激素;以及大量不同结构的二级代谢产物-吲哚类生物碱,这一类化合物由于其有效的生理活性被广泛作为药物使用。
吲哚的结构单元也大量出现在许多人工合成的药物中,如具有消炎镇痛作用的环氧酶抑制剂吲哚美辛,止吐作用的5-HT 3受体拮抗剂昂丹司琼等。
NCH 3CH 3OOClCOOHNHON NMe由于吲哚在天然产物全合成和药物合成中的重要性,有机合成领域不断有大量关于吲哚环的全新合成方法和改进方法出现,已经形成了一个相当系统的合成框架,以下是一些目前可行的最重要的合成方法及示例。
1.通过醛和酮的苯腙的制备方法 (1) Fischer 合成法Fischer吲哚合成法发明于1883年,利用苯腙在酸或Lewis酸催化下通过重排反应,亲核关环,再消除氨而形成吲哚环N H NCH3NHPh1事实上,有时将醛或酮与苯肼在乙酸中一起加热即可发生“一锅煮”的反应2,生成的苯腙可不经分离直接发生重排反应。
甲基苯磺酸、阳离子交换树脂及三氯化磷都可有效地催化环化反应,有时在室温或更低的温度下反应也可进行3。
苯环上的供电基能提高Fischer环化反应的速率,而吸电基则降低反应速率。
但带有硝基的苯腙在合适的酸和反应条件下也可较好地发生反应,如甲苯与多聚磷酸的两相混合物4或三氟化硼的乙酸溶液5。
5 吲哚的合成
The reaction mechanism is divided among three steps. The first step is the oxidation of the aniline 1 using (t-BuOCl) to give the chloramine 2. The second step is the addition of the ketone to give the sulfonium ion 3, and is typically done at low temperatures (-78 °C). The third and final step is the addition of a base, which in this case is triethylamine. Upon warming to room temperature, the base will deprotonate the sulfonium ion creating the sulfonium ylide 4, which quickly undergoes a [2,3]-sigmatropic rearrangement to give the ketone 5. The ketone 5 will undergo a facile condensation to give the desired 3thiomethylindole 6.
Buchwald改进法 芳基溴化物在钯和BINAP催化下也可以与腙反应生成吲哚环,这个方法称为
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
经典化学合成反应标准操作吲哚的合成目录2. Fischer 吲哚合成 (1)2.1 Fischer 吲哚合成反应示例 (1)3. 从硝基苯的衍生物出发合成吲哚 (2)3.1 邻甲基硝基苯衍生物合成吲哚 (3)3.1.1 邻甲基硝基苯衍生物合成吲哚示例 (3)3.2 邻甲酰基硝基苯衍生物合成吲哚 (3)3.1.2 邻甲酰基硝基苯衍生物合成吲哚示例 (4)3.3 邻氰甲酰基硝基苯衍生物合成吲哚示例 (4)3.4 邻乙烯基硝基苯衍生物合成吲哚示例 (5)3.5 邻位有氢的硝基苯衍生物直接用乙烯格氏试剂合成吲哚(Bartoli反应)示例64. 从苯胺的衍生物出发合成吲哚 (6)4.1苯胺经佛克烷基化再还原关环合成吲哚 (6)4.2 N-羟基苯胺DMAP催化下与丙炔酸酯缩合合成3-羧酸吲哚衍生物 (8)4.3 Nenitzescu吲哚合成 (8)5. 2-叠氮基-3-芳基丙烯酸酯环合合成2-羧酸吲哚衍生物 (9)5.1 2-叠氮基-3-芳基丙烯酸酯环合合成2-羧酸吲哚衍生物示例 (10)1. Introduction吲哚及其衍生物是一类非常有效的药物中间体。
已有不少相关综述报道其合成方法1。
我们将一些常用的合成方法简单的列举了出来,供大家在合成此类化合物的时候参考。
1 (a) G. W. Gribble, Contemp. Org. Synth., 1994, 145. (b) U. Pindur and R. Adam, J. Heterocycl. Chem., 1988, 25, 1. (c) C. J. Moody, Synlett , 1994, 681. (d) R. J. Sundberg, Indoles , Academic Press, San Diego, CA, 1996. (e) T. L. Gilchrist , J. Chem. Soc., Perkin Trans. 1, 1999, 2849. (f) G. W. Gribble, J. Chem. Soc ., Perkin Trans. 1, 2000, 1045.2. Fischer 吲哚合成Fischer 吲哚合成法是一个常见的吲哚合成方法。
通过苯腙在酸催化下加热重排消除一分子氨得到2-取代或3-取代吲哚衍生物。
在实际操作中,常可以用醛或酮与等当量的苯肼在酸中加热回流得到苯腙,其在酸催化下立即进行重排、消除氨而得到吲哚化合物。
常用的催化剂有氯化锌、三氟化硼、多聚磷酸等,常用的酸有AcOH , HCl, 三氟乙酸等。
其机理大致如下:N H NR'RH +H2HR N +R'NH 2HH 3N HRR'2.1 Fischer 吲哚合成反应示例BrNHNH 2.HCl +ON H Br1234-Bromophenylhydrazine hydrochloride 1 (21 g) was suspended in 150 mL of acetic acid, and the mixture was heated to reflux. Then a solution of cyclohexanone 2 (9.3 mL) in 10 mL ofacetic acid was added dropwise. After the addition, the mixture was stirred under reflux for another 2 h. Water (50 mL) was added dropwise slowly, cooled to room temperature, the solid was filtered, washed with water, dried, pale brown solid 3 (21.65g, 91 %) was obtained.Ref: (a) B. Robinson, Chem. Rev., 1963, 373. (b) B. Robinson, Chem. Rev., 1969, 227. (c) H. Ishii, Accts. Chem. Res., 1981, 233. (d) B. Robinson, The Fischer Indole Synthesis , 1982, 923. (e) D. L. Hughes, Org. Prep. Proced. Int., 1993, 607. (f) S. M. Hutchins, K. T. Chapman, Tetrahedron Letters , 1996, 4869. (g) O. Miyata et al., ibid. 1999, 3601. (h) S. Wagaw et al., J. Am. Chem. Soc., 1999, 10251.3. 从硝基苯的衍生物出发合成吲哚对于2,3位没有取代基的吲哚,一般工业上大多采用硝基苯的衍生物出发合成,邻甲基、邻甲酰基、邻氰乙基、邻乙烯基、及邻位有氢的硝基苯衍生物都可通过相应的方法得到吲哚。
NO 2RNO 2RNN HRH 2, Raney Ni or H , Pd/Cor Fe, HCl or Zn, AcOHor TiCl 3, NH 4OAc or NH 2NH 2, Raney NiCHONO 2R32NO 2RNO 2N HRH 2, Raney NiH 2, Pd/CHNO 2RNO 2RN HRCO, Pd(OAc)2MgBrN HRNO 2RN HR3.1 邻甲基硝基苯衍生物合成吲哚该方法是目前最常用的,邻甲基硝基苯衍生物与DMF-DMA反应后得到相应的烯胺,然后硝基可通过多种方法还原后加成得到吲哚。
还原方法一般通过加氢,但当分子内有敏感官能团(比如:Br,I都可或烯烃等)存在时可通过化学还原如:NH2NH2-Raney Ni, 铁粉,TiCl3, 锌粉还原得到吲哚。
3.1.1 邻甲基硝基苯衍生物合成吲哚示例MeO NO2DMFDMA/pyrrolidineDMF, 105 0C, 19 h MeO NO2N10% Pd/C50 psi. H2EA, r.t., 3 hMeO NH123To a solution of 4-methoxy-2-nitrotoluene 1 (17.9 g, 0.107 mol) in 200 mL of dry DMF was added DMFDMA (42 mL, 0.316 mol) and pyrrolidine (10 mL, 0.12 mmol). The mixture was heated at 105 0C for 19 h under nitrogen, then cooled, diluted with water and extracted with ether (8×50 mL). The ether layer was extracted with water (3×25 mL), dried with sodium sulfate, and concentrated to give a deep red oil 2 which was dissolver in ethyl acetate (150 mL), and to the solution was added 10% palladium on carbon (1.8 g). Hydrogenation at 50 p.s.i. with shaking for 3 h and then filtration through celite gave a light brown filtrate. This filtrate is evaporated to purple oil, which was purified by chromatography on silica gel (eluent: DCM) to give 6-methoxyindole Yield: 76%Ref: (a) Feldman, et al, Synthesis, 1986, 735. (b) Kline.T.B. et al,J. Med. Chem., 1982, 908.(c) Schumacher, R.W. et al, Tetrahedron, 1999, 935. (d) bromidge, S.M., et al, J. Med. Chem., 1998, 1598. (e) Maehr, H. et al, J. Org. Chem. 1984, 1549. (f) Nicolaou, K.C. et al, J. Am. Chem. Soc., 2004, 10162.3.2 邻甲酰基硝基苯衍生物合成吲哚该邻甲酰基硝基苯衍生物与硝基甲烷反应后得到相应的不饱和硝化物再还原后得到吲哚。
3.1.2 邻甲酰基硝基苯衍生物合成吲哚示例CHO NO 2MeNO 2, NH 4OAc N H2 r.t./5hNO 2NO 2123To a solution of 2-nitro-benzaldehyde 1 (3.14 g, 0.02 mol) in nitromethane (40 mL) was added ammonia acetate (0.9 g, 0.012 mol) under N 2 protected. Then it was heated to reflux for 1.25 h. After cooled to room temperature, it was poured into water and stirred for 30 min. Then it was extracted with DCM (50 mL×3), and the combined organic layer was washed with brine, dried over Na 2SO 4 and evaporated under vacuum. The residue was purified by flash column chromatography to yield 1.2 g pure 2-(2-nitro-vinyl)-nitrobenzene 2. Yield: 42%To a solution of 2-(2-nitro-vinyl)-nitrobenzene 2 (1.0 g, 0.005 mol) in ethanol (10 mL), glacial acetate acid (10 mL) and water (3 mL) was added iron powder (5.7 g, 0.1 mol) portionwise. After the addition, it was heated to 50 C for 30 min. After cooled to room temperature, aq. NaHSO 3 was added to it and extracted with ether (50 mL×3). The combined organic layer was washed with saturated aq. NaHCO 3, dried over Na 2SO 4 and evaporated under vacuum. The residue was purified by flash column chromatography to yield 0.45 g 1H-indole 3. Yield: 75%Ref: (a) Sinhababu, Achintya K.; Borchardt, Ronald T., J. Am. Chem. Soc., 1985, 7618, (b) He, Feng; Bo, Yunxin; Altom, Jason D.; Corey, E. J.; J. Am. Chem. Soc., 1999, 6771.3.3 邻氰甲酰基硝基苯衍生物合成吲哚示例NO 2CN NHH , Pd/C EtOH, AcOH, H 2OTo a solution of 2-nitro-1-naphthyl-acetonitrile (33g, 0.155 mol) in 630 mL of ethanol containing 10% water and 6.3 mL of pure acetic acid was added 19 g of 10% palladium-on-carbon. Then it was stirred at r.t. under 4 bars of hydrogen. After thereaction completed, the catalyst was filtered and the filtration was concentrated under reduced pressure. Then residue was dissolved in 250 mL of DCM, washed with 100 mL of 0.1 N KOH solution and then dried over Na 2SO 4, evaporated under reduced pressure to give the crude product, which was purified by column chromatography using cyclohexane/EA=4:1 as eluant to yield 13 g of 3H-benzo[e]indole. Yield: 50%Ref: (a) Makosza, M. et al., Tetrahedron , 1995, 7263. (b) Bromidge, S.M. et al., J. Med. Chem., 1998, 1598.3.4 邻乙烯基硝基苯衍生物合成吲哚示例Br NO 2NO 2N HCH 2=CHSn(C 4H 9)3bis(dibenzylideneacetone) palladium3Pd(OAc)2, PPh 3MeCN, 70 0C, 15 h123To a solution of 2-bromo-4-methylnitrobenzene 1 (1.00 g, 4.61 mmol) and vinyltri-n -butyltin (1.61 g, 5.07 mmol) in toluene (25 mL) was added, under a positive flow of argon, bis(dibenzylideneacetone) palladium (0) (265 mg, 0.46 mmol) together with triphenylphosphine (498 mg, 1.90 mmol). The solution was heated at reflux (19 h) whereupon a red solution containing a black precipitate was formed. The reaction mixture was cooled to ambient temperature, and the solvent was removed to give black oil. The oil was dissolved in dichloromethane (50 mL), washed with NH 4OH (10%, aq, 3 x30 mL), and dried (MgSO 4). Removal of solvent gave yellow oil containing a smaller amount of black viscous oil. The crude product was purified by chromatography (hexanes-EtOAc, 19:1) to give 2-ethenyl-4-methylnitrobenzene (589 mg, 3.61 mmol, 78%) as yellow oil 2. Toanoven-dried,threadedACEglasspressuretubewasadded2-ethenyl-4-methylnitrobenzene 2 (152 mg, 0.93 mmol), Pd(OAc)2 (13 mg, 0.06 mmol), triphenylphosphine (62 mg, 0.24 mmol), and 4 mL of MeCN. The tube was fitted with a pressure head, the solution was saturated with CO (four cycles to 4 atm of CO), and the reaction mixture was heated to 70 °C (oil bath temperature) under CO (4 atm) until all starting material was consumed (15 h) as judged by TLC. The reaction mixture was diluted with HCl (aq, 10%, 10 mL) and extracted with Et 2O (3x10 mL). The combined organic phaseswere washed with HCl (aq, 10%, 10 mL) and dried (MgSO4), and the solvent was removed to give the crude product. The crude product was purified by chromatography (hexanes-EtOAc, 9:1) to give 5-methylindole 3 (62 mg, 0.47 mmol, 51%) as faint yellow crystals.Ref: Soederberg, B. et al, J. Org. Chem., 1997, 58383.5 邻位有氢的硝基苯衍生物直接用乙烯格氏试剂合成吲哚(Bartoli反应)示例NO2MgBr+-40 0C, 1 hNHThe 2-nitrotoluene (685 mg, 5 mmol) was placed in a two–necked round bottomed flask fitted with a gas inlet (argon) and rubber septum. The flask was purged several times with argon before adding THF (35–40 ml) and cooling to between –40 and –45 °C. The Grignard reagent (3 eq.) was then added rapidly in one portion to the THF solution and stirring continued for a further 30 mins to 1 hour (exact length of time had little effect on yield). Saturated ammonium chloride solution was added to the reaction mixture (at ca. –40 °C) before allowing the mixture to warm to room temperature. The mixture was thoroughly extracted with diethyl ether (2 x 200 ml), the ether extracts combined and thoroughly washed with further ammonium chloride (300 ml), water (300 ml) and brine (300 ml) before drying (MgSO4) and concentrating in vacuo to give a dark brown gum, which was purified by flash column chromatography (hexane:ethyl acetate 9:1) to give 465 mg of 7-methyl-indole. Yield: 71%.Ref: (a) Adrian P. Dobbs,Martyn Voyle, Neil Whittall, Synlett, 1999, 1594, (b) Curtin, M.L et al, J.Med.Chem., 1998, 74.4. 从苯胺的衍生物出发合成吲哚从苯胺的衍生物合成吲哚虽不常用,但还是有一些方法被报道。
