2018高三化学朝阳二模
2018年高考北京卷化学试题(含答案解析)

绝密★启封并使用完毕前2018年普通高等学校招生全国统一考试理科综合能力测试化学(北京卷)本试卷共16页,共300分。
考试时长150分钟。
考生务必将答案答在答题卡上,在试卷上作答无效。
考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16第一部分(选择题)1. 下列我国科技成果所涉及物质的应用中,发生的不是..化学变化的是()2. 我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。
该历程示意图如下。
下列说法不正确...的是()A. 生成CH3COOH总反应的原子利用率为100%B. CH4→CH3COOH过程中,有C―H键发生断裂C. ①→②放出能量并形成了C―C键D. 该催化剂可有效提高反应物的平衡转化率3. 下列化学用语对事实的表述不正确...的是()A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH C17H35COOC2H5+H218OB. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O+OH−C. 由Na和C1形成离子键的过程:D. 电解精炼铜的阴极反应:Cu2+ +2e −Cu4. 下列实验中的颜色变化,与氧化还原反应无关的是()A B C D实验NaOH溶液滴入FeSO4溶液中石蕊溶液滴入氯水中Na2S溶液滴入AgCl浊液中热铜丝插入稀硝酸中现象产生白色沉淀,随后变为红褐色溶液变红,随后迅速褪色沉淀由白色逐渐变为黑色产生无色气体,随后变为红棕色5. 一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。
其结构片段如下图下列关于该高分子的说法正确的是()A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2C. 氢键对该高分子的性能没有影响D. 结构简式为:6. 测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
2018北京丰台高三二模化学试题及答案(供参考)

丰台区2018年高三年级第二学期综合练习化学(二)可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 Cl S 32 Mn 556.“笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,下列叙述中不正确...的是A.可用灼烧法鉴别毛笔笔头是否含蛋白质B.用墨写字可长久不褪色C.主要成分是纤维素D.用工具打磨石材的过程是化学变化7. 清代《本草纲目拾遗》中关于“鼻冲水(氨水)”的记载明确指出:“鼻冲水,……贮以玻璃瓶,紧塞其口,勿使泄气,则药方不减……唯以此水瓶口对鼻吸其气,即遍身麻颤出汗而愈,虚弱者忌之。
宜外用,勿服。
”下列有关“鼻冲水”的推断不正确...的是A. 鼻冲水是弱电解质B. 鼻冲水滴入酚酞溶液中,溶液变红色C. 鼻冲水中含有分子和离子的种类为6种D. 存在平衡:NH3 + H2O NH3·H2O NH4+ + OH-8. 下列说法正确的是A. 麦芽糖的水解产物不能发生银镜反应B. 油脂在酸性或碱性条件下均可发生水解反应,最终产物不相同C. 蛋白质溶液里加入饱和硫酸铵溶液,蛋白质析出,再加水不再溶解D. 用甘氨酸和丙氨酸缩合最多可形成3种二肽9.X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能..实现右图所示转化关系的是X Y Z 箭头上所标数字的反应条件A. NO NO2HNO3①常温遇氧气B. Cl2NaClO HClO ②通入CO2C. Na2O2NaOH NaCl ③加入H2O2D. Al2O3NaAlO2Al(OH)3④加NaOH溶液②③XY Z①④CH3CH-COOHNH2NH2CH2COOH10.下列关于物质结构和元素性质说法正确的是A. 非金属元素之间形成的化合物一定是共价化合物B. 乙醇可与水以任意比例混溶,是因为与水形成氢键C. IA族与VIIA族元素原子之间形成的化学键是离子键D. 同主族元素的简单阴离子还原性越强,水解程度越大11. 下列说法不正确...的是A. mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)B. 常温下把等物质的量浓度的盐酸和NaOH溶液等体积混合后,其溶液的pH恰好等于7C. 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) + c(OH-) =c(H+) + c(Na+)D. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+) > c(HX) > c(X-) > c(H+) > c(OH-) 12.下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理,下列说法不正确...的是热化学硫碘循环水分解制氢系统(I)①H 2SO4(aq) SO2(g) + H2O(l) + 1/2O2(g) ΔH1 = +327 kJ/mol②SO 2(g) + I2(s) + 2H2O(l) 2HI(aq) + H2SO4(aq) ΔH2 = −151kJ/mol③2HI(aq) I 2(s) + H2(g) ΔH3 = +110 kJ/mol④H 2S(g) + H2SO4(aq) S(s) +SO2(g) + 2H2O(l) ΔH4 = +61 kJ/mol热化学硫碘循环硫化氢分解制氢气、硫磺系统(Ⅱ)A. 反应②为反应③提供了原料B. 反应②也是SO2资源利用的方法之一C. 制得等量H2所需能量较少的是系统(Ⅰ)D. 系统(Ⅰ)制氢的热化学方程式为H 2O(l) H2(g) + 1/2O2(g) ΔH = +286 kJ/mol25.(17分)2005年诺贝尔化学奖授予了研究烯烃复分解反应的科学家,以表彰他们作出的卓越贡献。
2018年北京高考理综化学试卷解析版

2018年北京高考理综化学试卷解析版D化学反应中的能量变化、催化剂对化学反应的影响,解题的关键是准确分析示意图中的信息。
注意催化剂能降低反应的活化能,加快反应速率,催化剂不能改变ΔH、不能使化学平衡发生移动。
3. 下列化学用语对事实的表述不正确...的是A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH C17H35COOC 2H5+H218OB. 常温时,0.1 mol·L-1氨水的pH=11.1:NH 3·H2O+OH−C. 由Na和C1形成离子键的过程:D. 电解精炼铜的阴极反应:Cu2+ +2e−Cu 【答案】A【解析】分析:A项,酯化反应的机理是“酸脱羟基醇脱氢”;B项,氨水为弱碱水溶液,存在电离平衡;C项,Na易失电子形成Na+,Cl易得电子形成Cl-;D项,电解精炼铜时,精铜为阴极,粗铜为阳极。
详解:A项,酯化反应的机理是“酸脱羟基醇脱氢”,硬脂酸与乙醇反应的化学方程式为C17H35COOH+C2H518OH C17H35CO18OC2H5 +H2O,A项错误;B项,常温下0.1mol·L-1氨水的pH=11.1,溶液中c(OH-)=10-2.9mol·L-10.1mol·L-1,氨水为弱碱水溶液,电离方程式为NH 3·H2O NH4++OH-,B项正确;C项,Na原子最外层有1个电子,Na易失电子形成Na+,Cl 原子最外层有7个电子,Cl易得电子形成Cl-,Na将最外层的1个电子转移给Cl,Na+与Cl-间形成离子键,C项正确;D项,电解精炼铜时,精铜为阴极,粗铜为阳极,阴极电极反应式为Cu2++2e-=Cu,D项正确;答案选A。
点睛:本题考查酯化反应的机理、电离方程式的书写、用电子式表示物质的形成过程、电解精炼铜的原理。
注意强电解质和弱电解质电离方程式的区别、用电子式表示离子化合物和共价化合物形成过程的区别。
辽宁省协作校2022-2023学年度高三第二次模拟考试暨朝阳一高中第三次模拟考试化学试题答案

2022—2023 学年度下学期高三第二次模拟考试试题化学答案1.C2.A3.B4.B5.D6.D7.B8.A9.C 10.A 11.C 12.B 13.D 14.D 15.C16.(14分,每空2分)(1) PbSO 4 (2)323242WO +Na CO Na WO +CO ↑高温(3) 2Fe 2++H 2O 2+2H +=2H 2O+2Fe 3+(4)1.0×10-56.8 1.3~ 2.1 cd(5)ρ白锡=4×1196.02×1023×(0.5832×10﹣7)2×0.3181×10﹣7>ρ灰锡=8×1196.02×1023×(0.6489×10﹣7)3密度变小,体积变大(列式1分,结论1分)17.(13分,除标注外,每空2分)(1) +42 kJ•mol ﹣1 高温(1分) (2) ①反应I 和反应II 都是吸热反应,温度升高,平衡都向正向移动;温度较低时,反应I 正向进行的程度大,的物质的量分数增大;温度较高时反应Ⅱ正向进行的程度增大,的物质的量分数减小②2TiO −−−→ (g)+H 2O(g) 第二步反应非常快③0.012 ④反应II 反应为气体分子数增大的反应,恒压密闭容器中充入一定量N 2,降低各气体分压(相当于扩大容器体积),会使反应II 的平衡正向移动(多答反应Ⅰ不扣分)18.(14分,除标注外,每空2分)(1) ①观察气泡的产生速率,便于控制氨气的通入速率(1分)②溶液不再分层 使溶液中的NH 4HS 分解完全432NH SCN+KOH KSCN+NH +H O∆↑③bcg (答对1个给1分,全对2分)(2)83.3 (写83.3%不给分)(3) 0.15(1分)2Cu2++4SCN-=2CuSCN↓+(SCN)219.(14分,每空2分)(1)邻二甲苯(1,2—二甲苯) 酯基、醚键、羟基(2) AB (3)19(4)(5) NaNO3反应生成的NaBr易溶于水,而AgNO3反应生成的AgBr难溶于水,使平衡正向移动促进反应进行(6) 3。
朝阳区2022届高三二模化学试题答案

朝阳区高三年级第二学期质量检测二化学参考答案2022.5第一部分(选择题,共42分)第二部分(非选择题,共58分)15.(9分)(1)①乙醇分子间能形成氢键②乙醚沸点低,蒸馏时所需温度低,青蒿素不易分解(2)①O>C>H②4×282N A×abc×10-21③b(3)①sp3②四面体16.(10分)(1)②2SO3 === 2SO2 + O2(2)①<②一定压强下,相比于H2O浓度的增加,SO2浓度的减小对平衡的影响更大,不利于SO2转化(答案合理即可)(3)①I2 + SO2 + 2H2O == 4H++ 2I-+ SO2-4②a.SO2的水溶液(SO2或H2SO3)b.加热反应后的混合物,挥发的物质用SO2的水溶液吸收,过滤(滤渣用SO2的水溶液洗涤),得产品。
(答案合理即可)17.(12分)(1)过滤(2)3Fe + NO-3+ 2H+ + H2O === Fe3O4 + NH+4(3)a.还原NO-3所需电子为3.24×10-4mol,Fe2+提供的电子最多为3.6×10-5mol ( 或Fe2+提供2.4×10-5 mol电子) ,Fe2+失去的电子数明显少于NO-3所需的电子数。
d.7.2×10﹣5 mol NaCl(4)Fe2+ + 2FeO(OH) === Fe3O4 + 2H+,Fe2+ 破坏了钝化层(5)①c1v1-6c2v23v②偏大18.(14分)(1)碳碳双键、醛基(2)取代反应(3)NHOO(4)CH3COOH + CH3CH2CH3COOCH2CH3 + H2O(5)CH3CCH2COCH2CH3O O(6)①CH3ONHCOONa CH2CH2NH2②CH3ONHCH2CH2NH2③CH3COOCCH3O(CH3CO)2O [或CH3COOH、CH3COCl等]19.(13分)(1)降低温度,减缓H2O2分解(2)Ⅰ.H2O2-2e-=== O2↑+ 2H+Ⅱ.还原(3)①MnSO4溶液②H2O2、NaOH;H2O2、H2SO4(4)2H2O222H2O + O2↑;MnO2 + 2H++ H2O2 == Mn2++ 2H2O + O2↑;前者MnO2做催化剂,后者做氧化剂。
2018朝阳区二模散文阅读

达了作者对杜甫的赞叹之情(1分)。
22.请简要概括第⑧段的内容,并说说它在文 中的作用。
• ⑧青年时代喜欢李白,中年以后,觉杜甫更亲。 杜甫之所以逐渐被后世认可并尊称为诗圣,不仅 仅在于他情怀中的仁慈、广大,也在于他诗的驳 杂、多元。“四十明朝过,飞腾暮景斜。谁能更 拘束,烂醉是生涯。”这样恣肆、霸气、脱口而 出的句子,像那个总在痛哭流涕的杜甫写的吗? 的确是他写的。集嶙峋与柔软、秋兴与春愁、沉 痛与轻快、放歌与烂醉、展示与讲述于一身,一 个诗人才可能伟大。伟大的诗人像山川,峰岭变 幻、一言难尽。
• ⑨2012年,杜甫诞辰一千三百周年,我与众多 诗人赴河南祭拜。杜甫出生地——郑州郊区巩 县依山而凿的一间窑洞,木门紧闭,门前有杜 甫童年打枣的雕塑。杜甫墓:庞大土丘混同于 山坡,衰草绵延,如白发瑟瑟——“白头搔更 短,浑欲不胜簪”。融入故乡山坡的一个诗人 的巨大白头,依旧忧思难眠。 • 10以杜甫为镜,一个人、尤其是中年人,其写 作应能够与内心及周遭广大苍凉的秋意,保持 呼应,发生关系。是时候了,与无边落木一同 萧萧而下,尽管夏日曾经盛大。
己所想,具有“为敌”的勇气与才力。所以作
者认为它既是现实主义诗人又是先锋主义诗人。
• 2分: • 因为杜甫诗的内容真实自然,没有欺瞒,是对于当时
社会状态,人文情况以及内心情感的真实写照,然而
他的勇气、才力,也是他为先锋主义诗人的原因,他 敢于对那个时代的丑恶,黑暗表达自己内心的不满。
他的思想是自由的,他始终坚持着对于思想自由、表
• 4分: 杜甫的诗自然真实、不回避现实;他能 与古人窠臼、时风流弊为敌;思想自由、表 达自由,有勇气有才力。
• 3分:
• 现实主人诗人不回避现实,敢于描写揭露现实,
杜甫本人不瞒不骗,所做的诗都有揭露平庸残 酷的现实,并且将现实坚持下去,作者提到先 锋的思想与表达自由,杜甫在唐代敢于指出社 会的不足与缺陷并且毫无畏惧,自由的表达自
2018年朝阳区高三语文二模试题及答案

北京市朝阳区高三年级第二次综合练习语文学科测试2018.5(考试时间150分钟满分150分)本试卷共8页。
考生务必将答案写在答题卡上,在试卷上作答无效。
考试结束后,将本试卷和答题卡一并交回。
一、本大题共8小题,共24分。
阅读下面的材料,完成1—8题。
材料一早在1980年,未来学家阿尔文·托夫勒便在《第三次浪潮》一书中将大数据称为“第三次科技浪潮的华彩乐章....”。
从2009年起,“大数据”逐渐成为人们争相讨论的词汇之一。
如今,无论在自然科学还是在社会科学的研究项目中,都能看到大数据的身影。
有学者认为对不同的使用者来说,大数据的价值体现在不同的方面:对于投资人和创业者而言,大数据是热门的融资标签;对于大多数互联网公司或工程师来说,大数据意味着对一堆数据进行计算;对于消费者或者互联网用户来说,大数据是商家尽可能搜集的跟终端消费者相关的行为数据……有学者认为大数据的特点主要体现在以下四个方面:第一,大数据相较于传统数据来说,最大的区别体现在数据规模上,传统的大型数据集规模一般为TB级别,而大数据的规模则呈千倍级的增长,从TB跃升至PB。
第二,大数据不再是传统的结构化数据,而是包括网络日志、视频、图片和地理位置信息等多种类型的非结构化信息。
第三,大数据本身拥有海量信息,但信息必须通过分析才能实现从数据到价值的转变,而真正可用的数据可能只有很小一部分。
第四,大数据的采集、分析及时,流转快速,能保证大数据的新鲜和价值。
为什么人们对大数据如此关注?牛津大学互联网研究院教授维克托·迈尔·舍恩伯格和《经济学人》杂志数据编辑肯尼思·库克耶在其合著的畅销书《大数据时代:生活、工作与思维的大变革》中指出,大数据时代分析的信息量很多,在处理个别现象的数据时不用依赖随机采样。
大数据的出现改变了人们的思维方式,它让人们关注相关事物之间的关系,只需知道“是什么”,而不用知道“为什么”。
燃烧条件的探究
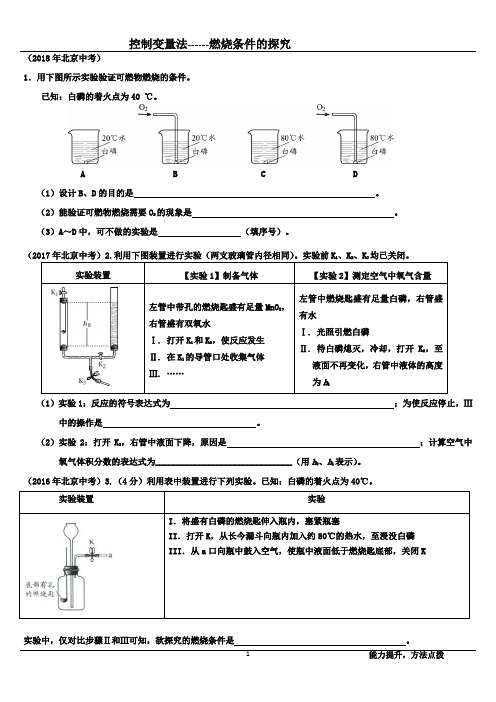
(2018年北京中考)1.用下图所示实验验证可燃物燃烧的条件。
已知:白磷的着火点为40 ℃。
A B C D(1)设计B、D 的目的是。
(2)能验证可燃物燃烧需要O2的现象是。
(3)A~D中,可不做的实验是(填序号)。
(2017年北京中考)2.利用下图装置进行实验(两支玻璃管内径相同)。
实验前K1、K2、K3均已关闭。
实验装置【实验1】制备气体【实验2】测定空气中氧气含量左管中带孔的燃烧匙盛有足量MnO2,右管盛有双氧水Ⅰ. 打开K1和K2,使反应发生Ⅱ. 在K1的导管口处收集气体Ⅲ. ……左管中燃烧匙盛有足量白磷,右管盛有水Ⅰ. 光照引燃白磷Ⅱ. 待白磷熄灭,冷却,打开K2,至液面不再变化,右管中液体的高度为h1(1)实验1:反应的符号表达式为;为使反应停止,Ⅲ中的操作是。
(2)实验2:打开K2,右管中液面下降,原因是;计算空气中氧气体积分数的表达式为_______________________________(用h0、h1表示)。
(2016年北京中考)3.(4分)利用表中装置进行下列实验。
已知:白磷的着火点为40℃。
实验装置实验I.将盛有白磷的燃烧匙伸入瓶内,塞紧瓶塞II.打开K,从长今漏斗向瓶内加入约80℃的热水,至浸没白磷III.从a口向瓶中鼓入空气,使瓶中液面低于燃烧匙底部,关闭K实验中,仅对比步骤Ⅱ和Ⅲ可知,欲探究的燃烧条件是。
(2015年北京中考)4.(3分)依据下图进行实验(夹持仪器略去)。
实验过程:①通入2N ,点燃酒精灯,一段时间后,a 、b 中均无明显现象;②熄灭酒精灯,立即改通2O ,a 中无明显现象,b 中红磷燃烧。
(1)实验过程②中,红磷燃烧的符号表达式为 。
(2)实验过程②中,对比a 、b 中的实验现象,可知可燃物燃烧的条件之一是 。
(3)实验过程中,能说明可燃物燃烧需要氧气的实验是 。
(2014年北京中考)5.(6 分)用右图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2018高三化学朝阳二模北京市朝阳区高三年级第二次综合理科综合测试化学试题6.我国科技创新成果斐然,下列成果中以制备非金属单质为主要目的的是AB C D低温制备 H 2成功开采可燃冰 (CH 4·n H 2O )研制出 超高强钢合成全氮阴离子盐 (N 5)6(H 3O)3(NH 4)4Cl7.下列关于NH 4Cl 的化学用语正确的是A .氯离子的结构示意图:B .其溶液呈酸性的原因:NH 4Cl + H 2O ⇌ NH 3·H 2O +HCl液态甲醇氢气催化剂C .工业上“氮的固定”:NH 3 + HCl = NH 4ClD .比较微粒半径:N >Cl ->H8.下列变化中,未涉及...到电子转移的是 A .H 2C 2O 4使酸性KMnO 4溶液褪色 B .C 2H 5OH 使酸性K 2Cr 2O 7溶液变绿C .CO 2使苯酚钠溶液变浑浊D .H 2O 2使酸化的KI 溶液变黄 9.中国学者在水煤气变换[CO(g) + H 2CO 2(g) + H 2(g)ΔH ]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。
反应过程示意图如下:催化剂C H O下列说法正确的是A .过程Ⅰ、过程Ⅲ均为放热过程B .过程Ⅲ生成了具有极性共价键的H 2、CO 2C .使用催化剂降低了水煤气变换反应的ΔHD .图示过程中的H 2O 均参与了反应过程10.一种长效、缓释阿司匹林(有机物L )的结构如下图所示:CH 2CH OnC O OCOCH 3下列分析不.正确..的是 A .有机物L 为高分子化合物 B .1 mol 有机物L 中含有2 mol 酯基 C .有机物L 能发生加成、取代、氧化反应 D .有机物L 在体内可缓慢水解,逐渐释放出OH COOH11.实验室模拟工业漂白液(有效成分为NaClO )脱除废水中氨氮(NH 3)的流程如下:提纯粗盐水精制盐水电解Cl 2吸收漂白液①②③④废水(含NH 3)NaCl下列分析正确的是A .①中采用蒸馏的方法精制粗盐水B .②中阳极的主要电极反应:4OH - - 4e - = 2H 2O + O 2↑C .③中制备漂白液的反应:Cl 2 + OH - = Cl - + HClOD .②、③、④中均发生了氧化还原反应 12.某小组比较Cl -、Br -、I - 的还原性,实验如下:实验1实验2实验3装置现象溶液颜色无明显变化;把蘸浓氨水的玻璃棒靠近试管口,产生白烟溶液变黄;把湿KI 淀粉试纸靠近试管口,变蓝 溶液变深紫色;经检验溶液含单质碘下列对实验的分析不合理...的是A .实验1中,白烟是NH 4ClB .根据实验1和实验2判断还原性:Br ->Cl -C .根据实验3判断还原性:I ->Br -D .上述实验利用了浓H 2SO 4的强氧化性、难挥发性等性质25.(17分)药物Q 适用于治疗高血压、心绞痛,可由有机物P 和L 制备。
H 2NCO CH 2OCH 2CH OH CH 2NHCHCH 3CH 3(药物Q )(1)有机物P 的合成路线如下。
催化剂2AB3(有机物P )H 2NCHCH 3CH 3CH 3CHCH 2已知:RNH 2+R'C R''O +C R''NRH 2O(R 、R ’、R ”代表烃基或氢)① A 的分子式为C 3H 8O ,其所含的官能团是 。
② B 的核磁共振氢谱只有一个吸收峰,其结构简式是。
③由D生成有机物P的反应类型是。
(2)有机物L的合成路线如下。
CH3CH CH22CHCHCOOHHO催化剂F有机物 LHCl已知:R NH2+R NH CH2CH2OHO①生成E的化学方程式是。
②OH与有机物M发生加成反应,M的结构简式为。
③F含羧基,化合物N是。
④生成有机物L的化学方程式是。
(3)以O为起始原料合成聚合物甲的路线如下:ONH 3一定条件HOOCCOOH聚合物甲C 4H 11NO 2写出聚合物甲的结构简式: 。
26.(12分)2017年采用中国自主知识产权的全球首套煤基乙醇工业化项目投产成功。
某地煤制乙醇的过程表示如下。
煤乙酸甲酯…乙醇过程aH / 催化剂X(1)Cu(NO 3)2是制备“催化剂X ”的重要试剂。
① 气体A 是 。
② 实验室用Cu(NO 3)2固体配制溶液,常加入少量稀HNO 3。
运用化学平衡原理简述HNO 3的作用 。
③NaClO溶液吸收气体A的离子方程式是。
(2)过程a包括以下3个主要反应:Ⅰ.CH3COOCH3(g) + 2H2(g)C2H5OH(g) + CH3OH(g)ΔH1Ⅱ.CH3COOCH3(g) + C2H5OH(g)CH3COOC2H5(g) + CH3OH(g)ΔH2Ⅲ. CH3COOCH3(g) + H2(g)CH3CHO(g) + CH3OH(g)ΔH3相同时间内,测得CH3COOCH3转化率、乙醇和乙酸乙酯的选择性(如乙醇)如下图所示。
选择性= n(最终转化为乙醇的CH3COOCH3)n(转化的CH3COOCH3)①已知:ΔH1 < 0。
随温度降低,反应Ⅰ化学平衡常数的变化趋势是。
②下列说法不合理...的是。
A.温度可影响反应的选择性B.225℃~235℃,反应Ⅰ处于平衡状态C.增大H2的浓度,可以提高CH3 COOCH3的转化率③为防止“反应Ⅲ”发生,反应温度应控制的范围是。
④在185℃下,CH3COOCH3起始物质的量为 5 mol,生成乙醇的物质的量是-____。
27.(14分)SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。
(1)方法Ⅰ的过程如下。
①制备Al2(SO4)x(OH)y向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。
CaO的作用之一是促进水解(填离子符号,下同),二是沉淀一部分。
②吸收:Al2(SO4)x(OH)y吸收SO2后的产物是(写化学式)。
③解吸:加热②中产物,产生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是。
(3)方法Ⅱ中,Fe2+的催化过程可表示如下:ⅰ:2Fe2+ + O2 + SO2 = 2Fe3+ + SO42-ⅱ:……①写出ⅱ的离子方程式:。
②下列实验方案可证实上述催化过程。
将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红。
c.取b中溶液,。
(4)方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。
将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用下图所示装置滴定,共消耗a mL c mol/L NaOH标准液。
①H2O2氧化SO2的化学方程式。
②废气中残留SO2的体积分数为。
28.(15分)某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。
反应的离子方程式是,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较① 经检验,Ⅰ中溶液不含I 2,黄色沉淀是 。
② 经检验,Ⅱ中溶液含I 2。
推测Cu 2+做氧化剂,白色沉淀A 是CuI 。
确认A 的实验如下:黄色沉淀白色沉淀Ba .检验滤液无I 2。
溶液呈蓝色说明溶液含有 (填离子符号)。
b .白色沉淀B 是 。
c .白色沉淀A 与AgNO 3溶液反应的离子方程式是 ,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:编号实验1 实验2 实验3实验KI溶液现象无明显变化a中溶液较快变棕黄色,b中电上析出银;电流计指针偏转c中溶液较慢变浅黄色;电流计指针偏转(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)①a中溶液呈棕黄色的原因是(用电极反应式表示)。
②“实验3”不能说明Cu2+氧化了I-。
依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是。
③方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:。
(资料:Ag++ I-= AgI↓K1=1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2K2= 8.7×108)朝阳区理综二模化学参考答案 2018.56.A 7.B 8.C 9.D 10.B 11.D 12.C 25.(17分)(1)① 羟基(或—OH ) ② CH 3CO CH 3③ 加成反应(或还原反应) (2)① 50023222CH CH CH Cl CH CH CH Cl HCl=-+−−−→=-+℃② HCOCOOH③ 3NH④CH 2CH CH 2O +CH 2OHC O H 2N CH 2O C O H 2N CH 2CHCH 2O +HCl(3)OCH 2CH 2NHCH 2CH 2O COC O OHnH26.(12分)(1)① NO② Cu 2+ + 2H 2O ⇌ Cu(OH)2 + 2H + ,加入硝酸,使c(H +)增大,平衡逆向移动,从而抑制 Cu(NO 3)2的水解③ 322OH3ClO 2NO 2NO 3Cl H O----++=++(2)① 增大 ② B ③ < 205℃ ④ 0.2 mol 27.(14分)(1)① 3Al +, 24SO -② ()()2432Al SO SO y x(2)222242SOO 2H O 2H SO ++===(3)① 3222242H O 2Fe SO 2Fe SO 4H ++-+++=++② 通入2SO ,溶液红色褪去(或变浅)(4)① 22224SO H O H SO +=②21.1210100%-⨯⨯acVF e2+28.(15分) (1)2Cu 2Ag2Ag Cu +++=+(2)① AgI ② a .2Cu +b .AgClc .2CuI 2Ag Cu Ag AgI+++=++(3)① 22I2e I ---=② 将d 烧杯内的溶液换为pH ≈4的 1mol/L 24Na SO 溶液,c 中溶液较慢变浅黄,电流计指针偏转(4)K 1>K 2,故Ag +更易与I -发生复分解反应,生成AgI 。
2Cu 2+ + 4I -= 2CuI + I 2 ,生成了CuI 沉淀,使得2Cu +的氧化性增强。
