李艳梅有机化学-20 杂环化合物
有机化学课件--第二十章杂环化合物

1
S
1
N
f u r a np y r r o l et h i o p h e n e p y r i d i n e
呋 喃 吡 咯噻 吩吡 啶
1
N H indole
吲哚
1
N
quinoline 喹啉
2019/8/23
课件
7
2. 杂环及环上取代基的编号 (1) 母体杂环的编号:杂原子的编号为“1”。
2019/8/23
课件
11
二、呋喃、噻吩、吡咯杂环的化学性质
1.亲电取代反应 从结构上分析,五元杂环为Π 56共轭体系,电
荷密度比苯大,发生亲电取代反应的速度也比苯快 得多。 如以苯环上碳原子的电荷密度为标准(作为 0),则五元杂环化合物的有效电荷分布为:
0
0
0
0
0
0
- 0.02
- 0.03
O
+0.1
DMF, POCl3
N H
20-30℃
吡啶 SO3 N H
NO2
N H CHO
N H SO3H
N H
3-硝基吲哚 3-吲哚甲醛 3-吲哚磺酸
含吲哚的生物碱广泛存在于植物中, 如麦角碱、马钱子碱、利血平等
2019/8/23
课件
34
C H 2C O O H
β -吲 哚 乙 酸 ( 植 物 生 长 调 节 剂 ) N H
CH3I O
△ N
CH3 N-甲 基 吡 咯
CH3CCl
△ N
COCH3 N-乙 酰 基 吡 咯
C H C l3/KO H
CHO N H α-吡 咯 甲 醛
课件
N
CH3
有机化学 第二十章杂环化合物
2.加成反应 呋喃、吡咯催化氢化,失去芳香性,得到饱和 的杂环化合物:
四氢吡咯为有机碱,广泛存在于自然界中的某 些生物碱中。
四氢呋喃是重要的有机溶剂。
噻吩中含硫,会使一般的催化剂中毒,氢化时必 须采用特殊催化剂。
工业上通常用开链化合物合成四氢噻吩。四氢噻 吩氧化成四亚甲基砜(或环丁砜),它是一个重要的 溶剂。
(6 )取代呋喃、噻吩、吡咯的定位效应
一取代呋喃、噻吩及吡咯进一步取代,定位效 应应由环上杂原子的α定位效应及取代基共同决定。 例如,3位上有取代基,第二个基团进入环的1位或5 位(即α位),是1位还是5位又由环上原有取代基 的性质决定◦例如,噻吩-3-甲酸溴代,生成5-溴噻 吩-3-甲酸。羧基是间位定位基,因此第二个基团进 入5位即羧基的间位。
一、五元杂环
五元环中含两个或两个(至少有一个氮原子) 以上的杂原子的体系称唑(azole)。如果杂原子不 同,则按氧、硫、氮的顺序编号。
二、六元杂环 三、稠杂环
20.2 五元单杂环化合物
一、呋喃、噻吩、吡咯的物理性质和结构
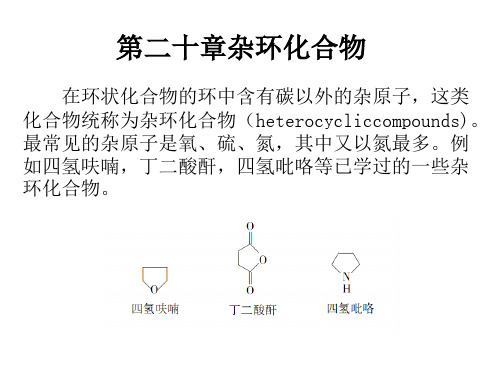
呋喃、噻吩、吡咯是最重要的含一个杂原子的 五元杂环化合物。它们的重要性不在于它们的单体, 而是它们的衍生物。它们的衍生物不但种类繁多, 而且有些是重要的工业原料,有些具有重要的生理 作用。
叶绿素与蛋白质结合,存在于植物的叶和绿色 的茎中,叶绿素利用卟啉环的多共辗体系易吸收紫 外光,成为激发态,促进光合作用,使光能转变为 化学能。
血红素存在于哺乳动物的红血球中,它与蛋白 质结合成血红蛋白,血红素中的Fe2+具有空的d轨道, 可以可逆地络合氧,在动物体内起到输送氧气的作 用。一氧化碳会使人中毒,其原因之一是因为它与 血红蛋白结合的能力强于氧,从而阻止了血红蛋白 与氧的结合。
李艳梅有机化学(课堂PPT)

“对旋”
21.2.1
4n电子体系
(一)丁二烯电环化
共轭烯烃分子轨道数目等于组成分子轨道的原子轨道(p 轨道)的数,亦即等于参加共轭的碳原子数。
由各碳原子上的p轨道的不同方式线性组合构成
E4 LUMO
E3
LUMO
HOMO
E2
HOMO
E1
Ground State 加热时
Activated State 光照时
环加成反应:
两分子烯烃或多烯烃经无中间体的反应生成环状化合物。 可以认为是两个烯烃平面相互接近成键
关键:反应条件 不同体系反应条件不同
21.3.1 2+2 体系
电子流向: 甲分子 HOMO LUMO
乙分子 LUMO HOMO
轨道相互作用 关键:位相匹配
甲分子: 乙分子:
LUMO HOMO
2+2 体系:加热时(基态)
21.1 周环反应的理论
AB
A +B
AB
A +B
Reactant
Free radical Ion
Product
No intermediate
协同反应
反应中不形成离子或自由基中间体, 化学键的断裂和生成同时发生的反应
周环反应
CH3 H
CH3 H
175oC
5CH3
4H
hv
3
CH3
21
H
(2E,4Z)-hexa-2,4-diene
在加热或光照条件下,共轭多烯烃的两端环化成环烯烃
的反应,或其逆反应。
“分子内的周环反应”
CH3 H CH3
H
Cis
5CH3
175oC 4
李艳梅有机化学Chapter_4_Cycloalkanes

多环
桥头碳
螺原子 Spiro rings 螺环 两环之间共用一个 碳原子
Fused ring 稠环 Bridged ring 桥环
两环之间共用一根共 价键(共用两个直接 相连的碳原子)
两环之间共用两个 不直接相连的碳原 子
几环?
To define the number of the rings: The number of cutting you need to get a chain molecule out of a poly ring compound
Large ring
多于13个碳原子的环体系中,分子链一般呈皱折形
Strain energy in cycloalkanes
Name C3 C4 C5 C6 C7~C12 C12~
Angle strain Great Great Slight No Medium No
Twist strain Medium Medium Medium No Medium No
螺[4.5]癸烷
“小原则”:在不违背螺环烃命名的“大”原则基础上,在编号 时应尽可能令取代基的位号最小。
1 2 3 46Βιβλιοθήκη 7 85910
1-甲基螺[4.5]癸烷
思考!
2 3
1 5
6
7 8
4 10 9
螺[4.5]癸烷 spiro[5.5]undecane 螺[5.5]十一烷
spiro[4.5]decane
角张力:111.50-109.50 = 20
H
H H H
H
扭转张力较小
4
H
3
H
2
H
1
H H
4
H H
清华大学有机化学李艳梅课件全共7文档

清华大学有机化学李艳梅课件全共7文档•课程介绍与有机化学概述•烃类化合物及其衍生物•羰基化合物及其衍生物•碳碳重键与芳香性目录•立体化学基础与手性合成策略•有机合成方法与路线设计•现代有机化学实验技术与方法01课程介绍与有机化学概述介绍清华大学有机化学课程的开设背景、历史沿革以及在国内外的学术地位。
课程背景课程内容教学方法概述本课程的主要教学内容,包括有机化合物的结构、性质、合成方法以及反应机理等。
介绍本课程采用的教学方法,如课堂讲授、实验操作、小组讨论等。
030201清华大学有机化学课程简介有机化学研究对象与特点研究对象阐述有机化学的研究对象,即有机化合物,包括其结构、性质、合成和反应等方面。
特点介绍有机化学的特点,如化合物种类繁多、结构复杂、反应条件温和等。
有机化学发展历史及现状发展历史回顾有机化学的发展历程,包括早期有机化学、近代有机化学和现代有机化学等阶段。
现状介绍当前有机化学的研究热点和前沿领域,如有机合成、有机材料、生物有机化学等。
本课程教学目标与要求教学目标明确本课程的教学目标,包括知识目标、能力目标和素质目标等。
教学要求提出本课程对学生的教学要求,如掌握基本概念和原理、具备实验技能和创新能力等。
02烃类化合物及其衍生物烷烃饱和链烃,分子中只含有单键,通式为CnH2n+2,性质稳定,主要发生取代反应。
烯烃含有碳碳双键的链烃,通式为CnH2n,性质活泼,可以发生加成、氧化、聚合等反应。
炔烃含有碳碳三键的链烃,通式为CnH2n-2,性质活泼,可以发生加成、氧化、聚合等反应。
烷烃、烯烃、炔烃结构和性质苯的结构和性质苯分子为平面正六边形结构,6个碳原子和6个氢原子共平面。
苯环上的碳碳键是介于碳碳单键和碳碳双键之间的独特键,使得苯具有特殊的稳定性。
芳香烃含有苯环的烃类化合物,具有特殊的芳香气味,通式为CnH2n-6。
芳香烃的取代反应芳香烃在催化剂作用下可以发生取代反应,如硝化、磺化、卤化等。
清华大学有机化学李艳梅课件全

Reactions:
H 3 C C H 2 H :C C l 2 H 3 C C H 2 C C l 2 H
H 插入C-H键H Cl
H
H
与C=C双键反应
Cl Cl Cl
制备环丙烷衍生物
立体选择性?
Singlet carbene
等待其中一个电 子的自旋方向发 生改变
Triplet carbene
eg: Pt, Pd / CaCO3, BaSO4, Al2O3 eg: Raney Ni:
NiAl + NaOH N* i注+意N:a二Al价O2硫+化H物2易使 催化剂中毒( : S 占据金 属的空d轨道)
Syn Addition(在非均相催化剂的表面发生顺式加成)
烯烃的相对氢化速率: 乙烯 > 一元取代烯烃 > 二元取代烯烃 > 三元取代烯烃 > 四元取代烯烃
Answer
满足反式共平面,过渡态能量低
?
?
Question 3:Try to finish the reaction !
Substituted cyclohexene
Br Br
(B) With HA
HA: HX H2SO4 H2O, H2O / H3PO4 有机酸、醇、酚 + H+
汞催化下的水合反应:
Carbocation may undergo rearrangement
注意之三:立体化学
等量
不等量
strereochemistry
不等量
(C) With HOX 次卤酸
试剂中带部分正电荷的部分加在含氢较多的双键碳原子 上。
(D) With B2H6
B外层3个电子 B2H6 共12个电 H外层1个电子 子
有机化学精品课件——杂环化合物

杂环化合物在材料科学中具有广泛的应用,因为它们可以提供优良的物理和化学性能。例如,聚酰亚胺、聚醚醚酮等杂环高分子材料在航空航天、电子和汽车等领域广泛应用。
杂环化合物作为材料合成的关键组分,能够提高材料的耐热性、耐腐蚀性和机械性能等,同时降低生产成本和提高生产效率。
杂环化合物的研究进展与展望
05
在亲电反应机理中,试剂的性质和杂环化合物上的取代基的性质都会影响反应的进程和产物的生成。因此,在选择合适的试剂和反应条件时,需要考虑这些因素。
亲核反应机理是指反应过程中,试剂首先进攻杂环化合物上的电子云密度较高的部位,从而形成负碳离子中间体。然后,负碳离子中间体再与试剂发生反应,形成新的键,最终生成产物。
杂环化合物的应用
04
杂环化合物在药物合成中具有广泛的应用,因为它们具有独特的化学结构和生物活性。例如,嘧啶衍生物在抗肿瘤药物中发挥重要作用,喹啉衍生物具有抗菌和抗癌活性。
杂环化合物作为药物合成中的关键中间体,可用于合成多种类型的药物,如抗高血压药物、抗病毒药物和抗癌药物等。
VS
杂环化合物在农药合成中具有不可替代的地位,因为它们可以提供高效、低毒、低残留的农药。例如,吡啶衍生物可用于合成除草剂和杀虫剂,嘧啶衍生物可用于合成杀菌剂和杀虫剂。
杂环化合物作为农药合成的关键组分,能够提高农药的生物活性、选择性和稳定性,从而降低对环境和人体的危害。
杂环化合物在染料合成中具有重要作用,因为它们可以提供鲜艳的色彩和优良的染色性能。例如,偶氮染料和酞菁染料等杂环染料在纺织品、皮革和纸张等领域广泛应用。
杂环化合物作为染料合成的关键组分,能够提高染料的色牢度和稳定性,同时降低生产成本和对环境的污染。
杂环化合物的物理性质与其结构密切相关,如熔点、沸点、溶解度等。
清华大学有机化学李艳梅老师第9章 ppt课件

2,Wiki百科
燃烧热(kJ/mol): 3264.4
临界温度(℃): 289.5
临界压力(MPa): 4.92
/
辛醇/水分配系数的对数值: 2.15
闪点(℃): -11
引燃温度(℃): 560 爆炸上限%(V/V): 8.0
/
(C) 磺化反应 1 Formation of +E
+SO3H or SO3 as E+
清华大学有机化学李艳梅老师第9章
2 Sulfonation
反应可逆 稀酸加热下可脱去
“保护基团”
清华大学有机化学李艳梅老师第9章
(D) Friedel-Crafts 反应
R + 或 RCO+ as E+
1 Formation of +R or RCO+
清华大学有机化学李艳梅老师第9章
(二)预测反应位点
CH3
定位一致时
定位不一致时
CO OH
(1)一般地,活化基团的作用
超过钝化基团的作用
(2)强活化基团的影响大于
弱活化基团
(3)两个基团的定位能力差
不多时,得混合物
CH3 COOH
CH3
NH2 Cl
CH3
清华大学有机化学李艳梅老师第9章
COOH OCH3
第三类;致钝的邻对位定位基 -F, -Cl, -Br, -CH2Cl
定位基的定位能力
清华大学有机化学李艳梅老师第9章
第一类;致活的邻对位定位基
CH3 E
o-
H
CH3 E H
致活:给电子基团 邻对位定位:
CH3 E H
CH3 E H
CH3
p-
HE
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
SO
4
(CH
H
2
oC
CO)
3
H
25
95 %
PO
3
O
2
4
S SO3H
O S
CH3
20.2.2.2 加成反应
1、催化加氢
N2/Ni O
N2/Ni S
N2/Ni N H
N2/Ni
O
O
N2/Ni
S
S
N2/Ni
N
N
H
H
2、Diels-Alder反应
+ O
+ S
O
30oC
O
O
O
100oC
O
High pressure
氧(杂)茂
O
氮(杂)茂
N H
茂 硫(杂)茂
S
氮苯
N
N N
1,4-二氮苯
1,2-二氮苯
N N
N N
1,3-二氮苯
N 2-氮萘 萘 1-氮萘
N
环上只有一个杂原子时,有时也把靠近杂原子的位置叫α位,其 次是β位,再次为γ位。
β α O
β α
O
γ β α
N
γ β
Nα
20.1.3 杂环化合物的结构
1.44Å 1.35Å
N+ N
H
SO3
C2H4Cl2 3 days, r.t.
100oC
HCl
O SO3 N H
HCl
N SO3 N
H
H
+
C2H4Cl2
S
N
r.t.
SO3
Ba(OH)2
S SO3 Ba2+ 2
O SO3H +
N H
Cl
N SO3H + H
N H Cl
噻吩较稳定,可以在室温 下直接磺化。
95% H2SO4
S
4-甲基咪唑
3 4N
2 5S
1
5-methylthiazole
5-甲基噻唑
5-methyl-2-phenyl-2,3-dihydro-pyrazole
1-苯基-3-甲基吡唑
当环上含多个相同杂原子时,编号 时应使杂原子所在的位次最小
环上有不同杂原子时,按O、S、N 次序编号
根据相应的碳环来命名
第一部分 五元杂环化合物
20.2 Five membered heterocyclic compounds with one heteroatom
含有一个杂原子的五元杂环化合物
20.2.1 Physical and spectroscopic properties of furan, thiophene, and pyrrole
O
20.2.2.3 吡咯的弱碱、弱酸性
碱性
One pair of p electrons in nitrogen is involved in the
2-甲基呋喃
5
4 3O OH
6N2 1
nicotinic acid
Pyridine-3-formic acid
吡啶-3-甲酸
以杂环为母体 一般从杂原子开始,沿着环编号
3 NH
N1
当杂原子 上有取代 基时,从 含取代基 的原子开 始编号
3 4N
5
2 NH1
4-methyl-imidazole
5、其它反应
ph-N2X
N H
N NN H
2-吡咯偶氮苯
吡咯可与重氮盐起偶联反应
6、定位效应
4 3G
5
2
Y
1
一般地:位 规律性不太强
Y=O, S, N G=邻、对位定位基, 第二个基团进入与G相邻的α位, 即C-2位。 G=间位定位基, 第二个基团进入与G间位的α位, 即C-5位。
43
5
O
2 G
O
Hemoglobin
NN
Fe NN
β-subunit of hemoglobin
O
O
HO
OH
Vitamin B12
Studies on synthesis of Vitamin B12, please see attached files.
பைடு நூலகம் RO
O R'O
H
R,R' = H
O R,R' = H3C C H NCH3 R = CH3, R' = H
Cl2
Br2
Cl N
0oC
N
0oC
Br N Br
O
H
O
(CH 3C1O50)~2O200o C
H
N
C 6H
5N 2X
H
100oC
N H
SO3
N H
HCl
N SO3 N
N
H
H
H
SO3H +
Cl N H
H
H
H3COOC O NO2
or
N
O NO2
CH3COONO2 -5~-30oC
Cl2
Br2
Cl O Cl
20.1 杂环化合物的分类、命名和结构 杂环化合物
由C原子和至少一个其它原子(如: O、S、N等)所组成的环。
杂原子(Hetroatom)
杂环 (Hetrocycle)
通常具有芳香性
自然界中的杂环化合物
R NN Mg
NN
O CH3 O
O O
R = CH3 Chloropgyll a R= CHO Chloropgyll b
O
O
O
H
O
H O
+
HOO
OO
H
main product
S
O
HOO H
呋喃、噻吩均可与顺丁烯二酸酐反应 吡咯只与苯炔反应
O
O
100oC
+
CC
S RO
O R High pressure
S COOR
COOR
H N + N H
COOR COOR
O
N H
+ H CO C C CH3
HH
BF3
N H
O C
CH3
20.2.2 Chemical properties of furan, thiophene, and pyrrole 20.2.3 Preparation of furan, thiophene, and pyrrole 20.2.4 α-furanformaldehyde
20.2.1 呋喃、噻吩、吡咯的物理性质与光谱性质
1.42Å 1.37Å
1.37Å 呋喃 Furan
1.71Å 噻吩 Thiophene
1.43Å 1.37Å
1.38Å 吡咯 Pyrrole
C=C C-O C-N C-S
1.34Å 1.43Å 1.47Å 1.82Å
sp2杂化
每个杂原子给出2 个电子参与共轭
杂环具有芳香性、 富含电子
键长平均化 分子极性方向:指向芳环 环上亲电反应性高 吡咯的碱性与弱酸性
25oC
S SO3H
3、傅-克酰基化反应 F-C acylation
(CH3CO2)2
O
150~200oC
O COCH3
(CH3CO2)2
N
BF3, 0oC
N COCH3
H
H
(CH3CO2)2
S
H3PO4
S COCH3
4、傅-克烷基化反应 F-C alkylation
很难得到一烷基取代产物,常常得到混合的多烷基取代物。
电荷分布的定量状态
以苯环碳原子的电荷密度为标准(定为0正值表示电荷密度(有效电 荷)比苯小,负值表示电荷密度比苯大 。
0
0
0
0
0
0
-0.04 -0.06
S
-0.02 -0.03
O
-0.06 -0.10
N H
+0.12 +0.05
N +0.15
环碳上净电荷增加,有利于亲电;净电荷减少,有利于亲核。
Hetrocyclic compounds
第二十章 杂环化合物
Organic Chemistry A (2) By Prof. Li Yan-Mei Tsinghua University
Contents
20.1 杂环化合物的分类、命名和结构 第一部分 五元杂环化合物
20.2 含一个杂原子的五元杂环体系 20.3 含一个杂原子的五元杂环苯并体系 20.4 含两个或两个以上杂原子的五元杂环体系 20.5 含卟啉环的化合物 第二部分 六元杂环化合物 20.6 含一个杂原子的六元杂环体系 20.7 含一个杂原子的六元杂环苯并体系 20.8 含两个或两个以上杂原子的六元杂环体系 第三部分 其它杂环化合物 20.9 三元、四元、七元杂环体系
1、卤化
室温下,与Cl2、Br2反应,一般得到多卤代物。
Br Br
Br2
N
0oC Br N Br
H
H
Cl2 O - 40oC
O Cl + Cl O Cl
Cl2
S
50oC
S Cl + Cl S Cl
在温和的条件下,如溶剂稀释及低温,可以得到一取代物。
N Br H O Br
NBS
S Br
SO2Cl2
NH2 OH
,
~~
>
>
>>
N
O
S
H
亲电性比较
室温下乙酸溶液中,噻吩与溴发生取代反应的速率为苯的109倍。
