抗肿瘤新药研发
抗肿瘤新药雷替曲塞制备的关键技术及其产业化

抗肿瘤新药雷替曲塞制备的关键技术及其产业化雷替曲塞是一种抗肿瘤新药,它的制备涉及到多个关键技术和产业化过程。
以下是雷替曲塞制备的关键技术及其产业化的简要介绍:1. 化学合成:雷替曲塞是通过化学合成的方式获得的。
首先,需要确定合成路线和原料选择。
然后,按照合成路线进行有机合成反应,合成目标化合物。
在此过程中,需要优化反应条件、控制反应的立体选择性和收率。
2. 结构确认:在合成完成后,需要对合成的化合物进行结构确认。
这通常通过核磁共振(NMR)、质谱(MS)等技术来进行。
结构确认的准确性对于后续的研究和临床应用非常重要。
3. 药物筛选:在化合物合成完成并结构确认后,需要进行药物筛选以评估其抗肿瘤活性和毒性。
这包括体外细胞实验和动物模型实验。
通过药物筛选,可以选择出具有较高疗效和较低毒性的化合物。
4. 生产工艺开发:成功经过药物筛选的化合物需要进行生产工艺开发。
这包括药物的合成工艺优化、中间体和原料的供应链建立、反应条件的规模放大等。
5. 临床试验:在完成生产工艺开发后,需要进行临床试验以评估雷替曲塞在人体内的安全性和疗效。
临床试验通常分为三个阶段:I期试验是初步评估药物的安全性;II期试验是评估药物的有效性和安全性;III期试验是与目前标准治疗相比较的大规模试验。
6. 监管审批和上市:在完成临床试验并证明了雷替曲塞的疗效和安全性后,需要向监管机构提交申请,如美国FDA 或中国国家药品监督管理局(NMPA),以获得批准上市的许可。
7. 产业化:一旦获得上市许可,就可以进行规模化生产和销售。
这涉及到建立生产设施、制定质量控制标准、确保生产过程的一致性和稳定性,并与分销商建立合作关系。
以上是对抗肿瘤新药雷替曲塞制备关键技术及其产业化过程的简要介绍。
这些技术和过程需要经过严格的研究和验证,以确保新药的质量、安全性和疗效。
抗肿瘤药物研究及新药筛选

抗肿瘤药物研究及新药筛选提纲一、化疗药物的发展二、肿瘤的药物治疗三、抗肿瘤药物筛选及评价四、体外抗肿瘤活性试验五、体内抗肿瘤活性试验一、化疗药物的发展•近代肿瘤化疗学始于20世纪40年代。
• 50年代通过动物筛选化疗药物发现了5FU、MTX、CTX等,化疗学有了发展。
• 60年代认识到肿瘤细胞动力学及化疗药药代动力学的重要性。
大部分目前所用的抗癌药已发现,有急淋、HD、睾丸癌等可化疗治愈。
• 70年代形成肿瘤内科学,更多肿瘤有了比较成熟的化疗方案。
• 80年代研究以生物反应修饰剂等药物来提高化疗疗效,探索抗药性产生的原因,5%肿瘤患者可治愈。
• 90年代新抗癌药进入临床,多药耐药基因发现,生物治疗,基因治疗辅助治疗改善等,疗效进一步提高。
二、肿瘤的药物治疗1、细胞毒类抗肿瘤药a、拓扑异构酶抑制剂原理:真核细胞DNA拓扑异构酶Ⅰ(Topo Ⅰ)是生物体内及其重要的细胞核内酶,参与DNA复制、转录和修复等所有关键的核内过程。
DNA拓扑异构酶Ⅰ已成为重要的抗肿瘤药物研究新靶点。
拓扑异构酶Ⅰ抑制剂已成为高选择性抗肿瘤药物研究的一个主攻方向。
代表药物:喜树碱类化合物对S期的毒性作用,这一作用需共价TopoI-DNA复合物的形成和DNA复制。
TopoI抑制剂诱导的细胞凋亡而非DNA断裂是引起细胞最终死亡的原因。
b、胸苷酸合成酶抑制剂原理:胸苷酸合成酶(TS)把单磷酸脱氧尿嘧啶(DUMP)转换成单磷酸胸腺嘧啶(TMP),在DNA复制和细胞生长过程中起着关键作用。
是已知抗肿瘤药物的重要有效靶点之一。
胸苷酸合成酶抑制剂导致了DNA断裂从而导致细胞死亡。
代表药物:培美曲塞它是一种结构上含有核心为吡咯嘧啶基团的抗叶酸制剂,通过破坏细胞内叶酸依赖性的正常代谢过程,抑制细胞复制,从而抑制肿瘤的生长。
体外研究显示,培美曲塞能够抑制胸苷酸合成酶、二氢叶酸还原酶和甘氨酰核苷酸甲酰转移酶活性,这些酶都是合成叶酸所必需的酶。
一旦培美曲塞进入细胞内,它就在叶酰多谷氨合成酶的作用下转化为多谷氨酸的形式。
抗肿瘤新药的相关政策

抗肿瘤新药的相关政策
抗肿瘤新药涉及到广泛的政策和法规,这些政策旨在促进新药研发、确保患者获得高质量的医疗服务、平衡药品价格以及推动医疗科技的创新。
以下是一些与抗肿瘤新药相关的主要政策方面:
1.药物研发和批准政策:
•药物研发支持:许多国家提供资金、税收激励和其他支持,以鼓励制药公司投入肿瘤新药的研发。
•快速通道批准:一些国家设立了快速通道,加速肿瘤新药的审批过程,以满足患者紧急需求。
2.药品定价与准入:
•药价谈判:政府或保险公司可能与制药公司进行药价谈判,以确保患者能够负担得起这些抗肿瘤新药。
•专利政策:政府可能采取措施鼓励仿制药的发展,以增加市场竞争,从而降低药品价格。
3.医疗保险政策:
•医保覆盖:许多国家的医保系统会纳入一些抗肿瘤新药,以提供患者更广泛的医疗保障。
•患者支付辅助:一些政策可能提供患者支付辅助计划,帮助患者应对抗肿瘤治疗的高额费用。
4.创新和科研资助:
•科研基金:政府和私营部门可能设立科研基金,用于支持肿瘤领域的创新研究。
•合作伙伴关系:政府可能鼓励学术机构、制药公司和研究机构之间的合作,以推动抗肿瘤新药的创新。
5.患者准入和医学伦理:
•患者权益:国家通常有规定保护患者权益和隐私的法规,确保患者在参与临床试验和接受治疗过程中得到妥善保
护。
•伦理审查:临床试验和研究可能需要经过伦理委员会的审查和批准。
这些政策方面的调整和实践可能因国家而异,因此具体情况可能会受到各国医疗体系和政策环境的影响。
此外,抗肿瘤新药的发展和使用也需要考虑全球卫生的问题,因为肿瘤是全球范围内的重要健康挑战。
药物化学中的抗肿瘤新药研发

药物化学中的抗肿瘤新药研发近年来,肿瘤成为医学界的重要研究领域。
在对抗肿瘤的治疗方法中,药物化学研发发挥着重要的作用。
本文将探讨药物化学中的抗肿瘤新药研发的现状和未来趋势。
抗肿瘤药物的研发是一项极具挑战性的任务。
肿瘤的发生与生长机制十分复杂,单一的治疗手段往往难以达到预期的治疗效果。
因此,药物化学研发人员需要从多个角度入手,不断寻找新的药物靶点和研发方法。
当前,药物化学研发中的一个重要方向是针对肿瘤细胞的靶向治疗。
通过寻找肿瘤细胞的特异性分子标志物,研发出与之相互作用的化合物,可以实现对肿瘤细胞的特异性杀伤。
例如,抗HER2的治疗药物是乳腺癌治疗中的重要突破,它能够通过与HER2受体结合,抑制肿瘤细胞的生长和扩散。
另一个重要的研发方向是通过药物化学修饰来提高药物的效果和减少副作用。
药物研发人员可以通过改变药物分子的结构,提高其在体内的稳定性和药效。
例如,通过对化合物进行酰化、硝化等反应,可以降低药物的代谢速率,延长其在体内的半衰期,从而提高药物的疗效。
此外,药物化学中的新技术也为抗肿瘤新药的研发提供了更多可能性。
例如,近年来兴起的高通量筛选技术(HTS)可以同时对大量的化合物进行快速筛选,有助于发现潜在的抗肿瘤药物。
同样,计算机辅助药物设计(CADD)技术的广泛应用,也为药物化学研发提供了便捷的工具。
通过计算机模拟和化学计算,研发人员可以预测药物分子的结构和活性,加快新药的研发速度。
然而,抗肿瘤新药的研发仍然面临着一系列的挑战。
首先,药物的靶向性和选择性仍然是一个难题。
许多抗肿瘤药物在治疗过程中不可避免地对正常细胞产生一定的毒副作用,影响病人的生活质量。
因此,在研发过程中需要对药物的选择性进行更加精确的设计,并加强对药物在体内的降解代谢和清除途径的研究。
此外,影响抗肿瘤药物研发的另一个关键因素是药物的药代动力学和药效学。
药代动力学研究药物在体内的吸收、分布、代谢和排泄的过程,而药效学则关注药物对目标细胞的作用效果。
抗肿瘤药物药效学实验方法及指导原则

抗肿瘤药物药效学实验方法及指导原则一、基本原则1. 抗肿瘤药物分类(1) 细胞毒类药物(cytotoxic agent):包括干扰核酸和蛋白质合成、抑制拓扑异构酶及作用于微管系统的药物等;(2) 生物反应调节剂(biological response modifier);(3) 肿瘤耐药逆转剂(resistance reversal agent);(4) 肿瘤治疗增敏剂(oncotherapy sensitizer);(5) 肿瘤血管生成抑制剂(tumor angiogenesis inhibitor);(6)分化诱导剂(differentiation inducing agent);(7) 生长因子抑制剂(growth factor inhibitor);(8)反义寡核苷酸(antisense oligonucleotide) 。
2. 抗肿瘤药物药效学需研究内容2.1 包括体外抗肿瘤试验,体内抗肿瘤试验。
2.2 评价药物的抗癌活性时,以体内试验结果为主,同时参考体外试验结果以做出正确的结论。
2.3 I类抗肿瘤新药应进行药物作用机制初步研究。
二、体外抗肿瘤活性试验1. 试验目的1.1 对候选化合物进行初步筛选;1.2 了解候选化合物的抗瘤谱;1.3 为随后进行的体内抗肿瘤试验提供参考,如剂量范围、肿瘤类别等。
2. 试验方法选用10-15株人癌细胞株,根据试验目的选择相应细胞系及适量的细胞接种浓度,按常规细胞培养法进行培养;推荐使用四氮唑盐MTT还原法、XTT 还原法、磺酰罗丹明B(SR染色法、或51Cr释放试验、集落形成法等测定药物的抗癌作用。
药物与细胞共培养时间一般为48-72 小时,贴壁细胞需先贴壁24 小时后再给药。
试验应设阳性及阴性对照组,阳性对照用一定浓度的标准抗肿瘤药,阴性对照为溶媒对照。
3. 评价标准以同一样品不同浓度对肿瘤细胞抑制率作图可得到剂量效应曲线,然后采用Logit法计算半数有效浓度(IC50值或EC50值)。
抗肿瘤新药CD19临床试验效果、在研产品及市场销售规模分析(2021年)
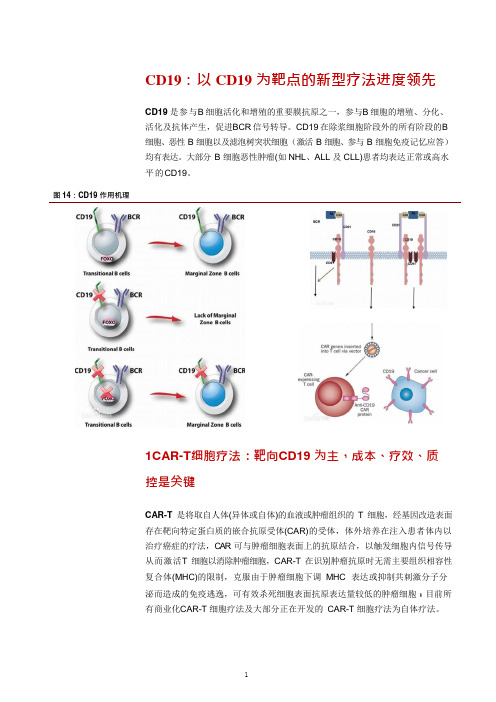
CD19:以CD19 为靶点的新型疗法进度领先CD19 是参与B 细胞活化和增殖的重要膜抗原之一,参与B 细胞的增殖、分化、活化及抗体产生,促进BCR 信号转导。
CD19 在除浆细胞阶段外的所有阶段的B细胞、恶性B 细胞以及滤泡树突状细胞(激活B 细胞、参与B 细胞免疫记忆应答)均有表达。
大部分B 细胞恶性肿瘤(如NHL、ALL 及CLL)患者均表达正常或高水平的CD19。
图14:CD19 作用机理1CAR-T细胞疗法:靶向CD19 为主,成本、疗效、质控是关键CAR-T 是将取自人体(异体或自体)的血液或肿瘤组织的T 细胞,经基因改造表面存在靶向特定蛋白质的嵌合抗原受体(CAR)的受体,体外培养在注入患者体内以治疗癌症的疗法,CAR 可与肿瘤细胞表面上的抗原结合,以触发细胞内信号传导从而激活T 细胞以消除肿瘤细胞,CAR-T 在识别肿瘤抗原时无需主要组织相容性复合体(MHC)的限制,克服由于肿瘤细胞下调MHC 表达或抑制共刺激分子分泌而造成的免疫逃逸,可有效杀死细胞表面抗原表达量较低的肿瘤细胞,目前所有商业化CAR-T 细胞疗法及大部分正在开发的CAR-T 细胞疗法为自体疗法。
图15:CAR-T 细胞疗法治疗过程及CAR 结构域CAR-T 疗法主要应用于血液肿瘤,主要源于实体瘤的异质性、缺乏独特且足量的相关抗原作为CAR-T 靶点、CAR-T 细胞难以有效进入肿瘤组织、实体肿瘤内部微环境的抑制等。
血液瘤方面,我国针对DLBCL、FL、MCL 及CLL 等疾病的主要治疗方案一般由单抗(利妥昔单抗)联合化疗,通常疗效有限,BTK 抑制剂通常会导致耐药性,约20%-30%的ALL 患者复发难治,约50%的NHL 患者最终会因抗药性而出现病情恶化,其中约15%DLBCL 患者对一线R-CHOP 疗法表现出原发难治性,约30-40%的DLBCL 患者复发,MCL 五年生存率约为25%,约60%的MM 患者标准治疗后仍面临复发或疾病进展,此外还可能导致脱靶毒性引起的严重全身不良反应等副作用,CAR-T 被认为是针对恶性血液肿瘤的最有希望的治疗手段。
全球新型抗肿瘤药物研发进展及趋势

全球新型抗肿瘤药物研发进展及趋势作者:李积宗张博文方淑蓓韩佳毛开云江洪波陈大明来源:《上海医药》2022年第25期李积宗,中共党员﹑高级工程师,上海市生物医药科技发展中心主任、上海医药行业协会副会长,长期从事生物医药领域科研项目管理、科技成果转化和软课题研究等工作,牵头建设运行上海市生物医药研发与转化功能型平台,熟悉上海生物医药科技创新政策,具有丰富的项目管理和成果转化经验。
通信作者:陈大明,研究员,长期从事生物医药等领域的科技情报研究,创新了基于关联索引的情报研究新方法,揭示了多学科交叉融合演进的范式,构建了用于专利价值和成果转化的评估框架,在软科学研究、知识产权分析、产业情报研究等方面带领团队完成了数十项研究课题,有力支撑了多种决策。
摘要:新型抗肿瘤药物已成功用于规避常规策略的某些局限性,同时提供更高的敏感性和特异性、更高的生物利用度和改善的综合治疗效果。
本文总结了过去70年的抗肿瘤药物开发里程碑,综述了基于肿瘤标志性特征的14类抗肿瘤药物开发路径,并且从多学科交叉融合的视角探索了抗肿瘤药物开发中的前景。
关键词:抗肿瘤药物多学科研究中图分类号:R979.1文献标志码:A文章编号:1006-1533(2022)S2-0001-o8引用本文李积宗,张博文,方淑蓓,等.全球新型抗肿瘤药物研发进展及趋势[J.上海医药,2022,43(S2):1-8.Noval anti-tumor drugs: global advances and trendsLlJizong' , ZHANG Bowen', FANG Shubei' ,HAN Jia', MAO Kaiyun',JIANG Hongbo , CHEN Daming( 1.Shanghai Center of Biomedicine Development,Shanghai 201203,China; 2. Shanghai lnformation Center for LifeSciences,Shanghai Institute of Nutrition and Health, Chinese Academy of Sciences ,Shanghai 200031 , China)ABSTRACT Noval anti-tumor drugs have been successfully employed to circumvent certain limitations of conventionalstrategies while providing higher sensitivity and specificity,greater bioavailability, and improved comprehensive effects fortherapeutic outcomes. This paper summarized anti-tumor drug development milestones in the past seven decades,reviewed anti-tumor drug based therapies accroding to 14 different targeting approaches, and discussed the imperative role of multidisciplinaryresearches that could drive anti-tumor drug developments.KEY WORDS anti-tumor ; drug; multidisciplinary research過去数十年来,全球肿瘤治疗巨大需求的拉动力、多种技术融合创新的驱动力,共同推动了全球抗肿瘤药物研发的快速发展。
肿瘤科中的新药研究和临床试验

肿瘤科中的新药研究和临床试验在现代医学领域中,肿瘤科是一个备受关注的领域。
肿瘤是威胁人类健康的重大疾病之一,而新药研究和临床试验是推动肿瘤科发展的重要组成部分。
本文将探讨肿瘤科中新药研究和临床试验的意义、方法以及挑战。
一、新药研究的意义肿瘤科中的新药研究对于提高肿瘤治疗效果至关重要。
随着科学技术的进步和对肿瘤发病机制的深入了解,新药的研发成为改善肿瘤患者生存率和生活质量的重要手段。
通过研究新的抗肿瘤药物,可以发现更有效的治疗方法,降低患者的病情进展风险,甚至实现肿瘤的彻底治愈。
二、新药研究的方法1. 分子生物学方法分子生物学方法在肿瘤科中的新药研究中起着重要的作用。
通过分析肿瘤相关基因的表达和突变,可以筛选出特定的药物靶点。
这些靶点可以作为新药的研发方向,帮助治疗肿瘤。
2. 细胞模型和动物模型细胞模型和动物模型是肿瘤科中新药研究的重要工具。
通过建立与人体肿瘤相似的模型,可以评估药物的疗效和毒副作用。
这些模型能够反映肿瘤在不同阶段的生长规律和治疗反应,为临床试验提供重要参考。
3. 临床前试验临床前试验是新药研究的重要环节。
在临床前试验中,研究人员通过体外和体内实验评估新药的安全性和药效。
这些试验为新药的临床应用提供了重要依据,为临床试验的设计和实施提供了指导。
三、临床试验的意义临床试验是将新药应用到人体的关键环节。
通过严格的临床试验,可以评估新药的安全性、有效性以及副作用。
临床试验的结果能够指导医生在肿瘤患者的治疗中使用合适的药物,提高治疗效果。
四、临床试验的类型1. 临床治疗试验临床治疗试验是肿瘤科中最常见的临床试验类型之一。
这些试验通常分为随机对照试验和非随机对照试验。
研究人员将肿瘤患者随机分成两组,一组接受标准治疗,另一组接受新药治疗。
通过比较两组患者的治疗效果,可以评估新药的疗效和安全性。
2. 安全性评价试验安全性评价试验是评估新药毒副作用的重要手段。
这些试验通过给健康志愿者或肿瘤患者使用新药,观察并记录其不良反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
疗失败。
• 另外,采用直接作用于癌细胞,这种疗法对正常细胞也敏感。
• 2.新策略
• 以抑制血管内皮细胞生长的基因治疗,是以血管内皮细胞为靶, 而血管内皮细胞具有相对稳定性,不易产生耐药。况且,成人正 常情况下,血管细胞是不生长的,只有在异常情况下,如出血、 伤口愈合、怀孕、胎盘生长等异常情况下才出现出现血管生长。
品的销量。
治疗肿瘤的新策略
• 饿死肿瘤的五个一
• 1.
• 2. • 3. • 4. •5
一种奇异的现象:血管疯长是病态 一种大胆的假设:肿瘤生长靠血管 一种前卫的理论:饿死肿瘤有可能 一种有益的尝试:抑制血管克癌症 一次创新的实践:饿死癌症有突破
抗肿瘤新药的研究与开发
• 项目概况:
• 1.以往治疗肿瘤的策略及缺陷
生物高技术产业及中国的机遇
• 21世纪,是人类进入信息和生命科学的社会。15年前, 远见卓识的科学家曾预言,人类基因组计划的发展, 将促成一场生物技术的革命,带来一个崭新的生物高 技术工业,从而使世界的经济及社会产生根本性的变 化。
• 基因剔除术、干细胞技术、克隆技术、功能基因组学, 特别是生物芯片技术、生物信息科学、生物功能的科 学研究、高密度发酵技术和蛋白质复性技术的发展等 等,都展现出生物高技术产业的光明前景。生物技术 产品的市场巨大,利润极其丰厚,许多国家都在积极 采取措施,鼓励和加强生物技术产业的发展。
我国医药行业存在的问题
• 药厂多且规模小;新药的研究创新不够、产品严重重 复、结构有待调整
• 我国最大的制药企业新华鲁抗制药年销售收入仅30亿人民币,
而国外的制药企业年销售收入在几十亿至几百亿美元。我国全年 的医药销售额仅相当于美国MerK公司。我国制药企业接近6500家, 远远超过西方发达国家,但按产值计还不到全国工业总产值的2%, 资产总额只占1.87%。而在美国,与健康有关的产业的产值已占 其GDP的13%。我国的制药企业并购势在必行,以改变目前药厂 多,规模小的现状,今后会有许多医药上市公司像太极集团、新华 鲁抗、三九医药等通过并购壮大。
• 判断制药业投资价值的重要方面:新药的研制开发能 力及药品的市场定位
•
一个制药企业要在竞争中获得高的收益,必须有很强的新药
研制能力。在国外一类新药的研制一般要经过8-15年,开发费用
5—8亿美元,有很大的风险性。
•
国际上一类新药的开发一般要经过以下阶段:实验室研究阶
段---中试放大阶段---临床前试验(动物实验)---一期临床试验---
内蒙古大学基因工程制药的团队介绍
• 人员优势
• 李充璧 博士 专业 医药、分子生物学 项目主持人
• 哈斯、阿古拉 教授 专业 基因工程
• 方天祺 教授、博士 专业 生化与分子生物学
• 苏格尔 教授
专业 药物化学
• 孟青 教授、博士 专业 分子生物学
• 李煜 博士
专业 组织、发育生物学
• 张竟秋 硕士
技术持有人情况
• 项目负责人李充璧博士在新药开发、基因工程、蛋白质和发酵工 程的研究中积累了丰富的经验。曾研究成功了布鲁氏菌特异性转 移因子、鸡法氏囊活性因子、抗乙肝转移因子、治疗鸡白痢的中 草药合剂、在杆状病毒的表达系统中表达了杆状病毒膜蛋白gp37 基因、克隆了10多个杆状病毒基因,输入基因库。近来在癌症的 抗血管治疗研究中取得了新的突破,已经得到了抑制肿瘤血管生成 的基因。为该项研究奠定了结实的基础和丰富的经验。发表论文 20余篇,取得科研成果2项。
二期临床试验---三期临床试验---申请新药证书---生产上市。因此,
要判断一个企业投资开发新药何时盈利,必须清楚处于哪个研制
阶段
生物制药行业特点
• 高技术、 高投入、周期长、高附加值。
• 投资者要了解生物制药行业的特点及我国的实际情况来选择公司, 公司必须有一批分子生物学方面的高级研究人员和专门人才;从 研制到生产至少有五千万至亿元的投资〈包括厂房和设备〉;一 个一类新药从实验室水平到生产上市至少3-5年以上;生物药品的 毛利率平均高达100%-200%,但企业是否盈利主要取决于生产产
• 第二年投入经费20万,要完成基因的改造、构建、筛选、整合工 作。要得到一株高表达的重组子;
• 第三年投入经费30万元。要完成基因工程菌的发酵、纯化和活性
。 检测。为下一步的动物实验以及临床实验提供样品
市场需求分析
• 全世界每年有590万人发生肿瘤,430万人死于肿瘤。我国肿瘤发 病率约为105/100000,居死亡原因的第二位,每年约有125万新病
专业 组织培养、分子生物学
• 刘晓强 硕士
专业 生化分子生物学•Leabharlann 周明海 硕士生• 曙光 硕士生
• 阿丽娅 硕士生
• 王利春硕士生
• 组织优势
• 内蒙古大学生物工程中心又是内蒙古大学211工程重点 实验室。也是自治区唯一的农牧业工程重点实验室。 实验室配备了基因工程、细胞培养、新药开发研究的 基础设备。有高速离心机、基因扩增仪、细胞培养室、 凝胶成像仪、DNA序列测定仪、蛋白纯化的层析柜、 高压电泳仪。物质分离的超滤设备。低温冷柜等。已 经基本具备了基因工程及新药分离研究的基本设施。 为完成该项目提供了良好的条件。
• 谢谢
抗肿瘤血管新药的研究与开发
• 一.项目的目的意义 • 二.国内外的研究进展 • 三.完成项目的经验及工作基础 • 四 项目完成优势和条件 • 五.项目研究的方法、技术路线 • 六 .经费预算 • 七. 项目计划的进度安排与成果 • 八.项目完成的成果及应用的市场分析
• 大都存在侵犯知识产权的问题。
• 仿制带来的后果,是我国医药企业在加入WTO后将受到严重的 影响: 一是“洋药”的大量进入对我国制药业形成较大冲击。改
革开放20多年来,我国进口药价总金额高达15亿美元。加入WTO 之后,医药产品的关税将降至5.5%—6.5%左右,这就意味着在今 后相当长的时间内,我国药品市场中的国产旧药将被疗效更快、 科技含量更高的国外新药所代替。二是加入WTO后,生产仿制药 的企业将付出高昂的费用。目前,国外药业公司在我国申请药品 发明专利数占总申请量的85%,同时还有近百个药品在我国申请 行政保护,其中已授权70多个。加入WTO后,按照国际知识产权 保护条款,仿制国外一个专利药,外方要索取4—10亿美元的赔款, 而买断一个专利药的生产许可证,至少需500至600万美元对于专 利期的仿制药品是个大问题。
预期成果
• 预计该项目完成可申报国家一类新药,并可申报具有 自我知识产权的专利。相信,在目前全球癌症呈上升 势头的情况下,类似于同类抗血管生长药的新药,由 于具有同类药研究无副作用以及抑癌效果显著的结果, 因此,其应用前景将非常广阔。
竞争对手分析:
• 国外该项目仍在实验阶段,还未进入临床。国内目前还未进行该 项研究。若我们现在开始动手,在我们前期研究的工作基础上, 若资金到位,有把握抢在国内别的研究单位之前。研究定位于国 内。若研究成功,由于其产品紧俏可以销往国外。
•
。
•
• 我国制药企业由于资金短缺,在新药的研究开发上 大多以仿制为主,导致了新药的研究创新不够、产品 严重重复、产品技术含量低、结构不合理。
• 国外制药公司年研制新药的投入,一般为销售额的8%—15%, 而我国的研发费用平均不到销售额的1%,在我国影响很大的华 北制药及新华制药,一年的开发费用为几千万元,而国外一家可 达几亿美元。化学药物仿制达97.4%,从产品结构看,抗感染类 药、维生素类、解热阵痛类占主导地位,而国外以预防、治疗心 脑血管病药为主。生物技术药物重复严重,大都存在侵犯知识产 权的问题。 仿制带来的后果,是我国医药企业在加入WTO后将 受到严重的影响: 一是“洋药”的大量进入对我国制药业形成较 大冲击
• 肿瘤细胞的生长是属于一种异常情况。采用抗肿瘤血管生长的治 疗是治疗肿瘤首选的方法。
• 有报道一个内皮细胞可支持50—100个肿瘤细胞生长,因此,抗血
管生成抑制必将在治疗肿瘤等方面有广阔的前景。
• 2.本项目的特点
• Tumstatin(抑制血管生成的新物质)2000年底从人的血管基底膜 中发现。
。 人,约90万人因此死亡,抗肿瘤血管生成药物具有巨大的需求量
项目的其它分析
• 合作方式:
• 合资、合作
• 经济效益分析:
• 根据测算,药品上市后年创汇可达8000万美元
• 项目实施过程中的风险:
• 项目在基因分离的基础上进行的研究,鉴于国外研究的肯定结果, 成功的可能性大。可以分期进行,可将风险降低到最底程度
抗肿瘤新药的研究与开发
研发单位:内蒙古大学生物工程中心
资助单位:
时
间 : 2002 年
内容介绍
• 生物高技术产业及中国的机遇
• 我国医药行业存在的问题
• 治疗肿瘤 • 抗肿瘤新药的研究与开发
• 内蒙古大学生物工程中心优势 • 本项目的概况及目的意义 • 国内外的研究进展 • 完成项目的经验及工作基础 • 项目完成优势和条件 • 项目研究的方法、技术路线 • 经费预算 • 项目计划的进度安排与成果 • 项目完成的成果及应用的市场分析
• 参加项目的其他研究人员全是由博士和硕士组成的科研队伍,特 别需要提到的是项目的主要参加人方天祺博士、教授是原内蒙古 大学校长,该同志学识渊博、经验丰富,工作负责。在生命科学, 特别是生物化学和分子生物学上具有丰厚的经验,是内蒙古自治 区的少有的专家。
投入资金分析
• 总计划任务在三年内完成。总投入70万元人民币。先期(第一年) 投入20万元,从投入经费算起的第一年要完成药品的基因分离、 体外重组。投入资金年底要写出上报材料;
• Tumstatin的抗血管生成作用是内皮抑素(Endostatin)的10倍, 而Endostatin是专一的内皮细胞增殖抑制物,其研究成果已得到肯 定。本品以抗肿瘤血管生成的药物作为靶向药物,一方面可避免 或减少对正常细胞的杀伤,另一方面可避免细胞抗药性的产生, 具有副作用小以及抑癌效果显著的特点,其应用前景非常广阔
