卵巢癌、卵管癌和腹膜癌的FIGO分期(2014)
FIGO卵巢癌,输卵管癌

2012 FIGO 卵巢癌,输卵管癌1.1原发病灶:卵巢癌、输卵管癌和腹膜癌本章所用分期采用2006年FIGO分期。
目前,FIGO妇科肿瘤委员会正在修订卵巢癌、输卵管癌和原发性腹膜癌分期。
新分期需要相关领域的所有国际组织达成一致意见,2012年在罗马召开的FIGO大会中公布(实际上没有公布——译者注)。
如有可能,肿瘤的原发部位将被明确指出(如卵巢、输卵管或腹膜)。
某些情况下,可能无法确定肿瘤的原发位置,这种情况将列为“不明确的”[1,2]。
以前,我们常以为输卵管癌罕见[2]。
近年来病理学、分子学以及遗传学证据显示,许多被诊断为低分化浆液性卵巢癌和腹膜癌可能来源于输卵管伞端[3–8]。
因此,可能严重低估了输卵管癌的发病率。
当无法判断肿瘤原发部位时,以往通常认为肿瘤起源于卵巢,最新的研究结果支持将低分化浆液性卵巢癌、腹膜癌和输卵管癌看做一类疾病。
有建议采用更准确的术语“盆腔浆液性癌”(定义为肿瘤病理类型为浆液性且肿瘤源于卵巢、输卵管或腹膜)[9]。
目前尚无针对腹膜癌的分期,可参照FIGO分期标准;根据该标准不存在I 期腹膜癌。
1.1.1原发位置上皮性卵巢癌可来源于子宫内膜异位症或卵巢皮质包涵囊肿。
(卵巢癌二元论)它包括高分化子宫内膜样腺癌、透明细胞癌、交界性和高分化浆液性癌以及粘液性癌。
这类肿瘤可能由低级别前驱病变缓慢发展而来(内膜异位囊肿或囊腺瘤等),它们可归类为I类肿瘤[5]。
输卵管癌来源于输卵管远端,多数为低分化浆液性癌。
它们可由更隐蔽的前驱病变迅速发展而来,可归类为II类肿瘤[5,6],这类疾病还包括低分化子宫内膜样腺癌和癌肉瘤,所有低分化恶性肿瘤都与TP53基因突变密切相关[5]。
(I型起病缓慢,II型起病迅速,侵袭能力强,高级别的卵巢浆液性癌起源于输卵管。
)1.1.2淋巴引流卵巢和输卵管的淋巴引流是通过子宫--卵巢骨盆漏斗韧带和圆韧带淋巴干和髂外的一分支引流到如下区域淋巴结:髂外、髂总、髂内、骶骨外侧和主动脉旁淋巴结,偶尔会引流入腹股沟淋巴结[1,10–12]。
第27章 卵巢肿瘤、输卵管肿瘤及原发性腹膜癌

妇产科学(第9版)
病理
侧别 质地 囊壁
囊内液 镜下
良性 多为单侧
浆液性肿瘤
交界性 双侧多见
单房或多房,囊性
多房囊性为主
单房:光滑, 多房:乳头(粗大, 不脆,以内生为主) 淡黄色浆液
乳头丰富,较细, 多数为外生性
浆液
单层立方或柱状上皮
①细胞轻、中度异型 ②复层上皮 ③无间质浸润
恶性 多为双侧 多房囊性,半实质性 大量乳头,分支细, 质脆,易脱落-恶性乳头
• 恶性肿瘤的鉴别诊断 – 子宫内膜异位症 – 盆腔结缔组织炎 – 结核性腹膜炎 – 生殖道以外的肿瘤
妇产科学(第9版)
治疗
卵巢肿瘤一经发现,应行手术。手术目的: ①明确诊断 ②切除肿瘤 ③恶性肿瘤进行手术病理分期 ④解除并发症
妇产科学(第9版)
治疗
• 术中应剖检肿瘤,必要时作冰冻切片组织学检查以明确诊 断
妇产科学(第9版)
组织学分类
• 分类方法多,最常用的是世界卫生组织的卵巢肿瘤组织 学分类(2014版)
分类 上皮性肿瘤
比例 50%~70%
生殖细胞肿瘤
20%~40%
性索-间质肿瘤 恶性转移性肿瘤
5%~8% 5%~10%
妇产科学(第9版)
组织学分类
一、上皮性肿瘤
1.浆液性肿瘤 2.黏液性肿瘤 3.子宫内膜样肿瘤 4.透明细胞肿瘤 5.移行细胞肿瘤 6.鳞状细胞肿瘤 7.混合性上皮性肿瘤 8.未分化和未分化类肿瘤
妇产科学(第9版)
恶性肿瘤随访
卵巢癌易于复发,需长期接受监测和随访。 随访时间:术后1年内,每3月随访1次;术后第2年后,每4-6个月 随访1次;第5年后每年1次。随访内容包括询问病史,体格检查 ,肿瘤标志物检测,影像学检查。CA125、AFP、HCG等肿瘤标志 物根据组织学类型选择。 超声检查异常再选择CT、MRT或PET-CT 检查。
卵巢癌、输卵管癌、腹膜癌手术分期标准-FIGO2014年
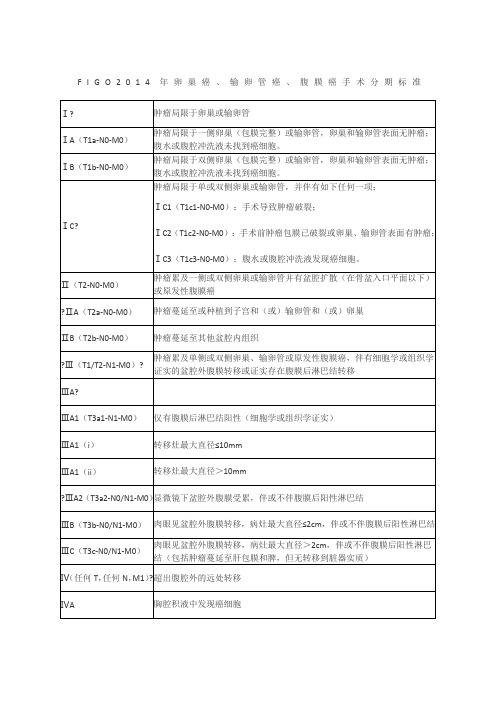
F I
G O2014年卵巢癌、输卵管癌、腹膜癌手术分期标准
注:(1)肿瘤原发部位——卵巢、输卵管还是腹膜应尽可能明确。
但是在某些情况下,可能无法确定肿瘤的原发位置,这种情况将列为“原发部位不明确”。
(2)应当记录肿瘤的组织学类型。
(3)新分期对Ⅲ期进行了修改,肿瘤扩散至腹膜后淋巴结但无腹腔内转移的
患者,分期被调整为ⅢA1期,这样调整的原因在于这些患者的预后显着优于发生腹腔内播散的患者。
(4)腹膜后淋巴结转移应当使用细胞学或组织学进行证实。
(5)肿瘤从大网膜扩散至脾或肝脏(ⅢC)应当与孤立性脾或肝实质转移相区别。
2024卵巢癌的基本介绍及病理分型

2024卵巢癌的基本介绍及病理分型在我国,卵巢癌年发病率居女性生殖系统肿瘤第3位,位于子宫颈癌和子宫体恶性肿瘤之后,呈逐年上升的趋势,而病死率位于女性生殖道恶性肿瘤之首。
卵巢恶性肿瘤包括多种病理类型,其中最常见的是上皮性癌,约占卵巢恶性肿瘤的80%,其次是恶性生殖细胞肿瘤和性索间质肿瘤,各约占10%和5%,本指南主要针对卵巢上皮性癌和恶性生殖细胞肿瘤。
卵巢深处盆腔,卵巢病变处于早期时常无特异临床症状,因出现症状就诊时,70%的患者已处于晚期。
卵巢癌具有一定的遗传性和家族聚集特征,目前已知与卵巢癌相关的遗传易感基因中以乳腺癌易感基因(BRCA影响最为显著。
BR约有20个,其CAl和BRCA2胚系突变携带者在一生之中发生卵巢癌的累积风险分别达54%和23%,是卵巢癌的高危人群。
对于BRCA1/2胚系突变携带者,推荐从30-35岁起开始定期行盆腔检查、血CA125和经阴道超声的联合筛查。
止匕外,还有林奇综合征、利-弗劳梅尼综合征家族的女性都是卵巢恶性肿瘤的高危人群,需要检测的基因还包括ATM、RAD51C x RAD51D、MLH1、MSH2、MSH6、PSM2、EPCAM x STK11等。
卵巢上皮癌多见于绝经后女性。
由于卵巢深居盆腔,卵巢上皮性癌早期症状不明显,往往是非特异性症状,难以早期诊断,约2/3的卵巢上皮性癌患者诊断时已是晚期。
晚期时主要因肿块增大或盆腹腔积液而出现相应症状,表现为下腹不适、腹胀、食欲下降等,部分患者表现为短期内腹围迅速增大,伴有乏力、消瘦等症状。
也可因肿块压迫出现大小便次数增多的症状。
出现胸腔积液者可有气短.难以平卧等表现。
卵巢恶性生殖细胞肿瘤常见于年轻女性,临床表现与上皮癌有所不同,早期即出现症状,除腹部包块腹胀外,常可因肿瘤内出血或坏死感染而出现发热,或因肿瘤扭转.肿瘤破裂等而出现急腹症的症状。
约60%~70%的患者就诊时属早期。
组织病理组织学检查是卵巢癌诊断的金标准。
卵巢癌分期

卵巢癌、卵管癌和腹膜癌的FIGO分期(2014)分享|发布时间:2014年06月04日点击数:3141 次字体:小大1973年FIGO首次发布卵巢癌、卵管癌和腹膜癌的分期,1988年有过一次修订。
本次为第三个版本。
卵巢癌不是一种单纯的疾病,包括数种临床和病理特点迥异的肿瘤。
大约90%为恶性上皮性癌(carcinomas)。
根据组织学、免疫组化和分子遗传学分析,至少有5种主要类型:高级别浆液性癌(70%),内膜样癌(10%),透明细胞癌(10%),粘液性癌(3%)和低级别浆液性癌(不足5%)。
上述类型占据约98%的卵巢癌类型。
恶性生殖细胞肿瘤(无性细胞瘤,卵黄囊瘤,未成熟畸胎瘤)约占3%,恶性潜能的性索间质肿瘤(主要是颗粒细胞瘤)约占1-2%。
原发性卵管癌和原发性腹膜癌比较罕见,和HGSC有很多相似的临床及形态特点,且主要发生在BRCA1/2遗传变异的女性中。
大量证据发现这些肿瘤主要为卵管起源。
而散发的HGSC则有多种来源可能。
既往“苗勒氏管新生化生(mullerian neometaplasia)”的概念得到更多证据支持。
而绝大部分ECs和CCCs则可能来源于内异症。
新的FIGO分期在2012年10月12日提交至FIGO执行委员会,2周后通过。
表1至表3是建议的具体分期系统。
准确的组织病理诊断对于卵巢癌成功分类及治疗至关重要,不同组织学类型对治疗的反应是不同的。
FIGO委员会选择的这种分类系统,将所有肿瘤类型共享的最相关的预后因素考虑在内。
但是,在诊断和分期的时候,仍应清楚说明具体卵巢癌的组织类型。
目前达成一致的组织学类型包括:1.上皮性癌(按频率顺序排列):高级别浆液性癌(HGSC),内膜样癌(EC),透明细胞癌(CCC),粘液性癌(MC),低级别浆液性癌(LGSC)。
注:移行细胞癌目前认为是HGSC 的一种变异形态;恶性Brenner瘤则被认为是极端罕见的低级别癌。
2.恶性生殖细胞肿瘤(无性细胞瘤,卵黄囊瘤,未成熟畸胎瘤)。
卵巢癌病理figo分级i级

卵巢癌病理FIGO分级I级,指的是肿瘤局限在卵巢或输卵管内,没有或者很少有淋巴结转移。
根据FIGO(国际妇产科联盟)的定义,I级卵巢癌包括以下三个亚类:
1. IA类:肿瘤局限在单个卵巢或输卵管内,没有肿瘤破裂。
2. IB类:肿瘤局限在两个卵巢或输卵管内,没有肿瘤破裂。
3. IC类:肿瘤局限在一个或两个卵巢或输卵管内,有肿瘤破裂。
需要注意的是,FIGO分级只是对卵巢癌的病理严重程度进行了分类,具体的治疗方案还需要根据患者的个体情况(如年龄、身体状况等)和肿瘤的具体特征(如大小、生长速度、病理类型等)来制定。
妇科肿瘤PPT课件

其他CA125升高的常见原因
良性肿瘤和其他疾病 子宫内膜异位症 子宫肌瘤
PID OHSS 放疗 卵巢良性肿瘤
生理状态 月经来潮
妊娠 手术后
生物学特性
蛋白酶抑制剂家族 • 相应的底物和HE4的生物学功能未知 • 可能是抗菌、抗炎因子
HE4特点 • 在生殖系统和呼吸系统表达 • 卵巢癌最常见升高的标志物 • 无论疾病的早期还是晚期阶段,均出现mRNA和蛋白水平表达的升高 • 对 CA125有效补充
立因素 在肝癌、睾丸癌及一些良性肝脏疾病也可升高
参考范围<7ng/ml
其他原因: 恶性肿瘤 良性疾病或生理状态
原发性肝癌 病毒性肝炎、肝硬
化
卵巢生殖细胞肿瘤 妊娠
胃癌
胎儿神经管畸形
胰腺癌
双胎
结肠癌
CEA是应用最广泛是肿瘤标志物 在很多上皮性肿瘤,肺癌、乳腺癌、卵巢癌等都
有升高 也可在多种良性疾病中升高,胃肠道疾病、肺部
妇科肿瘤 与
肿瘤标志物
.
盆腔图
2014卵巢癌FIGO分期
I期:局限于卵巢
III期:局限于腹腔或腹膜后淋巴结
II期:局限于盆腔
IV期:远处转移
卵巢肿瘤组织来源
上皮性肿瘤:60% 生殖细胞肿瘤:30% 性索/间质肿瘤:8% 转移性肿瘤:2% 恶性肿瘤90%为上皮来源,高级别浆液
参考范围HE4 <140pmol/L
1 Bouchard D et al. Lancet Oncol 2006; 7, 167–74. 2 Hellström I et al. Cancer Res. 2003, 63, 3695–3700.
HE4 高表达
第18届FIGO世界妇产科学术会议纪要——卵巢肿瘤篇

仝国篡厦塑整董芒柱童盍2Q塑至!堡旦蔓丝鲞蔓堕翅文章编号:1005—2216(2007)10-0809—03809t医学动态第18届FIGO世界妇产科学术会议纪要——卵巢肿瘤篇中图分类号:R7i文献标志码:A姚润斯。
罗新第18届FIGO世界妇产科会议(XⅦFIGOWorldCon-gressofcynecologyandObste廿ics)于2006年11月5日至10习在马来西亚的吉隆坡举行,来自世界各地的与会代表数千人。
在5天的会议期间,关于卵巢肿瘤方面的交流文章有74篇,内容包括卵巢肿瘤的病因、病理、筛查、诊断、治疗、预后、特殊临床病例等方面。
l发病高危因素及病因丹麦肿瘤流行病协会和肿瘤协会的研究表明,曾经妊娠、妊娠次数多、末次妊娠年龄较大、使用过口服避孕药和较长时间持续使用口服避孕药可以降低卵巢浆液性肿瘤、子宫内膜样肿瘤的发病风险.而吸烟是患黏液性卵巢癌的一个危险因素。
另一个研究用标准发病率比较不孕妇女与普通妇女患卵巢癌的风险,结果不孕妇女比普通妇女患卵巢癌的风险高,但需进一步证实究竟是激素治疗不孕症还是其他因素造成不孕症妇女的卵巢癌发病风险增高。
波兰医科大学介绍了类吗啡物质结合蛋自/细胞黏附分子(OPCML)近年来被认为可能是肿瘤抑制基因,OPCML基因在卵巢癌中的表达减少可能是由于启动子区的超甲基化使抑制因子功能丧失所致。
波兰Mother§Memorial医院和中国浙江大学的研究都发现,晚期卵巢癌妇女的外周血中CD4+/CD25+调节T细胞增多而CD4/CD8T细胞的比侧下降,表明晚期卵巢癌妇女的免疫功能不良。
波兹南大学与预防和流行病学中心联合研究鉴定了卵巢癌或子宫内膜癌妇女中BRCAI基因在13位突变。
21%的患者患卵巢癌。
波兰的多位学者还研究了外周血淋巴细胞与卵巢癌细胞问的相互作用。
结果示TNF-alpha和IL-2(Thl)水平下降,IL-10和IL-6(Th-2)生成增加。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
卵巢癌、卵管癌和腹膜癌的FIGO分期(2014)
1973年FIGO首次发布卵巢癌、卵管癌和腹膜癌的分期,1988年有过一次修订。
本次为第三个版本。
卵巢癌不是一种单纯的疾病,包括数种临床和病理特点迥异的肿瘤。
大约90%为恶性上皮性癌(carcinomas)。
根据组织学、免疫组化和分子遗传学分析,至少有5种主要类型:高级别浆液性癌(70%),内膜样癌(10%),透明细胞癌(10%),粘液性癌(3%)和低级别浆液性癌(不足5%)。
上述类型占据约98%的卵巢癌类型。
恶性生殖细胞肿瘤(无性细胞瘤,卵黄囊瘤,未成熟畸胎瘤)约占3%,恶性潜能的性索间质肿瘤(主要是颗粒细胞瘤)约占1-2%。
原发性卵管癌和原发性腹膜癌比较罕见,和HGSC有很多相似的临床及形态特点,且主要发生在BRCA1/2遗传变异的女性中。
大量证据发现这些肿瘤主要为卵管起源。
而散发的HGSC则有多种来源可能。
既往“苗勒氏管新生化生(mullerian neometaplasia)”的概念得到更多证据支持。
而绝大部分ECs和CCCs则可能来源于内异症。
新的FIGO分期在2012年10月12日提交至FIGO执行委员会,2周后通过。
表1至表3是建议的具体分期系统。
准确的组织病理诊断对于卵巢癌成功分类及治疗至关重要,不同组织学类型对治疗的反应是不同的。
FIGO委员会选择的这种分类系统,将所有肿瘤类型共享的最相关的预后因素考虑在内。
但是,在诊断和分期的时候,仍应清楚说明具体卵巢癌的组织类型。
目前达成一致的组织学类型包括:
1.上皮性癌(按频率顺序排列):高级别浆液性癌(HGSC),内膜样癌(EC),
透明细胞癌(CCC),粘液性癌(MC),低级别浆液性癌(LGSC)。
注:移行细
胞癌目前认为是HGSC的一种变异形态;恶性Brenner瘤则被认为是极端罕见的
低级别癌。
2.恶性生殖细胞肿瘤(无性细胞瘤,卵黄囊瘤,未成熟畸胎瘤)。
3.恶性潜能的性索间质肿瘤(主要是颗粒细胞瘤,以及含有异源性肉瘤成分的
Sertoli-Leydig细胞瘤)。
作者最后说:分期如水(Staging should be considered fluid),世界越来越小,更多的研究组织应该一起为更加准确的预后系统而努力奋斗。
表1. 2014年FIGO有关卵巢癌、输卵管癌和腹膜癌的分期系统及相应的TNM。
注1:包括肿瘤蔓延至肝脏和脾脏包膜,但不包括脏器实质的受累。
注2:脏器实质转移属于IVB期。
表2. 卵巢癌、输卵管癌和腹膜癌的分组。
注:1.如有可能就应该标注原发部位。
有些情况下可能无法明确说明原发部位,即“未明确部位的(undesignated)”。
2.应该记录组织学类型。
3.分期包括对III期的修订。
分配至IIIA1期的情况基于肿瘤播散至腹膜后淋巴结但没有
腹腔内播散,因为对这些患者的分析发现她们的生存显著优于那些有腹腔内转移的情况。
4.腹膜后淋巴结的受累必须通过组织学或细胞学确诊。
5.从大网膜转移至脾脏或肝脏的情况(IIIC期)应该和那些脾脏或肝脏实质孤立转移的
情况(IVB期)相鉴别。
表3. 对分期改变的解释。
