第二章 晶体结构
第二章晶体结构

为6个晶胞所共有,上下底面中心的原子为2个晶胞所共有,
所以六方柱晶胞所包含的原子数为:
12
1 6
2
1 2
3 6
二、非金属元素单质的晶体结构
1.惰性气体元素的晶体 惰性气体在低温下形成的晶体为A1(面心立方)型 或A3(六方密堆)型结构。由于惰性气体原子外层为满 电子构型,它们之间并不形成化学键,低温时形成的晶 体是靠微弱的没有方向性的范德华力直接凝聚成最紧密 堆积的A1型或A3型分子晶体。
-填充在八个小立方体的体心。
Ca2+的配位数是8,形成立方配位多面体[CaF8]。F-的配位数
是4,形成[FCa4]四面体,F-占据Ca2+离子堆积形成的四面体
空隙的100%。 或F-作简单立方堆积,Ca2+占据立方体空隙的一半。 晶胞分子数为4。 由一套Ca2+离子的面心立方格子和2套F-离子的面心立方格子
金
红
石
0 .4 1 4 ~ 0 .7 3 2
TeO 2 C oF2 SnO 2 O sO 2 VO2 M nO 2
( T iO 2 ) 型
-方 石 英 型
0 .2 2 5 ~ 0 .4 1 4
S iO 2
1.萤石(CaF2)型结构及反萤石型结构
立方晶系,点群m3m,空间群Fm3m,如图2-10所示。 Ca2+位于立方晶胞的顶点及面心位置,形成面心立方堆积,F
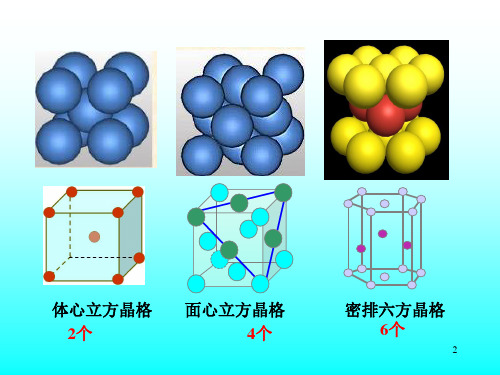
(a)面心立方 (A1型)
(b)体心立方 (A2型)
(c)密排六方 (A3型)
图2-1 常见金属晶体的晶胞结构
面心立方结构
常见面心立方的金属有Au、Ag、Cu、Al、-Fe 等,晶格结构中原子坐标分别为[0,0,0],[0,1/2,1/2],
第二章 晶体结构

晶胞
• 有实在的具体质点所 组成
平行六面体
• 由不具有任何物理、化学 特性的几何点构成。
是指能够充分反映整个晶体结构特征的最小结构单位, 其形状大小与对应的单位平行六面体完全一致,并可用 晶胞参数来表征,其数值等同于对应的单位平行六面体 参数。
晶胞棱边长度a、b、c,其单位为nm ,棱间夹角α、β、 γ。这六个参数叫做点阵常数或晶格常数。
面网密度:面网上单位面积内结点的数目; 面网间距:任意两个相邻面网的垂直距离。
相互平行的面网的面网密度
和面网间距相等; 面网密度大的面网其面网间 距越大。
空间格子―――连接分布在三维空间的结点构成空 间格子。由三个不共面的行列就决定一个空间格子。
空间格子由一系列 平行叠放的平行六 面体构成
2-1 结晶学基础
一、空间点阵
1.晶体的基本概念 人们对晶体的认识,是从石英开始的。 人们把外形上具有规则的几何多面体形态的 固体称为晶体。 1912年劳厄(德国的物理学家)第一次成功 获得晶体对X射线的衍射线的图案,才使研究 深入到晶体的内部结构,才从本质上认识了 晶体,证实了晶体内部质点空间是按一定方 式有规律地周期性排列的。
第二章 晶体结构
第二章 晶体结构
1
结晶学基础 晶体化学基本原理 非金属单质晶体结构
2
3 4 5
无机化合物晶体结构
硅酸盐晶体结构
重点:重点为结晶学指数,晶体中质点的堆 积,氯化钠型结构,闪锌矿型结构,萤石型 (反萤石型)结构,钙钛矿型结构,鲍林规 则,硅酸盐晶体结构分类方法。 难点:晶体中质点的堆积,典型的晶体结构 分析。
• 结点分布在平行六面
体的顶角; •平行六面体的三组棱长 就是相应三组行列的结 点间距。
第二章 晶体结构 - 2.3.9尖晶石型晶体结构分析_06.15_CG

材料科学基础第2 章2.3.9尖晶石型晶体结构分析AB 2O 4的单位晶胞24化学式AB 2O 4A: 2价阳离子B: 3价阳离子晶体结构立方晶系Z=8离子堆积情况O 2-按立方紧密堆积排列,A 2+填充八分之一四面体空隙,B 3+填充二分之一八面体空隙24尖晶石晶体结构[AlO6]八面体[MgO4]四面体代表性物质镁铝尖晶石MgAl2O4a0=0.808nm,Z=8有缘学习更多驾卫星ygd3076或关注桃报:奉献教育(店铺)[AlO 6]八面体[MgO 4]四面体24[AlO 6]八面体[MgO 4]四面体[AlO 6]八面体[MgO 4]四面体共顶连接共棱连接彼此孤立通过八面体共顶连接共顶连接尖晶石晶体结构(a)(b)M 区(c) N 区Mg 2+O 2-Mg 2+O 2-At 3+24反尖晶石24 如果二价阳离子分布在八面体空隙中,而三价阳离子一半在四面体空隙中,另一半在八面体空隙中的尖晶石,称为反尖晶石。
性能与用途①性能②用途典型的磁性非金属材料,性能比磁性金属材料更优越。
具有强磁性,高电阻,低松弛损耗等特点可做无线电、电视、电子装置的元件,计算机中做记忆元件,微波器中做永久磁石24尖晶石型结构晶体氟、氰化物氧化物硫化物BeLi 2F 4TiMg 2O 4ZnCr 2O 4ZnFe 2O 4MgAl 2O 4MnCr 2S 4MoNa 2F 4VMg 2O 4CdCr 2O 4CoCo 2O 4MnAl 2O 4CoCr 2S 4ZnK 2(CN)4MgV 2O 4ZnMn 2O 4CuCo 2O 4FeAl 2O 4FeCr 2S 4CdK 2(CN)4ZnV 2O 4MnMn 2O 4FeNi 2O 4MgGa 2O 4CoCr 2S 4MgK 2(CN)4MgCr 2O 4MgFe 2O 4GeNi 2O 4CaGa 2O 4FeNi 2S 4FeCr 2O 4FeFe 2O 4TiZn 2O 4MgIn 2O 4AB 2O 4型无机化合物(尖晶石)的晶体结构MgAl2O4性能与用途①性能②用途硬度较大,莫氏硬度为8级,熔点为2105℃,ρ=3.55g/cm3,化学性质较稳定,热稳定性好(热膨胀系数小,为7.6×10-6)镁铝尖晶石是用途很广泛的优良耐高温材料24Al-O键与Mg-O离子结合键强24在镁铝尖晶石结构中,在一个氧离子周围,有一个镁离子和三个铝离子,由静电价规则:由此可见,氧离子的电价是饱和的。
第二章--节晶体结构与常见晶体类型
2r-+2r+= a0
2r-=x
2r- x
2r 2r 2x
2r 2r 2x
2r
x
r 0.414 r
正负离子相互 接触状态
26
当r+/r-=0.414时,正负离子刚好处于相互接触状态(临界 状态); 当r+/r-<0.414时,负离子间相接触,而正、负离子相脱 离,负离子间斥力大,能量高,使结构不稳定; 当r+/r->0.414时,正、负离子间相接触,而负离子间相 脱离,这时正、负离子引力较大,负离子间斥力小,能 量较低,结构仍是稳定的。
对于面心立方晶胞,原子半径=R,
a 2 2R
V a3 16 2R3
V球
4 4 R3
3 100 % 74.05%
V晶胞 16 2R3
15
名称
堆积方式
配位 数
密排面
空隙
堆积 系数
六方密 堆积
ABAB……
12
∥ 四面体空隙 (0001) 八面体空隙
0.74
立方密 ABCABC…… 堆积 Nhomakorabea12
r + /r 0~0.155 0.155 ~0.225 0.225 ~0.414 0.414 ~0.732 0.732 ~1
1
配位数 2 3 4 6 8 12
配位多面体 直线 三角形 四面体 八面体 立方体
立方八面体
P29
23 23
※分析:对于NaCl晶体,Na+的配位数是6;对于CsCl晶 体 , Cs+ 的 配 位 数 是 8 。 这 是 由 于 rCs+ > rNa+ (0.182nm>0.110nm)。Cs+填入的空隙比八面体更大些, 即Cs+周围比Na+周围能排列更多的Cl-。所以,Cs+离子 的配位数大于Na+的配位数。
材料科学基础第二章

y
[111]
x
[111]
例:画出晶向
[112 ]
2.立方晶系晶面指数
晶面指数的确定方法
(a)建立坐标系,结点为原点, 三棱为方向,点阵常数为单位 (原点在标定面以外,可以采 用平移法); (b)晶面在三个坐标上的截距a1 a2 a3 ; (c)计算其倒数 b1 b2 b3 ; (d)化成最小、整数比h:k:l ; 放在圆方括号(hkl),不加逗号, 负号记在上方 。
3.六方晶系晶面和晶向指数
三指数表示六方晶系晶面和晶向的缺点:晶体学上等价的 晶面和晶向不具有类似的指数。 例:
晶面指数
(11 0)
(100)
[010] [100]
从晶面指数上不能明确表示等同晶面,为了克服这一缺点, 采用a1、a2、a3及c四个晶轴, a1、a2、a3之间的夹角均 为120º ,晶面指数以(hkil)表示。 根据立体几何,在三维空间中独立的坐标轴不会超过三 个可证明 : i= - (h+k) 或 h+k+i=0
六方晶系
d hkl
h k l a b c
2 2 2
d hkl
a h2 k 2 l 2
1 l c
2
4 h 2 hk k 2 3 a2
注:以上公式是针对简单晶胞而言的,如为复杂晶胞, 例如体心、面心,在计算时应考虑晶面层数增加的影 响,如体心立方、面心立方、上下底(001)之间还有 一层同类型晶面,实际
[1 00 ]
[0 1 0]
[010]
[1 00]
y
[100]
x
[00 1]
第2章 材料中的晶体结构

b. 已知两不平行晶向[u1v1w1]和[u2v2w2 ],由其决定的 晶面指数(hkl)为:
h v1 w 2 v 2 w 1 , k w 1u 2 w 2 u 1, l u 1 v 2 u 2 v1
补充
cos
2
(对于立方晶系)
两个晶面(h1k1l1)与(h2k2l2)之间的夹角φ
h h
1 2
k k
1 2
2
2
ll
1
2 2 2
(h1
k
2 1
l1 )
(h 2
k
l
2 2
)
两个晶向[u1v1w1]与[u2v2w2]之间的夹角θ
cos
2
u u
1
2
vv
1 2
2
w w
1 2
2
(u 1
v
2 1
w1)
(u 2
v
2 2
w
2 2
)
晶面(hkl)与晶向[uvw]之间的夹角ψ
晶向指数用[uvtw] 来表示。其中 t =-(u+v)
120° 120°
晶面指数的标定
1.求晶面与四个轴的截距
2.取倒数
3.再化成简单整数
4.用圆括号括起来(h k i l)
六方系六个侧面的指数分别为:
(1 1 00),(01 1 0),(10 1 0),(1 100),(0 1 10),(1 010)
(210)
(012)
(362)
注意
选坐标原点时,应使其位于待定晶面以外,防止 出现零截距。 已知截距求晶面指数,则指数是唯一的;而已知 晶面指数,画晶面时,这个晶面就不是唯一的。
第二章材料中的晶体结构
TiO2
体心四方
1个正离子 2个负离子
6
3
八面体 VO2, NbO2, MnO2, SnO2, PbO2, …
7. MgAl2O4(尖晶石)晶型
8.Al2O3(刚玉)晶型
第四节 共价晶体的结构
一、共价晶体的主要特点 1. 共价键结合,键合力通常强于离子键 2. 键的饱和性和方向性,配位数低于金属和离 子晶体 3. 高熔点、高硬度、高脆性、绝缘性
(2) 求投影.以晶格常数为单位,求待定 晶向上任一阵点的投影值。
(3) 化整数.将投影值化为一组最小整数。
(4) 加括号.[uvw]。
2.晶面指数及其确定方法
1) 晶面指数 — 晶体点阵中阵点面的 方向指数。 2) 确定已知晶面ห้องสมุดไป่ตู้指数。
(1) 建坐标.右手坐标,坐标轴为晶胞 的棱边,坐标原点不能位于待定晶面内。
cph
a=b≠c
a 2r
5. 致密度 — 晶胞中原子体积占总体积的分数
bcc
fcc
cph
3 0.68
8
2 0.74
6
2 0.74
6
6. 间隙 — 若将晶体中的原子视为球形,则相 互接触的最近邻原子间的空隙称为间隙。
间隙内能容纳的最大刚性球的半径称为
间隙半径 rB。 间隙大小常用间隙半径与原子半径 rA之
比 rB / rA 表示。
1) 面心立方结构晶体中的间隙 正八面体间隙:位于晶胞各棱边中点及体心位置.
一个晶胞中共有4个.
rB / rA 0.414
正四面体间隙:位于晶胞体对角线的四分之一处. 一个晶胞中共有8个.
rB / rA 0.225
2) 体心立方结构晶体中的间隙 扁八面体间隙:位于晶胞各棱边中点及面心处. 一个晶胞中共有6个. rB / rA 0.155
第二章晶体结构与常见晶体结构类型

2.1.2 三维空间点阵中直线点阵与平面点阵的表达
结晶符号
定义:表示晶面、晶列(棱)等在晶体上方位的简单的数字符号。 坐标系体的构成; 原点和三个不共面的基矢a、b、和c。
(1)直线点阵或晶列的表达
晶向符号(晶棱符号)
定义:用简单数字符号来表达晶棱或者其他直线(如坐标轴) 在晶体上的方向的结晶学符号。也称Miller指数。
补充 2、数学的证明方法为: t’ = mt
t’= 2tsin(-90)+ t = -2tcos + t
所以,mt = -2tcos + t
t’
2cos = 1- m
cos = (1 - m)/2
-2 1 - m 2
t t
m = -1,0,1,2,3
相应的 = 0 或2 , /3,
晶体的宏观对称操作与对称要素 对称操作 假想的辅助几何要素
对称要素
简单 复杂
反伸(倒反)
点
反映
面
旋转
线
旋转+反伸
线和线上的定点
旋转+反映 线和垂直于线的平面
对称中心 对称面 对称轴
旋转反伸轴 旋转反映轴
1、对称中心i(inversion):一个假想的几何点,在通过该
点的任意直线的两端可以找到与其等距离的点。
1 结点(node):点阵中的点。 结点间距:相邻结点间的距离。
空间点阵几何要素(点线面)
2 行列(row) :结点在直线上的排列。 特点:平行的行列间距相等。
3 面网(net)
面网:由结点在平面上分布构成的平面。 特点:任意两个相交行列便可以构成一个面网。
面网密度:面网上单位面积内的结点数目。 面网间距:两个相邻面网间的垂直距离,平行面网间距相等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章晶体结构【例2-1】计算MgO和GaAs晶体中离子键成分的多少。
【解】查元素电负性数据得,,,,则MgO离子键%=GaAs离子键%=由此可见,MgO晶体的化学键以离子键为主,而GaAs则是典型的共价键晶体。
【提示】除了以离子键、共价键结合为主的混合键晶体外,还有以共价键、分子间键结合为主的混合键晶体。
且两种类型的键独立地存在。
如,大多数气体分子以共价键结合,在低温下形成的晶体则依靠分子间键结合在一起。
石墨的层状单元内共价结合,层间则类似于分子间键。
正是由于结合键的性质不同,才形成了材料结构和性质等方面的差异。
从而也满足了工程方面的不同需要。
【例2-2】NaCl和MgO晶体同属于NaCl型结构,但MgO的熔点为2800℃, NaC1仅为80l℃,请通过晶格能计算说明这种差别的原因。
【解】根据:晶格能(1)NaCl晶体:N0=6.023×1023 个/mol,A=1.7476,z1=z2=1,e=1.6×10-19 库仑,,r0===0.110+0.172=0.282nm=2.82×10-10 m,m/F,计算,得:E L=752.48 kJ/mol(2)MgO晶体:N0=6.023×1023个/mol,A=1.7476,z1=z2=2,e=1.6×10-19库仑,r0==0.080+0.132=0.212 nm=2.12×10-10 m,m/F,计算,得:E L=3922.06 kJ/mol则:MgO晶体的晶格能远大于NaC1晶体的晶格能,即相应MgO的熔点也远高于NaC1的熔点。
【例2-3】根据最紧密堆积原理,空间利用率越高,结构越稳定,但是金刚石的空间利用率很低,只有34.01%,为什么它也很稳定?【解】最紧密堆积的原理只适用于离子晶体,而金刚石为原子晶体,由于C-C共价键很强,且晶体是在高温和极大的静压力下结晶形成,因而熔点高,硬度达,很稳定。
(金刚石结构属于立方晶系,碳原子的配位数为4,在三维空间形成架状结构,刚性非常大)【例2-4】证明:对于一个密排面中的每个原子,在两个密排面之间有两个四面体空隙和一个八面体空隙。
【解】根据密堆积中四面体和八面体空隙出现的规律,在两层密排面之间,每个原子周围有四个四面体空隙和三个八面体空隙。
同时,该原子也与上层原子形成密排堆积。
故每个原子周围相邻的四面体空隙数为=2×4=8;八面体空隙数=2×3=6个。
因四面体空隙由4个原子(或球)构成,八面体空隙由六个原子构成,故平均属每一个原子的四面体空隙数NT=1/4 × 8=2个,而八面体空隙数为NO=1/6 × 6=1个。
【例2-5】指出等径球面心立方堆积中的八面体和四面体空隙位置,并计算其空间利用率。
【解】参阅教材图2-17(b),等径球单位面心立方晶胞内球体数目为8×1/8+6×1/2=4个,则八面体空隙数为4个,分别位于:体中心和每条棱的中点。
位于棱中点的八面体空隙位置共有12个,但属于单位晶胞的仅为1/4,即12×1/4=3个,加上体心1个,单位晶胞中共有4个八面体空隙。
四面体空隙数为2×4=8,分别位于:单位晶胞的4条体对角线上,每条体对角线1/4和3/4位置处为2个四面体空隙位置,每个四面体空隙由顶角球与其相邻的三个面心球围成。
若球体半径为r,晶胞参数为a,则,即,于是:空间利用率(堆积系数)【提示】采用同样方法可以计算出六方密堆积的PC亦为0.7405。
通过比较晶体空间利用率的大小,可以判断晶体宏观物理性质密度、折射率等的相对大小,建立起结构和性质之间的相互关系。
【例2-6】有一个面心立方结构的晶体,密度为8.94 g/cm3,计算其晶胞参数和原子间距。
【解】设该晶体的原子相对质量为M,晶胞体积为V。
在面心立方紧密堆积晶胞中,原子数为n=4。
据此可求得:晶胞体积nm3晶胞参数nm在面心立方密堆积中原子半径r与晶胞参数之间有如下关系:则:原子间距nm【例2-7】对于AX型化合物,当正、负离子为1价时,大多数为离子化合物;正负离子为2价时,形成的离子化合物减少,ZnS即为共价型化合物;正负离子为3价、4价时,则形成共价化合物,如AlN、SiC等,试解释原因。
【解】对于1价正离子而言,最外层只有1个电子,很容易失去,其电负性比较小;对于1价负离子而言,最外层有7个电子,很容易得到1个电子而形成满壳层结构,其电负性比较大。
两种1价离子形成化合物时因电负性相差较大,故多形成离子化合物。
随价态升高,正离子极化能力增强,负离子极化率增大,形成化合物时,极化效应很强。
加之两元素之间电负性差值减小,故共价键成份增加,形成的为共价化合物。
【例2-8】临界半径比的定义是:密堆的负离子恰好互相接触,并与中心的正离子也恰好接触的条件下,正离子与负离子半径之比。
即出现一种形式配位时,正离子与负离子半径比的下限。
计算下列各类配位时的临界半径比:(1)立方体配位;(2)八面体配位;(3)四面体配位;(4)三角形配位。
【解】(1)立方体配位在(110)面上正负离子正好接触。
则体对角线长为:且故得:立方体配位的临界半径比(2)八面体配位为中间层正负离子接触,可得(3)已知正四面体的夹角为109º28´,可得:(4)三角形配位,有:【例2-9】MgO具有NaCl结构。
(1)画出MgO在(111)、(110)和(100)晶面上的离子排布图,计算每种晶面上离子排列的面密度,并指出四面体及八面体空隙的位置;(2)根据O2-半径为0.132nm 和Mg2+半径为0.080nmn,计算MgO晶体的空间利用率及密度。
【解】(1)MgO在(111)、(110)和(100)晶面上的原子排布图如图2-1所示。
面排列密度的定义为:在该面上接触球体所占的面积分数。
图2-1 MgO在(111)、(110)和(100)晶面上的原子排布①(111)晶面上排布的全是O2-,个数为每个O2-的截面积nm2∵ nm(111)晶面面积nm2则:(111)晶面离子的面排列密度②(110)面上离子排列个数为:,每个Mg2+的截面积为nm2(110)晶面面积nm2则:(110)晶面离子的面排列密度③(100)面上离子排列个数:,(100)晶面面积nm2则:(100)晶面离子的面排列密度四面体空隙在处,故在上述三个晶面上无四面体空隙位置,为悬空。
八面体空隙位在图2-1中(110)和(100)晶面上可见,即Mg2+所占位置。
(2)单位晶胞中离子个数,∴单位晶胞中离子所占体积nm3单位晶胞晶胞体积cm3则:MgO晶体的空间利用率MgO晶体的密度g/cm3【例2-10】钙钛矿(CaTiO3)是ABO3型结构的典型,属-Pmna。
它是由Ca原子和Ti原子的正交简单格子各一套,O原子的正交简单格三套,相互穿插配置组成其结构晶胞。
若以Ca原子的格子作为基体,Ti原子的简单格子错位[a+b+c]插入,而三套O原子的格子分别配置于(O)、(O)、(O)。
(1)画出钙钛矿的理想晶胞结构。
(提示:单位晶胞中含一个分子CaTiO3)。
(2)结构中离子的配位数各为若干?(3)结构遵守胞林规则否?【解】(1)钙钛矿的理想晶胞结构略。
(2)结构中各离子的配位数为:,,(3)即:在CaTiO3结构中,O2-离子周围最邻近的是四个Ca2+和二个Ti4+正离子,所以O2-离子的两价负电荷被价强度为的四个Ca-O键与价强度为的2个Ti-O键所抵消,结构保持电中性,故符合鲍林第二规则——静电价规则。
【例2-11】在实验中,从一种玻璃熔体中结晶出层状晶体,经X射线衍射图谱鉴定,它们是单相,即只有一种晶体结构,而化学分析结果表明,它具有复杂的化学式:KF·AIF3·BaO·MgO·Al2O3·5MgSiO3,请说明:(1)这与滑石、白云母(钾云母)或叶腊石哪一类晶体有关;(2)这个晶体是在滑石中进行了何种置换而形成的。
【解】(1)滑石,白云母及叶蜡石均属2∶1复网层结构,它们的结构式分别为:滑石白云母叶腊石可看出:滑石是2∶1层状结构三八面体型;叶腊石是2∶1层状结构二八面体型;白云母可视为原叶腊石结构中硅氧四面体层中有四分之一Si4+被Al3+取代(产生多余的负电荷),而铝氢氧八面体层中有1/2的OH-被F-取代,为保持电中性,层间进入K+。
目前结晶出的片状晶体,据化学分析所得的化学式可写成相应的结构式为:,可见,在层间存在K+,Ba2+,层间有Al3+取代了Si4+,故将其归于与白云母有关的晶体。
(2)成分中含有Mg2+,恰是2∶1层状结构三八面体型,因而可认为此片状晶体的原型是滑石结构,即看成为滑石结构中硅氧层有1.5/4的Si4+被Al3+取代,多余的负电荷由K+与Ba2+进入层间而中和;在铝氢氧八面体层中的OH-全部为F-所取代。
【例2-12】Si和Al原子的相对质量非常接近(分别为28.09和26.98),但SiO4和Al2O3的密度相差很大(分别为2.65g/cm3和3.96g/cm3),试计算SiO2和Al2O3堆积密度,并用晶体结构及鲍林规则说明密度相差大的原因。
【解】(1)计算SiO2堆积系数,计算中(四配位),(二配位)每cm3中含SiO2分子数个/cm3即个/cm3,个/cm3每cm3中Si4+和O2-各自所占体积为:则SiO2晶体中离子堆积系数=0.0044+0.4556=0.46(2)计算Al2O3堆积系数,计算中(六配位),(三配位)每cm3中含Al2O3分子数个/cm3即个/cm3,个/cm3每cm3中Al3+和O2-各自所占体积为:则Al2O3中离子堆积系数=0.0445+0.6162=0.6607由于Al2O3粒子堆积系数0.6607大于SiO2晶体中离子堆积系数,故Al2O3密度大于SiO2。
从鲍林规则可得, Al2O3中Al3+配位数为6,Al3+填充O2-六方密堆中八面体空隙的。
而SiO2晶体中,Si4+为高电价低配位,Si4+配位数为4,Si4+仅填充结构中四面体空隙的,Si-O四面体以顶角相连成骨架装结构,堆积疏松,空隙率大,故密度低。
【提示】SiO2堆积密度为0.46,表明结构有相当开放的空间,大多数简单原子(氦除外)必须以离子形式将进行扩散。
因此,它们带的电荷妨碍它们在室温下进行剧烈地运动。
【例2-13】石墨、云母和高岭石具有相似的结构。
说明它们结构区别及由此引起的性质上的差异。
【解】石墨、云母和高岭石均具有层状结构,但层的形状及层间情况各不相同。
石墨的每层基面上的碳原子有强的定向共价键结合在一起形成六角形排列,层与层之间由微弱的范德华力键合,使石墨结构具有很强的方向性,表现出垂直于层方向的线膨胀系数比层平面方向大27倍。
