不饱和度和推断题眼
有机化学推断题(全71题推断题答案完整版)

有机化学推断题(全71题推断题答案完整版)史上最全的《有机化学推断题》全71题推断题答案完整版!!其中包括各种结构、方程式、化学反应的题目以及答案!!Ps:亲!给好评,有送财富值哦! #^_^!!推结构题1 已知化合物(a)为烷烃,电子轰击质谱(即EI)图有m/z : 86( M+) 71、57(基峰)、43、29、27、15,推测它的结构。
解:(a)由分子离子峰知分子式为C6H14, 有典型的C n H2n+1系列(m/z 71、57、55、43、41、29、15),伴随丰度较低的C n H2n-1系列(m/z 55、41、27 ), 基峰m/z57,确认是无支链的直链烷烃己烷。
2 已知化合物(b)为烷烃,电子轰击质谱子(即EI)图有m/z(%) : 98( M+, 45), 83 (100)、69(25)、55(80)、41(60)、27(30)、15(5),推测它的结构。
解:(b)由分子离子峰知分子式为C7H14, 不饱和度为1,可见是环烷烃。
分子离子峰丰度较大及C n H2n-1系列(m/z 83、69、55、41、27 ),佐证了环烷烃,基峰是M-15峰,说明环烷烃侧链是甲基,(b)结构为甲基环己烷。
3 写出符合下列分子离子峰数值的烃类化合物的分子式。
(1)M+=86 (2)M+=110(3)M+=146解86 ,C6H14;110, C8H14;146,C11H14或C12H2。
( 1,3,5,7,9,11-十二碳六炔).4 2-甲基戊烷的质谱图为EI (m/z,%): 86(5)、71(53)、57(27)、43(100)、29(40)。
分子离子峰和基峰各在哪里?为何基峰是这个数值呢?m/z为71,57,43和29的碎片离子峰又分别代表了怎样的碎片结构?解:分子离子峰m/z86,基峰m/z43,说明有C3H7结构。
43+ .(base peak) 718657295某烯烃,分子式为C10H14,可吸收2mol氢,臭氧化后给出一个产物OHCCH 2CH 2CH 2CCCH 2CH 2CH 2CHOOO解:不饱和度=4, 但只能吸收2mol 氢,可见化合物可能有两个环。
不饱和度计算口诀

不饱和度计算口诀不饱和度是有机化合物中不饱和度的含量,一般表示为双键或环的数量。
下面是不饱和度的计算口诀:不饱和度 = (2C + 2 - H - X) / 2其中,C代表碳原子的数量,H代表氢原子的数量,X代表其他原子的数量。
双键的数量可以通过以下公式计算:双键数量 = (2C + 2 - H - X - N) / 2其中,N代表含有氮原子的数量。
环的数量可以通过以下公式计算:环的数量 = (2C + 2 - H - X - N - S) / 2其中,S代表含有硫原子的数量。
举例说明:假设有一个化合物的分子式为C4H6O,其中含有一个双键和一个醛基(CHO)。
首先,根据分子式得到C的数量为4,H的数量为6,O的数量为1,没有其他原子。
代入不饱和度的公式进行计算:不饱和度 = (2 × 4 + 2 - 6 - 1 - 1) / 2不饱和度 = 3可以得到该化合物的不饱和度为3,证明该化合物中含有三个双键或环。
接着,可以使用双键数量的公式计算出该化合物中双键的数量:双键数量 = (2 × 4 + 2 - 6 - 1 - 1) / 2 - 1双键数量 = 2可以得到该化合物中含有两个双键。
最后,可以使用环的数量的公式计算出该化合物中环的数量:环的数量 = (2 × 4 + 2 - 6 - 1 - 1 - 0) / 2 - 0环的数量 = 1可以得到该化合物中含有一个环。
结论:该化合物的分子式为C4H6O,不饱和度为3,含有两个双键和一个环。
总结:以上是不饱和度的计算口诀和举例说明。
根据分子式可以计算出不饱和度,然后根据双键数量和环的数量可以进一步分析化合物的结构。
这些计算方法在有机化学领域中非常常见,是进行有机化合物结构分析的基础。
高考有机化学推断题解题技巧和相关知识点全总结

有机化学推断题解题技巧和相关知识点全总结一、常见有机物物理性质归纳1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N©≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
(3)具有特殊溶解性的:①乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分,也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提高反应速率。
例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH,又能溶解油脂,让它们在均相(同一溶剂的溶液)中充分接触,加快反应速率,提高反应限度。
② 苯酚:室温下,在水中的溶解度是9.3g(属可溶),易溶于乙醇等有机溶剂,当温度高于65℃时,能与水混溶,冷却后分层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳浊液。
苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的钠盐。
③乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
④有的淀粉、蛋白质可溶于水形成胶体..。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
但在稀轻金属盐(包括铵盐)溶液中,蛋白质的溶解度反而增大。
⑤线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
⑥氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
【高中化学中各种颜色所包含的物质】{方便推断时猜测}1.红色:铜、Cu2O、品红溶液、酚酞在碱性溶液中、石蕊在酸性溶液中、液溴(深棕红)、红磷(暗红)、苯酚被空气氧化、Fe2O3、(FeSCN)2+(血红)2.橙色:、溴水及溴的有机溶液(视浓度,黄—橙)3.黄色(1)淡黄色:硫单质、过氧化钠、溴化银、TNT、实验制得的不纯硝基苯、(2)黄色:碘化银、黄铁矿(FeS2)、*磷酸银(Ag3PO4)工业盐酸(含Fe3+)、久置的浓硝酸(含NO2)(3)棕黄:FeCl3溶液、碘水(黄棕→褐色)4.棕色:固体FeCl3、CuCl2(铜与氯气生成棕色烟)、NO2气(红棕)、溴蒸气(红棕)5.褐色:碘酒、氢氧化铁(红褐色)、刚制得的溴苯(溶有Br2)6.绿色:氯化铜溶液、碱式碳酸铜、硫酸亚铁溶液或绿矾晶体(浅绿)、氯气或氯水(黄绿色)、氟气(淡黄绿色)7.蓝色:胆矾、氢氧化铜沉淀(淡蓝)、淀粉遇碘、石蕊遇碱性溶液、硫酸铜溶液8.紫色:高锰酸钾溶液(紫红)、碘(紫黑)、碘的四氯化碳溶液(紫红)、碘蒸气2.有机物的密度(1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、酯(包括油脂)(2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯3.有机物的状态[常温常压(1个大气压、20℃左右)](1)气态:① 烃类:一般N©≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态② 衍生物类:一氯甲烷(....CCl.....).....-.29.8℃...2.F.2.,沸点为.....CH..3.Cl..,.沸点为...-.24.2℃.....).氟里昂(氯乙烯(....,沸点为...HCHO....-.21℃...).....-.13.9℃.....).甲醛(....CH..2.==CHCl......,沸点为℃.).一溴甲烷(CH3Br,沸点为3.6℃)氯乙烷(........CH..3.CH..2.C.l.,沸点为....12.3四氟乙烯(CF2==CF2,沸点为-76.3℃)甲醚(CH3OCH3,沸点为-23℃)甲乙醚(CH3OC2H5,沸点为10.8℃)环氧乙烷(,沸点为13.5℃)(2)液态:一般N©在5~16的烃及绝大多数低级衍生物。
(完整版)不饱和度

C C 不饱和度一、不饱和度的概念不饱和度又称缺氢指数或者环加双键指数,是有机物分子不饱和程度的量化标志,即有机物分子中与碳原子数相等的开链烷烃相比较,每减少2个氢原子,则有机物的不饱和度增加1,用希腊字母Ω表示。
二、不饱和度的计算1、根据有机物的化学式计算常用的计算公式: 烃(C n H m ):Ω= 卤代烃(C n H m X Z ):Ω= 含氧衍生物(C n H m O Z ):Ω= 含氮衍生物(C n H m N Z ):Ω= 公式繁多,现简化如下:将有机物的化学式转化为CxHyOa(NH)b 则Ω=x+1-y/2此公式使用范围极广,可囊括几乎所有有机物,无需分类讨论,硅与碳等效,卤素与氢等效,硫与氧等效。
例:C 10H 4Cl 2可转化为C 10H 6 ,则Ω=10+1-6/2=8C 20H 31O 2N 3可转化为C 20H 28O 2(NH)3 ,则Ω=20+1-28/2=72、非立体平面有机物分子,可以根据结构计算Ω=双键数+叁键数×2+环数备注:双键包含碳碳、碳氮、氮氮、碳氧双键;叁键包含碳碳、碳氮叁键;环数等于将环状分子剪成开链分子时,剪开碳碳键的次数,环包含含N 、O 、S 等的杂环。
如苯:Ω=6+1-6/2=3+1=4,即苯可看成三个双键和一个环的结构形式。
例:Ω=4+0×2+2=6 Ω=6+1×2+2=10 Ω=8+0×2+3=133、立体封闭有机物分子(多面体或笼状结构)不饱和度的计算,其成环的不饱和度比面数少数1。
例:立方烷面数为6 ,Ω=5 降冰片烷面数为3 ,Ω=2 棱晶烷面数为 5 ,Ω=4三、不饱和度(Ω)与分子结构的关系1、若Ω=0,说明分子是饱和链状结构;2、若Ω=1,说明分子中有一个双键或一个环;3、若Ω=2,说明分子中有两个双键或一个三键;或一个双键和一个环;或两个环;余类推;4、若Ω≥4,说明分子中很可能有苯环。
不饱和度计算口诀

不饱和度计算口诀
1.首先,了解化合物分子式中含有的碳原子数和氢原子数。
假设化合物分子式为CnHm。
2.利用化合物分子式中的碳原子数和氢原子数,计算化合物中的结构式单位。
碳原子数除以氢原子数,得到结构式单位。
记作r。
3.判断结构式单位的类型。
根据结构式单位中化学键的数目,将结构式单位分为饱和和不饱和两类。
4.对于饱和的结构式单位,不饱和度为0。
5.对于不饱和的结构式单位,判断其类型。
如果是单键,不饱和度为1、如果是双键,不饱和度为2、如果是三键,不饱和度为3
6.如果化合物中存在多个不饱和结构式单位,将每个结构式单位的不饱和度相加,得到化合物的总不饱和度。
7.不饱和度计算公式如下:
不饱和度=(n-(m/2)+1)*r
其中,n是碳原子数,m是氢原子数,r是结构式单位的类型。
8.总结不饱和度计算口诀如下:
确定分子式,计算结构式单位,判断饱和不饱和。
单1,双2,三3结果相加得总量,公式计算终截。
这是一个较为简单的不饱和度计算口诀,可以帮助你快速计算化合物的不饱和度。
如果你对有机化学有更深入的了解,可以使用更精确的计算方法。
202X高考化学有机推断必考点

千里之行,始于足下。
202X高考化学有机推断必考点202X年高考化学有机推断必考点有机化学是高中化学的重要内容之一,也是高考中最常考的题型之一。
有机化学推断题考察学生对有机化合物性质、结构、反应等方面的推断能力。
针对202X年高考,以下是有机化学推断的必考点。
一、有机化合物的结构与性质的推断1. 碳骨架的推断:推断有机化合物的碳骨架结构,包括直链、支链、环状等。
可以根据化合物的摩尔质量和燃烧产物进行推断。
2. 饱和度的推断:判断有机化合物是饱和化合物还是不饱和化合物,可以根据化合物的摩尔质量、燃烧产物和附加试剂的反应进行推断。
3. 官能团的推断:判断有机化合物中含有的官能团,可以根据化合物的化学性质进行推断。
如有机酸、醇、醛、酮、酯、醚等。
二、有机化合物的反应特性的推断1. 酸碱性的推断:根据有机化合物的酸碱性质,推断其是酸性、碱性还是中性。
可以根据有机酸的酸解离常数、酸碱指示剂等进行推断。
2. 氧化性的推断:根据有机化合物的氧化性质,推断其是否具有氧化性。
可以根据有机化合物的氧化剂反应、燃烧产物等进行推断。
3. 还原性的推断:根据有机化合物的还原性质,推断其是否具有还原性。
可以根据有机化合物的还原剂反应进行推断。
4. 共轭体系的推断:根据有机化合物的共轭体系特点,推断其是否具有共轭体系。
可以根据有机化合物的紫外可见光谱进行推断。
三、有机化合物的合成途径的推断第1页/共2页锲而不舍,金石可镂。
1. 加成反应的推断:根据有机化合物的结构特点,推断其是否可以发生加成反应,如硫醇与烯烃发生加成反应得到硫醇-烯烃加成产物。
2. 缩合反应的推断:根据有机化合物的结构特点,推断其是否可以发生缩合反应,如卡宾与烯烃发生缩合反应得到环戊二烯。
3. 消去反应的推断:根据有机化合物的结构特点,推断其是否可以发生消去反应,如醇与酸发生消去反应得到醚。
4. 氧化反应的推断:根据有机化合物的结构特点,推断其是否可以发生氧化反应,如醇发生氧化反应得到醛或酮。
高三化学有机推断题(带详解和评分标)

质对市爱慕阳光实验学校的有机推断题〔带详解和评分〕一中王维德在有机化学复习中,特别要对有机化学推断题进行研究,使学生把握题给信息,去伪、去繁求简,从而做到:整理信息、逻辑论证、得出结论、正确表达。
思维能力的训练,强化信息的整理,提高逻辑推理能力。
解题思路:第一步审题——你看到什么?第二步显形信息与隐形信息整合——你想到什么?你的依据是什么?第三步推断验证与标准解答——你的解题思路是什么?1、〔16分〕某有机物X〔C12H13O6Br〕分子中含有多种官能团,其结构简式为:〔其中I、II为未知的结构〕。
为推测X的分子结构,进行如图转化:向E的水溶液中滴入FeCl3溶液发生显色反,G、M都能与NaHCO3溶液反。
请答复:〔1〕M的结构简式为;D分子中所含官能团的结构简式是。
〔2〕E可以发生的反有〔选填序号〕。
①加成反②消去反③氧化反④取代反〔3〕G在一条件下发生反生成分子组成为C4H4O4的有机物〔该有机物可使溴的四氯化碳溶液褪色〕,写出G发生此反的化学方程式:。
〔4〕假设在X分子结构中,I里含有能与氯化铁溶液发生显色反的官能团,且E与溴水反生成的一溴代物只有一种,那么X的结构简式是。
〔5〕F与G互为同分异构体,F的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基。
那么F的分子结构可能为、。
2、〔15分〕某有机物X分子中只含C、H、O三种元素,分子量小于110,其中氧元素含量为1 %,该物质可与FeCl3溶液发生显色反,答复以下问题:〔1〕X 的分子式为。
假设1mol X 与浓溴水反时消耗了3 mol Br2,那么X 的结构简式为。
〔2〕假设X 和 Y 能发生如下反得到Z〔C9H10O2〕,X + Y Z + H2O写出该反的化学方程式,反类型为。
〔3〕Z 有多种同分异构体,其中属于酯类且苯环上只有一个取代基的有种,写出其中任意两种的结构简式:。
3、〔16分〕香豆素是一种广泛使用的香料,其结构简式为:提示:有机物C X H Y O Z的不饱和度Ω=x+1-2y,CH3CHO+CH3CHO OH-−−−→CH3CH=CHCHO,试答复:〔1〕香豆素的分子式为,不饱和度M〔C2H2O4〕Ω。
不饱和度和推断题眼
一、不饱和度1不饱和度的概念不饱和度乂称缺氢指数或者环加双键指数,是有机物分子不饱和程度的量化标志,即有机物分子中与碳原子数相等的开链烷轻相比较,每减少2个氢原子, 则有机物的不饱和度增加1,用希腊字母Q表示。
2不饱和度的计算2.1根据有机物的化学式计算常用的计算公式:2.2非立体平■面有机物分子,可以根据结构计算Q=双键数+参键数X2+环数备注:双键包含碳碳、碳氮、氮氮、碳氧双键;参键包含碳碳、碳氮参键;环数等丁将环状分子剪成开链分子时,剪开碳碳键的次数,环包含含 N 、O 、S 等的杂环。
如苯:Q=6+1-6/2=3+0 X2+1=4 即苯可看成三 个双键和一个环的结构形式。
例子:=8+0 X2+3=132.3立体封闭有机物分子(多面体或笼状结构)不饱和度的计算,其成环的不饱 和度比面数少数1 例子:立方烷面数为6, Q=5 降冰片烷面数为3, Q=2 棱晶烷面数为5, Q=43不饱和度的应用3.1分子的不饱和度(Q )与分子结构的关系: ① 若Q=0,说明分子是饱和链状结构② 若Q=1 ,说明分子中有一个双键或一个环;③ 若Q=2 ,说明分子中有两个双键或一个三键; 或一个双键和一个环;或两个环; 余类推;④ 若Q >4,说明分子中很可能有苯环。
3.2辅助推导化学式,思路如下结构简式一一计算不饱和度一一计算H 原子数一一确定分子式例1 : 1mo1X 能与足量碳酸氢钠溶液反应放出 44.8LCO 2(标准状况),则X 的分 子式是:()A 、C 5H 10O 4 B. C 4H 8O 4 C. C 3H 6O 4 D. C 2H 2O 4例2: 一种从植物中提取的天然化合物 a-damascone ,可用丁制作“香水”,其结 构如下图,有关该化合物的下列说法不正顿.的是()A.分子式为C 13H 20O 0B. 该化合物可发生聚合反应C.1mol 该化合物完全燃烧消耗19mol O 2[ ID .与漠的CCl 4溶液反应生成的产物经水解、稀硝酸化后可用AgNO 3溶液检验例3:请仔细阅读以下转化关系:=6+1 X2+2=10QQ=4+0 X2+2=6Q oA 是从蛇床子果实中提取的一种中草药有效成分,是由碳、氢、氧元素组成 的酯类化合物;B 称作冰片,可用丁医药和制香精、樟脑等;C 的核磁共振氢谱显示其分子中含有 4种氢原子;D 中只含一个氧原子,与 Na 反应放出H2; F 为轻。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
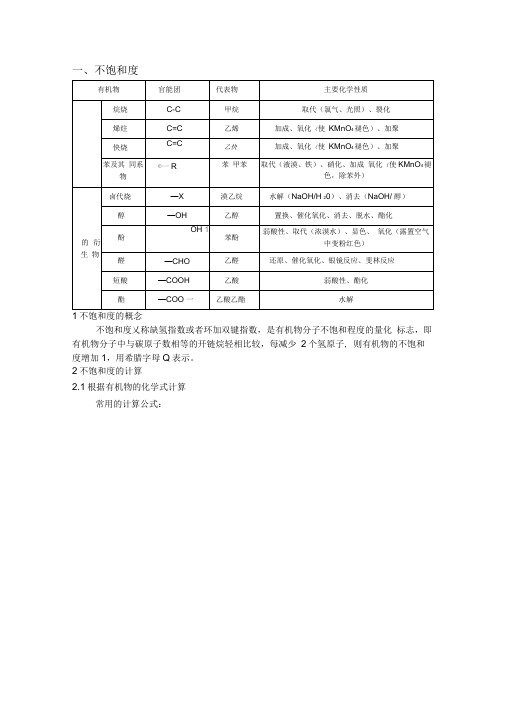
有机物官能团代表物主要化学性质烃烷烃C-C甲烷取代(氯气、光照)、裂化烯烃C=C乙烯加成、氧化(使KMnO4褪色)、加聚炔烃C=C乙炔加成、氧化(使KMnO4褪色)、加聚苯及其同系物—R苯甲苯取代(液溴、铁)、硝化、加成氧化(使KMnO4褪色,除苯外)烃的衍生物卤代烃—X溴乙烷水解(NaOH/H2O)、消去(NaOH/醇)醇—OH乙醇置换、催化氧化、消去、脱水、酯化酚—OH苯酚弱酸性、取代(浓溴水)、显色、氧化(露置空气中变粉红色)醛—CHO乙醛还原、催化氧化、银镜反应、斐林反应羧酸—COOH乙酸弱酸性、酯化酯—COO—乙酸乙酯水解不饱和度又称缺氢指数或者环加双键指数,是有机物分子不饱和程度的量化标志,即有机物分子中与碳原子数相等的开链烷烃相比较,每减少2个氢原子,则有机物的不饱和度增加1,用希腊字母Ω表示。
2 不饱和度的计算2.1 根据有机物的化学式计算常用的计算公式:2.2 非立体平面有机物分子,可以根据结构计算Ω=双键数+叁键数×2+环数备注:双键包含碳碳、碳氮、氮氮、碳氧双键;叁键包含碳碳、碳氮叁键;环数C C 等于将环状分子剪成开链分子时,剪开碳碳键的次数,环包含含N 、O 、S 等的杂环。
如苯:Ω=6+1-6/2=3+0×2+1=4 即苯可看成三个双键和一个环的结构形式。
例子:Ω=4+0×2+2=6 Ω=6+1×2+2=10 Ω=8+0×2+3=132.3 立体封闭有机物分子(多面体或笼状结构)不饱和度的计算,其成环的不饱和度比面数少数1。
例子:立方烷面数为6,Ω=5 降冰片烷面数为3,Ω=2 棱晶烷面数为5,Ω=4 3 不饱和度的应用3.1 分子的不饱和度(Ω)与分子结构的关系: ①若Ω=0,说明分子是饱和链状结构②若Ω=1,说明分子中有一个双键或一个环; ③若Ω=2,说明分子中有两个双键或一个三键;或一个双键和一个环;或两个环;余类推;④若Ω≥4,说明分子中很可能有苯环。
3.2 辅助推导化学式,思路如下结构简式——计算不饱和度——计算H 原子数——确定分子式例1: 1mo1X 能与足量碳酸氢钠溶液反应放出44.8LCO 2(标准状况),则X 的分子式是:( )A 、C 5H 10O 4B .C 4H 8O 4 C .C 3H 6O 4D .C 2H 2O 4例2:一种从植物中提取的天然化合物a-damascone ,可用于制作“香水”,其结构如下图,有关该化合物的下列说法不正确...的是( ) A .分子式为1320C H OB. 该化合物可发生聚合反应C .1mol 该化合物完全燃烧消耗19mol 2OD .与溴的4CCl 溶液反应生成的产物经水解、稀硝酸化后可用3AgNO 溶液检验例3:请仔细阅读以下转化关系:A 是从蛇床子果实中提取的一种中草药有效成分,是由碳、氢、氧元素组成的酯类化合物;B 称作冰片,可用于医药和制香精、樟脑等;C 的核磁共振氢谱显示其分子中含有4种氢原子;D 中只含一个氧原子,与Na 反应放出H 2; F 为烃。
请回答:(1)B 的分子式为___________。
(4)F 的分子式为____________。
化合物H 是F 的同系物,相对分子质量为56,写出H 所有可能的结构:_______________。
3.3 辅助推断有机物的结构与性质,思路如下分子式——计算不饱和度——预测官能团及数量——确定结构——推测性质 例4:有一环状化合物C 8H 8,它不能使溴的CCl 4溶液褪色;它的分子中碳环上的1个氢原子被氯取代后的有机生成物只有一种。
这种环状化合物可能是( )答案:C例5:(2008四川卷29)(3)①芳香化合物E 的分子式是C 8H 8Cl 2。
E 的苯环上的一溴取代物只有一种,则E 的所有可能的结构简式是_______________________。
例6:(09全国卷Ⅱ30)化合物A 相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。
A 的相关反应如下图所示:已知R-CH=CHOH(烯醇)不稳定,很快转化为2R CH CHO 。
根据以上信息回答下列问题:(1) A 的分子式为 ;(5) A 有多种同分异构体,写出四个同时满足(i)能发生水解反应(ii)能使溴的四氯化碳溶液褪色两个条件的同分异构体的结构简式:、、、;(6)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为。
二、有机推断题中的“题眼”1.由特征反应条件推断有机物种类或官能团种类及反应类型“光照”是烷烃或烷基(苯及其同系物侧链或不饱和烃中烷基)的取代反应条件。
“催化剂(Ni)、H2和加热”是不饱和键(如>C=C<、一 C 三 C 一、>C=O、—CHO)加氢反应条件。
“浓 H2SO4和170℃”是乙醇(可以是其他低级醇)分子内脱水生成乙烯(或单烯烃)的反应条件。
“浓 H2SO4和140℃”是乙醇(可以是其他低级醇)分子间脱水生成乙醚(或其他醚)的反应条件。
“浓 H2SO4并加热”是酯化反应、纤维素的水解反应条件。
“浓 H2SO4和 55~60℃”是苯的硝化反应条件。
“浓 H2SO4和浓HNO3”是硝化反应的条件。
“稀 H2SO4并加热”是酯类水解、多糖水解、油脂的酸性水解、淀粉水解等反应条件。
“NaOH 醇溶液并加热”是卤代烃消去反应的条件。
“NaOH水溶液并加热”是卤代烃、酯水解消去反应的条件。
“催化剂和同时加热加压”是烯烃水化、烯烃氧化成醛、丁烷氧化醇的条件。
“Cu(或 CuO)、Ag、O2和加热”是醇氧化条件。
“O2或 Cu(OH)2或 Ag(NH3)2OH”是醛氧化条件。
“酸性 KMnO4溶液”是不饱和烃和苯的同系物氧化条件。
“Fe 或 FeX3做催化剂”是苯及苯的同系物苯环上的氢被卤代的条件。
“溴水或 Br2的 CCl4溶液”是不饱和烃加成反应的条件。
“连续氧化”是醇→醛→酸的条件。
“醋酸和醋酸酐”是酯化反应的条件。
“碱石灰并加热”是脱羧反应的条件。
【例 1】咖啡酸苯乙酯是一种天然抗癌药物。
在一定条件下能发生如下转化。
请回答下列问题:(1)A 分子中的官能团是_______________________________。
(2)高分子化合物 M 的结构简式是_______________________________。
(3)写出A→B 反应的化学方程式:__________________________________。
(4)A→B 的反应类型为__________;E→M 的反应类型为________。
(5)A 的同分异构体有很多种,其中同时符合下列条件的同分异构体有________ 种。
①苯环上只有两个取代基②能发生银镜反应③能与碳酸氢钠溶液反应④能与氯化铁溶液发生显色反应【例 2】查尔酮类化合物 G 是黄酮类药物的主要合成中间体,其中一种合成路线如下:已知以下信息:①芳香烃 A 的相对分子质量在 100~110 之间,1mol A 充分燃烧可生成72g 水.②C 不能发生银镜反应.③D 能发生银镜反应、可溶于饱和 Na2CO3溶液、核磁共振氢谱显示其有 4 种氢.④+RCH2I→⑤RCOCH3+RʹCHO RCOCH═CHRʹ回答下列问题:(1)A 的化学名称为.(2)由 B 生成 C 的化学方程式为.(3)E E 生成 F(4)G 的结构简式为(不要求立体异构).(5)D 的芳香同分异构体 H 既能发生银镜反应,又能发生水解反应,H 在酸催化下发生水解反应的化学方程式为.(6)F 的同分异构体中,既能发生银镜反应,又能与 FeCl3溶液发生显色反应的共有种,其中核磁共振氢谱为 5 组峰,且峰面积比为 2:2:2:1:1 的为.(写结构简式)2.由特征反应现象推断溴水或 Br2的 CCl4溶液褪色:>C=C<、一C≡C 一、一 CHO。
酸性 KMnO4溶液褪色:>C=C<、一C≡C 一、-CHO、苯的同系物。
遇 FeCl3溶液显紫色:酚羟基。
遇浓 HNO3变黄:蛋白质。
遇碘水变蓝:淀粉。
新制 Cu(OH)2悬浊液,加热,有红色沉定:一 CHO.银氨溶液有银镜生成:一 CHO。
浓溴水有白色沉淀:苯酚。
加入 NaOH 溶液,浑浊溶液变澄清,通入 CO2又变浑浊的:苯酚。
加入 Na 有 H2放出:一 OH、一 COOH。
加人 NaHCO3溶液放出气体:一 COOH。
在空气中被氧化变色的:苯酚。
燃烧时冒出浓烟的有:C2H2、苯及其同系物。
【例 3】分子式为 C7H8O 的芳香化合物中,与 FeCl3溶液混合后显紫色和不显紫色的物质分别有()A.2 种和 1 种B.2 种和 3 种C.3 种和 2 种D.3 种和 1 种【例 4】有机物 A 由 C、H、O、Cl 四种元素组成,其相对分子质量为 198.5, Cl 在侧链上.当 A 与 Cl2分别在 Fe 作催化剂和光照条件下以物质的量之比为 1: 1 反应时,分别是苯环上一氯取代产物有两种和侧链上一氯取代产物有一种;A与NaHCO3溶液反应时有气体放出.已知 A 经下列反应可逐步生成 B~G.请你按要求回答下列问题:(1)A 的化学式为;D 的结构简式为.(2)上述反应中属于取代反应的是(填编号);(3)C 中含氧官能团的名称分别为;(4)E 的同分异构体中,满足下列条件:①含有苯环,苯环上只有一个侧链,且侧链上只含有一个一 CH3;②能发生银镜反应;③属于酯类.请写出一种符合上述条件 E 的同分异构体的结构简式:.(5)写出下列指定反应的化学方程式(有机物写结构简式):A 与 NaOH 的醇溶液共热:;E 在一定条件下生成 F:.【例 5】下图中每一方框的字母代表一种反应物或生成物:已知气态烃 D(其密度在同温同压下是氢气密度的 13 倍)与物质 F 反应时产生明亮而带浓烈黑烟的火焰。
请写出下列字母代表的物质的化学式(或分子式):A、B、D、E、H。
3.由特征性质确定有机物常温常压下为气态的有:烃 C x H y(x≤4)、甲醛、CH3Cl、C2H5Cl。
具有苦杏仁气味:硝基苯。
水果香味:低级酯。
能与水任意比互溶的有:乙醇、乙醛、乙酸等。
不溶于水易溶于有机溶剂的有:乙炔、卤代烃。
有毒:甲醇、甲醛、苯酚、三溴苯酚等。
【例 6】已知有机物 A 是具有果香味的液体,其分子式是 C4H8O2,在一定条件下有下列转化关系:4.由特征用途推断某些有机物医疗消毒:乙醇。
环境消毒、药皂:苯酚。
护肤品、汽车防冻剂:甘油。
浸泡标本:福尔马林(甲醛水溶液)。
【例 7】如图为 A~I 几种有机物间的转化关系,其中 A 碱性条件下水解生成 B 、C 、 D 三种物质的物质的量之比为 1∶1∶2,F 是其同系物中相对分子质量最小的物质,它的水溶液常用于浸泡生物标本及手术器材消毒,I 的苯环上的一氯代物只有一种。
