高考化学专题复习 元素推断题
高三化学一轮复习——元素或物质推断题
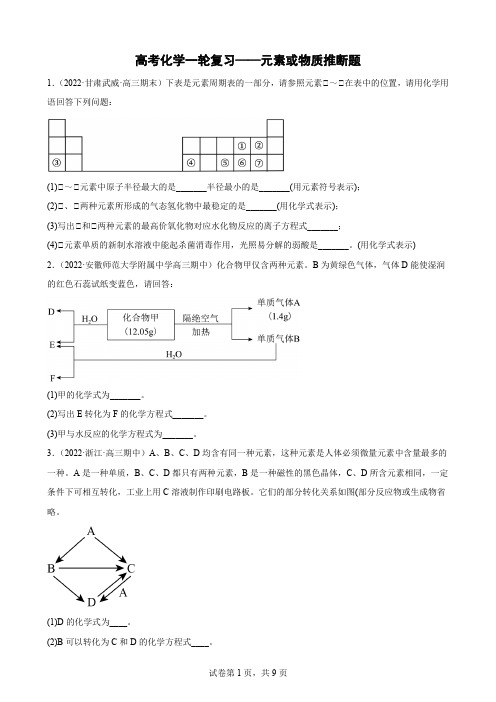
高考化学一轮复习——元素或物质推断题1.(2022·甘肃武威·高三期末)下表是元素周期表的一部分,请参照元素①~①在表中的位置,请用化学用语回答下列问题:(1)①~①元素中原子半径最大的是_______半径最小的是_______(用元素符号表示);(2)①、①两种元素所形成的气态氢化物中最稳定的是_______(用化学式表示);(3)写出①和①两种元素的最高价氧化物对应水化物反应的离子方程式_______;(4)①元素单质的新制水溶液中能起杀菌消毒作用,光照易分解的弱酸是_______。
(用化学式表示) 2.(2022·安徽师范大学附属中学高三期中)化合物甲仅含两种元素。
B为黄绿色气体,气体D能使湿润的红色石蕊试纸变蓝色,请回答:(1)甲的化学式为_______。
(2)写出E转化为F的化学方程式_______。
(3)甲与水反应的化学方程式为_______。
3.(2022·浙江·高三期中)A、B、C、D均含有同一种元素,这种元素是人体必须微量元素中含量最多的一种。
A是一种单质,B、C、D都只有两种元素,B是一种磁性的黑色晶体,C、D所含元素相同,一定条件下可相互转化,工业上用C溶液制作印刷电路板。
它们的部分转化关系如图(部分反应物或生成物省略。
(1)D的化学式为____。
(2)B可以转化为C和D的化学方程式____。
试卷第1页,共9页(3)工业上用C制作印刷电路板的原理用离子方程式表示为_____。
(4)检验C中阳离子的离子方程式_____。
4.(2022·浙江·高三期中)某兴趣小组对物质X(仅含2种常见元素)进行如下探究分析已知:溶液A的焰色试验为黄色,且A溶液恰好被含0.1molHCl的盐酸中和;红棕色粉末B是某铁矿石的主要成分。
请回答以下问题:(1)X中所含的金属元素是_______(填元素符号),X的化学式为_______。
高考化学一轮专复习练习元素或物质推断

元素或物质推断题1.(2022·黑龙江·哈九中高三期末)下表列出了①~①所代表的十种元素在周期表中的位置,按要求填写下列空白:(1)①、①按原子个数比为3:1组成的分子的电子式_______。
当今,考古工作者是利用①的一种核素_______(请写出其核素符号)衰变测定装置,对文物进行年代的测定和研究。
①①①三种元素的简单离子半径从大到小排序_______(用离子符号表示),元素X与①同一主族,X原子比①原子多一个电子层,X的原子结构示意图为_______。
元素Y与①同一主族,位于周期表第四周期,其氢化物的化学式为_______。
(2)以下组合的原子间反应最容易形成离子键的是_______(选填A、B、C、D)A.①和①B.①和①C.①和①D.①和①非金属性最强的元素的氢化物在水中的电离方程式为_______。
(3)写出①元素的最高价氧化物与氢氧化钠溶液反应的化学方程式_______﹔磁性氧化铁溶解于元素①的氢化物的浓溶液发生反应的离子方程式为_______。
(4)高铁的快速发展方便了人们的出行,工业上利用①的单质参与的反应焊接钢轨间的缝隙,反应的化学方程式为_______。
其中①的单质发生_______(填:氧化或还原)反应。
(5)只含元素①和元素①的化合物可在野外作供氢剂。
请写出该化合物跟水反应的化学方程式_______。
1 mol 该化合物溶于足量水中完全反应,共转移_______mol电子。
2.(2022·辽宁·沈阳市第三十一中学高三阶段练习)下图表示各物质之间的转化关系。
已知:常温下B、D、F、G、I、J是气体,F、G是空气中的主要成分,D是一种碱性气体;A中阴、阳离子个数比是1:1,E是一种黑色氧化物,H是紫红色金属单质(部分生成物和反应条件省略)请按要求填空:(1)A物质是______________;X物质是________________;K物质是________________(均写化学式)(2)反应①的化学方程式是_______________________________________________;(3)反应①中产生标准状况下1.12L气体F,则转移的电子数目是__________________________;(4)反应①的化学反应方程式为__________________________________________________________,其中作氧化剂的是_________________________;(5)检验溶液A中阳离子的方法是_______________________;3.(2022·重庆八中高三期末)图为元素周期表的部分,请参照元素①-①在表中的位置,回答下列问题。
高三化学一轮专题复习---元素或物质推断题专题训练

高考化学一轮专题复习---元素或物质推断题专题训练1.由两种短周期元素以原子个数比1:9组成的化合物M是一种高爆炸性物质,撞击M爆炸时发生分解反应生成气体单质A和化合物B。
8.20gB与足量NaOH溶液反应,生成4.48L(标况)能使湿润的红色石蕊试纸变蓝色的气体C;所得溶液滴加稀硫酸至过量,先产生白色胶状沉淀D,后沉淀逐渐消失。
请回答下列问题:(1)气体C的电子式为_______。
(2)M→A+B的化学方程式为_______。
(3)下列说法正确的是_______A.气体A和O2在一定条件下反应生成的氧化物能形成酸雨B.化合物B与NaOH溶液反应不属于氧化还原反应C.工业制备C时宜采用高温低压,以提高反应物的转化率D.沉淀D可溶于气体C的水溶液2.X、Y、Z、E、F五种元素的原子序数依次递增。
已知:①F位于周期表中第四周期IB族,其余的均为短周期主族元素;①E的氧化物是光导纤维的主要成分;①Y的核外电子总数是E的一半;①X与E在同一主族;①Z原子P 轨道的电子数为4。
请回答下列问题:(1)Y原子价层电子的轨道表达式(电子排布图)为___________。
(2)X、Y、E三种元素的第一电离能数值由小到大的顺序为___________。
(填元素符号)。
(3)常温下X、Z和氢元素可以形成XH2Z,该物质分子中X原子轨道的杂化类型为___________。
(4)F2+与NH3反应能生成[F(NH3)4]2+离子,[F(NH3)4]2+中的配位原子为___________(填元素符号)。
(5)1个F2Z晶胞结构如图所示,F原子个数为___________个。
晶胞中F的配位数为___________。
(6)若晶胞边长为a pm,N A为阿伏伽德罗常数,请算出该晶胞的密度ρ=___________(用a、N A表示,列出计算式即可)。
3.化合物A、B是中学常见的物质,其阴阳离子可从表中选择.阳离子K+、Na+、NH4+、Fe2+、Ba2+、Cu2+阴离子OH﹣、I﹣、NO3﹣、AlO2﹣、HCO3﹣、HSO4﹣(1)若A的水溶液为无色,B的水溶液呈碱性,A、B的水溶液混合后,只产生不溶于稀硝酸的白色沉淀及能使湿润的红色石蕊试纸变蓝的气体,则:①A中的化学键类型为_________(填“离子键”、“共价键”).①A、B溶液混合后加热呈中性,该反应的离子方程__________________________ .(2)若A的水溶液为浅绿色,B的焰色反应呈黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合后无明显变化.则:①A的化学式为__________________________.①经分析上述过程中溶液变黄的原因可能有两种(请用文字叙述)①._______________________.①._________________________.①请用一简易方法证明上述溶液变黄的原因_________________________.①利用上述过程中溶液变黄原理,将其设计成原电池,若电子由a流向b,则b极的电极反应式为_.4.原子序数依次增大的短周期主族元素a、b、c、d、e中,a的最外层电子数为其周期数的2倍;b的-2价离子比d的-2价离子少8个电子;c的+1价离子比e的-1价离子少8个电子。
高三化学一轮专题复习题—元素或物质推断题

高考化学一轮专题复习题—元素或物质推断题1.(2022·吉林吉林·高三阶段练习)“价—类”二维图是基于核心元素的化合价和物质类别研究物质。
如图是硫元素的常见化合价与部分物质类别的对应关系:(1)硫元素在周期表的位置____。
(2)A 的电子式为____。
(3)图中A 、B 、D 三种物质中,属于电解质的是____(用化学式表示)。
(4)实验室可用Cu 与E 的浓溶液反应制取D ,该反应的化学方程式为____。
(5)将D 通入酸性高锰酸钾溶液中,观察到溶液褪色,体现了D 的____。
(填标号)a.漂白性b.氧化性c.还原性(6)G 在医疗上可用作石膏绷带,关于它的用途还有____。
(填标号)a.在食品中,可用来作营养强化剂b.在工业上,可来调节水泥的硬化速率c.在美术上,可用来制作各种模型2.(2022·湖北·高三阶段练习)现有A 、B 、C 、D 、E 五种元素,其对应的原子序数(前20号)依次增大。
①A 单质可以在D 单质中燃烧,生成AD ,燃烧时火焰的颜色为苍白色;①22A B 是常见的氧化剂,且易分解;①C 单质与沸水缓慢反应,在二氧化碳中可以燃烧;①E 的原子序数=C 的原子序数+8倍A 的原子序数。
回答下列问题:(1)A 、B 、C 、D 、E 元素符号分别为____、____、____、____、____。
(2)将AD 溶液滴入碳酸钠溶液中,没有气泡产生,离子方程式为_______。
(3)请写出22A B 生活中的一种用途____;向硫酸亚铁溶液中加入22A B 溶液产生红褐色沉淀的离子方程式为_______。
(4)C 单质在二氧化碳中燃烧的化学方程式为_______。
(5)E 的氧化物有多种,其氧化物中氧元素为1 价的化学式为_______;该氧化物与水反应的化学方程式为_______。
3.(2022·河北沧州·高三阶段练习)物质之间的转化关系如图,部分生成物省略。
高三化学备考一轮复习 训练题:元素或物质推断题

高考化学备考一轮训练题:元素或物质推断题1.(2022·内蒙古赤峰·高三期末)A、B、C、D、E为原子序数依次增大的短周期元素,A是周期表中原子半径最小的元素,B是形成有机物的必备元素,C的最外层电子数是次外层的3倍,D与水能剧烈反应产生一种化合物X和H2,E的最高价氧化物的水化物是二元强酸。
(1)B在元素周期表中的位置___________;(2)B、E两元素形成的各原子均达8电子稳定结构的化合物的结构式为___________ ;(3)A和C两元素形成一种具有强氧化性的化合物Y,其电子式___________ ;(4)元素的非金属性:E____C。
(填“强于”或“弱于”),其实验依据是_____ (用化学方程式表示);(5)A、B、C三种元素可形成多种化合物,其中Z、W是生活中常见的有机物,Z是食醋的成分,一定浓度的W的水溶液可用于消毒。
Z、W和浓硫酸在加热条件下发生反应的化学方程式为____;2.(2022·四川南充·高三期末)下图是元素周期表的一部分。
根据图中标注的9种元素,用化学符号填写下列空格:族IA0周期1IIA IIIA IV A V A VIA VIIA④2④④④3④④④④④以上9种元素中,(1)单质的化学性质最不活泼的元素是_______;常温下,会在浓硫酸中发生钝化的金属是_______。
(2)金属性最强的元素是_______非金属性最强的元素是_______。
(3)最高价氧化物对应的水化物,碱性最强的是_______,酸性最强的是_______。
(4)④的原子结构示意图是_______。
(5)④的最高价氧化物的电子式是_______,其所含化学键类型为_______(填“极性键”或“非极性键”)。
(6)④和④分别形成的最简单氢化物更稳定的是_______。
(7)④的最高价氧化物形成的水化物与④的最高价氧化物反应的离子方程式为_______。
高三化学一轮专题复习--元素或物质推断题专题训练

高考化学一轮专题复习--元素或物质推断题专题训练1.下列属于加成反应的是A .2C 2H 5+13/2O 24CO 2+5H 2O B .CH 2=CH 2+H 2CH 3CH 3C .+HO—NO 2+H 2O ;D .2CH 3COOH+Na 2CO 32CH 3COONa+CO 2↑+H 2O 2.下列说法不正确的是A .元素“氦、铷、铯”等是通过原子光谱发现的B .锂原子的1s 与2s 轨道均为球形分布C .2Co +的价电子排布式为523d 4sD .钠元素的第二电离能大于镁元素的第二电离能3.一种以镍电极废料(含Ni 以及少量23Al O 、23Fe O 和不溶性杂质)为原料制备NiOOH 的过程如图所示,“酸浸”后溶液中的金属离子除2Ni +外还有少量的3Al +和2Fe +等。
下列说法正确的是A .还原性:32Fe Ni ++>B .除杂过程仅为过滤操作C .氧化过程中每生成1mol NiOOH 消耗4mol OH -D .工业上也可电解碱性()2Ni OH 悬浊液制备NiOOH ,加入一定量的KCl 有助于提高生产效率4.C 5H 10O 2具有多种同分异构体,其中能与NaHCO 3反应放出气体的同分异构体的结构有A .2种B .3种C .4种D .5种5.将等物质的量的①Na 、①2Na O 、①22Na O 、①NaOH 投入到等体积且足量的水中,得到四种溶液,其中说法正确的是A .①①①①溶质的质量分数相等B .①①溶质的物质的量浓度相等C .①溶质质量分数最大,①溶质的质量分数最小D .无法确定四种溶液溶质的质量分数的大小6.下列有关Fe 3+、Fe 2+的性质及应用的说法正确的是①向盛有FeCl 3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN 溶液,黄色逐渐消失,加KSCN 后溶液颜色不变①将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2①向FeCl2溶液中滴加NH4SCN溶液,溶液显红色①将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体①向Fe2(SO4)3溶液中加入过量铁粉的离子方程式:Fe3++Fe=2Fe2+①Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2OA.①①①B.①①①C.①①①D.①①①7.下列离子方程式书写正确的是A.FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+B.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-C.铝与氢氧化钠溶液反应:2Al+2OH-+2H2O=2AlO +3H2↑2D.氧化铁与稀盐酸反应:FeO+2H+=Fe2++H2O8.氨碱法(索氏)和联合制碱法(侯氏)是两大重要的工业制碱法,下列表达正确的是()A.A B.B C.C D.D9.硒(Se)是人体必需的微量元素,在元素周期表中的位置如图所示。
高三化学一轮专题复习---元素或物质推断题

高考化学一轮专题复习---元素或物质推断题1.一澄清溶液中可能含有的离子如表所示,为测定其含有的离子的种类,取该溶液进行实验:阳离子K+、Mg2+、Ba2+、Al3+、H+阴离子I-、Br-、CO23-、SO24-、OH-实验①:用pH试纸检验,测得溶液呈强酸性。
实验①:取2 mL原溶液于试管中,加入少量CCl4及数滴新制氯水,经振荡,CCl4层呈紫红色。
实验①:取2 mL原溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,滴加过程中和滴加完毕后,均无沉淀产生。
实验①:另取部分上述实验①中的碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。
已知:Br2、I2易溶于CCl4,且Br2的CCl4溶液呈橙红色,I2的CCl4溶液呈紫红色。
根据所学知识,回答下列问题:(1)根据实验①,可排除___________的存在。
(填离子符号,下同)(2)根据实验①,可证明含有的离子为___________,写出氯水中的氯气与溶液中的离子反应的离子方程式___________。
该反应中被还原的物质为___________ (填离子符号或化学式)。
(3)根据实验①,可确定肯定不含的离子为___________。
(4)根据实验①,可证明___________的存在,又排除___________的存在。
(5)综上所述,该溶液中上述离子尚不能确定是否存在的是___________。
2.现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,B为日常生活中最常见的无色无味液体,E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,G为黄绿色气体单质,H是漂白液的有效成分,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。
请回答下列问题:(1)写出H的化学式:___________。
F的俗名是___________。
(2)①写出反应①的化学方程式:___________。
①写出反应①的化学方程式:___________。
2023届高考化学一轮专题复习—元素或物质推断题

1.(2022·广东广州·高三期末)前四周期元素A、B、C、D、E原子序数依次增大,其相关性质如表所示:
A
基态A原子核外电子占据3个轨道
B
原子核外有6种运动状态不同的电子
C
元素原子的核外p电子数比s电子数少1个
D
基态原子核外有6个原子轨道排有电子,且只有1个未成对电子
(5)硒(Se)位于第四周期,与②同主族。下列推断正确的是_______。
a.SeO2只具有还原性
b.Se的最低负化合价是 价
c.Se的气态氢化物的稳定性比⑥的强
Ⅱ.碘及其化合物广泛用于医药、染料等方面。从含I-废水中可提取碘单质,其主要工艺流程如下:
(6)5.(2022·广东汕头·高三期末)元素周期表是学习化学的重要工具。下表列出了①~⑩十种元素在周期表中的位置:
族
周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
二
①
②
三
③
④
⑤
⑥
⑦
⑧
四
⑨
⑩
请按要求回答下列问题:
(1)元素⑦简单氢化物的化学式为___________。
(2)写出元素②③形成一种化合物,可在呼吸面具中作为氧气的来源,其电子式是___________。
(3)写出元素⑦的最高价氧化物对应的水化物分别与元素⑥、⑩的最高价氧化物对应的水化物反应的离子方程式:_______、_______。
(4)元素⑧、⑨、⑩的最高价氧化物对应的水化物的酸性由弱到强的顺序是_______(填化学式)。
(5)常温下,单质⑩与元素⑥的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式为_______。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.(2019·高考全国卷Ⅲ)X、Y、Z 均为短周期主族元素,它们原子的最外层电子数之和 为 10。X 与 Z 同族,Y 最外层电子数等于 X 次外层电子数,且 Y 原子半径大于 Z。下 列叙述正确的是( B ) A.熔点:X 的氧化物比 Y 的氧化物高 B.热稳定性:X 的氢化物大于 Z 的氢化物 C.X 与 Z 可形成离子化合物 ZX D.Y 的单质与 Z 的单质均能溶于浓硝酸
4.“三看”比较微粒半径大小 (1)“一看”电子层数:当电子层数不同时,电子层数越多,半径越大。 例如:r(Li)<r(Na)<r(K)<r(Rb)<r(Cs); r(O2-)<r(S2-)<r(Se2-)<r(Te2-)。 (2)“二看”核电荷数:当电子层数相同时,核电荷数越大,半径越小。 例如:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl); r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。 (3)“三看”核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。 例如:r(Cl-)>r(Cl);r(Fe2+)>r(Fe3+)。
解析:选 B。X、Y、Z 均为短周期主族元素,它们原子的最外层电子数之和为 10,X、 Z 同主族,Y 最外层电子数等于 X 次外层电子数,则 X 的次外层电子数为 2,设 X 的最 外层电子数为 a,有 a+a+2=10,解得 a=4,又 Y 原子半径大于 Z,则 X 为 C 元素, Y 为 Mg 元素,Z 为 Si 元素。MgO 为离子晶体,碳的氧化物为分子晶体,故 Mg 的氧 化物的熔点高于碳的氧化物,A 错误;非金属性:C>Si,故氢化物的热稳定性:CH4>SiH4, B 正确;C、Si 形成的化合物 SiC 为共价化合物,C 错误;Mg 能溶解在浓硝酸中,Si 不与浓硝酸反应,D 错误。
【高考真题再现】 1.(2019·高考全国卷Ⅰ)科学家合成出了一种新化合物(如图所示),其中 W、X、Y、Z 为同一短周期元素,Z 核外最外层电子数是 X 核外电子数的一半。下列叙述正确的是 (C)
A.WZ 的水溶液呈碱性
B.元素非金属性的顺序为 X>Y>Z
C.Y 的最高价氧化物的水化物是中强酸 D.该新化合物中 Y 不满足 8 电子稳定结构
3.利用区间定位推断元素
对于原子序数较大的元素,可采用区间定位确定元素。元素周期表中各族序数的排列顺
序由左到右依次为ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA、ⅣA、
ⅤA、ⅥA、ⅦA、0,牢记各周期对应的 0 族元素的原子序数,可以快速确定周期数。
周期 一 二
三
四
五
六
七
起止序数 1~2 3~10 11~18 19~36 37~54 55~86 87~118
解析:选 C。该化合物由阴、阳离子组成,说明它是离子化合物。从该化合物的结构式 看出,W 为金属元素;1 个 Z 原子形成 1 个共价键,说明 Z 原子最外层有 1 个或 7 个电 子;1 个 X 原子形成 4 个共价键,说明 X 原子最外层有 4 个电子;1 个 Y 原子形成 2 个 共价键,阴离子得 1 个电子,说明 Y 原子最外层有 5 个电子;根据“Z 核外最外层电子 数是 X 核外电子数的一半”知,W、X、Y、Z 分别为 Na、Si、P、Cl。氯化钠是强酸 强碱盐,其水溶液呈中性,A 项错误;元素非金属性的顺序为 Z(Cl)>Y(P)>X(Si),B 项 错误;磷的最高价氧化物是 P2O5,其对应的水化物为 HPO3、H3PO4,它们均是中强酸, C 项正确;2 个硅原子和 1 个 P 原子形成 2 个共价键,阴离子得到 1 个电子,所以该化 合物中磷原子最外层达到 8 电子稳定结构,D 项错误。
5.(2018 年全国一卷). 主族元素 W、X、Y、Z 的原子序数依次增加,且均不大于 20。 W、X、Z 最外层电子数之和为 10;W 与 Y 同族;W 与 Z 形成的化合物可与浓硫 酸反应,其生成物可腐蚀玻璃。下列说法正确的是( B ) A. 常温常压下 X 的单质为气态 B. Z 的氢化物为离子化合物 C. Y 和 Z 形成的化合物的水溶液呈碱性 D. W 与 Y 具有相同的最高化合价
【答案】D
B.HCl 是强酸,HF 是弱酸,所以 X(F)的氢化物水溶液的酸性弱于 Z(Cl)的。选项 B 错误。 C.ClO2 的中心原子是 Cl,分子中只存在 Cl 和 O 之间的极性共价键,选项 C 错误。 D.标准状况下,W 的单质 O2 或 O3 均为气态,X 的单质 F2 也是气态。选项 D 正确。 点睛:本题相对比较简单,根据题目表述可以很容易判断出四个字母分别代表的元素,再代入四 个选项判断即可。要注意选项 D 中,标准状况下氧气、臭氧、氟气的状态为气体。
2.(2019·高考全国卷Ⅱ)今年是门捷列夫发现元素周期律 150 周年。下表是元素周期表 的一部分,W、X、Y、Z 为短周期主族元素,W 与 X 的最高化合价之和为 8。下列说 法错误的是( D )
A.原子半径:W<X B.常温常压下,Y 单质为固态 C.气态氢化物热稳定性:Z<W D.X 的最高价氧化物的水化物是强碱
⑦焰色反应呈黄色的元素:Na。焰色反应呈紫色(透过蓝色钴玻璃观察)的元素:K。 ⑧单质密度最小的元素:H。单质密度最小的金属元素:Li。 ⑨常温下单质呈液态的非金属元素:Br。常温下单质呈液态的金属元素:Hg。 ⑩最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素:Be、Al。 ⑪元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应的元素:N。元 素的气态氢化物和它的最高价氧化物对应的水化物能发生氧化还原反应的元素:S。 ⑫单质为常见的半导体材料:Si、Ge。 ⑬元素的气态氢化物和它的氧化物能在常温下反应生成该元素的单质的元素:S。 ⑭元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。
专题六 元素推断题
解题方法:
元素的“位、构、性”的推断及综合应用
元素“位、构、性”的关系及其应用 【专题知识整合】
1.熟记元素周期表的结构
2.明确四个数量关系 (1)电子层数=周期序数。 (2)质子数=原子序数。 (3)最外层电子数=主族序数。 (4)主族元素的最高正价=主族序数(O、F 除外), 最低负价=主族序数-8。
解析:选 D。由题中信息和图示可知 W 位于第二周期,X、Y、Z 位于第三周期,结合 W 与 X 的最高化合价之和为 8,且族序数相差 2,可知 X 为 Al,W 和 Z 分别为 N 和 P, Y 为 Si。原子半径:N<Al,A 项正确;常温常压下,单质硅呈固态,B 项正确;由非金 属性:P<N 可知,气态氢化物热稳定性:PH3<NH3,C 项正确;Al 的最高价氧化物对 应的水化物 Al(OH)3 是典型的两性氢氧化物,不是强碱,D 项错误。
6.(2017 年全国三卷).短周期元素 W、X、Y 和 Z 在周期表中的相对位置如表
所示,这四种元素原子的最外层电子数之和为 21。下列关系正确的是
(D)
A.氢化物沸点:W<Z
WX
Y
Z
B.氧化物对应水化物的酸性:Y>W
C.化合物熔点:Y2X3<YZ3
D.简单离子的半径:Y<X
4.(2018 年全国三卷). W 、 X 、 Y 、 Z 均为短周期元素且原子序数依次 增大,元素 X 和 Z 同族。盐 YZW 与浓盐酸反应,有黄绿色气体产生,此气 体同冷烧碱溶液作用,可得到 YZW 的溶液。下列说法正确的是( D ) A. 原子半径大小为 W<X<Y<Z B. X 的氢化物水溶液酸性强于 Z 的[来源:学科网 ZXXK] C. Y2W2 与 ZW2 均含有非极性共价键 D. 标准状况下 W 的单质状态与 X 的相同
5.金属性、非金属性强弱的判断方法
6.建立“位、构、性”关系模型 这类题目往往将元素化合物知识、物质结构理论、化学基本理论等知识串联起来,综合 性较强,难度较大,解题的关键是正确推断元素,常用的主要依据如下: (1)原子或离子结构示意图。 (2)元素主要化合价的特征关系。 (3)原子半径的递变规律。
(4)元素及其化合物的特性。 ①形成大的物质的元素:C。 ②空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。 ③地壳中含量最多的元素或简单氢化物在通常情况下呈液态的元素:O。 ④地壳中含量最多的金属元素:Al。 ⑤最活泼的非金属元素或无正化合价的元素或无含氧酸的非金属元素或无氧酸可腐蚀 玻璃的元素或气态氢化物最稳定的元素或阴离子的还原性最弱的元素:F。 ⑥最活泼的金属元素或最高价氧化物对应水化物的碱性最强的元素或阳离子的氧化性 最弱的元素:Cs。
