第三节醛酮自制
醛和酮3
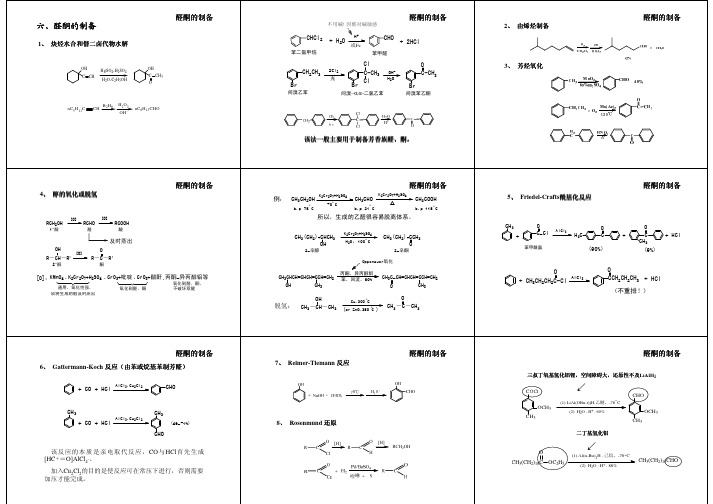
该法一般主要用于制备芳香族醛该法一般主要用于制备芳香族醛、。
R COCI[H]R COHRCH2OH[H]羰基合成由α-烯烃合成多一个碳的醛!+ COCH [Co(CO)4],加压CH -CH 八羰基二钴CH 3CH 2CH CHO CH 3CHCHOCH3正丁醛(多)异丁醛(少)H 2CH=CH 2+CO [Co(CO)4],加压CH CH-CH C OO=CNCH OOCC=CCOOH碳负离子的反应C CCH6HBrC CCHC6Br2EtCO2CHCCH3H5C=CH-OH35CHCHO -CO产生碳负离子OHC CHCO-BrH COOHCH 3COOH (RCH COOH)Benzoin condensation芳香醛在氰化钾的作用下芳香醛在氰化钾的作用下,,发生双分子缩合发生双分子缩合,,α-羟基酮的反应------安息香缩合反应安息香缩合反应。
俗称安息香ArCH-CAr OKCN 醇碳负离子的反应反应机理HNO 3C CO O 碳负离子的反应CHO碳负离子的反应反应机理反应机理::R 1R 2CH-Xph 3PR 1R 2C H -Pph 3 XphLi -HXR 1R 2C-Pph 3R 1R 2C=Pph 3蒽醌类染料的重要组成部分。
蒽醌类染料的重要组成部分。
醛酮的制备方法.
要控制氧化条件防止醛的进一步氧化。用CrO3-醋酐能防止醛
的氧化:
O
CH3
CH(OCCH3)2
CHO
CrO3-Ac2O
H2O
HOAc/H2SO4
Br
Br
Br
在这里生成的中间物二乙酸酯不易继续被氧化,它水解后即 得芳醛。
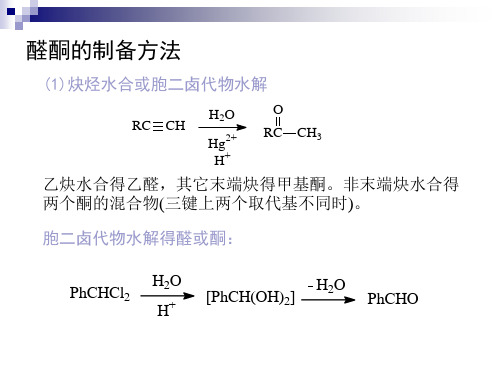
(4) 由醇氧化或脱氢(见醇酚醚章) (5) Friedal-Crafts酰基化(见芳香烃章) (6) Gattermann-Koch反应(见芳香烃章) (7) Reimer-Tiemann反应(见醇酚醚章) (8) Rosenm炔烃水合或胞二卤代物水解
RC CH
H2O
Hg2+ H+
O RC CH3
乙炔水合得乙醛,其它末端炔得甲基酮。非末端炔水合得 两个酮的混合物(三键上两个取代基不同时)。
胞二卤代物水解得醛或酮:
PhCHCl2
H2O H+
[PhCH(OH)2]
H2O
PhCHO
(2) 由烯烃制备 (a)烯烃氧化
i) 烯烃臭氧化然后还原水解得醛或酮 ii) 氢甲醛化
RCH=CH2
例如:
H2, CO, Co2(CO)8 加热,加压
RCH2CH2CHO (主) + RCHCH3 (次) CHO
H2, CO, Co2(CO)8 加热,加压
CHO 65%
(3) 由芳烃氧化
CH3 MnO2
65% H2SO4
CHO 40%
O RCCl + H2
Pd+BaSO4 喹啉+S
O RCH
(9) 酰氯与烷基铜锂作用
COCl + Me2CuLi
醚 78°C
COMe 81%
醛酮的合成

经典化学合成反应标准操作醛酮的合成编者:雷耀辉,周盛峰药明康德新药开发有限公司化学合成部目录1.前言 (4)2.由醇合成醛酮 (5)2.1铬(VI)试剂 (5)2.1.1 Jones氧化(Cr2O3/H2SO4/acetone) (5)2.1.2 Collins氧化(Cr2O3.2Py) (6)2.1.3 PCC(Pyrindium Chlorochromate)氧化 (9)2.1.4 PDC(Pyrindium Dichromate)氧化 (10)2.2 用活性MnO2氧化 (11)2.3用DMSO氧化 (12)2.3.1 DMSO-DCC氧化 (Pfitzner-Moffatt Oxidation or Moffatt Oxidation) (12)2.3.2 DMSO-(COCl)2氧化(Swern Oxidation or Moffatt-Swern Oxidation) (14)2.3.3 DMSO-Cl2,DMS-NCS (Corey-Kim氧化) (15)2.3.4 DMSO-SO3-Pyridine (17)2.4 用氧铵盐氧化 (18)2.5 用高价碘试剂氧化 (18)2.6 亚硝酸钠和醋酐氧化 (20)2.7 其它氧化方法 (21)2.8 1,2-二醇的氧化 (22)3.由卤化物合成醛酮 (25)3.1 由伯卤甲基和仲卤甲基的氧化合成醛酮 (25)3.1.1 用DMSO氧化(Kornblum反应) (25)3.1.2用硝基化合物氧化(Hass反应) (26)3.1.3用乌洛托品氧化(Sommelet反应) (26)3.1.4用对亚硝基二甲苯胺氧化吡啶翁盐氧化(Kröhnke反应) (28)3.1.5用胺氧化物氧化 (28)3.2 由二卤甲基或二卤亚甲基合成醛酮 (28)3.3 由有机金属化合物的酰化合成醛酮 (29)3.4 由Pd催化反应合成醛 (31)4.由活泼甲基或活泼亚甲基烷烃合成醛酮 (32)4.1 用SeO2氧化合成醛酮 (32)4.2用空气氧化合成酮 (34)4.3 用铬酸氧化合成酮 (35)4.4用高锰酸盐氧化合成酮 (36)4.5 用醌氧化合成酮 (36)5.由羧酸及其衍生物合成醛酮 (37)5.1由羧酸合成醛 (37)5.1.3由羧酸合成酮 (38)5.2由酰氯及酸酐合成醛酮 (40)5.2.1用Rosenmund法合成 (40)5.2.2用金属氢化物还原 (41)5.3由酯及内酯合成醛 (42)5.4由酰胺合成醛酮 (43)5.5由酯或酰氯经Weinreb酰胺合成醛酮 (46)5.6由氰合成醛酮 (49)6. 由烯烃合成醛酮 (53)6.1 由烯烃臭氧氧化合成醛 (53)6.2 烯烃用OsO4/NaIO4氧化合成醛 (55)6.3 烯烃经由有机硼化合物中间体的烯烃甲酰化合成醛 (56)6.4 由烯烃的加氢甲酰化合成醛(羰基合成法) (56)6.5 由烯烃的甲酰化合成醛 (57)6.6烯烃经加成-氧化反应合成酮 (58)6.7 其它方法 (60)7.由炔烃合成醛酮 (61)7.1 由加成-氧化反应合成醛酮 (61)7.2 由氧化反应合成酮 (61)7.3 由加成-水解反应合成酮 (61)7.4 由加成-还原反应合成酮 (62)7.5 由加成-烷基化,酰化等反应合成酮 (62)8. 由醚及环氧化合物合成醛酮 (63)8.1 Claisen重排 (63)8.2酸催化下环氧化物重排 (64)8.3氧化法 (65)8.4 水解法合成醛酮 (66)9. 由胺合成醛 (68)9.1胺的氧化 (68)9.2 由胺经由西佛碱的方法 (68)9.3 自苯胺衍生物合成 (69)10. 由硝基化合物合成醛酮 (71)11 由砜合成醛酮 (74)12.由芳环合成醛酮 (75)12.1 由芳环的Friedel-Crafts反应合成芳基酮 (75)12.2 由芳环的甲酰化反应合成芳香醛 (79)12.2.3 Reimer-Tiemann 甲酰化 (83)12.2.4 Gattermann甲酰化 (84)12.2.5 多聚甲醛/甲醇镁苯酚甲酰化 (85)12.2.6氯化锡/多聚甲醛苯酚甲酰化 (86)13. 由Dieckmann 缩合脱酸合成酮 (87)14 Michael 反应和类似反应(Addition, Condensation) (89)15 由合成子合成醛酮 (90)16. 参考文献 (94)1.前言醛和酮是一类重要的有机化合物,其合成在有机合成中占有非常重要的地位。
03-5 醛酮的合成

1,41,4-加成反应制酮
R2CH=CHY COR CN R' R2 RCOCHCHCH2Y COOR
酮与亲电试剂的1 加成(Michael反应 反应) ① 酮与亲电试剂的1,4-加成(Michael反应)
COH
烯胺与亲电烯的1 ② 烯胺与亲电烯的1,4-加成
N + RCH=CHY N CHCHY R CN COOR H2O O CHCH2Y R
⑤ 芳烃的侧链氧化
ArCH3 CrO3 (CH3CO)2
NO2 X
ArCH(OCOCH3)2
CN
HCl H2O
ArCHO
COOR 不受影响
ArCOCH3
SeO2
ArCOCHO
2. 还原反应
① 酰卤的还原
O RCCl H2 Pd-BaSO4 O RCH
酰胺、 ② 酯、酰胺、羧酸的还原
O RCZ Z=-OR' -NR'2 -OH LiAlH(OR')3 O RCH
O n-C6H13MgBr + CH3COCl THF n-C6H13CCH3
7. 缩合生成醛酮
① 羟醛缩合
RCH2CHO OHRCH2CH=CCHO R
② 酮酯缩合
CH3COCH2R + HCOOC2H5 NaOC2H5 CH3COCHCHO R
③ 酯缩合
RCH2COOC2H5 RCH2COCHCOOC2H5 R
ArH + HCN + HCl
OH
ZnCl2
ArCH=NHHCl
CHO
H2O
ArCHO
Zn(CN)2/HCl H2O OH
OH
OH
芳烃或烯烃用甲酰胺甲酰化(Vilsmeier反应 反应) ③芳烃或烯烃用甲酰胺甲酰化(Vilsmeier反应)
3.3醛酮教学设计2023-2024学年高二下学期化学人教版(2019)选择性必修3

3. 实验法:安排学生进行醛酮的制备实验,让学生通过实际操作观察实验现象,增强对醛酮化学性质的理解和记忆。
教学手段:
1. 多媒体课件:利用多媒体课件,以图文并茂的形式展示醛酮的结构、化学反应过程和实验操作,增强学生的直观感受,提高学习兴趣。
引导学生思考这些案例对实际生活或学习的影响,以及如何应用醛酮解决实际问题。
小组讨论:让学生分组讨论醛酮的未来发展或改进方向,并提出创新性的想法或建议。
4. 学生小组讨论(10分钟)
目标:培养学生的合作能力和解决问题的能力。
过程:
将学生分成若干小组,每组选择一个与醛酮相关的主题进行深入讨论。
小组内讨论该主题的现状、挑战以及可能的解决方案。
3.利用多媒体课件,生动展示实验过程和结果
4.注重课堂互动,鼓励学生提问和发表见解
5.及时给予反馈,帮助学生巩固所学知识
八、教学难点
1.醛酮的结构特点
2.醛酮的氧化反应、加成反应和缩合反应的机理
3.实验操作的安全性和注意事项
九、教学准备
1.教材和实验器材的准备
2.多媒体课件的制作
3.实验方案的设计和安全措施的落实
- 加成反应机理:醛酮中的醛基或酮基与氢气、卤素、醇等物质发生加成反应,形成新的化合物。
- 缩合反应机理:醛酮分子之间通过缩合反应,形成高分子化合物,如聚酮、聚醛等。
4. 题目:分析醛酮在有机合成中的应用实例。
答案:
- 实例1:将醛酮与氢气反应,生成相应的醇。
- 实例2:将醛酮与卤素反应,生成相应的卤化物。
- 醛酮的化学性质,包括氧化反应、加成反应和缩合反应
第三章 第三节 醛 酮-人教版高二化学选择性必修3课件

O
还原性
C
H
醛基中碳氢 碳 键较活泼,能被 氢 键 氧化成相应羧酸。
3、化学性质 (1)氧化反应
① 银镜反应
a、配制银氨溶液:取一洁净试管,加入1ml 2%的 AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的 沉淀恰好溶解。
b、水浴加热生成银镜:在配好的上述银氨溶液中滴 入三滴乙醛溶液,然后把试管放在热水浴中静置。
微点拨:酮与醛可能为官能团异构,如丙醛与丙酮互 为同分异构体。
课堂小结
羰基的两端连有两个烃基的化合物 饱和的一元酮为CnH2nO(n≥3)
O R1—C—R2
主要化学性质
1、加成反应:
O
=
R1—C—R2
+ H2
Ni △
OH | R1—CH—R2
2、难被氧化(燃烧除外):难被银氨溶液或新制氢 氧化铜氧化。
主链的碳原子数称“某醛” 。
(2)编号位: 从醛基一端开始,醛基中的碳原子编
号为1 。
(3)写名称: 把取代基名称写在母体名称前,用
“二、三、四等”写出醛的个数。
CH3 CH3—CH—CHO
2-甲基丙醛
CHO CH3—CH—CH2—CH3
2-甲基丁醛
5、常见的醛
甲醛: HCHO是最简单的醛,为无色、有刺激性气味
混合加入40%的乙醛溶液加热至沸腾,无红色沉淀,
实验失败的原因是( B )
A.乙醛溶液太少
B.氢氧化钠不够用
C.硫酸铜不够用
D.加热时间不够
2、为了鉴别己烯、甲苯和丙醛,使用的试剂组先
后关系正确的是 ( A )
A. 新制氢氧化铜悬浊液及溴水 B. 高锰酸钾酸性溶液及溴水 C. 银氨溶液及高锰酸钾酸性溶液 D. 新制氢氧化铜悬浊液及银氨溶液
醛酮的合成

氧化成醛(和/或酸)和酮的方法。
OH
CrO3 C5H5N
O
Collins氧化法是在Sarett氧化法(以吡啶为溶剂)基础上的改进,
以二氯甲烷为溶剂氧化伯醇为醛
PCC (氯铬酸吡啶鎓盐)氧化
PCC易于合成和保存,操作简单,是将伯醇和仲醇氧化成 醛和酮的应用最广的氧化方法。PCC中所用的碱除吡啶外, 也可以是其它碱,且随着碱性部分碱性的增强,氧化的选择 性也提高。其中,DMAP· HCrO3Cl为适用于烯丙醇类及苄醇 类的选择性氧化试剂。
OH HO DMAP, HCrO3Cl O HO
PCC的氧化以均相反应为主,但有的方法是将催化剂吸附于 硅胶、氧化铝等无机载体或离子交换树脂等有机高分子载体 上,对醇作非均相催化氧化。后处理简单并可控制反应的选 择性。
2017/12/28
PDC(Pyrindium Dichromate)氧化
PDC的氧化能力较PCC强,其氧化作用一般在中性条件下进 行。PDC的氧化一般在二氯甲烷中进行,如在DMF中进行时, 氧化性增强,能将伯醇最终氧化成酸。
P OH N C N i-Pr O
H2PO4, DMSOI, benzene, 25 oC
(Organic Syntheses, Coll. Vol. 6, p.218; Vol. 56, p.99)
DMSO-Cl2,DMS-NCS
(Corey-Kim氧化)
2017/12/28
用DMSO-Cl2和DMS-NCS体系使醇氧化虽应用广泛且收率也高, 但还是以DMSO-(COCl)2氧化较为方便。
2017/12/28
DMSO-(COCl)2氧化
醛酮的合成-060331

经典化学合成反应标准操作醛酮的经典合成目录1.前言 (4)2.由醇合成醛酮 (4)2.1铬(VI)试剂 (4)2.1.1 Jones氧化(Cr2O3/H2SO4/acetone) (4)2.1.2 Collins氧化(Cr2O3.2Py) (5)2.1.3 PCC(Pyrindium Chlorochromate)氧化 (8)2.1.4 PDC(Pyrindium Dichromate)氧化 (9)2.2 用活性MnO2氧化 (10)2.2.1 用活性MnO2氧化示例一: (10)2.3用DMSO氧化 (11)2.3.1 DMSO-(COCl)2氧化(Swern Oxidation) (11)2.3.2 DMSO-SO3-Pyridine (12)2.4 用氧铵盐氧化 (13)2.4.1 用氧铵盐氧化示例: (13)2.5 用高价碘试剂氧化 (14)2.5 .1 Dess-Martin氧化反应示例: (14)2.5.2 IBX氧化反应示例: (15)2.6 亚硝酸钠和醋酐氧化 (15)2.6.1 亚硝酸钠和醋酐氧化示例 (15)2.6 TPAP-NMO 氧化 (16)2.6.1 TPAP-NMO 氧化示例 (16)2.7 1,2-二醇的氧化 (16)2.7.1 1,2-二醇的氧化示例一: (17)2.7.1 其他1,2-二醇的氧化相关文献: (18)3.由卤化物合成醛酮 (18)3.1 由伯卤甲基和仲卤甲基的氧化合成醛酮 (18)3.1.1 用DMSO氧化(Kornblum反应) (18)3.1.2用硝基化合物氧化(Hass反应) (20)3.1.3用乌洛托品氧化(Sommelet反应) (21)3.1.4用对亚硝基二甲苯胺氧化吡啶翁盐氧化(Kröhnke反应) (22)3.1.5用胺氧化物氧化 (22)3.2 由二卤甲基或二卤亚甲基合成醛酮 (23)3.2.1 由二卤甲基合成醛反应示例: (23)3.3 由有机金属化合物的酰化合成醛酮 (24)3.3.1 由有机金属化合物的酰化合成醛酮示例 (25)3.4 由Pd催化反应合成醛 (25)4.由活泼甲基或活泼亚甲基烷烃合成醛酮 (25)4.1 用SeO2氧化合成醛酮 (26)4.1.1 用SeO2氧化合成醛酮示例 (26)4.2用空气氧化合成酮 (26)4.2.1用空气氧化合成酮反应示例: (27)4.3 用铬酸氧化合成酮 (27)4.3.1 用铬酸氧化合成酮示例 (27)4.4用高锰酸盐氧化合成酮 (29)4.5 用醌氧化合成酮 (29)5.由羧酸及其衍生物合成醛酮 (30)5.1由羧酸合成醛 (30)5.1.1用金属氢化物还原 (30)5.1.2由脱CO2合成醛 (31)5.1.3由羧酸合成酮 (31)5.2由酰氯及酸酐合成醛酮 (33)5.2.1用Rosenmund法合成 (33)5.2.2用金属氢化物还原 (34)5.3由酯及内酯合成醛 (35)5.3.1 酯通过DIBAL还原为醛示例: (36)5.4由酰胺合成醛酮 (36)5.4.1 由酰胺合成醛酮 (37)5.4.2 McFadyen-Stevens Reaction (38)5.5由酯或酰氯经Weinreb酰胺合成醛酮 (39)5.5.1 由Weinreb酰胺还原合成醛反应示例一 (40)5.5.2由Weinreb酰胺还原合成酮反应示例: (41)5.6由氰合成醛酮 (41)5.6.1DIBAL 还原腈到醛示例(最重要的方法) (42)5.6.2Li(EtO)3AlH 还原腈到醛示例(较重要的方法) (43)5.6.3Ranney Ni 加氢还原氰到合成醛示例 (43)5.6.4有机金属试剂对腈加成合成酮示例 (44)6. 由烯烃、芳环合成醛酮 (46)6.1 由烯烃臭氧氧化合成醛 (46)6.2 烯烃用OsO4/NaIO4氧化合成醛 (47)6.3 烯烃经由有机硼化合物中间体的烯烃甲酰化合成醛 (47)6.5 由烯烃的甲酰化合成醛 (48)6.5.1 Vilsmeyer反应 (48)6.5.2 Duff’s 甲酰化 (51)6.5.3 Reimer-Tiemann 甲酰化 (52)6.5.4 Gattermann甲酰化 (53)6.5.5 多聚甲醛/甲醇镁苯酚甲酰化 (53)6.5.6氯化锡/多聚甲醛苯酚甲酰化 (54)6.5.7重氮化后甲酰化 (54)6.6烯烃经加成-氧化反应合成酮 (56)6.6.1 烯烃经加成-氧化反应合成酮示例 (56)7. 由炔烃合成醛酮 (57)7.1 由加成-氧化反应合成醛酮 (57)7.2 由氧化反应合成酮 (57)7.3 由加成-水解反应合成酮 (58)7.4 由加成-还原反应合成酮 (59)7.5 由加成-烷基化,酰化等反应合成酮 (59)8. 由醚及环氧化合物合成醛酮 (59)8.1 Claisen重排 (59)8.2酸催化下环氧化物重排 (61)8.2.1 酸催化下环氧化物重排合成醛酮示例一 (61)8.3氧化法 (61)8.4 水解法缩醛或酮合成醛酮 (61)9. 由胺合成醛 (62)9.1胺的氧化 (62)9.1.1 胺的氧化合成醛反应示例: (63)9.2 由胺经由西佛碱的方法 (64)9.2.1 由胺经由西佛碱合成醛示例 (64)9.3 自苯胺衍生物合成 (64)10. 由硝基化合物合成醛酮 (64)11. 由Friedel-Crafts反应合成芳基酮 (65)11.1 由Friedel-Crafts反应合成芳基酮示例 (68)12. Dieckmann 缩合脱酸 (69)13. 由合成子合成醛酮 (71)14. 由砜合成醛酮 (71)15. Michael 反应和类似反应(Addition, Condensation) (71)1.前言醛和酮是一类重要的有机化合物,其合成在有机合成中占有非常重要的地位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲酸:
甲酸酯:
甲酸盐:
麦芽糖
3.还原反应 加成反应
, (R )H R C O +H H
催化剂
, (R )H
R
C
H
OH 与H2反应
练习:写出HCHO、CH3CHO、
的方程式 小结: RCHO+H2 R R′ C=O+H2 催化剂 RCH2OH R
、
逆推RCH2OH — 醛
催化剂
CHOH 逆推RCHOH—酮 R′ R′
(5)与新制Cu(OH)2悬浊液反应 ① 新制Cu(OH)2悬浊液的制备: 向NaOH溶液中加入几滴CuSO4,充分振荡 2NaOH+CuSO4 = Cu(OH)2↓ + Na2SO4
②加乙醛0.5mL,加热至沸腾 CH3CHO+ 2 Cu(OH)2
现象:
产生砖红色沉淀
CH3COOH + Cu2O ↓ + 2 H2O ② NaOH 要过量
一乙酸铵
、HCHO的银镜反应方程式
注意:
①银氨溶液的制备(现用现配,不可长时间放置)
逐滴加氨水 边加边振荡
AgNO3溶液 至产生沉淀 恰好消失
得银氨溶液
AgNO3 + NH3·H2O=AgOH↓ + NH4NO3 AgOH +2NH3·H2O = [Ag(NH3)2]OH + 2H2O 银氨溶液主要成分:[Ag(NH3)2]OH
9% ,则氧元素的质量分数是(
A. 16%
B. 37%
C. 48%
D.无法计算
5.下列操作正确的是(
)
A.配制银氨溶液:在一定量AgNO3溶液中,滴加氨水至沉
淀恰好溶解
B.配制Cu(OH)2悬浊液:在一定量CuSO4溶液中加入少量
NaOH溶液
C.制溴苯时,为了充分吸收HBr,将导气管插入水中
D.制乙酸乙酯时,在一定量浓硫酸中,依次加入乙酸和乙醇
。
(2)检验分子中碳碳双键的方法是
,化学方程式为:
。
(3)实验操作中,哪一个官能团应先检验?
德州市实验中学高二化学组
2018.4. 27
乙醛
丙酮
丙醛
一、醛、酮的结构
醛: 1.官能团 酮:
或
醛基
酮羰基 R为烃基可同可不同
2.饱和一元醛酮通式: CnH2nO 同碳数的醛、酮互为同分异构体
3.醛酮同分异构体的书写: 先写碳骨架,再放官能团
分子式 结构数
CH2O C2H4O C3H6O 1 1 2
C4H8O
C5H10O
7
3
4.醛酮命名:
高二化学
有机化学基础
第二章 官能团与化学反应——烃的衍生物
第三节 醛和酮 糖类(Ⅰ)
学习目标
1.了解醛、酮组成和结构特点
2.了解几种常见的醛、酮的组成、结构、性质及用途
3.掌握饱和一元醛、酮的同分异构体的书写 4.能够用系统命名法对简单的醛、酮命名
常见的醛、酮
甲醛
甲醛、乙醛、丙醛、丙酮在结 构上有什么相同和不同之处?丙醛 和丙酮有什么关系?你能归纳出醛、 酮的概念吗?
可电离:[Ag(NH3)2]OH = [Ag(NH3)2]+ + OH-
②试管要洁净 ③必须水浴(60∽70℃)加热,不能用酒精灯直接加热
④加热时不能摇动试管否则得到黑色银粒
⑤氨水不能过量(防止生成易爆物)
⑥实验后试管的洗涤: 先用稀HNO3、再用水洗
⑦碱性条件下的反应 应用:检验醛基 、制镜、制瓶胆(葡萄糖)
后加热
6.下列醇不可由醛或酮与H2加成还原而来的是( A. CH3CH2CH2OH B. CH3CHCH3 OH D.
)
C.
7.下列关于醛 判断正确的是(
)
A.用溴水检验CH2=CHCHO中是否含有碳碳双键 B.1molHCHO发生银镜反应最多生成2molAg C.对甲基苯甲醛( )使酸性高锰酸钾溶液褪色
(1)醛:醛基碳为一号碳的最长碳链为主链,醛基位置不标 (2)酮:选择含羰基的最长碳链为主链
从离羰基最近一端开始编号
用阿拉伯数字标明羰基位置 如:
4,4—二甲基—2 —戊酮
3,4—二甲基戊醛
5.几种常见的醛酮:(P70) 甲醛 乙醛 苯甲醛 丙酮
甲醛 结构 简式 HCHO
乙醛 CH3CHO
苯甲醛 C6H5CHO
丙酮 CH3CCH3
强烈刺激性气 有刺激性气味 杏仁气味的液体 又称苦杏仁油 色、态、 味的无色气体 的无色液体 又叫蚁醛 味 溶解性
特殊气味的无色 液体
与水任意比互溶, 能溶解多种有机 化合物
易溶于水
遇水、乙醇 等互溶
微溶于水
应用
制造脲醛树脂 酚醛树脂等 福尔马林
重要的有机 化工原料
制造染料、香 料的中间体
催化剂
RCOOH
醛也可使溴水退色
2 CH3COOH
练习:写出
、 CH3CH2CHO 催化氧化反应方程式
(4)银镜反应
CH3CHO + 2[Ag(NH3)2]OH
H2O + 2Ag ↓+ 3NH3 + CH3COO NH4
一水 二银 三氨 现象:试管内壁形成光亮的银镜
练习:写出CH3CH2CHO 、 总结: RCHO ∽ 2Ag R(CHO)2 ∽ 4Ag HCHO ∽ 4Ag
A.丁醇和乙醚
)
B.丙醛和丙醇 C.丙醇和甘油 D.乙烯和丁二烯 )
3.某饱和一元醛与银氨溶液反应时生成21.6gAg,将等量的该醇 完全燃烧,生成标况下的CO2 13.44L,则该醛是( A.丙醛 B.丁醛 C.3-甲基丁醛 ) D.己醛
4.甲醛、乙醛、丙醛和丙酮组成的混合物中,氢元素的质量分数为
说明它含有醛基
D.能发生银镜反应的有机物不一定是醛类
8.可鉴别1-己烯、甲苯和丙醛三种物质的一组试剂的是( A.银氨溶液和酸性高锰酸钾溶液 B.酸性高锰酸钾溶液和溴的四氯化碳溶液 C.FeCl3溶液和银氨溶液 D.银氨溶液和溴的四氯化碳溶液
)
9.某醛的结构简式为CH2=CHCH2CHO
(1)检验分子原
醛
氧化
酸
酯
跟踪练习
1.下列关于常见的醛酮的说法中正确的是( )
A.甲醛和乙醛都是有刺激性气味的无色液体
B.丙酮是结构最简单的酮,也可以发生银镜反应和加氢还原
C.丙酮难溶于水,但丙酮是常用的有机溶剂
D.人体缺乏维生素A时,难以氧化生成视黄醛,从而引起夜盲症
2.下列各组物质属于同分异构体的是(
注意: ①Cu(OH)2悬浊液现用现配
③用酒精灯直接加热至沸
应用:检验醛基、检测尿糖
练习:写出CH3CH2CHO、
、HCHO 与新制氢氧化铜悬浊
液反应的方程式 总结: RCHO ∽ Cu2O
R(CHO)2 ∽ 2 Cu2O HCHO ∽ 2 Cu2O
小结: 含醛基的物质
可发生银镜反应
可与新制氢氧化铜悬浊液反应 葡萄糖: CH2OH(CHOH)4CHO
有机溶剂和有 机合成原料
二、醛、酮的化学性质
1. 羰基的加成反应 , (R )H
d+ d d + d - 催化剂
(R )H R , C O A 双键断裂,异电相吸
,
R
, (R )H R
C O +A B
B C
A
(R )H
催化剂
C O +A A
d+ d -
R
OA
d - d+
加成物质: HCN、NH3(H-NH2)、ROH(醇)
d+ d-
练习:写出CH3CHO、
分别与H2、HCN、NH3、
CH3OH的加成反应方程式(条件:催化剂)
2.氧化反应(醛) (1)燃烧: CnH2nO + O2
点燃
n CO2 + n H2O
KMnO4 H+
(2)与酸性高锰酸钾反应: RCHO 现象: 紫色退去 (3)催化氧化 2 CH3CHO + O2
