第十二章 醛和酮中文
有机化学徐寿昌第二版第12章醛和酮核磁共振

◆醛酮的红外光谱
羰基化合物在1680~1850cm-1处有一个强的羰基伸 缩振动吸收峰。醛基C-H在2720cm-1处有尖锐的特征 吸收峰。
乙醛的红外光谱
1
2
羰基若与邻近基团发生共轭,则羰基吸收频率降低: 苯乙酮的红外光谱
12.4.1 亲核加成反应 ◆烯烃的加成一般为亲电加成. ◆醛、酮的加成为亲核加成,易与HCN、NaHSO3、
R1 R2
例如:
C=C
R1 R2
+Ph3P=O
=O + Ph3P=CH2
=CH2
CH3CH=CHCHO+ Ph3P=C(CH3)2
CH3CH=CHC=C(CH3)2
该反应1945年由德国化学家Wittig发现,对有机合成特别是 维生素类的合成做出了巨大贡献。1979年Wittig 在82岁时获得了 Nobel化学奖.
◆反应历程(亚硫酸氢根离子为亲核试剂):
O
◆ -羟基磺酸钠与等摩尔的NaCN作用,则磺酸基可 被氰基取代,生成 -羟基腈,避免用有毒的氰化氢, 产率也比较高。
PhCHONaHSO3PhCHSO3NaNaCNPhCHCNHCl/△ PhCHCOOH
OH
OH
OH
பைடு நூலகம்
◆醛酮与NaHSO3的加成反应活性: 甲醛>乙醛>苯甲醛>丙酮>环戊酮>苯乙酮(不反应).
◆希夫碱还原可得仲胺。在有机合成上常利用芳醛与 伯胺作用生成希夫碱,再还原来制备仲胺。
⑦醛酮与Wittig试剂的加成:
Wittig试剂为磷的内蓊盐,即磷叶立德.由三苯基磷 与卤代烷反应得到磷盐.磷盐与碱作用得到Wittig试 剂: Ph3P+—C-R1(R2). 反应通式为:
第十二章 醛和酮 亲核加成 共轭加成

1. 醛、酮的定义和分类酮分子中的羰基也可称为酮基。
羰基与两个相同的烃基相连,称为简单酮或对称酮,与两个不同的烃基相连则称为混合酮或不对称酮。
2. 醛、酮的定义和分类结构当羰基的α位有羟基或氨基时,羰基氧原子可以与羟基或氨基的氢原子以氢键缔合,倾向于以重叠型为优势构象形式存在,如:第十二章 醛和酮 亲核加成 共轭加成3.醛、酮的物理性质由于羰基的偶极矩增加了分子间的吸引力,因此醛、酮的沸点比相应相对分子质量的烷烃高,但比醇低。
醛酮的氧原子可以与水形成氢键,因此低级醛酮能与水混溶(甲醛易溶于水,丙酮能与水以任意比例互溶,乙醛的溶解度为16g(100g H2O)-1)。
脂肪族醛酮相对密度小于1,芳香族醛酮相对密度大于1。
4.醛、酮的反应(1)羰基的亲核加成由于电子效应和空间位阻的原因,醛比酮表现的更活泼。
1)和含碳亲核试剂的加成①与有机金属化合物的加成此反应仅限于酮的烃基和格氏试剂的烃基都不太大,即空间位阻不很突出。
否则将发生两种“不正常”的反应:烯醇化反应及酮被还原。
烷基锂体积较小,因此当格氏试剂反应结果不好时,有时可以用烷基锂进行反应,会得到较好的结果,因此,格氏试剂与烷基锂可以相互补充。
当羰基与一个手性中心相连时,它与格氏试剂(也包括氢化铝锂等试剂)反应就是一个手性诱导反应。
亲核加成反应遵循Cram规则一,即:亲核试剂从空间位阻较小的一边进攻羰基碳原子。
为什么R与L取重叠型构象?因为这些试剂与羰基发生加成反应时,它们的金属部分须与羰基氧络合,因此羰基氧原子一端位阻增大,α碳上最大基团(L)与羰基处于反式,故R与L取重叠型构象为最有利于反应的构象。
②与HCN的加成丙酮与氢氰酸在氢氧化钠的水溶液中反应,生成丙酮羟腈,然后和甲醇在硫酸的作用下,即发生失水及腈的醇解反应,氰基变成甲氧酰基(-COOCH3):工业上就是利用这个反应步骤合成有机玻璃的。
碱性条件能加速该反应,这是由于氢氰酸是弱酸,其离解很少,[CN-]浓度很低,当加入NaOH时,碱与H+ 结合促使离解平衡右移,使亲核性的增大,但是碱性不能太强,因为最后还需要H+才能完成反应。
课堂_第十二章_醛和酮 (2)

CH3CH2MgX
CH2CH3 CH3 C CH2CH3
OMgBr
CH2CH3 CH3 C OH CH 2CH 3
所有的格氏试剂均需自制。
空间位阻的影响
O (CH3)3CCC(CH3)3 =
OH (CH3)3CCC(CH3)3 80% C2H5
+ C2H5MgBr
= =
O (CH3)3CCC(CH3)3 + CH3CH2CH2MgBr O (CH3)3CCC(CH3)3 + (CH3)2CHMgBr
第十二章
醛和酮
本章提纲
一、 醛酮的定义和分类 二、 醛酮的结构 三、 醛酮的物理性质 四、 醛酮的反应 五、 醛酮的制备
第一节 醛酮的定义和分类
一、定义:羰基和烃基(或氢原子)相连的烃 的衍生物
羰基: 酮: 醛: 醛基:
O C
O R C R'
O R C H
O C H
(甲酰基)
对应的醛和酮是同分异构体
C=C C OH R
(CH3)2CHCH2MgX + CH2O 无水醚 (CH3)2CHCH2CH2OMgX H2O (CH3)2CHCH2CH2OH
用甲醛在分子中引入羟甲基
解二
O
(CH3)2CHMgX + 无水醚 (CH3)2CHCH2CH2OMgX H2O (CH3)2CHCH2CH2OH
用环氧乙烷在分子中引入羟乙基
R C=O
+
R HC(OC2H5)3 C
OC2H5
+
R R
R
C=O
+
HC(OC2H5)3
OC2H5 R R OC2H5 + HCOOC2H5 C OC2H5 R
12 醛和酮化学性质

中间体 烷氧基负离子
2017/1/10 21
羟醛缩合反应机理(四步) 亲核加成-消除反应
A: 生成亲核试剂(烯醇负离子) B: 亲核加成 C: 生成β-羟醛
H3 C OC H
H2O
OH H3 C C H
CH2 CHO
CH2 CHO
D: 脱水形成不饱和醛
OH H3 C C H
,— H2O
H3C
CH
2017/1/10 30
A: 托伦斯试剂
R(Ar) CHO
+
2 Ag(NH3)2OH
RCOONH4
Байду номын сангаас
+
2 Ag
+
3 NH3
+
H2O
银镜反应 B: 费林试剂
RCHO
+
2 Cu
2+
+
OH
-
+
H2O
RCOO -
+
Cu2O
+
4H
+
2017/1/10
31
托伦斯、菲林试剂的特点
① 此两种试剂都是弱氧化剂,只氧化醛基,对原结 构中的双键没有影响;
2017/1/10 28
卤仿反应的应用:
定性鉴别
合成其它方法难以得到的、减少了一个碳的羧酸。
如:制备2,2-二甲基丙酸
嚬 呐 酮
CH3 O H3 C C CH3 C CH3
① Br2 / NaOH ② H+
H3 C
CH3 O C CH3 C OH
思考:能否用卤烃氰解的方法?
CH3 H3 C
CH2CH2
E
《有机化学》(徐寿昌)第12章 醛和酮 核磁共振谱

N
Pyridine
NH+-O
O Cr Cl
O
Pyridinium chlorochromate
O HO Cr OH
O
Chromic acid 8
醛酮的制备-炔烃的水合
9
醛酮的制备-酰基化反应
10
醛酮的制备-臭氧化反应
11
醛酮的物理性质-沸点
醛酮的羰基具有平面结构,分子容易相互接近。
73
反-3-苯基丁烯醛的核磁共振谱-复杂图谱
醛和酮
O
C
羰基(Carbonyl group)
O
O
RCH
醛(Aldehyde)
R C R'
酮(Ketone)
1
羰基的结构
C
O
2
乙醛的结构参数
3
羰基的极性
O – C +
O
C
H
H
= 2.27D
O
C
H3C
CH3
= 2.85D
4
醛酮的命名
O CH3 C H
乙醛 Ethanal(Acetaldehyde)
59
化学位移的计算
用四甲基硅烷(Tetramethylsilane, TMS, (CH3)4Si) 做标准物,其它质子的化学位移是两者之间的相 对差值。为了消除工作频率不同的仪器使相同的 质子有不同的吸收,化学位移定义为:
TMS 106 ppm 0
: 待测质子的化学位移 : 待测质子的共振频率 TMS:TMS中质子的共振频率 0 : 仪器的工作频率
70
丙酸异丙酯的核磁共振谱
singlet:单 峰 quartet:四重峰
doublet:二重峰 quintet:五重峰
第十二章醛和酮核磁共振谱答案解析
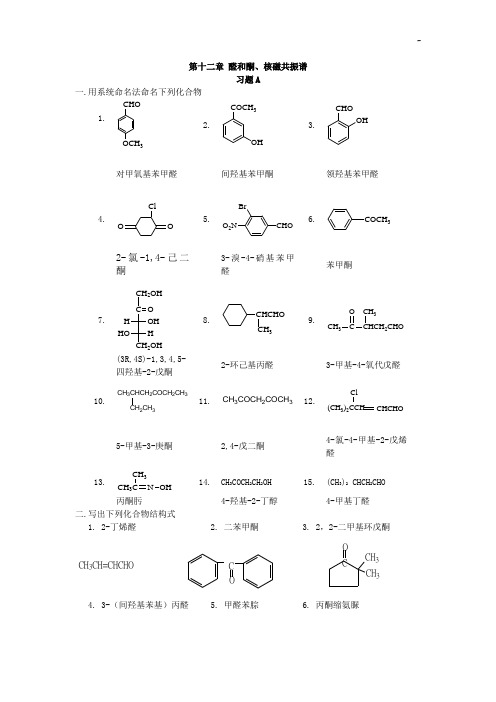
第十二章 醛和酮、核磁共振谱习题A一.用系统命名法命名下列化合物二.写出下列化合物结构式1. 2-丁烯醛2. 二苯甲酮3. 2,2-二甲基环戊酮COCH 3CH 3CH 3CH=CHCHOC O4. 3-(间羟基苯基)丙醛5. 甲醛苯腙6. 丙酮缩氨脲1.CHO OCH 32.COCH 3OH3.CHOOH对甲氧基苯甲醛 间羟基苯甲酮领羟基苯甲醛4.OO Cl5.O 2NBrCHO6. COCH 32-氯-1,4-己二酮3-溴-4-硝基苯甲醛苯甲酮7. CH 2OHC OH OHCH 2OH HO H8.CHCHO CH 39. CH 3CO CHCH 2CHO CH 3(3R,4S)-1,3,4,5-四羟基-2-戊酮2-环己基丙醛 3-甲基-4-氧代戊醛10.CH 3CHCH 2COCH 2CH 3CH 2CH 311. CH 3COCH 2COCH 3 12.Cl CHCHO (CH 3)2CCH5-甲基-3-庚酮2,4-戊二酮4-氯-4-甲基-2-戊烯醛13. CH 3CN CH 3OH14. CH 3COCH 2CH 2OH 15. (CH 3)2 CHCH 2CHO丙酮肟 4-羟基-2-丁醇 4-甲基丁醛CH2CH2CHOOH H2C=NNH CH3CH3C=N NH CONH27. 苄基丙酮 8. α-溴代丙醛 9. 对甲氧基苯甲醛CH2CH2CH2CH3CO CH3CH CHOBrCHOOCH310. 邻羟基苯甲醛 11. 1,3-环已二酮 12. 1,1,1-三氯-3-戊酮CHO OH OOO ClClCl三.写出苯甲醛与下列试剂反应的主要产物:1. CH3CHO/稀NaOH,△2. 浓NaOH3. 浓OH, HCHO4. NH2OH5. HOCH2CH2OH /干燥HCl6. KMnO4/H+,△7. Fehling试剂 8. Tollens试剂 9. NaBH4/H3O+10. HNO3/H2SO4 11. ①HCN,②H2O/H+ 12. ①C2H5MgBr/干醚,②H2O/H+1. CH=CHCHO2. COO-,CH2OH3.CH2OH,HCOO-4. CH=NOH5.OO6.COOH7. 不反应8.COONH4,Ag9.CH2OH10.CHONO211.CHOCN12. CHCH2CH3OH四.选择合适的氧化剂或还原剂,完成下列反应五.完成下列反应式1.Br 2CH 2COCH 3CH 2COONa+ CHBr 32. CHO240%NaOH+COOH CH 2OH3. CH 3CHCHCHONaBH 42CH 3CHCHCH 2OH4.CHOCH 2OHHO HHCN OH-HHOCN CH 2OHHOH H NC OH CH 2OH HOH5.O +HCl干( )2C 2H 5OH OC 2H 5OC 2H 56. C 6H 5CH CHCHO 1)C 2H 5MgBr 2) H 3O +C 6H 5CH=C(OH)C 2H 57. O4H 3COHH 3C1.CO CH 2CH 32CH 2CH 3CHCH 2CH 3OHZn-Hg,HCl ;H 2,Ni2.O[ ]OHOHH 2,Ni ;NaBH 4,H 3O +3.CHO[ ]COOHAg(NH 3)2+, H 3O +4. CH 3CHCH 2CH 2OH[ ]HOOCCH 2CH 2COOHCO CH 3NaOH, Br 2;H 3O +8.C 6H 5CH CH C OCH(CH 3)21)C H MgBr 2) H 3O +C 6H 5CH CH C OHCH(CH 3)2C 2H 59.CH 3C OCH 2CH 3H 2NCONHNH 2C 2H 5C=NNHCONH 2CH 310.Zn-Hg/浓HClCH 2COCH 3CH 2CH 2CH 311.CHO+COOH CH 2OH12. CH 3COCH 2CH 3I 2+CHI 3CH 3CH 2COONa13. H 2C COCH 3H 2CCHCH 3OH14.CHO(1)LiAlD 4(2)H 2OCDHOH15.COCH 3OCH 3HOCH 2CH 2OHOCH 3OO CH 316.CHO+CH 3CHO-CH=CHCHO17. CH 3CH 2C OCH 2CH 3+NO 2H 2NNH NO 2CH 3CH 2C H 3CH 2CNO 2NNHNO 2六.选择题1-5 DBCAA 6-10 BCCBA 11-15 C,D,AB,A,A 16-20 DDBDD 21-23 BCC七.用化学方法区分下列化合物 (1)丙酮与苯乙酮OO白色无现象(2)己醛与2-己酮 己醛己酮Ag(NH 3)2+无现象(3)苯甲醇与苯甲醛苯甲醛苯甲醇32+无现象(4)乙醛与丙醛乙醛丙醛无现象I +NaOHCHI3(5)乙酸与丙醛乙酸丙醛无现象32CO(6)戊醛与2,2-二甲基丙醛CHO37. 环己烯.环己酮.环己醇加溴水褪色为环己烯,再加钠,有气体产生为环己醇,剩下的是环己酮 8. 2–己醇.3–己醇.环己酮先加氢氧化钠和碘,有白色沉淀的是2–己醇;再加2,4-二硝基苯肼,有沉淀的是环己酮 八.机理题 1.写出苯甲醛与乙醛在碱性条件下反应的产物和机理-CHCH 2CHOOH2CHOCH 3CHOCH=CHCHO2.写出丙酮与氢氰酸加成反应式并写出其机理。
有机化学:第十二章 醛和酮

分子量
58
58
58
60
沸点
-0.5
48.8
56.1
97.2
共四十八页
第三节 醛酮的化学性质(huàxuéxìngzhì)
δ δO CC
H
R (H )
酸和亲电试剂进攻富电子的氧 碱和亲核试剂进攻缺电子的碳
涉及醛的反应(氧化反应 ) α H 的反应 羟醛缩合反应
卤代反应
醛酮中的羰基由于π键的极化,使得氧原子上带部分负电荷,碳原子上带部分正电荷。
机理(jī lǐ):
共四十八页
氨的衍生物能与醛、酮起加成反应,用于鉴别羰基的存在,称为羰基 试剂。
常用试剂:2,4-二硝基苯肼
R C
R'
O + H2NNH
NO 2
NO 2
R
-H2O
C
NNH
R'
NO 2
NO 2
黄色(huángsè)结 晶
反应产物用稀酸水解(shuǐjiě),可生成原来的醛、酮。用与分离和提纯醛或酮。
羰基是醛、酮的官能团。
O
R1
R
CO
CO
R2
H
O
羰基化合物广泛存在于自然界,它们既是参与生物代谢过程的重要物质(wùzhì),如甘油
醛
(HOCH2CHOHCHO)和丙酮酸 (HOOCCOCH3)是细胞代谢作用的基本成分,
又是有机合成的重要原料和中间体。
共四十八页
第一节 醛和酮的分类(fēn lèi)和命名
共四十八页
一 、亲核加成反应(jiā chénɡ fǎn yīnɡ)
亲核加成反应是羰基(tānɡ jī)的特征反应,亲核试剂NuA与羰基C=O反应。
有机化学 第十二章_醛和酮ppt课件

C O H C H C H C H 3 2 2 ++
C ( H ) C H C H O C H C H C H C H O + 3 2 3 2 2
~170oC;
25MPa
(75% ( )25
炔烃的水合
甲基酮
H O , H g S O 2 4 RCC H H S O 2 4 R C C H 2 H O
O H C H 3
b e n z e n e ,r e f lu x
C H C H C H C H C C H C H 3C 2 O C H 3
Oppenauer氧化; 异丙醇铝是催化剂, 反应中双键不受 影响。
CrO3 Pyridine RCH2OH
Sarrett 试剂
RCH O
or PCC
Corey 试剂
羰基与双键、苯环共轭,c=o 吸收向低波数位移。
1 C H O C H C H C H C H O 1 7 2 4 c m 3 3 2 2
1 C H O 1 6 9 5 c m
O
1 C H C H C C H 1 7 2 0 c m 2 2 3
O
1 C C H C H C H 1 6 8 0 c m 2 2 3
光谱性质
IR: 羰基的伸缩振动νC=O在1680 cm-1~1740 cm-1之间有一强吸收峰,一 般情况下,醛羰基吸收频率约为 1730 cm-1 ,稍高于酮羰基 ( 约为 1715 cm-1)。同样芳醛的吸收频率(约为1705 cm-1)也稍高于芳酮(约为 1690 cm-1)。但一般彼此不易区别。而RCHO的νC-H在2700-2900 cm-1 附近还有特征吸收峰(通常为双带,若是单带则在2720cm-1附近),可 以证明分子中醛基的存在。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
烯烃与CO和H2在某些金属的羰基化合物催化下,与110~200℃、10~20 MPa下,发生反应,生成多一个碳原子的醛。
• 羰基合成的原料多采用双键在链端的-烯烃,其产物以直链醛为主(直 :支 = 4:1)。
12.3 醛酮的物理性质
• 室温下,甲醛为气体,12个碳 原子以下的醛酮为液体,高级醛 酮为固体。 • 低级醛有刺鼻的气味, 中级醛(C8~C13)则有果香。 •低级醛酮的沸点比相对分子量 相近的醇低。(分子间无氢键) 。 • 由于羰基是个极性基团,分子间偶极 的静电引力比较大,所以醛酮的沸点 一般比相对分子量的非极性化合物(如 烃类)高。
b.p. 21℃ 及时蒸出,否则氧化成酸
以三氧化铬和吡啶的络合物为催化剂制醛产率高:
正辛醇
正辛醛(95%)
欧芬脑尔氧化法(主要制酮):含有不饱和C=C双键的醛氧化,需采取特殊催化剂,如 :丙酮-异丙醇铝(或叔丁醇铝)或三氧化铬-吡啶络合物作氧化剂达到此目的。
虽然伯醇也可氧化成相应的醛,但因醛在碱性条件下易发生羟醛缩合反应, 故该方法一般用于氧化仲醇成酮。
醇在适当的催化剂条件下脱去一分子氢,生成醛 酮。
• 该反应得到的产品纯度高,但为一吸热反应,工业上常在脱氢的 同时,通入一定量的空气,使生成的氢与氧结合放出的热量供脱 氢反应。这种方法叫氧化脱氢法。
12.2.2 炔烃水合
在汞盐催化下,生成羰基化合物,除乙炔外,其他炔烃水合均生成酮 :
• 主要生产乙醛。其它炔不易制得。
• CN-离子为强的亲核试剂,它与羰基的加成反应历பைடு நூலகம்:
注意:由于氰化氢剧毒,易挥发。通常由氰化钠和无机酸与醛(酮)溶液反应。 pH值约为8有利于反应。
(2)与亚硫酸氢钠加成
醛和脂肪族甲基酮(或七元环以下的环酮P285)与之反应,生成
酸钠
-羟基磺
在酸碱下可逆反应,分离提纯
• -羟基磺酸钠易溶于水,不溶于饱和亚硫酸氢钠。将醛酮与过量的饱和亚硫酸氢钠 水溶液混合在一起,醛和甲基酮很快会有结晶析出。可以此来鉴别醛酮。
12.2.3 同碳二卤化物水解
生成相应的羰基化合物,该法主要制备芳香族醛酮(因为芳环侧链上-容易被卤化.)
12.2.4 傅-克酰基化反应
•芳烃在无水三氯化铝催化下,与酰卤或酸酐作用,生成芳酮:
二苯甲酮
• 此反应也是一个芳环上的亲电取代反应 , 傅-克酰基化反应历程 P130 • 芳烃与直链卤烷发生烷基化反应,往往得到重排产物,但酰基化反应没有重排现象
偶极矩 2.27D
偶极矩 2.85D
1pm = 10-12m 1Å = 10-10m
(2)醛酮的命名
1. 脂肪族醛酮命名: 以含有羰基的最长碳链为主链,支链作为取代基,主 链中碳原子的编号从靠近羰基的一端开始(酮需要标明位次):
• 也可用希腊字母表示靠近羰基的碳原子,其次为、、…...
2. 芳香醛、酮的命名,常将脂链作为主链,芳环为取代基:
缩醛的反应历程:
乙醛缩二甲醇
• 缩醛对碱和氧化剂都相当稳定。由于在酸催化下生成缩醛的反应是 可逆反应,故缩醛可以水解成原来的醛和醇:
• 在有机合成中常利用缩醛的生成和水解来保护醛基。
• 酰基是间位定位基。甲基,甲氧基为邻对位取代基,易酰化。 • 在AlCl3-Cu2Cl2催化剂下,芳烃与CO、HCl作用可在环上引入一个甲酰基的 产物,叫伽特曼-科赫反应。
46-51%
12.2.5 芳烃侧链的氧化
芳烃侧链上的-活泼易被氧化. •控制条件可生成相应的芳醛和芳酮(注意选择适当的催化剂)。
反应历程(亚硫酸氢根离子为亲核试剂):
• 此反应是个可逆反应,常被用来分离和提纯某些羰基化合物:
(3)与醇加成 将醛溶液在无水醇中通入HCl气体或其他无水强酸,则在酸的催化下, 醛能与一分子醇加成,生成半缩醛。半缩醛不稳定,可以和另一分子 醇进一步缩合,生成缩醛:
半缩醛反应历程:
• 半缩醛在酸催化下,可以失去一分子水,形成一个碳正离子,然后再与另 一个醇作用,最后生成稳定的缩醛:
(3) 比较简单的酮还常用羰基两边烃基的名称来命名:
(4) 二元酮命名时,两个羰基的位置除可用数字标明外, 也可用、、…表示 它们的相对位置, 表示两个羰基相邻, 表示两个羰基相隔一个碳原子:
4-苯基-2-丁酮
香料 麝香成分之一
麝香酮
12.2 醛酮的制法
12.2.1 醇的氧化和脱氢
伯醇和仲醇氧化或脱氢反应,可分别生成醛、 酮。
• 低级醛酮易溶于水,醛酮都能溶 于水。丙酮能溶解很多有机化合物 ,是很好的有机溶剂。
醛酮沸点与烷烃沸点的比较
醛酮的红外光谱
羰基化合物在1680~1850cm-1处有一个强的羰基伸缩振动吸收峰。醛 基C-H在2720cm-1处有尖锐的特征吸收峰。
乙醛的红外光谱
• 羰基若与邻近基团发生 共轭,则吸收频率降低: 苯乙酮的红外光谱
结构中的应用。▲
醛和酮均含有羰基官能团: 羰基碳原子上至少连有一个氢原子的叫醛:
—CHO 或
叫醛基。
醛基总是在碳链的一端
• 羰基碳原子上同时连有两个烃基的叫酮。
12.1 醛、酮的结构和命名
(1)醛酮的结构
甲醛的结构
易受亲核试剂进攻 发生亲核加成
羰基π电子云示意图
HCHO
CH3CHO
CH3COCH3
12.4 醛酮的化学性质 12.4.1 加成反应
烯烃的加成一般为亲电加成; • 醛酮的加成为亲核加成,易于HCN、NaHSO3、ROH、RMgX等发生亲核 加成反应。 (1)与氰化氢加成
• 在碱性溶液中反应加速,在酸 性溶液中反应变慢:
丙酮与氰氢酸作用,3-4h只有一半的原料起反应,若加一滴KOH,反应可 以在2min内完成。////在蒸馏氰醇时若不除去碱,会使挥发性大的HCN蒸 馏出来,使平衡向左移动,结果使氰醇完全分解。
第十二章 醛和酮中文
2020年4月23日星期四
1. 掌握醛、酮的结构特点及命名方法; 2. 熟悉醛、酮的制备方法; 3. 了解醛、酮的物理性质; 4. 掌握醛、酮的亲核加成反应历程及各类亲核加成反应;▲ 5. 掌握醛、酮的鉴别方法;▲ 6. 掌握α-H的反应;▲ 7. 掌握醛、酮的氧化、还原反应;▲ 8. 了解重要的醛、酮; 9. 理解核磁共振谱的基本原理,掌握其在鉴定有机化合物
