CE认证准则清单
CE认证介绍

CE介绍随着欧盟市场的统一,贸易壁垒基本消除,商品人员、服务、资金可以自由流通。
欧盟理事会为了避免成员国之间的重复检验,制定了一个统一的,针对一系列有关产品的CE安全指令,对进入欧盟市场的产品,规定了必须通过CE安全认证,即产品必须达到和符合欧洲EN标准或相关国际ISO标准,产品加贴CE标志。
相反,未通过CE 安全认证,未加贴CE标志的产品,不能也不允许在欧盟市场销售。
近几年,欧盟市场对来自中国的电子电器产品的需求呈不断上升形势,前景看好,因为:1. 中国设计和制造技术日趋成熟,且成本低;2. 中国企业可以自主进出口;3. 中国即将加入WTO。
中国企业进入欧盟市场,不仅有良好的经济效益,而且可以提高产品技术水准和开发能力,使其产品具备世界水平,从而开拓全球化市场。
如何进入市场?第一关就是使产品符合CE指令要求。
对中国的企业而言,完成CE符合性宣告,目前最有效的渠道就是委托一家官方认可的欧洲机构做认证。
CE标志CE –是Conformité Européenne 的缩写,是欧盟为了避免成员国之间商品的重复检验,而制定的一系列有关产品安全的政府指令,要求进入欧盟市场的相关产品必须符合指令所规定的相关标准,并且加贴CE标志。
CE指令于1995年1月1日起生效。
欧盟EU(European Union)目前欧盟有25个成员国:法国、联邦德国、意大利、荷兰、比利时、卢森堡、英国、丹麦、爱尔兰、希腊、葡萄牙、西班牙、奥地利、瑞典、芬兰、马耳他、塞浦路斯、波兰。
欧洲委员会(European Commission)是欧盟的执行机构,以前归属于欧洲共同体(European Community - EC),或称欧洲共同市场(Common Market),其颁布的指令目的在于:- 消除关税制约;- 确保产品符合通用的安全和环境标准;- 协调现存的法律;- 制定一套标准;- 督促成员国贯彻法定义务。
CE不符合之代价- 产品不能依法供应欧盟市场;- 以前投放在市场的产品,不能收回;- 可能导致产品的扣押和(或)罚款。
ce认证标准

CE认证的对比
01 独特优势
在欧盟市场具有影响力
02 优缺点分析
与其他认证制度对比
03
CE认证的未来发展
市场需求增长
CE认证制度不断完善 未来可能涵盖更多产品范围
商机与挑战
未来将带来更多机遇和挑战
CE认证的未来展望
随着市场的发展和需求的增加,CE认证制度将不断完善和发 展。企业应密切关注CE认证的动态,为适应未来的市场需求 做好准备。
CE认证的历史与背景
CE认证制度始 于1985年
旨在消除欧盟内部 贸易壁垒,统一产
品标准和要求
CE认证旨在保 护消费者权益
确保产品质量和安 全性
CE认证的基本原则
01 自我声明符合要求 02 通过合格评定机构进行评估 03 符合欧盟的统一标准和法规
CE认证的适用范围
工业
CE认证覆盖工业产品范围广泛
技术规格
产品的技术规格和标准要求
检测报告
产品的检测结果和证明文件
CE认证流程重 要性
CE认证流程中的每个阶段 都至关重要,申请者必须 严格遵循流程要求,确保 产品的质量和合格性。在 CE认证流程中,申请准备 阶段决定了后续流程的顺 利进行,产品测试和技术 文件准备阶段直接影响着 最终的认证结果。因此, CE认证流程的重要性不可 忽视。
建筑
建筑领域产品需要符合CE认证 要求
医疗器械
医疗器械必须通过CE认证才能 进入市场
电子产品
CE认证适用于各类电子产品
CE认证的重要性
提升产品竞争 力
CE认证是产品国 际认可的标志
遵守法规要求
符合欧盟标准和法 规
保障消费者权 益
确保产品质量和安 全
CE认证要求
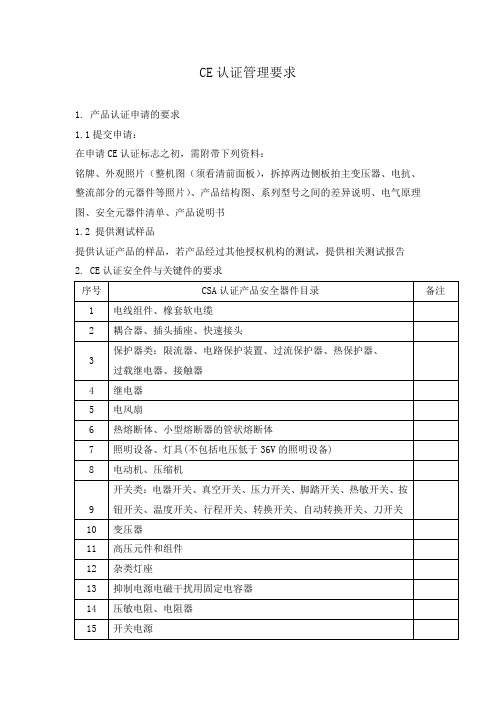
CE认证管理要求1. 产品认证申请的要求1.1提交申请:在申请CE认证标志之初,需附带下列资料:铭牌、外观照片(整机图(须看清前面板),拆掉两边侧板拍主变压器、电抗、整流部分的元器件等照片)、产品结构图、系列型号之间的差异说明、电气原理图、安全元器件清单、产品说明书1.2 提供测试样品提供认证产品的样品,若产品经过其他授权机构的测试,提供相关测试报告2. CE认证安全件与关键件的要求电焊机中要用以上表中所列器件时,必须要CE、TUV和VDE认证字样或标志。
3. 申请报备以下情况需申请报备增加或减少认证型号(名称)、电气参数变更(与原来的CE测试报告不一致)、结构发生重大变更(如:外形结构变更、设计结构的变更等)、内部重要的关键件发生变更(元器件的增减和替换)、元器件供应商的追加或更换4. 认证标志与标识的要求4.1 CE 标志的型式CE 标志的型式必须符合下图1-1 所示,其各部位的位置、比例如下:CE 字母高为20格、宽各为11格、笔划粗细为3格,圆弧部份由两个同心圆组成,即上圆直径为20格、内圆直径为14格;“E”中间的一横线长6格,居中(即通过圆的横径计算,上下各占1.5格);CE 两字母在水平方向的相对位置正好满足两字母的外圆重叠,重叠部份为3格(即一个字母的外圆与另一个字母的内圆正好相切)。
图1-14.2 附加标志4.2.1 若公告机构参与了生产阶段,则应在CE 标志之后加附公告机构的识别编号,如有几个公告机构参与了生产阶段的合格评定,此时CE 标志之后可能会附有几个公告机构的识别编号。
当CE标志后附有识别编号,就意味着公告机构承担相关的职责。
4.2.2 对于附加公告机构的识别编号,应由公告机构进行或其授权制造商或其确定的在欧盟的授权代理进行。
CE标志和公告机构的识别编号,可分开加施,但要保持他们的联合作用。
4.2.3 CE标志使用的注意事项4.2.3.1 CE 标志应加在产品上或产品标牌上,但在特殊情况下可施加在产品的包装或随产品附带的文件(相关指令规定的文件)上。
CE认证适用标准清单2012

EN 12470-4:2000
(21/03/2010)
2000A, 01.07.09
EN ISO 13485:2003/AC:2009
Medical devices - Quality management systems - Requirements for regulatory purposes
疗器械的生物学评价第1部分:评价和试验
EN ISO 10993-1:2003
(21/03/2010)
—
EN ISO 10993-1:2009/AC:2010(new)
First publication
EN ISO 10993-3:2009
Biological evaluation of medical devices - Part 3: Tests for genotoxicity, carcinogenicity and reproductive toxicity (ISO 10993-3:2003)
非侵入式血压表.第3部分:电机血压表的补充要求
EN 1060-3:1997
(31/05/2010)
2005A, 1.07.09
EN ISO 9919:2009
Medical electrical equipment - Particular requirements for the basic safety and essential performance of pulse oximeter equipment for medical use (ISO 9919:2005)
(IEC 60601-1:2005)
医疗电气设备.基本安全和主要性能的一般要求
CE认证准则清单

CE认证准则清单CE认证是指产品符合欧洲联盟(EU)相关法规和指令的要求,可以在欧洲市场销售和使用。
CE认证准则是指CE认证过程中需要遵守的一系列规定和标准。
1.完整性:CE认证申请文件必须包含产品完整的技术文件,包括设计、制造、性能和安全等方面的信息。
2.产品分类:根据CE认证的产品种类,确定适用的欧洲法规和指令。
根据产品的特性,例如医疗器械、电器和机械等,可以选择不同的CE认证模块。
3.技术规格:根据适用的欧洲法规和指令,制定产品的技术规格。
这些规格包括产品的设计、材料、制造工艺、性能和安全等要求。
4.产品测试:在CE认证过程中,需要进行产品测试以验证其符合欧洲法规和指令的要求。
这些测试包括性能测试、安全测试和电磁兼容性测试等。
6.CE标志:凡符合CE认证要求的产品,可以在产品上标记CE标志。
CE标志是证明产品符合欧洲法规和指令要求的标志。
7.追溯性:产品在整个生命周期中需要保持追溯性。
即产品应当有完整的文档和记录,可以追踪到供应链、制造过程和销售渠道等。
8.法规要求:CE认证要求产品符合一系列的欧洲法规和指令,如低压指令(LVD)、机械指令(MD)、EMC指令等。
申请人需要了解并遵守这些法规的要求。
9.委托评估:在CE认证申请过程中,申请人可以委托第三方机构进行产品评估和测试。
这些机构需要得到合适的认可,并出具相关的评估报告。
10.文件保存:申请人需要保存完整的CE认证文件,包括申请材料、技术文件、测试报告和厂商声明等。
这些文件需要在相关部门的要求下提交或提供。
11.更新认证:CE认证具有有效期限,根据产品的特性和规定,需要定期进行更新认证,以确保产品持续符合相关法规和指令的要求。
12.合规监督:CE认证机构会对已获得认证的产品进行合规监督,包括市场抽查、产品抽查和工厂检查等。
申请人需要配合合规监督,并保持产品的合规性。
13.限制条件:根据欧洲法规和指令的要求,一些特定产品可能有限制性条件,如医疗器械和化妆品等。
CE认证标准清单
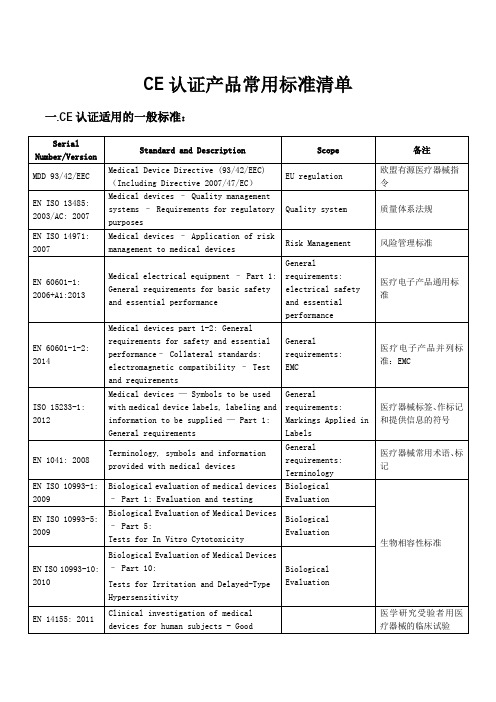
CE认证产品常用标准清单一.CE认证适用的一般标准:
二. 监护仪系列产品适用标准:
三. 生理参数检测仪适用标准:
注:生理参数检测含有的心电、血糖、无线传输功能并没有随产品做CE认证。
四. 血氧系列产品(含血氧探头)适用标准:
注:血氧探头没有IEC 60601-1-11: 2010标准。
五. 多普勒胎心仪适用标准:
六. 快速心电检测仪适用标准:
备注:第一部分属于常用标准,适用于公司做过CE认证的所有医疗产品,后面是根据产品的功能、特性附加的标准。
所以一般情况下,可用第一部分加上其他部分即可组成具体产品的适用标准。
CE认证及标示

CE认证及标示欧盟为消除各成员国间的贸易壁垒,逐步建立成为一个统一的大市场,以确保人员、服务、资金和产品(如医疗器械)的自由流通。
在医疗器械领域,欧盟委员会制定了三个欧盟指令,以替代原来各成员的认可体系,使有关这类产品投放市场的规定协调一致。
这三个指令分别是:1.有源植入性医疗器械指令(AIMD,90/335/EEC),适用于心脏起搏器,可植入的胰岛素泵等有源植入性医疗器械。
AIMD于1993年1月1日生效。
过渡截止期为1994年12月31日,从1995年1月1日强制实施。
2.活体外诊断器械指令(IVD),适用于血细胞计数器,妊娠检测装置等活体外诊断用医疗器械。
该指令目前仍在起草阶段,可能于1998年末或1999年初正式实施。
3.医疗器械指令(Medical Devices Direc-tive,93/42/EEC),适用范围很广,包括除有源植入性和体外诊断器械之外的几乎所有的医疗器械,如无源性医疗器械(敷料、一次性使用产品、接触镜、血袋、导管等);以及有源性医疗器械,如核磁共振仪、超声诊断和治疗仪、输液泵等。
该指令已于1995年1月1日生效,过渡截止日期为1998年6月13日从1998年6月14日起强制执行。
上述指令规定,在指令正式实施后,只有带有CE标志的医疗器械产品才能在欧盟市场上销售。
医疗器械CE认证(Medical Devices Direc-tive,93/42/EEC)介绍MDD是目前欧洲可见到的最为全面的医疗器械方面的规定,在该指令中,共有23个条款和12个附录。
其重要部分包括在以下条款中:第1条款:本指令适用于医疗器械及其附件第2条款:成员国必须确保投放其市场和使用的医疗器械是安全的。
第3条款:所谓“安全”的器械应满足附录1中的基本要求。
第4条款:带有CE标志的医疗器械可在欧盟自由流通。
特殊条款(附录和X)允许使用无CE标志客户定制产品及临床研究的产品。
第5条款:符合协调标准的医疗器械被认为满足基本要求。
医疗器械CE认证标准清单

医疗器械CE认证标准清单医疗器械CE认证标准清单一、概述1.1 目的1.2 适用范围1.3 定义二、认证标准2.1 法规法律要求2.1.1 医疗器械法规2.1.2 CE认证标准要求2.2 设计与开发要求2.2.1 设计规范2.2.2 安全性要求2.2.3 性能要求2.2.4 材料选择与使用要求2.3 制造过程要求2.3.1 生产流程规范2.3.2 设备及环境要求2.3.3 质量管理体系要求 2.4 验证与验证要求2.4.1 验证方法2.4.2 验证结果分析2.5 标签与说明书要求2.5.1 标签要求2.5.2 说明书要求2.6 产品跟踪与售后服务要求 2.6.1 产品跟踪要求2.6.2 售后服务要求三、申请与审核流程3.1 申请流程3.2 审核流程3.3 监督与更新四、CE认证标志使用指南4.1 标志说明4.2 标志使用规范五、常见问题解答5.1 CE认证的必要性5.2 如何选择认证机构5.3 认证周期及费用5.4 认证标志的有效期限六、附件附件1:CE认证申请表格附件2:产品设计规范模板附件3:产品验证报告示例附件4:标签样本附件5:说明书模板附件:附件1:CE认证申请表格附件2:产品设计规范模板附件3:产品验证报告示例附件4:标签样本附件5:说明书模板法律名词及注释:1. CE:Conformité Européene的缩写,表示符合欧洲标准2. 医疗器械法规:指规定医疗器械生产、销售和使用等方面的法律法规文件3. 设计规范:医疗器械设计过程中需要符合的规范要求4. 安全性要求:医疗器械在使用过程中需要满足的安全性能要求5. 性能要求:医疗器械在设计和制造过程中需要满足的性能要求6. 材料选择与使用要求:医疗器械制造过程中对材料选择和使用的要求7. 生产流程规范:医疗器械制造过程中需要遵循的生产流程规范8. 质量管理体系要求:医疗器械制造过程中需要建立的质量管理体系要求9. 验证方法:医疗器械验证过程中的方法和步骤10. 标签要求:医疗器械标签设计和使用过程中需要遵循的要求11. 说明书要求:医疗器械说明书编写和使用过程中需要遵循的要求12. 产品跟踪要求:医疗器械生产和售后过程中对产品跟踪的要求13. 售后服务要求:医疗器械生产商对售后服务的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CE认证产品常用标准清单一.CE认证适用的一般标准:
二. 监护仪系列产品适用标准:
三. 生理参数检测仪适用标准:
注:生理参数检测含有的心电、血糖、无线传输功能并没有随产品做CE认证。
四. 血氧系列产品(含血氧探头)适用标准:
注:血氧探头没有IEC 60601-1-11: 2010标准。
五. 多普勒胎心仪适用标准:
六. 快速心电检测仪适用标准:
备注:第一部分属于常用标准,适用于公司做过CE认证的所有医疗产品,后面是根据产品的功能、特性附加的标准。
所以一般情况下,可用第一部分加上其他部分即可组成具体产品的适用标准。
