33 共价晶体PPT课件
合集下载
3.3共价键共价晶体第2课时课件高二下学期化学选择性必修2

提升点一 键参数及其应用 [例1] Ⅰ.已知氢分子的形成过程示意图如图所示,请据图回答问题。 (1)H—H键的键长为__7_4_p_m___,①~⑤中,体系能量由高到低的顺 序是_①_⑤__②__③_④___。
核间距过小时,原子核间排斥力增强。 (2)下列说法正确的是__B__C____(填字母)。 A.氢分子中含有一个π键 B.由①到④,电子在核间出现的概率增大 C.由④到⑤,需要消耗外界的能量 D.氢分子中含有一个极性共价键
共价键
H—F H—Cl H—Br H—I
键能/(kJ·mol-1) 567 431 366 298
(1) 若 使 2 mol H—Cl 键 断 裂 为 气 态 原 子 , 则 发 生 的 能 量 变 化 是 ___吸__收__8_6_2 _k_J的__能__量_____。
(2)表中共价键最难断裂的是_H__—_F__,最易断裂的是_H_—__I______。 (3) 由 表 中 键 能 数 据 的 大 小 说 明 键 能 与 分 子 稳 定 性 的 关 系 :
晶体 熔点/K 沸点/K 摩氏硬度
金刚石 大于3 820
5 100 10
晶体硅 1 683 2 628
7.0
晶体硼 2 573 2 823
9.5
(1)晶体硼的晶体类型属于_共__价__晶__体__, 理由是_晶__体__硼_的__熔__、_沸__点__和__硬_度__都__介_于__共__价__晶_体__金__刚_石__和__晶__体_硅__之__间__。
(2)晶体硼的基本结构单元是由硼原子构成的正二十面体(如图所示), 各正二十面体之间以B—B键相互结合,在每个正二十面体中有二十 个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通 过观察图形及推算,得出此基本结构单元是由____1_2___个硼原子构成, 其中B—B键之间的键角是___6_0_°___。
苏教版化学选修三33共价键 原子晶体PPT课件
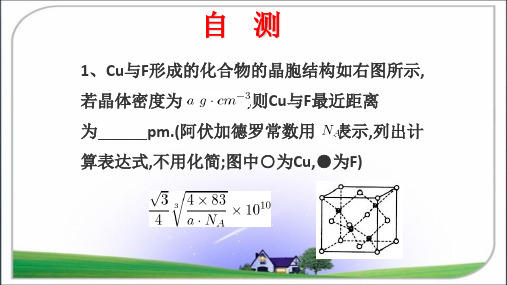
自测
1、Cu与F形成的化合物的晶胞结构如右图所示,
若晶体密度为
,则Cu与F最近距离
为
pm.(阿伏加德罗常数用 表示,列出计
算表达式,不用化简;图中○为Cu,●为F)
2、锗(Ge)是典型的半导体材料,细胞有两个
基本要素:①原子坐标参数,表示晶胞内部各
原子的相对位置。下图为锗单晶的晶胞,其中
原子坐标参数A为(0,0,0);
讨论:HF分子中共价键是怎样形成的?
思考1:当F原子与H原子成键后,F原子能否再与其 它氢原子形成共价键?
思考2:比较离子键成键特点,H总原结子共价键的成键特点。
1s1
F原子
2pz1 2py2
2s2 2px2
共价键有方向性 和饱和性
一、共价键
1.定义:原子间通过共用电子对所形成的化学键
2.本质:原子轨道重叠,自旋相反的未成对电子形成 电子对,原子核间电子密度增加,体系能量降低。
3.共价键的特点:饱和性和方向性
4.共价键的键参数 P49
(1)键长: 两原子核间的平均间距
(2)键能: 1mol气态AB分子生成气态A原子
……
和B原子过程中吸收的能量
H+H H + Cl Cl + Cl
HH
s-s
“
头
碰
H Cl
头
s-p
”
Cl Cl
σ 键
s-p
交流与讨论
(1)写出氮原子的轨道表示式
b、结构式 :
H-H O=O N N
6、共价键表示分子的形成过程
· · ·
2H + ·O ·
H ·O ·H
·· ·· ·· ··
练习
1、Cu与F形成的化合物的晶胞结构如右图所示,
若晶体密度为
,则Cu与F最近距离
为
pm.(阿伏加德罗常数用 表示,列出计
算表达式,不用化简;图中○为Cu,●为F)
2、锗(Ge)是典型的半导体材料,细胞有两个
基本要素:①原子坐标参数,表示晶胞内部各
原子的相对位置。下图为锗单晶的晶胞,其中
原子坐标参数A为(0,0,0);
讨论:HF分子中共价键是怎样形成的?
思考1:当F原子与H原子成键后,F原子能否再与其 它氢原子形成共价键?
思考2:比较离子键成键特点,H总原结子共价键的成键特点。
1s1
F原子
2pz1 2py2
2s2 2px2
共价键有方向性 和饱和性
一、共价键
1.定义:原子间通过共用电子对所形成的化学键
2.本质:原子轨道重叠,自旋相反的未成对电子形成 电子对,原子核间电子密度增加,体系能量降低。
3.共价键的特点:饱和性和方向性
4.共价键的键参数 P49
(1)键长: 两原子核间的平均间距
(2)键能: 1mol气态AB分子生成气态A原子
……
和B原子过程中吸收的能量
H+H H + Cl Cl + Cl
HH
s-s
“
头
碰
H Cl
头
s-p
”
Cl Cl
σ 键
s-p
交流与讨论
(1)写出氮原子的轨道表示式
b、结构式 :
H-H O=O N N
6、共价键表示分子的形成过程
· · ·
2H + ·O ·
H ·O ·H
·· ·· ·· ··
练习
共价晶体PPT课件

P 1X 6 A X B 3 .5 (X A X B )2
离 子 性 百 P 分 数
பைடு நூலகம்
P 1X 6 A X B 3 .5 (X A X B )2
100 80
6 0 P = 50%
40 20
x = 2.1
0 0.0 0.5 1.0 1.5 2.0 2.5 3.0
电 负 性 差 X
当X = 2.1时,P = 50%。这时原子间的化学键离 子性成分和共价性成分相当。
N+N
H
Cl
NN H Cl
共价键概念的提出成功地解释了诸如 O2、H2、 HCl 等化合物的形成机制,并揭示出了共价 键与离子键之间的区别。但是,共价键的饱 和性和方向性仍然没有得到解释,共价键的 本质也仍然不是很清楚。
1927 年,量子力学理论被海特勒和伦敦用于 处理 H2 分子结构,第一次揭示出了共价键的 本质。
共价键的特点:饱和性
两个原子之间形成的共价键的数量与原子中含有的 未成对电子的数量有关。各含有一个未成对电子的两个原 子之间只能形成一个共价键,而各含有两个或三个未成对 电子的两个原子之间就可以分别形成两个或三个共价键。 如果 A 原子中含有一个未成对电子,而 B 原子中含有两个 未成对电子,那么 A 原子和 B 原子之间也只能形成一个共 价键。一个原子中一个未成对电子与另一个原子中的未成 对电子配对后,就不能再与其他原子的未成对电子配对。
H2 分子中的化学键
V
0
-D
ro
r
量子力学计算表明,两个具有 1s1 电子构型的 H 彼此靠近时, 两个 1s 电子以自旋相反的方式形成 电子对,使体系的能量降低。
从电子云的观点考虑,可认为 H 的 1s 轨道在两核间重叠,使电子在两核间出现 的几率大,形成负电区。两核吸引核间负 电区,使 2 个 H 结合在一起。
离 子 性 百 P 分 数
பைடு நூலகம்
P 1X 6 A X B 3 .5 (X A X B )2
100 80
6 0 P = 50%
40 20
x = 2.1
0 0.0 0.5 1.0 1.5 2.0 2.5 3.0
电 负 性 差 X
当X = 2.1时,P = 50%。这时原子间的化学键离 子性成分和共价性成分相当。
N+N
H
Cl
NN H Cl
共价键概念的提出成功地解释了诸如 O2、H2、 HCl 等化合物的形成机制,并揭示出了共价 键与离子键之间的区别。但是,共价键的饱 和性和方向性仍然没有得到解释,共价键的 本质也仍然不是很清楚。
1927 年,量子力学理论被海特勒和伦敦用于 处理 H2 分子结构,第一次揭示出了共价键的 本质。
共价键的特点:饱和性
两个原子之间形成的共价键的数量与原子中含有的 未成对电子的数量有关。各含有一个未成对电子的两个原 子之间只能形成一个共价键,而各含有两个或三个未成对 电子的两个原子之间就可以分别形成两个或三个共价键。 如果 A 原子中含有一个未成对电子,而 B 原子中含有两个 未成对电子,那么 A 原子和 B 原子之间也只能形成一个共 价键。一个原子中一个未成对电子与另一个原子中的未成 对电子配对后,就不能再与其他原子的未成对电子配对。
H2 分子中的化学键
V
0
-D
ro
r
量子力学计算表明,两个具有 1s1 电子构型的 H 彼此靠近时, 两个 1s 电子以自旋相反的方式形成 电子对,使体系的能量降低。
从电子云的观点考虑,可认为 H 的 1s 轨道在两核间重叠,使电子在两核间出现 的几率大,形成负电区。两核吸引核间负 电区,使 2 个 H 结合在一起。
沪科版化学高一上册-3.3 共价键 课件 ppt

共 价键
3.3 共价键
2020/10/27
1
课前微课学习反馈
共 价键
物质 ①NaCl
项目
离子键
②HCl
③K2O
④ H2O
⑤N2
⑥ CO2 ⑦NaOH
共价键
电子式
2020/10/27
2
Na和Cl通过_得__失_电__子_形成稳定结构
Na
+
+11
你 掌 握 了 吗? Cl
+17
静 电 引 力:
Na+和Cl-离子之间相互吸引,
各个构件之间的结点以榫卯相吻合, 可以承受较大的荷载。
榫卯:凹凸部分相互结合的连接方式。
共价键的形成过程(以HCl为例)
共 价键
共价键: 原子间通过共用电子对所形成的相互作用。
共价化合物: 直接相邻的原子均以共价键结合形成的化合物。
共价分子:
共价化合物 共价单质
【构建模型】
共 价键
一般原子达到稳定结构 的两种途径
④ H2O ⑤N2
共 价键
⑥ CO2 ⑦NaOH
共价化合物
电子式
2020/10/27
11
【共价键的表征】
共 价键
共价键的表示
1.电子式: 用·或×表示原子最外层电子的式子 2.结构式: 用一根短线表示一对共用电子,其他电子省略的式子
2020/10/27
12
【共价键的表征】
共 价键
3.模型构建(球棍模型)
得失电子 共用电子
思考1:氯化氢中氢原子和氯原子是电子共用来达 到稳定结构,那两者是各拿出几个电子来共用以达 到稳定结构呢?
【共价键的模型构建】
共 价键
3.3 共价键
2020/10/27
1
课前微课学习反馈
共 价键
物质 ①NaCl
项目
离子键
②HCl
③K2O
④ H2O
⑤N2
⑥ CO2 ⑦NaOH
共价键
电子式
2020/10/27
2
Na和Cl通过_得__失_电__子_形成稳定结构
Na
+
+11
你 掌 握 了 吗? Cl
+17
静 电 引 力:
Na+和Cl-离子之间相互吸引,
各个构件之间的结点以榫卯相吻合, 可以承受较大的荷载。
榫卯:凹凸部分相互结合的连接方式。
共价键的形成过程(以HCl为例)
共 价键
共价键: 原子间通过共用电子对所形成的相互作用。
共价化合物: 直接相邻的原子均以共价键结合形成的化合物。
共价分子:
共价化合物 共价单质
【构建模型】
共 价键
一般原子达到稳定结构 的两种途径
④ H2O ⑤N2
共 价键
⑥ CO2 ⑦NaOH
共价化合物
电子式
2020/10/27
11
【共价键的表征】
共 价键
共价键的表示
1.电子式: 用·或×表示原子最外层电子的式子 2.结构式: 用一根短线表示一对共用电子,其他电子省略的式子
2020/10/27
12
【共价键的表征】
共 价键
3.模型构建(球棍模型)
得失电子 共用电子
思考1:氯化氢中氢原子和氯原子是电子共用来达 到稳定结构,那两者是各拿出几个电子来共用以达 到稳定结构呢?
【共价键的模型构建】
共 价键
《共价晶体》 课件-高二化学人教版(2019)选择性必修二

不导电,个别为半导体
分子晶体 分子
分子间作用力 较小 较小
部分溶于水
固体和熔化状态都不导 电,部分溶于水导电
方法与技巧 1. 判断共价晶体和分子晶体的方法
①依据组成晶体的粒子和 粒子间的作用力判断
② 依据晶体的熔点判断
组成共价晶体的粒子是原子,粒子 间的作用力是共价键;组成分子晶 体的粒子是分子,粒子间的的作用 力是分子间作用力。
共价晶体
回忆分子晶体有哪些性质?
熔点和沸点较低
物质 CO2 SiO2
熔点/℃ -56.2 1723
硬度较小
沸点/℃ -78.5 2230
SiO2是分子晶体吗, 为什么
为什么CO2与SiO2的熔沸点相差这么多
结构决定性质
分子晶体
共价晶体
常见的共价晶体
一、共价晶体的概念、构成、作用力
1. 概念:所有原子都以共价键相互结合形成三维的立体网状结构的晶体 2. 构成粒子:原子 3. 粒子间作用力:共价键
C 一个B原子,则C物质的化学式可能为( )
A.AB
B.A5B4
C.AB2
D.A2B5
随堂检测
6.单质硼有无定形和晶体两种,参考下表数据回答问题:
熔点/℃ 沸点/℃
硬度
金刚石 >3 550
5 100 10
晶体硅 1 410 2 355
7.0
晶体硼 2 573 2 823
9.5
(1)晶体硼属于__共__价____晶体,理由是_晶___体__硼__的__熔___、__沸__点__高__,___硬__度__大__________。
随堂检测
2.美国《科学》杂志曾报道:在40 GPa的高压下,用激光加热到1 800 K,人们成功制得
分子晶体 分子
分子间作用力 较小 较小
部分溶于水
固体和熔化状态都不导 电,部分溶于水导电
方法与技巧 1. 判断共价晶体和分子晶体的方法
①依据组成晶体的粒子和 粒子间的作用力判断
② 依据晶体的熔点判断
组成共价晶体的粒子是原子,粒子 间的作用力是共价键;组成分子晶 体的粒子是分子,粒子间的的作用 力是分子间作用力。
共价晶体
回忆分子晶体有哪些性质?
熔点和沸点较低
物质 CO2 SiO2
熔点/℃ -56.2 1723
硬度较小
沸点/℃ -78.5 2230
SiO2是分子晶体吗, 为什么
为什么CO2与SiO2的熔沸点相差这么多
结构决定性质
分子晶体
共价晶体
常见的共价晶体
一、共价晶体的概念、构成、作用力
1. 概念:所有原子都以共价键相互结合形成三维的立体网状结构的晶体 2. 构成粒子:原子 3. 粒子间作用力:共价键
C 一个B原子,则C物质的化学式可能为( )
A.AB
B.A5B4
C.AB2
D.A2B5
随堂检测
6.单质硼有无定形和晶体两种,参考下表数据回答问题:
熔点/℃ 沸点/℃
硬度
金刚石 >3 550
5 100 10
晶体硅 1 410 2 355
7.0
晶体硼 2 573 2 823
9.5
(1)晶体硼属于__共__价____晶体,理由是_晶___体__硼__的__熔___、__沸__点__高__,___硬__度__大__________。
随堂检测
2.美国《科学》杂志曾报道:在40 GPa的高压下,用激光加热到1 800 K,人们成功制得
2.3共价晶体

两边分别乘以
* * ϕ A ,ϕ B
后积分:
第三节 共价结合与共价晶体
[ H aa − ε ] + λH ab = 0 H ab + λ[ H bb − ε ] = 0
其中
A dr = 0
* B
∫ϕ ϕ
* A
A
dr = ∫ ϕ ϕ B dr = 1
* B
H ab = ∫ ϕ Hϕ B dr = ∫ ϕ Hϕ A dr
ψ = c(ϕ A + λϕ B )
h2 2 将上式带入 H Ψ = ( − ∇ i + V Ai + VBi )Ψi = ε i Ψi , i = 1,2 i i 2m 2 h Hψ = [− ∇ 2 + V A + VB ]c (ϕ A + λϕ B ) = εc(ϕ A + λϕ B ) 2m
上面表示单电子波动方程,其解称为分子轨道。分子轨道 的波函数可以选原子波函数的线性组合。下面分两种情况 讨论波函数解的情况。
第三节 共价结合与共价晶体
(1)设A、B原子是同一种原子 设 此时,自由原子的原子能级εA=εB=ε0 ,分子轨道波函 数有如下形式:
ψ + = C+ (ϕ A + ϕ B ) ψ − = C− (ϕ A − ϕ B )
ψ+ ψ−
为成键态 为反键态
第三节 共价结合与共价晶体
进一步写出两种分子轨道之间的能量差别:
ε+ =
* ψ + Hψ + dr ∫
∫ψ ψ
* +
+
dr
= H aa + H ab
ε− =
* ψ − Hψ − dr ∫
* * ϕ A ,ϕ B
后积分:
第三节 共价结合与共价晶体
[ H aa − ε ] + λH ab = 0 H ab + λ[ H bb − ε ] = 0
其中
A dr = 0
* B
∫ϕ ϕ
* A
A
dr = ∫ ϕ ϕ B dr = 1
* B
H ab = ∫ ϕ Hϕ B dr = ∫ ϕ Hϕ A dr
ψ = c(ϕ A + λϕ B )
h2 2 将上式带入 H Ψ = ( − ∇ i + V Ai + VBi )Ψi = ε i Ψi , i = 1,2 i i 2m 2 h Hψ = [− ∇ 2 + V A + VB ]c (ϕ A + λϕ B ) = εc(ϕ A + λϕ B ) 2m
上面表示单电子波动方程,其解称为分子轨道。分子轨道 的波函数可以选原子波函数的线性组合。下面分两种情况 讨论波函数解的情况。
第三节 共价结合与共价晶体
(1)设A、B原子是同一种原子 设 此时,自由原子的原子能级εA=εB=ε0 ,分子轨道波函 数有如下形式:
ψ + = C+ (ϕ A + ϕ B ) ψ − = C− (ϕ A − ϕ B )
ψ+ ψ−
为成键态 为反键态
第三节 共价结合与共价晶体
进一步写出两种分子轨道之间的能量差别:
ε+ =
* ψ + Hψ + dr ∫
∫ψ ψ
* +
+
dr
= H aa + H ab
ε− =
* ψ − Hψ − dr ∫
高中化学苏教版选修三 3.3.2 共价键 原子晶体 原子晶体课件(共21张PPT)
二、原子晶体
1、概念:原子间以共价键相结合而形成 的空间网状结构的晶体。
2、构成微粒: 原子 微粒之间的作用力:共价键 气化或熔化时破坏的作用力:共价键
3、物理性质: 熔沸点高,硬度大,难溶于一般溶剂。
(共价键键能越大,熔沸点越高,硬度越大)
4、常见原子晶体 (1)某些非金属单质:硼(B)、金刚石 (C)、硅(Si)、锗(Ge)、灰锡(Sn)等 (2)某些非金属化合物:SiC、BN等 (3)某些氧化物:SiO2、Al2O3等
(1)由图中观察可知:每个碳原子被 相邻的4个碳原子包围,以共价键跟4 个碳原子接个,形成四面体。这些四 面体向空间发展,构成一个坚实的、 彼此联结的空间网状晶体。每个 C-C 键长相等,键角均为109。28`。 (2)晶体中最小环由__6__个C组成且不共面。
(3)晶体中C原子数与C-C 键数之比为:
第二节 分子晶体与原子晶体 第二课时
复习提问: 1、什么是分子晶体?试举例说明。 2、分子晶体通常具有什么样的物理性质? 3、典型的分子晶体有哪些?
思与交流
比较CO2和SiO2 的一些物理性质和
结构,试判断SiO2 晶体是否属于分子
晶体。
物质 熔点 沸点
干冰 很低 很低
金刚石 3550℃ 4827℃
知识拓展-石墨
石 墨 晶 体 结 构
石墨
1、石墨为什么很软? 石墨为层状结构,各层之间是范德华力结 合,容易滑动,所以石墨很软。
2、石墨的熔沸点为什么很高(高于金刚石)? 石墨各层均为平面网状结构,碳原子之间存 在很强的共价键,故熔沸点很高。
3、石墨属于哪类晶体?为什么? 石墨为混合晶体。
练习 1、金刚石(晶体硅结构与此类似)
石墨
共价晶体(课件)高二化学(人教版2019选择性必修2)
二.典型的共价晶体
2.二氧化硅晶体 (1)二氧化硅晶体中,每个硅原子均以4个共价键对称地与相邻的4个氧原子 相结合,每个氧原子与 2个硅原子相结合,向空间扩展,形成三维骨架结 构。晶体结构中最小的环上有6个硅原子和6个氧原子,硅、氧原子个数比 为1∶2。
二.典型的共价晶体
2.二氧化硅晶体
相同点
硅(Si)
2019人教版 选择性必修2
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第2课时 共价晶体
【课程学习目标·学科核心素养】
一.借助共价晶体模型认识共价晶体的结构特点,发展“证据推理 与模型认知”学科核心素养。
二.能够从化学键的特征,分析理解共价晶体的物理特性,发展 “宏观辨识与微观探析”学科核心素养。
分子 晶体
判断 键能的大小
判断 分子间的作
用力
键能越大 熔点越高
子 质量大小
效果检测
【典例1】下列有关共价化合物的说法: ①具有较低的熔、沸点; ②不是电解质; ③固态时是分子晶体 ④都由分子构成; ⑤固态时不导电,其中一定正确的是 A.①③④ B.②⑤ C.①②③④⑤ 【答案】D
低温石英:硅氧四面 体相连构成的螺旋链
石英的左、右型晶体
石英手表
二.典型的共价晶体
2.二氧化硅晶体 (3)二氧化硅有许多重要用途,是制造水泥、玻璃、人造红宝石、单晶硅、 硅光电池、芯片和光导纤维的原料。
同属于共价晶体,熔点和硬度都很高
C、Si、Ge原子半径依次递增,C-C、Si-Si、Ge-Ge键长依次递增,键能减小
不对,分子晶体中的CO2、H2O等大多数分子也有共价键; 很多离子晶体,如NaOH、KNO3、NH4Cl等,在阴离子或阳离子内部也含有 共价键。
共价型物质晶体ppt课件
〔2〕诱导力
当极性分子与非极性分子相邻时,极性分子就好像一 个外电场,使非极性分子发生变形极化,产生诱导偶 极。极性分子的固有偶极与诱导偶极之间的这种作用 力称为诱导力。 诱导力的本质是静电引力,极性分子的偶极矩愈大, 非极性分子的变形性愈大,产生的诱导力也愈大;而 分子间的间隔愈大,那么诱导力愈小。 极性分子之间也会相互诱导产生诱导偶极,所以极性 分子之间也会产生诱导力。
气态、液态物质和无定形物质在一定条件下 也可以转变成晶体。
一、晶体的特征
(1)各向异性(anisotropy),即在晶体的不同方向上具有不同的物理性质,如光学性质、电 学性质、力学性质和导热性质等在晶体的不同方向上往往是各不一样的,如石墨特别容 易沿层状构造方向断裂成薄片,石墨在与层平行方向的电导率要比与层垂直方向上的电 导率高一万倍以上。
二、 晶体的分类
〔1〕按晶体的对称性分类
晶系
晶胞
类型
实
例
立方晶系 a = b = c = = = 90
NaCl、CaF2、金属Cu
四方晶系 a = b c = = = 90º
SnO2、TiO2、金属Sn
(2) 按构造单元间作用力分类
离子晶体 离子晶体中晶胞的构造单元上交替陈列着 正、负离子,离子晶体具有较高的熔点和较大的 硬度,而多电荷离子组成的晶体那么更为突出。 是电的不良导体,比较脆,机械加工性能差。
*根据偶极矩大小可以判别分子有无极性,比较分 子极性的大小。 = 0,为非极性分子; 值愈大, 分子的极性愈大。
*偶极矩还可协助判别分子能够的空间构型。 例如NH3和BCl3都是由四个原子组成的分子,能够的 空间构型有两种,一种是平面三角形,一种是三角锥 形,根据
(NH3)=5.00 10 30 C m (BCl3)= 0.00 C m 可知,BCl3分子是平面三角形构型,而NH3分子是三 角锥形构型。
高中化学3.2.3共价晶体
延展性 差 。
1.怎样从原子结构角度理解金刚石、硅和锗的熔点和硬度
依次下降?
结构相似的原子晶体,原子半径越小,键长越短,
键能越大,晶体熔点越高:金刚石>硅>锗
2.“具有共价键的晶体叫做共价晶体”。这种说法对吗?为什么?
不对,分子晶体中通常也含有共价键,如CO2、O2,
某些离子晶体中也含共价键,如NaOH、NH4Cl
(3)某些氧化物:二氧化硅(SiO2)、Al2O3晶体(刚玉)
某些共价晶体的熔点和硬度
共价晶体 金刚石 氮化硼 碳化硅 石英
熔点/0C
硬 度
>3550
10
3000
9.5
2700
9.5
硅
锗
1710 1410 1211
7
6.5 6.0
Байду номын сангаас
3.共价晶体的物理性质
熔点 高 ,硬度 大 , 难 溶于一般溶剂, 不 导电,
原子,晶体结构中存在以_____
O(或Si)
中心、_________原子为顶点的正四面
体结构。
A
(2)晶体中存在的作用力有________。
A.共价键 B.离子键 C.配位键
D.范德华力 E.氢键
(3)美国Lawrence Livermore国家实验室(LLNL)的
V.Lota.C.S.Yoo和Cynn成功地在高压下将CO2转化为具有类似
4
109°28′
sp3
②键角为__________,碳原子采取了______杂化。
12
③最小碳环由____个C组成且不在同一平面内,每个C被_____个最小环
6
1/2
1
共用,每个环平均拥有______个C,平均拥有____个C-C键。
1.怎样从原子结构角度理解金刚石、硅和锗的熔点和硬度
依次下降?
结构相似的原子晶体,原子半径越小,键长越短,
键能越大,晶体熔点越高:金刚石>硅>锗
2.“具有共价键的晶体叫做共价晶体”。这种说法对吗?为什么?
不对,分子晶体中通常也含有共价键,如CO2、O2,
某些离子晶体中也含共价键,如NaOH、NH4Cl
(3)某些氧化物:二氧化硅(SiO2)、Al2O3晶体(刚玉)
某些共价晶体的熔点和硬度
共价晶体 金刚石 氮化硼 碳化硅 石英
熔点/0C
硬 度
>3550
10
3000
9.5
2700
9.5
硅
锗
1710 1410 1211
7
6.5 6.0
Байду номын сангаас
3.共价晶体的物理性质
熔点 高 ,硬度 大 , 难 溶于一般溶剂, 不 导电,
原子,晶体结构中存在以_____
O(或Si)
中心、_________原子为顶点的正四面
体结构。
A
(2)晶体中存在的作用力有________。
A.共价键 B.离子键 C.配位键
D.范德华力 E.氢键
(3)美国Lawrence Livermore国家实验室(LLNL)的
V.Lota.C.S.Yoo和Cynn成功地在高压下将CO2转化为具有类似
4
109°28′
sp3
②键角为__________,碳原子采取了______杂化。
12
③最小碳环由____个C组成且不在同一平面内,每个C被_____个最小环
6
1/2
1
共用,每个环平均拥有______个C,平均拥有____个C-C键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
( 2s
2px
2py
2pz )
4
1 2
( 2s
2px
2py
2pz )
这4个杂化轨 道分别沿四面体 的4个对称方向, 与氢原子形成4个
稳定的 s 键
12
固体物理导论
第 3 章 晶体结合与弹性常量
3.3 共价晶体
13
结束语
当你尽了自己的最大努力时,失败也是伟大的, 所以不要放弃,坚持就是正确的。
3
固体物理导论 第 3 章 晶体结合与弹性常量
3.3 共价晶体 氢分子相对于分立中性氢原子的能量
4
固体物理导论 第 3 章 晶体结合与弹性常量
3.3 共价晶体
2. 共价键的饱和性和方向性
饱和性是指一个原子只能形成一定数目的 共价键
例子 氮原子有7个电子:1s2, 2s2, 2p3
3 个 2p (px, py, pz) 电子 自旋未配对,它们可以与 其它原子形成3个共价键
9
固体物理导论
第 3 章 晶体结合与弹性常量
3.3 共价晶体
电子激发到高能态,单个碳原子的能 量升高,但是可以使碳原子形成更多的共 价键,在和其它原子结合时降低的能量完 全可以抵偿电子有 2s 能态激发到 2p 能态 时升高的能量
10
固体物理导论
第 3 章 晶体结合与弹性常量
3.3 共价晶体
碳原子的4个未配对电子:2s, 2px, 2py, 2pz
固体物理导论
第 3 章 晶体结合与弹性常量
3.3 共价晶体
理论上认为,4个未配对电子 2s, 2px, 2py, 2pz 轨道相互混合,重新组合成4个新的未配对 的 sp3 杂化轨道
1
1 2
( 2s
2px
2py
2pz )
2
1 2
( 2s
2px
2py
2pz )
3
1 2
When You Do Your Best, Failure Is Great, So Don'T Give Up, Stick To The End
谢谢大家
荣幸这一路,与你同行
It'S An Honor To Walk With You All The Way
演讲人:XXXXXX 时 间:XX年XX月XX日
3.3 共价晶体
轨道杂化
1s 2s 2p
碳原子有6个电子:1s2, 2s2, 2p2 ,共有2个未配 对电子,但碳原子在与其它原子结合的过程中,1 个 2s 电子常被激发到 2p 轨道,形成如下激发态
1s 2s 2p
这样4个价电子全变成未配对的电子,一个碳 原子便可以形成4个共价键,也满足 8-N 规则
7固体物理ຫໍສະໝຸດ 论第 3 章 晶体结合与弹性常量
3.3 共价晶体
方向性是指原子只在特定的方向上形成共 价键,一个原子在价电子波函数最大的方向上 形成共价键
例如 p 电子的波函数具有哑铃的形状, 便是在对称轴方向上形成共价键
由于共价键的方向 性,原子在形成共价键 时可以发生轨道杂化
8
固体物理导论 第 3 章 晶体结合与弹性常量
6
固体物理导论
第 3 章 晶体结合与弹性常量
3.3 共价晶体
饱和性
价电子壳层如果不到半满,能形成共 价键的数目与价电子相等;当价电子壳层 超过半满时,由泡利原理,部分电子必须 自旋相反配对,能形成共价键的数目少于 价电子数,对于 IV-VII 族元素依靠共价 键结合,共价键的数目满足 8-N 规则
3.3 共价晶体
成键态:两电子的自旋方向相反 反键态:两电子的自旋方向相同
2
固体物理导论
第 3 章 晶体结合与弹性常量
3.3 共价晶体
成键态的电子绝大部分分布于两氢核之间, 每个电子都为两氢原子所共有,依靠两电子的 负电把带正电荷的两氢核仅仅束缚在一起形成 稳定的共价键
反键态的两电子各自分布在两氢核的两侧, 不能使两个氢原子结合在一起
碳原子与4个氢原子形成加 CH4,碳原子 的3个 2p 轨道成相互垂直的哑铃状,而 2s 轨道
和氢原子的 1s 轨道则是球状
因此3个 2p 电子与氢的 1s 电子形成的价键 应相互垂直,而 2s 电子与氢的 1s 电子的价键 则可以在任何方位;但实验指出 CH4 的4个共 价键呈对称分布,为何?
11
5
固体物理导论 第 3 章 晶体结合与弹性常量
3.3 共价晶体 当两个氮原子沿着 z 轴方向靠近时,两个 pz 电子相 互交叠,交叠后的原子对称地分布在两氮原子连线的周围,
形成的共价键常称为 s 键
两 px 轨道交叠后的电子对称分布在 yz 平面的两侧, 这样的共价键常称为 p 键;其它两 py 电子同样形成一 个p键
固体物理导论
第 3 章 晶体结合与弹性常量
3.3 共价晶体
1. 氢分子中的共价键
氢原子:电子处于 1s
+
氢分子:两个电子的 1s 轨道发生 交叠,不再处于氢原子的 1s
分子轨道的波函数可选为原子波函数的线性 组合,有两种组合方式对应形成两个能级,分别 称为反键态
1
固体物理导论 第 3 章 晶体结合与弹性常量
