电偶腐蚀速度的测定
金属腐蚀与防护实验

金属腐蚀与防护实验实验部分实验1 腐蚀试样的制备电化学试样的制备 (2)实验2 恒电位法测定阳极极化曲线 (3)实验3 塔菲尔直线外推法测定金属的腐蚀速度 (5)实验4 失重法测定金属的腐蚀速度 (7)实验5 线性极化法测定金属的腐蚀速度 (10)实验6 电位-pH图的应用 (12)实验7 动电位扫描法测定金属的阳极极化曲线 (14)实验8 电偶腐蚀速度的测定 (15)实验9 闭塞电池腐蚀模拟实验 (17)演示实验部分实验1 腐蚀原电池 (18)实验2 原电池的极化 (19)实验3 钢在硝酸中的钝化 (20)实验4 缓蚀剂的缓蚀效果 (21)实验5 阴极保护----- 牺牲阳极法 (22)附录1 CR-3型多功能腐蚀测量仪的使用方法 (23)附录2 PS-1型恒电位/恒电流仪的使用方法 (26)综合实验部分锈蚀碳钢磷化及磷化膜性能检验试验................. • ............................ .30附录一 ............................ ... .............................. .34附录二 ........................................................................ .42附录三 ........................................................................ .45附录四 ........................................................................ .46实验部分实验1 腐蚀试样的制备电化学试样的制备一、目的学会一种用树脂镶制电化学实验用的金属试样的简易方法和焊接金属样品的方法。
二、材料和药品金属试样具有塑料绝缘外套的铜管塑料套圈金属砂纸电烙铁焊油焊锡丝玻璃板玻璃棒烧杯托盘天平乙二胺环氧树脂三、实验步骤1.焊接金属样品将金属试样的所有面金属都用砂纸打磨光亮,用水冲洗干净后待用。
电偶腐蚀测试方法介绍

电偶腐蚀测试方法介绍电偶腐蚀的定义及其原理电偶腐蚀也叫以异金属腐蚀或接触腐蚀,是指两种不同电化学性质的材料在与周围环境介质构成回路时,电位较正的金属腐蚀速率减缓,而电位较负的金属腐蚀加速的现象。
构成这种现象的原因是这两种材料间存在着电位差,形成了宏观腐蚀原电池。
电偶腐蚀作为一种普遍的腐蚀现象,可诱导甚到口速应力腐蚀、点蚀、缝隙腐蚀、氢脆等腐蚀过程的发生。
产生电偶腐蚀应同时具备下述三个基本条件:第一,具有不同腐蚀电位的材料,电偶腐蚀的驱动力是被腐蚀金属与电连接的高腐蚀电位金属期E金属之间产生的电位差;第二,存在离子导电支路,电解质必须连续地存在于接触金属之间,构成电偶腐蚀电池的离子导电支路;第三,存在电子导电支路,即被腐蚀金属与电位高的金属或非金属之间要么直接接触,要么通过其他电子导体实现电连接,构成腐蚀电池的电子导电支路。
电偶腐蚀原理如下图所示:图1电偶腐蚀原理示意图电偶腐蚀测试的意义及应用领域电偶腐蚀存在于众多的工业装置和工程结构中,它是一种最普遍的局部腐蚀类型。
轮船、飞机、汽车等许多交通工具都存在着异种金属的相互接触,都会引起程度不同的电偶腐蚀。
电偶腐蚀甚至存在于电子和微电子装备中,它们在临界湿度以上及腐蚀性大气环境下工作时,许多铜导线、镀金、镀银件与焊锡相接触而产生严重的电偶腐蚀。
纽约著名的自由女神铜像内部的钢铁支架发生的严重腐蚀就是因为发生了电偶腐蚀,许多钢铁支架锈蚀得只剩下原来的一半,抑钉也已脱落;同时在潮湿空气、酸雨等作用下,铜皮外衣也被腐蚀得比原先薄了许多。
据报道,各军兵种的军事装备由于电偶腐蚀,破坏了它们的可靠性,导致电子装备的早期失效,直接影响乃至丧失它们的作战能力。
在某些情况下,两种不同的金属虽然没有直接接触,在意识不到的情况下也有引起电偶腐蚀的可能。
例如循环冷却系统中的铜零件,由于腐蚀下来的铜离子可通过扩散在碳钢设备表面上沉积,沉积下的疏松的铜粒子与碳钢之间便形成了微电偶腐蚀电池,结果引起了碳钢设备严重的局部腐蚀。
腐蚀与防护实验指导书

金属腐蚀与防护的实验一、重量法测定金属腐蚀速度一、目的要求1.掌握重量法测定金属腐蚀速度的原理和方法。
2.用重量法测定碳钢在稀硫酸中的腐蚀速度。
二、基本原理重量法是根据腐蚀前后金属试件的重量的变化来测定金属腐蚀速度的。
把待测的金属做成一定形状和大小的试件,放在测试环境中,经过一定时间后,取出并测量其重量和尺寸变化,计算其腐蚀速度。
对于失重法,可由下面公式计算腐蚀速度。
V-=(w0-w1)/(st)式中:V—金属的腐蚀速度,g/m2·h;w0—试件腐蚀前的重量,g;w1—试件腐蚀后并经过除去腐蚀产物后的重量,g;s—试件暴露在腐蚀环境中的面积,m2;t—试件腐蚀的时间,h。
腐蚀深度指标表示公式如下:V l=8.76×V-/ρ—用腐蚀深度表示的金属腐蚀速度,mm/a式中: Vlρ—金属的密度,g/cm3。
三、仪器与药品碳钢试件、稀硫酸8%、金相砂纸、细尼龙丝、电子天平等四、操作步骤1.试样用金相砂纸打磨,以除去表面氧化膜。
2.在电子天平上称重,精确到0.1mg。
用游标卡尺测量暴露的全部表面积,精确到0.02mm。
在烧杯中注入8%硫酸水溶液,将试件系于尼龙丝的一端,另一端系在玻璃棒上。
然后用无水酒精和丙酮棉球清洗试件的表面以除污垢。
把玻璃棒横担于烧杯上,使试件处于溶液的中部。
观察并记录现象。
3.记录时间,从试件进入溶液时起,到试件取出时止,实验时间为1小时。
4.试验结束后取出试件,用自来水冲洗。
5.试样干燥后(可用冷风吹),称重,除去腐蚀产物,再清洗干燥并称重,如此反复几次,直至前后相邻两次去膜后的重量差不大于0.5mg,即视为腐蚀产物完全清除,记录之。
五、数据记录室温介质试样浸入时间试样取出时间列出一组数据的计算过程。
七、思考与讨论1.重量法测定金属腐蚀速度的优点、缺点及适用范围?2.分析实验数据的误差来源。
3.写出有关电极反应式。
实验二恒电位法测定阴极极化曲线一、目的要求1.掌握恒电流法测定阴极极化曲线的基本原理和方法。
电化学腐蚀测量的方法
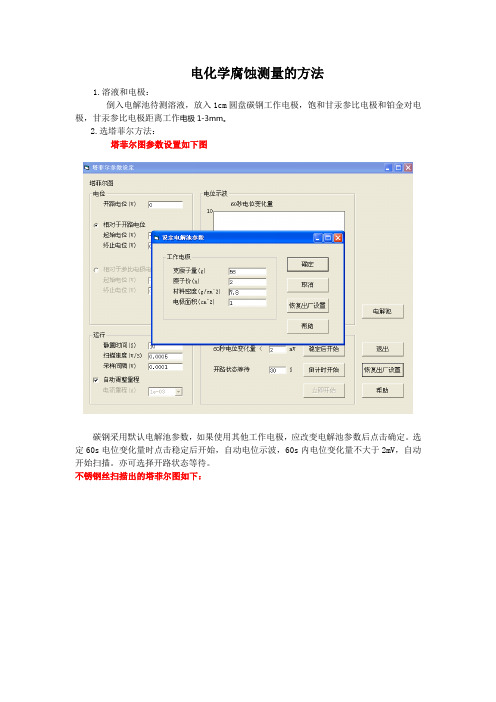
电化学腐蚀测量的方法1.溶液和电极:倒入电解池待测溶液,放入1cm圆盘碳钢工作电极,饱和甘汞参比电极和铂金对电极,甘汞参比电极距离工作电极1-3mm。
2.选塔菲尔方法:塔菲尔图参数设置如下图碳钢采用默认电解池参数,如果使用其他工作电极,应改变电解池参数后点击确定。
选定60s电位变化量时点击稳定后开始,自动电位示波,60s内电位变化量不大于2mV,自动开始扫描。
亦可选择开路状态等待。
不锈钢丝扫描出的塔菲尔图如下:扫描完成后,点击测量按钮,自动测量出腐蚀电流和腐蚀速率,亦可套入公式,计算出腐蚀速率。
RST5000系列电化学工作站自动测量可以得到腐蚀速率。
如果设置参数不好做出来的图从直观上明显不对,可以手动校正,方法:点击拟合阴、阳极段,就可以对阴极曲线或阴极曲线进行手动拟合,其值也自动在设置栏下面显示。
双击y 轴数值,作图的电流密度对数和电流密度可以互相转换,腐蚀速度换算公式:金属腐蚀速度可用腐蚀失重或腐蚀深度表示,也可用腐蚀电流密度表示。
它们之间可通过法拉第定律进行换算,即corr corr i n M i nF M 41073.3-⨯==υ (g/m 2h ) corr i n M d ρρυ31028.3-⨯==(mm/年) 式中:υ为腐蚀速度(g/m 2h );d 为腐蚀深度(mm/年);corr i 是腐蚀电流密度(μA/cm 2); M为金属的克原子量(g);n 为金属的原子价;F 为法拉第常数; ρ为金属的密度(g/cm 3)。
注:1.以上内容摘自《电化学测试技术》刘永辉 编著 P360~361;以钢铁为例:M=56g ,n=2,ρ=7.83cm g ,则腐蚀速度为: corr coor i i nM 241004.11073.3--⨯=⨯=υ (g/m 2h ) 腐蚀深度为:corr corr i i n M d 231017.11028.3--⨯=⨯==ρρυ (mm/年) 将实际测的腐蚀电流密度corr i (单位:μA/cm 2)代入公式即可得出结果。
金属腐蚀与防护考试试卷(附实验)及答案

金属腐蚀与防护试卷1一、解释概念:(共8分,每个2分)钝性,碱脆、SCC、缝隙腐蚀二、填空题:(共30分,每空1分)1.称为好氧腐蚀,中性溶液中阴极反应为,好氧腐蚀主要为控制,其过电位与电流密度的关系为。
2.在水的电位-pH图上,线ⓐ表示关系,线ⓑ表示关系,线ⓐ下方是的稳定存在区,线ⓑ上方是的稳定存在区,线ⓐ与线ⓑ之间是的稳定存在区。
3.热力系统中发生游离CO2腐蚀较严重的部位是,其腐蚀特征是,防止游离CO2腐蚀的措施是,运行中将给水的pH值控制在范围为宜。
4.凝汽器铜管在冷却水中的脱锌腐蚀有和形式。
淡水作冷却水时易发生脱锌,海水作冷却水时易发生脱锌。
5.过电位越大,金属的腐蚀速度越,活化极化控制的腐蚀体系,当极化电位偏离E corr足够远时,电极电位与极化电密呈关系,活化极化控制下决定金属腐蚀速度的主要因素为、。
6.为了防止热力设备发生氧腐蚀,向给水中加入,使水中氧含量达到以下,其含量应控制在,与氧的反应式为,加药点常在。
7.在腐蚀极化图上,若P c>>P a,极极化曲线比极极化曲线陡,这时E corr值偏向电位值,是控制。
三、问答题:(共24分,每小题4分)1.说明协调磷酸盐处理原理。
2.自然界中最常见的阴极去极化剂及其反应是什么?3.锅炉发生苛性脆化的条件是什么?4.凝汽器铜管内用硫酸亚铁造膜的原理是什么?5.说明热力设备氧腐蚀的机理。
6.说明腐蚀电池的电化学历程,并说明其四个组成部分。
四、计算:(共24分,每小题8分)1.在中性溶液中,Fe+2=106-mol/L,温度为25℃,此条件下碳钢是否发生析氢腐蚀?并求出碳钢在此条件下不发生析氢腐蚀的最小pH 值。
(E 0Fe 2+/Fe = - 0.44)2.写出V -与i corr 的关系式及V t 与i corr 的关系式,并说明式中各项的物理意义。
3.已知铜在含氧酸中和无氧酸中的电极反应及其标准电极电位:Cu = Cu 2+ + 2e E 0Cu 2+/Cu = + 0.337VH 2 = 2H + + 2e E 02H +/H = 0.000V2H 2O = O 2 + 4H + + 4e E 0O 2/H 2O = +1.229V问铜在含氧酸和无氧酸中是否发生腐蚀?五、分析:(共14分,每小题7分)1.试用腐蚀极化图分析铁在浓HNO 3中的腐蚀速度为何比在稀HNO 3中的腐蚀速度低?2. 炉水协调磷酸盐-pH 控制图如图1,如何根据此图实施炉水水质控制,试分析之。
基本的电化学腐蚀测量本的电化学腐蚀测量

基本的电化学腐介绍大多数金属腐蚀通过在金属与溶液层形成了溶液。
大桥中的钢筋发生发生在非水系统中。
腐蚀通常以正、逆反应达到平衡时一个是发生阴极反应,溶液中的离应达到平衡时,每个反应的电荷转同金属接触。
图1-1是上述过程的图解。
纵轴是曲线表示总电流—阴极电流和阳极点就是电流发生改变的地方,即反于将横轴对数化造成。
横轴对数化是由于钝化现象,电流值改变6个数图1-1 腐蚀过程中阳极和阴极电流金属电位 是阳极和阴极反应平衡时假设阳极反应产生过多电子只金属应。
这抵消了系统中的初始扰动在大多数腐蚀电化学试验中,第一偏向于开路电位。
腐蚀科学家在测量开路电位很重要定的开路电位表示所要研究的系统化学腐蚀测量与溶液界面上发生的电化学反应而产生。
对大气腐蚀而言金属筋发生腐蚀的电解液是潮湿的混凝土。
尽管大多数腐蚀发生在平衡时的速率发生。
首先是阳极反应,金属被氧化,释放离子中的离子(通常是O2 或 H+)被还原,吸收了来自金属的电电荷转移速度相等,没有净电流产生。
正、逆反应可发生在同纵轴是电位,横轴是电流的对数。
理想的阴、阳极反应电流如和阳极电流之和。
这是在用恒电位仪进行电位扫描时测得的电即反应从阳极反应转变成阴极反应或是阴极反应转变成阳极数化是必要的,因为在一个腐蚀试验中,较宽范围内的电流值个数量级不常见。
极电流部分平衡时的电位。
参照图1-1。
注意每个半反应的电流取决于金属只金属表面。
过剩电子使得金属电位向负向移动,减缓阳极反扰动。
第一步就是测量开路电位。
开路电位和腐蚀电位的关系通常很重要的一点就是在进行试验前给予足够时间使得开路电位达的系统处于稳定状态,即各种腐蚀反应的速度恒定。
有言金属表面薄的水分子发生在水中,也有腐蚀放离子至金属表面。
另属的电子。
当这两个反生在同一金属或两种不电流如图中直线所示。
得的电流。
图像中的尖成阳极反应。
尖点是由电流值需展示在图中。
于金属的电化学电势。
阳极反应,加快阴极反系通常可互换,但是更电位达到稳定状态。
实验三:电偶腐蚀
实验三:电偶腐蚀速度的测定
一、实验目的
1.掌握电偶腐蚀测试原理;
2.掌握电极电位、耦合电流的测量方法;
3.掌握实验分析方法。
二、实验仪器及用品
电偶腐蚀计,金属电极(Fe,紫铜,黄铜),饱和甘汞电极,烧杯,量筒,天平砂纸,滤纸,酒精棉,pH试纸
NaCl,
三、实验内容及步骤
1.将各电极用水砂纸打磨光亮,用酒精棉擦干待用;
2.配制100毫升3%NaCl溶液,连接电偶腐蚀计线路;
3.测定各电极在3%NaCl溶液中相对于石墨电极的自腐蚀电位,填入表格;4.测Fe-紫铜和黄铜-紫铜电偶电流随时间的变化
待电极自腐蚀电位稳定后接通电路,测定电偶电流随时间的变化情况,直到电流比较稳定时为止,测量耦合电极相对于参比电极的电位。
电偶电流最初随时间变化较快,可适当缩小记录时间间隔,15秒或半分钟计一次数。
四、实验数据及结果处理
1.所有测量数据记录于表格中
自腐蚀电位:Fe:黄铜:紫铜:
耦合电位:Fe-紫铜:黄铜-紫铜:
2.将Fe-紫铜和黄铜-紫铜电偶电流随时间的变化绘制在同一张图中;3.结果及讨论。
腐蚀与防护实验指导书
金属腐蚀与防护的实验一、重量法测定金属腐蚀速度一、目的要求1.掌握重量法测定金属腐蚀速度的原理和方法。
2.用重量法测定碳钢在稀硫酸中的腐蚀速度。
二、基本原理重量法是根据腐蚀前后金属试件的重量的变化来测定金属腐蚀速度的。
把待测的金属做成一定形状和大小的试件,放在测试环境中,经过一定时间后,取出并测量其重量和尺寸变化,计算其腐蚀速度。
对于失重法,可由下面公式计算腐蚀速度。
V-=(w0-w1)/(st)式中:V—金属的腐蚀速度,g/m2·h;w0—试件腐蚀前的重量,g;w1—试件腐蚀后并经过除去腐蚀产物后的重量,g;s—试件暴露在腐蚀环境中的面积,m2;t—试件腐蚀的时间,h。
腐蚀深度指标表示公式如下:V l=8.76×V-/ρ—用腐蚀深度表示的金属腐蚀速度,mm/a式中: Vlρ—金属的密度,g/cm3。
三、仪器与药品碳钢试件、稀硫酸8%、金相砂纸、细尼龙丝、电子天平等四、操作步骤1.试样用金相砂纸打磨,以除去表面氧化膜。
2.在电子天平上称重,精确到0.1mg。
用游标卡尺测量暴露的全部表面积,精确到0.02mm。
在烧杯中注入8%硫酸水溶液,将试件系于尼龙丝的一端,另一端系在玻璃棒上。
然后用无水酒精和丙酮棉球清洗试件的表面以除污垢。
把玻璃棒横担于烧杯上,使试件处于溶液的中部。
观察并记录现象。
3.记录时间,从试件进入溶液时起,到试件取出时止,实验时间为1小时。
4.试验结束后取出试件,用自来水冲洗。
5.试样干燥后(可用冷风吹),称重,除去腐蚀产物,再清洗干燥并称重,如此反复几次,直至前后相邻两次去膜后的重量差不大于0.5mg,即视为腐蚀产物完全清除,记录之。
五、数据记录室温介质试样浸入时间试样取出时间列出一组数据的计算过程。
七、思考与讨论1.重量法测定金属腐蚀速度的优点、缺点及适用范围?2.分析实验数据的误差来源。
3.写出有关电极反应式。
实验二恒电位法测定阴极极化曲线一、目的要求1.掌握恒电流法测定阴极极化曲线的基本原理和方法。
01实验一电偶腐蚀
实验一电偶腐蚀实验一、实验目的通过失重法和电位、电流测量实验,了解电偶的形成与单一金属腐蚀速率、耦合电位等参数的相互关系,同时通过实验数据了解电偶腐蚀的特点、腐蚀介质、电位差、面积比等因素对电偶腐蚀的影响规律,并总结出相对应的预防措施。
二、实验原理电偶腐蚀:当一种不太活泼的金属(阴极)和一种比较活泼的金属(阳极)在电解质溶液中接触时,因构成腐蚀原电池而引发电流,从而造成(主要是阳极金属)电偶腐蚀。
电偶腐蚀也称双金属腐蚀或金属接触腐蚀。
电偶腐蚀首先取决于异种金属之间的电极电位差。
这一电位指的是两种金属分别在电解质溶液(腐蚀介质)中的实际电位。
通常在手册、资料中能找到的是各种金属、合金在特定的介质中按腐蚀电位高低排列的电位顺序表,称作电偶序。
在其它条件不变的情况下,它们之间的电位差愈大,腐蚀初始驱动力愈大。
影响电偶腐蚀的因素还有介质导电性、极化性及面积比。
面积比是指阴、阳极面积比,比值愈大,即大阴极小阳极组成的电偶,其阳极腐蚀电流密度愈大,腐蚀愈严重。
在腐蚀电偶的阳极区有涂层时也会出现大阴极小阳极的情况,结果造成极严重的局部腐蚀而迅速穿孔。
对于耦合电流的测定,可以采用零欧姆计直接测定耦合电流,主要就是在测定耦合电流时,不引入耦合电阻,使得测定结果具有较高的准确度。
在实验室测定时如果没有零欧姆计,可以采用万用表或者直流电流表直接测定,也可以采用外加标准电阻测定电位差的方式进行评价,需要注意的是外加标准电阻越小测定准确度就越高,根据测量误差要求一般采用体系接水电阻的5-10%或者更小的外加电阻,最后换算成耦合电流即可。
常用的腐蚀评定方法:1. 失重法由于腐蚀作用,材料的重量会发生系统变化,此即重量法测定材料抗蚀能力的理论基础。
虽然近年来发展了许多新的腐蚀研究方法,但重量法仍然是最基本的定量评定腐蚀的方法,并已被广泛应用。
重量法简单而直观,适用于实验室和现场试验。
失重法是一种筒单而直接的方法;它不要求腐蚀产物牢固附着在材料表面,也不考虑腐蚀产物的可溶牲,因为试验结束后必须从试样上请除全部腐蚀产物。
电偶腐蚀测试
电偶腐蚀测试是一种评估金属材料在不同环境下的耐腐蚀性的方法。
在电偶腐蚀测试中,两种或多种不同的金属在电解质溶液中组成电偶对,其中一种金属为阴极,另一种金属为阳极。
阴极金属被保护,而阳极金属被腐蚀。
测试中需要测量和记录腐蚀速率、腐蚀电流、电位等参数。
电偶腐蚀测试的步骤如下:
1.选取不同的金属材料组合成电偶对。
2.将金属材料加工成适合测试的形状和尺寸。
3.将金属材料放入电解质溶液中,并确保稳定的电偶连接。
4.记录测试过程中的电位、电流等参数,并计算腐蚀速率。
5.分析测试结果,评估不同金属材料的耐腐蚀性。
电偶腐蚀测试的优点包括:能够模拟实际使用环境中的腐蚀情况,可以评估不同金属材料的耐腐蚀性,可以研究不同因素对金属腐蚀的影响。
缺点包括:测试周期较长,需要专业的测试设备和技能,测试结果会受到多种因素的影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验三:电偶腐蚀速度的测定
一、试验目的:
1.掌握电偶腐蚀测试原理;
2.掌握电极电位、耦合电流的测量方法;
3.掌握实验分析方法。
二、实验原理:
当两种金属或合金相接触在溶液中可以发现在该液中电,位较负的金属腐蚀速度加大,而电位较正的金属受到保护,这种现象就是电偶腐蚀。
金属或合金制成电极,应用电偶腐蚀计测量,便可测定其各个电极开路电位,耦合电位,回路电流等值。
三、仪器药品
电偶腐蚀计,金属电极(Fe,紫铜,黄铜),饱和甘汞电极,烧杯,量筒,天平
砂纸,滤纸,酒精棉,pH试纸,NaCl,
四、实验内容及步骤
1.将各电极用水砂纸打磨光亮,用酒精棉擦干待用;
2.配制100毫升3%NaCl溶液,连接电偶腐蚀计线路;
3.测定各电极在3%NaCl溶液中相对于石墨电极的自腐蚀电位,填入表格;
4.测Fe-紫铜和黄铜-紫铜电偶电流随时间的变化
待电极自腐蚀电位稳定后接通电路,测定电偶电流随时间的变化情况,直到电流比较稳定时为止,测量耦合电极相对于参比电极的电位。
电偶电流最初随时间变化较快,可适当缩小记录时间间隔,15秒或半分钟计一次数。
五、实验数据及结果处理
1.所有测量数据记录于表格中
自腐蚀电位:Fe:-0.595V 黄铜:-0.208V 紫铜:-0.192V
耦合电位:Fe-紫铜:-0.552V 黄铜-紫铜:-0.218V
Fe-紫铜电偶电流随时间变化
黄铜-紫铜电偶电流随时间变化
2.将Fe-紫铜和黄铜-紫铜电偶电流随时间的变化绘制在同一张图中;
Ig/mA
t (s)
3.结果及讨论
1.测量个电极开路电位时,其电位一直浮动不定,这是由于金属表面的极化和由
于阴、阳极反应生成表面膜或腐蚀产物的影响。
2.两金属电极电位差越大,其测量电流Ig越大,试验中Fe-紫铜电偶为-0.552V,
大于紫铜-黄铜电偶的耦合电位,所以其测量的Ig也大于后者。
3.随着反应的进行,Ig均随时间而减小,反应初始时Ig下降迅速,之后,随着
极化的进行,由于电极外侧生成钝化膜等原因,电流都逐渐减小,之后趋于平
稳,中间也有波动起伏的过程。
4.电极是否打磨干净会影响试验中电流的稳定和大小,但整体Ig-t变化趋势不变。
参考文献
1、《实验电化学》王圣平编中国地质大学出版社
2、《腐蚀电化学原理》第一版曹楚南编。
