材料科学基础_第二章-合金的相结构
材料科学基础_第2章_固体材料的结构

4
共价键
原子间不产生电子的转移,借共用电子对产生的力结合, 如金刚石,单质硅,SiC 特点: 1.饱和性:电子必须由(8-N)个邻近原子共有;
2.具有方向性:氧化硅四面体中硅氧键为109°
3. 脆性:外力作用,原子间发生相对位移,键将被 破坏
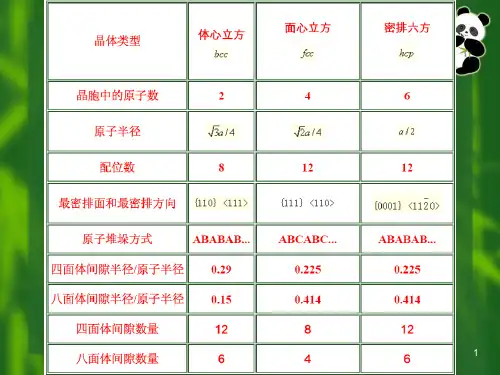
配位数与致密度 配位数 CN=12 致密度 k=0.74
25
体心立方结构(特征)
体心立方晶格密排面
26
ቤተ መጻሕፍቲ ባይዱ
体心立方晶格(间隙及堆垛方式)
间隙: 也是两种,为八面体和四面体间隙, 八面体间隙位于晶胞六面体每个面的中心和每个棱的 中心由一个面上四个角和相邻两个晶胞体心共6个原围成, 即数量为6。大小为rB=0.154R(在<100>) 或rB=0.633R (在<110>) 。
配位数: CN=8 致密度: k=0.68
31
密排六方晶格原子位置
32
密排六方晶格晶胞原子数
33
密排六方晶格密排面
34
密排六方晶格原子配位数
35
密排六方晶格(间隙及堆垛方式)
• 间隙: 较为复杂,如图2.34 八面体间隙rB=0.414R 有 6 个 四面体间隙rB=0.225R 有 12 个
图1 Cl和Na离子保持r0的距离
图2 NaCl 晶体
9
•
分子键(范德华力)
以若静电吸引的方式使分子或原子团连接在一起的。
特点:除高分子外,键的结合不如化学键牢固,无饱和性, 无方向性。
氢键: 分子间特殊作用力
表达为:X—H—Y 特点:具有饱和性和方 向性,可存在于分子内 或分子间。氢键主要存 在于高分子材料内。
材料科学基础第2章
可编辑ppt
10
2.3.1 固溶体
固溶体(solid solution) :
合金组元通过溶解形成一种成分和性能均匀的、 且结构与组元之一相同的固相称为固溶体。
➢ 固溶体的最大特点是保持溶剂的晶体结构。
➢ 与固溶体晶格相同的组元为溶剂,一般在合金中 含量较多;另一组元为溶质,含量较少。
✓ 各向异性:由于在不同方向上的原子排列的紧密程 度不同使晶体在不同方向上的物理、化学和力学性 能不同。而一般整个晶体不显示各向异性,称为伪 等向性。
✓ 晶粒:组成晶体的结晶颗粒。 ✓ 多晶体:凡由两颗以上晶粒组成的晶体一般金属都
是多晶体。。
可编辑ppt
4
晶粒
可编辑ppt
5
Байду номын сангаас
多相合金
可编辑ppt
6
可编辑ppt
12
(3)按溶质原子在溶剂中的分布特点分类 无序固溶体:溶质原子在溶剂中任意分布, 无规律性。
有序固溶体:溶质原子按一定比例和有规 律分布在溶剂晶格的点阵或间隙里。
(4)按基体类型分类: 一次固溶体:以纯金属为基形成的固溶体。
二次固溶体:以化合物为基形成的固溶体。
可编辑ppt
13
固溶体的两种类型(置换和间隙)
中间相可以用分子式来大致表示其组成。
合金相的性质由以下三个因素控制: (1)电化学因素(电负性或化学亲和力因素)
电负性—化学亲和力越大越容易形成化合物,电负性 相近的元素容易形成固溶体。
(2)原子尺寸因素 △r=(rA-rB)/rA △r越大,越易形 成中间相。 △r越小,越易形成固溶体
(3)原子价因素(电子浓度因素): C电子=[A(100-x) +Bx]/100 C越大,越易形成
材料科学基础相结构

-
1
引言
2 相结构的基本概念
3相结构的分类4源自相结构的应用5结论
1 引言
01
材料科学是研究 材料组成、结构、 性能及其应用的 一门科学
引言
02
相结构是材料科 学中的重要概念, 对于材料的性能 和用途有着决定 性的影响
03
本文将介绍材料 科学基础相结构 的基本概念、分 类及应用
2 相结构的基本概念
01
02
相结构的基本概念
相结构是指材料中不同相的组 成、分布及相互关系。这些不 同相可能是晶体、非晶体、液 体或气体等。在材料中,这些 相通常是由化学元素、化合物 或混合物组成的 相结构的确定对于材料性能的 研究至关重要。例如,材料的 强度、韧性、导电性、导热性 等性能都与其相结构密切相关。 因此,了解材料的相结构是研 究材料科学的基础
无机非金属材料:无机非金属材 料的硬度、耐磨性和电学性能等 与其相结构有关。通过调整材料 的成分和烧结工艺,可以制备出 具有优异性能的无机非金属材料 ,如陶瓷、玻璃等
PART-01
相结构的应用
3. 高分子材料
高分子材料的力学性能、化学反应活性等与其相结构有 关。通过控制高分子材料的合成和加工工艺,可以制备 出具有不同性能的高分子材料,如塑料、橡胶等
4. 复合材料
复合材料的性能取决于其组成相的结构和性质。通过选 择不同的增强体和基体材料,以及优化复合材料的制备 工艺,可以制备出具有优异性能的复合材料,如碳纤维 增强树脂基复合材料、陶瓷颗粒增强金属基复合材料等
5 结论
结论
1
结论
2
3
相结构是材料科学中的重要概念,对于材料的性能和 用途有着决定性的影响
材料科学基础第2章
晶胞示意图
晶胞大小和形状表示方法
晶胞大小和形状表示方法为:
晶胞的棱边长度a、b、c(称为点阵常数、晶格常 数(lattice constants/parameters)); 棱边的夹角为α、β、γ(称为晶轴间夹角)。 选取晶胞的原则: 1、应反映出点阵的高度对称性 2、棱和角相等的数目最多 3、棱边夹角为直角时,直角数目最多 4、晶胞体积最小
晶面指数(hkil)其中i=-(h+k)
晶向指数 [uvtw] 其中t=-(u+v)
六方晶系按两种晶轴系所得的晶面指数和晶向 指数可相互转化:
六方晶系的晶向(面)指数示意图
六方晶系的一些晶向(面)指数
4.晶带
晶带——所有平行或相交于同一直线的晶面构成一个 晶带,此直线称为晶带轴。属此晶带的晶面称为共 带面。 晶带定理:同一晶带上晶带轴[uvw]和晶带面(hkl) 之间存在以下关系:hu+kv+lw=0 通过晶带定理可以求晶向指数或晶面指数。 a) 求两不平行的晶面(h1k1l1)和(h2k2l2)的晶 带轴。 b) 求两个不平行的晶向[u1v1w1]和[u2v2w2]所决定 的晶面。
面心立方八面体间隙面心立方Biblioteka 面体间隙面心立方四面体间隙
面心立方四面体间隙
面心立方原子堆垛顺序
面心立方晶体的 ABCABC 顺序密堆结构
2.体心立方晶格(特征)
原子排列:晶胞八个顶角和晶胞体心各有一个原子 点阵参数:a=b=c,α=β=γ=90º 晶胞中原子数:n=8×1/8+1=2个 3 原子半径: 4R 3a, R a
三种典型金属晶体结构刚球模型
三种典型金属晶体结构晶胞原子数
原子半径与晶格常数
三种典型金属晶格密排面的堆垛方式
上海交大-材料科学基础-第二章-1

晶面的位向
h : k : l cos : cos : cos
cos2 cos2 cos2 1 立方晶系
晶面间距
dhkl
a h
cos
b h
cos
c h
cos
d
2hkl [(
h a
)2
( h )2 b
( h )2 ] c
cos2
cos2
cos2
式中h、k、l为晶面指数(hkl),a、b、c为 点阵常数,α、β、γ为晶面法线方向与晶轴夹角。
每个原子周围的情况完全相同,则这种原子所组成的
网格称为简单晶格。
复式晶格:如果晶体由两种或两种以上原子组成,同 种原子各构成和格点相同的网格,网格的相对位移而 形成复式晶格。
cc
金刚石结构
2.1.2 晶向指数和晶面指数
晶列:布拉菲格子的格点可以看成是分布在一系列相 互平行的直线上,而无遗漏,这样直线称为晶列;
uvw 放入方括号内,写成[uvw],即为待标定晶向的晶 向指数。若为负值,则在指数上加一负号。(化整数, 列括号)
xa : yb : zc u :v : w abc
立方晶系中一些常用的晶向指数
例:如图在立方体中, a i , b j , c k
方法2
D是BC的中点,求BE,AD的晶列指数
第二章 固体结构
本章主要内容
❖ 2.1晶体学基础 ❖ 2.2金属的晶体结构 ❖ 2.3合金相结构 ❖ 2.4离子晶体结构 ❖ 2.5共价晶体结构
概述
❖ 物质按聚集状态分类: 气态、液态和固态; ❖ 按原子(或分子)排列特征分类:晶体和非晶体。
绝大部分陶瓷、少数高分子材料、金属及合金是晶体; 多数高分子材料、玻璃及结构复杂材料是非晶体。
第2章 金属及合金相的晶体结构

1. 面心立方结构
面心立方结构金属:γ-Fe, Al, Cu, Ni, Au, Ag和Pt等。
结构符号A1,Pearson符号cF4。 每个晶胞含4个原子。
面心原子shared by 2 cells: 6 x 1/2 = 3 顶角原子shared by 8 cells: 8 x 1/8 = 1
略受压缩的八面体间隙; 八面体间隙中心位于棱边中心和面心 八面体间隙半径: r=1/2(a-2R)
r≈0.155 R 晶胞含6 (6×1/2+12×1/4 )个八面体间隙。 平均1个原子3有个八面体间隙。
非正四面体间隙。 四面体间隙半径: r= (a√5/4-R)
r≈0.291 R 晶胞含12 (4 ×6 ×1/2)个四面体间隙。 平均1个原子含6个四面体间隙。
ZA, ZB 为A、B组元价电子数, VB为B组元摩尔分数。
1933年,Bernal 建议称之为电子化合物。 Massalski认为称其为电子相更恰当。
§2.12正常价化合物
正离子价电子数正好能使负离子具有稳定的电子层结构,即 AmBn化合物中,meC=n(8-eA), 结合一般是离子键。 eA和eC分别是正和负离子在非电离状态下的价电子数。
§2.13 拓扑密堆积相(TCP相)
在很多化合物结构中,原子尺寸起主要作用,并倾向于紧密堆 垛,称为拓朴密堆相,包括间隙化合物、Laves、σ相等。
间隙化合物
由原子半径r比较大的过渡金属(M)与r比较小的H, B, C, N, O, 等非金属组成的化合物,非金属原子占据金属原子结构间隙。 具有金属光泽和导电性的高熔点、高硬度较脆的化合物。
§2.9间隙固溶体
面心立方结构
r=0.414R
r=0.225R
材料科学基础_04材料的原子结构_43合金的相结构_
合金的相结构一.基本概念Ø合金:以一种金属元素为基础,加入另一种或几种金属(非金属)元素组成的具有金属特性的物质。
Ø组元:组成合金的基本单元。
合金中的组元可以是金属元素和非金属元素,也可以是稳定化合物。
两个组元组成的合金称为二元合金,三个组元组成的合金称为三元合金。
合金的名称按其最主要的组元的名称命名,如铜合金、铝合金等。
也可以按主要合金元素的名称命名,如铁–碳合金、铜–锌合金等。
Ø相:合金中具有同一化学成分、同一结构和原子聚集状态,并以界面互相分开的、均匀的组成部分。
单相合金两相合金Ø显微组织:在显微镜下观察到的金属中各相或各晶粒的形态、数量、大小和分布的组合。
显微组织示意图固态合金中的相分为固溶体和金属化合物两类二.固溶体合金结晶时若组元相互溶解所形成固相的晶体结构与组成合金的某一组元相同,则这类固相称为固溶体。
固溶体中含量较多的组元称为溶剂,含量较少的组元称为溶质,固溶体的晶格类型与溶剂组元的晶格类型相同。
按溶质原子在溶剂晶格中所处位置不同间隙固溶体置换固溶体按溶质原子与溶剂原子的相对分布无序固溶体有序固溶体按固溶度无限固溶体有限固溶体1.置换固溶体金属元素之间一般都能形成置换固溶体,但固溶度往往相差很大。
如:Cu与Ni无限互溶,Zn在Cu中最大溶解度为39%,Pb几乎不溶解于铜。
原因:受元素间原子尺寸、化学亲和力、晶体结构类型等影响。
溶质原子置换了部分溶剂晶格结点上某些原子而形成的固溶体。
2.间隙固溶体特点:a.会引起点阵畸变;b.溶解度与原子大小和溶剂的晶格类型有关;c.间隙固溶体只能是有限固溶体。
当溶质与溶剂的原子半径之比小于0.59时,可能形成间隙固溶体(溶质元素均是原子半径小于0.1nm的非金属元素,溶剂元素则都是过渡族元素)溶质原子分布于溶剂晶格间隙中而形成的固溶体。
如:溶质元素有C、N、O、H、B 等非金属小半径原子。
(1) 保持着溶剂的晶格类型;(3) 偏聚与(短程)有序(4) 有序固溶体(长程有序化)当固溶体发生偏聚或有序化时,强度和硬度增加,而塑性和韧性降低。
材料科学基础试题及答案
第一章 原子排列与晶体结构1. fcc 结构的密排方向是 ,密排面是 ,密排面的堆垛顺序是 ,致密度为 ,配位数是 ,晶胞中原子数为 ,把原子视为刚性球时,原子的半径r 与点阵常数a 的关系是 ;bcc 结构的密排方向是 ,密排面是 ,致密度为 ,配位数是 ,晶胞中原子数为 ,原子的半径r 与点阵常数a 的关系是 ;hcp 结构的密排方向是 ,密排面是 ,密排面的堆垛顺序是 ,致密度为 ,配位数是 ,,晶胞中原子数为 ,原子的半径r 与点阵常数a 的关系是 。
2. Al 的点阵常数为0.4049nm ,其结构原子体积是 ,每个晶胞中八面体间隙数为 ,四面体间隙数为 。
3. 纯铁冷却时在912ε 发生同素异晶转变是从 结构转变为 结构,配位数 ,致密度降低 ,晶体体积 ,原子半径发生 。
4. 在面心立方晶胞中画出)(211晶面和]211[晶向,指出﹤110﹥中位于(111)平面上的方向。
在hcp 晶胞的(0001)面上标出)(0121晶面和]0121[晶向。
5. 求]111[和]120[两晶向所决定的晶面。
6 在铅的(100)平面上,1mm 2有多少原子?已知铅为fcc 面心立方结构,其原子半径R=0.175×10-6mm 。
第二章 合金相结构一、 填空1) 随着溶质浓度的增大,单相固溶体合金的强度 ,塑性 ,导电性 ,形成间隙固溶体时,固溶体的点阵常数 。
2) 影响置换固溶体溶解度大小的主要因素是(1) ;(2) ;(3) ;(4) 和环境因素。
3) 置换式固溶体的不均匀性主要表现为 和 。
4) 按照溶质原子进入溶剂点阵的位置区分,固溶体可分为 和 。
5) 无序固溶体转变为有序固溶体时,合金性能变化的一般规律是强度和硬度 ,塑性 ,导电性 。
6)间隙固溶体是 ,间隙化合物是 。
二、 问答1、 分析氢,氮,碳,硼在α-Fe 和γ-Fe 中形成固溶体的类型,进入点阵中的位置和固溶度大小。
北京科技大学材料科学基础A第2章-固态结构(3)
由两种或多种元素组成、以金属元素为主体、大多通 过冶炼或熔合而成、并在宏观上具有一般金属元素所 具有的共同特征,这一类材料或物质通称为合金。
纯金属 + 异类原子
怎样进入主组元中
代位固溶体结构 间隙固溶体结构 金属间化合物类型
第三节 合金相结构
一. 影响合金相结构的基本因素 1. 异类原子间的相互作用 异类原子间的相互作用与同类原子间的相互作用相比: ≈ 不使能量变化 均匀混合 > 使能量降低 有序固溶体 金属间化合物 正常价化合物 < 使能量升高 各自集聚、各自固有的晶体结构 2. 原子相对尺寸因素 原子尺寸差异,使得点阵发生畸变,引起能量升高, 量 变 结构变得不稳定,结构类型发生变化。 质 变
第三节 合金相结构
元素周期表中 同一周期 原子序数 负电性 同一族 原子序数 负电性
组元间负电性相差越大,
有利于形成化合物,不利于形成固溶体。
形成的化合物越稳定,固溶体的固溶度越小。 当电负性差小于0.4~0.5时,才有可能获得较大的固溶度。 金属元素 + VIA S、Se、Te, VA P、As、Sb、Bi, IVA Si、Ge、Sn、P
合金元素原子百分数
给定金属晶体结构,电子浓度有限,超过限度, 结构不稳定,发生改组 一价fcc, C电子<1.4(1.36) 一价bcc,C电子<1.5(1.48)
第三节 合金相结构
电子浓度确定困难: ① 每个原子不一定都贡献价电子; ② 变价金属的原子价随条件而变; ③ 过渡金属的 ns 层电子既可以为价电子, 又可以进入(n-1)d层和(n-2)f层, 而 (n-1)d层和(n-2)f层的电子又可能贡献价电子。 对于过渡金属的价电子数,通常有两种处理方法: 按零处理; 确定为除去与惰性气体相当的满壳层电子以外的所有电子。
第二章 铁碳合金的结构和相图
二、亚共析钢的平衡结晶过程 其平衡结晶过程的基本反应:匀晶反应+ 其平衡结晶过程的基本反应:匀晶反应+固溶体转变 反应+共析反应。 反应+共析反应。
亚共析钢室温组织为铁素体和珠光体构成, 亚共析钢室温组织为铁素体和珠光体构成 , 按杠杆 定律可以计算生成F和 的相对质量 的相对质量。 定律可以计算生成 和P的相对质量。
2、主要特性曲线
(1)AC线 液体向奥氏体转变的开始线。即:L→A。 ) 线 液体向奥氏体转变的开始线。 。 (2)CD线 液体向渗碳体转变的开始线。即:L→Fe3CⅠ。 ) 线 液体向渗碳体转变的开始线。 ACD线 为液相线,在此线之上合金全部处于液相状态,用符号 表示。 线 为液相线,在此线之上合金全部处于液相状态,用符号L表示 表示。 (3)AE线 液体向奥氏体转变的终了线。 ) 线 液体向奥氏体转变的终了线。 (4)ECF水平线 共晶线。 ) 水平线 共晶线。 AECF线 为固相线,液体合金冷却至此线全部结晶为固体,此线以下为固 线 为固相线,液体合金冷却至此线全部结晶为固体, 相区。 相区。 线 (5)ES线 又称 ) 线 又称Acm线,是碳在奥氏体中的溶解度曲线。即:L→Fe3CⅡ。 碳在奥氏体中的溶解度曲线。 (6)GS线 又称 3线, ) 线 又称A (7)GP线 奥氏体向铁素体转变的终了线。 ) 线 奥氏体向铁素体转变的终了线。 又称A (8)PSK线 共析线(727℃),又称 1线。 ) 线 共析线( ℃),又称 (9)PQ线 碳在铁素体中的溶解度曲线。 ) 线 碳在铁素体中的溶解度曲线。
熔点: 熔点:纯铁的熔点 共晶点: 共晶点:L4.3—→Ld(A2.11%+Fe3C共晶) 熔点: 熔点:渗碳体的熔点 碳在γ-Fe中的最大溶解度点 中的最大溶解度点 碳在 同素异构转变点 共析点: 共析点:A0.77%—→p(F0.0218%+Fe3C共析) 碳在α-Fe中的最大溶解度点 中的最大溶解度点 碳在 室温下碳在α-Fe中的溶解度 中的溶解度 室温下碳在
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2) TCP相 TCP相(topologically close-packed phase)的特点: ①由配位数为12、14、15、16的配位多面体堆垛而成;②呈层状 结构。
TCP相类型:①Lavs相 AB2型 镁合金、不锈钢中出现
②σ相 AB型或AxBx型 有害相
b.间隙化合物 间隙化合物的晶体结构比较复杂。其表达式有如下类型: M3C、M7C3、M23C6、M6C。间隙化合物中金属元素M常被其 它金属元素所代替形成化合物为基的固溶体(二次固溶体)。
在H、N、C、B等非金属元素中,由于H和N的原子半径很小,与所 有过渡族金属都满足rX/rM<0.59,所以过渡族金属的氢化物、氮化物 都为间隙相;而硼原子半径rB/rM>0.59较大, rB/rM>0.59,硼化物 均为间隙化合物;而碳原子半径处于中间,某些碳化物为间隙相,某些 为间隙化合物。
4.超结构—有序固溶体
超结构(super structure/lattice)类型: 有序化条件:异类原子之间的相互吸引大于同类原 子间 有序化影响因素:温度、冷却速度和合金成分
5.金属间化合物的性质及应用(P56) (1)——(7)
CuAu有序固溶体的晶体结构
2.4 离子晶体
离子晶体有关概念 1.离子晶体(ionic crystal) :由正、负离子通过离子键按
相分类:固溶体和中间相(金属间化合物)
固溶体——
中间相——
中间相可以用分子式来大致表示其组成。
合金相的性质由以下三个因素控制:
(1)电化学因素(电负性或化学亲和力因素)
电负性——
(2)原子尺寸因素 △r=(rA-rB)/rA 中间相。 △r越小,越易形成固溶体
△r越大,越易形成
(3)原子价因素(电子浓度因素):
棱和共面。同一类硅酸盐中, 一种。
[SiO4]4-四面体连接方式只有
(4)[SiO4]4-中Si-O-Si结合键不是一条直线,呈145º夹角。
四面体中硅与氧原子位置
硅酸盐的分类
5.固溶体的性质
固溶体中由于含有溶质原子会引起点阵常数、 性能的变化。表现: (1)点阵常数改变
置换固溶体:r质>r剂,a增大;r质<r剂,a减小。 间隙固溶体:a始终随溶质原子溶入而增大。 (2)固溶强化:溶质原子溶入,使其硬度和强度升高。 (3)物理化学性能改变。
2.3.2 中间相
➢ 中间相是合金组元间发生相互作用而形成的一种新相,它 可以是化合物,也可以是以化合物为基的固溶体(二次固溶 体),一般可以用化学分子式来表示,但不一定符合化合价规 律。
间隙固溶体示意图1
间隙固溶体示意图2
间隙固溶体中的点阵畸变
4.固溶体的微观不均匀性
固溶体中溶质原子的分布并不是完全无序的。 一般认为热力学上平衡状态的无序固溶体溶质原 子分布在宏观上是均匀的,在微观上是不均匀的。
在一定条件下,溶质原子和溶剂原子在整个晶体 中按一定的顺序排列起来,形成有序固溶体。有 序固溶体中溶质原子和溶剂原子之比是固定的, 可以用化学分子式来表示,因此把有序固溶体结 构称为超点阵。例如:在Cu-Al合金中,Cu:Al 原子比是1:1或3:1时从液态缓冷条件下可形 成有序的超点阵结构,用CuAl或Cu3Al来表示。
按其自身大小居于相应负离子空隙(负离子配位多面体)。
4.配位数CN(coordination number) :与某一离子邻 接的异号离子的数目。取决于正负离子的半径比R+/R—, 常见的是4、6、8, 不同配位数时,离子半径间关系为:
0.97 γCN=8≈γCN=6≈1.1γCN=4 5.负离子配位多面体:离子晶体中与某一正离子成配位
第二章 固体结构(Solid Structure)
2.3 合金相结构
重点掌握: 1.合金、相、组织、固溶体、中间相(金属间化合物)的概念 2.固溶体、中间相的分类、特点和用途
一般了解 1. 离子、共价和聚合物的晶态结构及相对应的性能特点
概述
1. 合金(alloy)----两种或两种以上的金属或金属与非金属 经冶炼、烧结或其他方法组合而成并具有金属特性的物质。 组元----组成合金的基本单元。组元可以是金属和非金属, 也可以是化合物 2. 组织(structure)----材料中的直观形貌,可以用肉眼观 察到,也可以借助于放大镜、显微镜观察到的微观形貌。 分为: 宏观组织:肉眼或是30倍放大镜所呈现的形貌;显微 组织:显微镜观察而呈现的形貌。 3. 相(phase)----合金中具有同一聚集状态,同一化学成分、 同一晶体结构和性质并以界面相互隔开的均匀组成部分。
关系而邻接的各负离子中心线所构成的多面体。
6.离子晶体的特点:离子键、硬度高、强度大、熔点高、 等。典型的离子晶体是无色透明的。
2.4.1 离子晶体的结构规则—鲍林规则
1. 负离子配位多面体规则 这一规则符合最小内 能原理
2. 电价规则 3. 负离子多面体共用顶、棱、面的规则 共用点、
棱、面,会降低结构稳定性 4. 不同种类正离子多面体间连接规则 电价高、配
C电子=[A(100-x) +Bx]/100 C越大,越易形成 化合物; C越小,越易形成固溶体
2.3.1 固溶体
固溶体(solid solution) : 固溶体的最大特点是保持溶剂的晶体结构。
1. 固溶体分类
(1)按溶质原子在点阵中所占位置分为: 置换固溶体(substitutional solid solution):溶质原子 置换了溶剂点阵中部分溶剂原子。 间隙固溶体(interstitial solid solution) :溶质原子分布 于溶剂晶格间隙中。
电子浓度 = (化合物元素价电子总数 / 化合物原子数)
注:计算时过渡族元素时价电子数视为0。
电子浓度、相、结构对应关系如下:
C电子==7/4(即21/12) ε 密排六方结构
C电子==21/13
γ 复杂立方结构
C电子==3/2(即21/14) β 体心立方结构
β-Mn 复杂立方或密排六方结构
电子价化合物具有金属特性,具有高熔点、高硬度但塑性 低,与固溶体适当搭配使合金得到强化,作为非Fe合金中重 要组成相。
有序固溶体:溶质原子按一定比例和有规 律分布在溶剂晶格的点阵或间隙里。
(4)按基体类型分类:
一次固溶体:以纯金属为基形成的固溶体。
二次溶体:以化合物为基形成的固溶体。
固溶体的两种类型(置换和间隙)
有序固溶体-短程
有序固溶体-长程
有序固溶体-偏聚
2. 置换固溶体
置换固溶体一般在金属元素之间形成,但要有一定条件。 (1)晶体结构相同是形成无限固溶体的必要条件。否则只 能形成有限固溶体。 (2) 原 子 尺 寸 在 其 它 条 件 相 近 时 ,△r<15% 或 r 质 /r 剂 >0.85固溶体中溶解度较大,否则较小。 如:铁基合金中,△r<8%才能形成无限固溶体。 铜基合金中,△r<10%才能形成无限固溶体。 (3)电负差越大,两者间亲和力大,易形成中间相。否则易形 成固溶体。 (4)电子浓度值大易形成化合物;电子浓度小易形成固溶 体。
硅酸盐晶体的结构特点:
(1)构成的基本结构单元是由Si和O组成的[SiO4]4-四面体。
(2)每个O最多只能为两个[SiO4]4-四面体所
(3)立连[S地接iO在成4]结单四构链面中、体存中双在未链饱,或和也成的可层O以状和通、金过网属[状S正i等O离4复]子4杂-共结结用合构四后,但面,不体可能顶以独点共
位数低的正离子配位多面体之间有尽量互不结合 的趋势. 5. 节约规则 同种正离子和同种负离子的结合方式 应最大限度地趋于一致.
2.4.2 典型的离子晶体
1. AB型 (1) CsCl型 (2) NaCl型 (3) 立方ZnS(闪锌矿)型: (4) 六方ZnS(纤锌矿)型:
2. AB2型(1) CaF2(萤石型) (2) TiO2(金红石)型 (3)β-SiO2(方晶石.方石英)型
➢ 中间相中原子的结合方式为金属键与其它结合键相混合的 方式。它们都具有金属特性。
➢ 中间相如:钢中Fe3C、铝铜合金中CuAl、黄铜中CuZn、 半导体中GaAs、形状记忆合金中NiTi和CuZn、核反应堆 材料中Zr3Al、储氢能源材料中LaNi5等。
➢ 中间相分类:正常价化合物、电子化合物、原子尺寸有关 化的化合物(间隙相、间隙化合物、TCP相)、超结构。
3. A2B3型 α- Al2O3 4. ABO3型(1) CaTiO3(钙钛矿、灰钛矿)型
(2) CaCO3(方解石)型、三方晶系 5. AB2O4型 尖晶石(MgAl2O4)
CsCl型结构
NaCl型结构
CaF2型结构
2.4.3 硅酸盐的晶体结构
硅酸盐的结构组成:硅氧骨干一硅和氧按不同比例组 成的负离子团、硅氧骨干以外的正离子和负离子。
1.正常价化合物
正常价化合物(valence compound)是一些金属与 电负性较强的ⅥA、ⅤA、ⅣA族的一些元素按照化学上 的原子价规律所形成的化合物。其特点是符合化合物规 律。具有严格的化合比、成分固定不变,成分可用化学 式表示,一般为AB型、AB2型或A2B型、A3B2型。
正常价化合物的晶体结构通常对应于同类分子式的离子 化合物结构。例如:A2B型 Mg2Pb Mg2Sn Mg2Ge Mg2Si AB型 MgS MnS FeS
a、间隙相 间隙相的晶格类型比较简单且与组元的结构不同。在间隙相 晶格中金属原子占据正常位置,非金属原子占据间隙位置,有如下规律: rX/rM<0.414时进入四面体间隙 rX/rM>0.414时进入八面体间隙 化学式:M4X M2X MX MX2。间隙相的化学式与晶格类型有 一定的对应关系。表2.11. 间隙相具有金属特性如有金属光泽、良好的导电性、极高的硬度和 熔点,是合金工具钢、硬质合金和高温金属陶瓷材料的重要组成相。
