沉淀的生成和溶解
沉淀的溶解和生成

难溶电解质的溶解平衡也是动态平衡,同 样可以通过改变条件使平衡移动-----溶液中的离 子转化为沉淀,或沉淀转化为溶液中的离子。
1.Байду номын сангаасaCl(MgCl2) 2.MgCl2(Fe3+) 沉淀的生成的方法:调pH、加沉淀剂、
同离子效应
沉淀溶解的方法:酸溶、碱溶、盐溶
1.在10mL 1×10-5mol·L-1KCl溶液中,加入l0mL2×10-5 mol·L-1 AgNO3溶液,是否有AgCl沉淀析出(AgCl的 Ksp=1×10-10)?
二、Q c 、Ksp相关计算
1.在10mL 1×10-5mol·L-1KCl溶液中,加入 l0mL2×10-5 mol·L-1 AgNO3溶液,是否有AgCl沉淀 析出(AgCl的Ksp=1×10-10)?
2.已知CaCO3的Ksp=2.8×10-9,现将浓度为 2×10-4 mol·L-1的Na2CO3溶液与CaCl2溶液等体积 混合,若要产生沉淀,则所用CaCl2溶液的浓度至少 应为? 注:体积变化
1.如果要除去某溶液中的SO42-,你选择加入钙盐 还是钡盐?为什么?
2.总结沉淀剂的选择有什么要求?
3.规范叙述:①CaCO3难溶于H2SO4却易溶于 CH3COOH的原因。 ②BaSO4难溶于H2SO4的原因。 4.在10mL 1×10-5mol·L-1KCl溶液中,加入 l0mL2×10-5 mol·L-1 AgNO3溶液,是否有AgCl 沉淀析出(AgCl的Ksp=1×10-10)?
三、沉淀的溶解
①加强酸。如可溶解难溶氢氧化物,难溶碳酸盐、某些 难溶硫化物等。
FeS中加盐酸 FeS+2H+===Fe2++H2S↑ ②加碱法。除去Al(OH)3 ③某些盐溶液也可用来溶解沉淀。
沉淀生成和溶解原理

沉淀生成和溶解原理
沉淀生成和溶解原理是指在化学反应中,溶液中存在的物质能够发生沉淀生成或溶解的过程。
沉淀生成是指溶液中的溶质与溶剂反应后形成固体沉淀的过程,而溶解则是指固体沉淀在溶液中发生溶解的过程。
沉淀生成的原理主要是由于反应过程中产生的物质在溶剂中的溶解度较低,使其过饱和而发生沉淀。
在化学反应中,当反应物相互作用而生成固体产物时,由于固体产物在溶剂中的溶解度有限,会超过其溶解度而发生沉淀。
沉淀生成的驱动力是溶液中各种相互作用力的变化,包括温度、浓度、pH值等。
溶解的原理与沉淀生成相反,是指固体物质在溶剂中发生溶解的过程。
当溶液中存在的物质与其溶剂间存在相互作用力时,固体物质会分散到溶液中,形成均匀分布的溶液。
溶解的驱动力主要是溶剂与溶质之间的相互作用力,包括溶剂能力、溶质的分子结构等。
总的来说,沉淀生成和溶解的原理取决于物质在溶液中的相互作用力,当溶质溶解度较低时会发生沉淀生成,而当溶质溶解度较高时则会发生溶解。
这种相互转化的过程在化学反应、溶液制备以及分离纯化等各种化学领域中都有广泛的应用。
化学反应中的溶解和沉淀知识点总结

化学反应中的溶解和沉淀知识点总结化学反应是物质之间发生变化的过程,其中涉及到溶解和沉淀两种常见的现象。
溶解是指溶质与溶剂相互作用使溶质分子或离子被溶解在溶剂中,而沉淀则是在反应中形成不溶于溶液的固体物质。
本文将对化学反应中的溶解和沉淀进行知识点总结。
一、溶解溶解是指溶质与溶剂之间发生相互作用,使溶质分散在溶剂中形成均匀的溶液。
溶解通常涉及到溶解度、饱和溶解度和离子溶解等概念。
1. 溶解度:指单位溶剂中能够溶解的溶质的最大量。
溶解度与温度和压力有关,通常用克/100克溶剂、摩尔/升或其他单位表示。
2. 饱和溶解度:指在给定条件下,溶剂中已经溶解的溶质量达到最大值的状态。
此时的溶液称为饱和溶液。
饱和溶液的溶解度取决于温度,温度升高通常会使溶解度增大。
3. 离子溶解:离子溶解是指当离子化合物溶解在水中时,其离子会与水分子进行相互作用形成水合离子。
例如,氯化钠(NaCl)溶解时,成为钠离子(Na+)和氯离子(Cl-)的水合离子。
二、沉淀沉淀是指在化学反应中形成不溶于溶液的固体物质。
沉淀通常与溶解度、溶液浓度等因素有关,以下是一些与沉淀相关的知识点。
1. 沉淀反应:沉淀反应是指在化学反应中生成沉淀的反应。
通常涉及到两种反应物溶液混合后产生的固体产物,这些固体产物会沉淀到溶液底部形成沉淀物。
2. 溶解度积:溶解度积是指在饱和溶液中,离子化合物的离子浓度之间的乘积。
对于一般的溶解度积反应,当离子浓度乘积大于溶解度积时,产生沉淀。
3. 沉淀规律:对于一些沉淀物,其生成的条件往往与溶解度有关。
例如,当溶液中的离子浓度超过其溶解度时,就会生成沉淀。
此外,一些其他因素如温度变化、溶液酸碱性等也会影响沉淀的生成。
三、应用实例溶解和沉淀在化学中有着广泛的应用,以下是一些常见的应用实例。
1. 盐类结晶:通过溶解离子化合物,在适当条件下使其溶解度超过饱和溶解度,然后进行结晶操作,从而得到纯净的盐类物质。
2. 沉淀析出:在一些化学反应中,通过反应生成的沉淀物可以用作分离、纯化和分析物质的工具。
沉淀的形成与溶解
§3 影响沉淀纯度的主要因素
(2) 混晶:
产生原因:如果溶液中杂质离子与沉淀构晶离子的半径相近, 晶体结构相似,杂质会进入晶格排列形成混晶共沉淀。
例如, BaSO 4与PbSO 4,AgCl与AgBr ,MgNH 4PO 4?6H2O 与MgNH 4AsO4?6H2O等都可形成混晶共沉淀。
§3 影响沉淀纯度的主要因素
2.后沉淀
当沉淀从溶液中析出后,与母液一起放置一段时间后,溶 液中某些杂质离子可能沉淀到原沉淀上面,这一现象称为后沉 淀。这类现象大多发生在该沉淀形成的稳定的过饱和溶液中。
例如,在Mg2+存在下沉淀CaC 2O4时,CaC 2O4沉淀析出时 并没有发现MgC 2O4沉淀析出。如果将草酸钙沉淀在含镁的母 液中长时间放置,则会有较多的草酸镁在草酸钙的表面上析出。
例如:在0.01mol/LZn 2+的0.15mol/LHCl 溶液中通H2S,放 置一个月也无ZnS 沉淀析出。但当在上述溶液中加入Cu 2+,最 初得到的CuS 沉淀中夹杂的ZnS 沉淀并不显著,但放置一段 时间,便不断有ZnS沉淀在CuS 沉淀表面析出。如何解释此 现象?
消除措施:避免和减少后沉淀的主要方法是 缩短沉淀在母液中的放置时间。
§2 沉淀的形成过程
2、哈伯理论 聚集速度
在沉淀的形成过程中,晶核逐渐长大成沉淀微粒, 这些微粒可以聚集成更大的聚集体。这种聚集过程的 快慢称为聚集速度。
定向速度 在发生聚集过程的同时,构晶离子按一定的晶格 排列而形成晶体,这种定向排列过程进行的快慢称为 定向速度。
§2 沉淀的形成过程
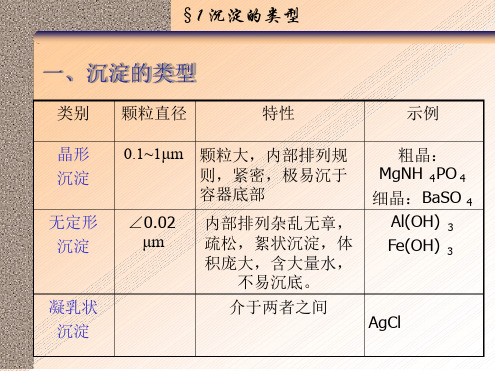
如何解释生成各种类型? 晶型取决于 聚集速度 与定向速度 的大小。 聚集速度大于定向速度 → 无定形沉淀 聚集速度小于定向速度 → 晶形 沉淀 例如:氢氧化物( n≧3) →无定形沉淀
离子反应中沉淀生成与溶解的平衡关系

离子反应中沉淀生成与溶解的平衡关系离子反应是化学反应中常见的一种类型,其中涉及到溶液中的离子之间的反应。
在一些反应中,会产生沉淀物,这是由于反应生成的产物在溶液中不溶而形成的。
然而,溶液中的沉淀物并不是永久存在的,它们也会发生溶解的过程。
沉淀生成与溶解之间存在着一种平衡关系,这种平衡关系可以通过一些因素来调节。
首先,沉淀生成与溶解的平衡与反应物的浓度有关。
根据化学反应的平衡定律,当反应物浓度增加时,反应向生成物的方向进行。
因此,在离子反应中,当反应物的浓度增加时,沉淀生成的速率会增加。
这是因为更多的反应物分子碰撞在一起,形成更多的产物。
然而,当反应物浓度过高时,溶解的速率也会增加。
这是由于溶液中的离子浓度增加,使得溶解的速率超过了生成的速率。
因此,反应物的浓度可以调节沉淀生成与溶解之间的平衡。
其次,溶液的温度也会影响沉淀生成与溶解的平衡。
一般来说,随着温度的升高,沉淀生成的速率会增加,而溶解的速率会减少。
这是由于温度的升高会增加溶质分子的动能,使其更容易与溶剂分子碰撞并形成沉淀。
同时,温度的升高也会减少溶质分子与溶剂分子之间的相互作用力,从而减少溶解的速率。
因此,通过调节溶液的温度,可以改变沉淀生成与溶解之间的平衡关系。
此外,pH值也是影响沉淀生成与溶解平衡的重要因素。
pH值是溶液中氢离子浓度的负对数,它可以影响溶液中的离子的浓度。
在一些离子反应中,沉淀的生成与溶解与pH值有关。
例如,在金属离子与碱溶液反应生成金属氢氧化物沉淀时,pH值的变化可以影响沉淀的生成与溶解。
当溶液的pH值较高时,溶液中的氢离子浓度较低,使得金属氢氧化物的生成速率较低。
相反,当溶液的pH值较低时,氢离子浓度较高,使得金属氢氧化物的生成速率较高。
因此,通过调节溶液的pH 值,可以调节沉淀生成与溶解之间的平衡。
总之,离子反应中沉淀生成与溶解的平衡关系是一个复杂而重要的问题。
通过调节反应物浓度、溶液的温度和pH值,可以改变沉淀生成与溶解之间的平衡。
溶液的沉淀反应和溶解反应

溶液的沉淀反应和溶解反应一、引言在化学中,溶液是一种将溶质溶解在溶剂中形成的混合物。
溶液可以发生多种反应,其中包括溶液的沉淀反应和溶解反应。
本文将对这两种反应进行详细探讨,并分析它们在化学实验和工业中的应用。
二、沉淀反应1. 沉淀反应的定义沉淀反应是指当两种溶液混合时,溶液中某些离子会以无法形成溶解物的形态,在溶液中生成可见的固体颗粒沉淀的过程。
这种沉淀物通常是一种离子间的化合物。
2. 沉淀反应的实验现象在进行沉淀反应实验时,可以添加试剂A和试剂B的混合物。
当两者混合后,如果形成 visible solid particles,即可认为发生了沉淀反应。
例如,当添加氯化钠溶液到硝酸银溶液中时,会产生可见的白色氯化银沉淀。
3. 沉淀反应的化学方程式沉淀反应的化学方程式需要根据反应过程中产生的离子进行推导。
以下是一些常见的沉淀反应方程式示例:- AgNO3(硝酸银)+ NaCl(氯化钠)→ AgCl(氯化银)↓ + NaNO3(硝酸钠)- Pb(NO3)2(硝酸铅)+ 2KI(碘化钾)→ PbI2(碘化铅)↓ +2KNO3(硝酸钾)4. 沉淀反应的应用沉淀反应在日常生活和实验室中具有广泛的应用。
例如,在水处理过程中,通过沉淀反应可以去除水中的污染物。
实验室中常用沉淀反应来检测物质的存在和浓度,或者用于分离和纯化化合物。
三、溶解反应1. 溶解反应的定义溶解反应是指将固体物质通过与溶剂的相互作用转变为离子或分子,从而形成溶液的过程。
在溶解反应中,固体被溶解于溶液中而不产生新的物质。
2. 溶解反应的实验现象溶解反应的实验现象通常是固体物质完全消失,转变为液体或气体状态,并与溶剂形成均匀的混合物。
例如,将食盐颗粒加入水中,食盐颗粒会逐渐消失,形成透明的盐水。
3. 溶解反应的化学方程式溶解反应的化学方程式通常以离子或分子的形式表示。
以下是一些常见的溶解反应方程式示例:- NaCl(氯化钠)→ Na+(钠离子)+ Cl-(氯离子)- H2O(水)→ H+(氢离子)+ OH-(氢氧根离子)4. 溶解反应的应用溶解反应在日常生活和工业中起着重要作用。
沉淀的生成实验报告

沉淀的生成实验报告沉淀的生成实验报告引言:在日常生活中,我们经常会遇到一些溶液中出现沉淀的现象。
沉淀是指溶液中的某种物质由于化学反应或物理因素的作用而从溶液中析出形成的固体颗粒。
本次实验旨在探究沉淀生成的原理与条件,并分析其对环境和人体的影响。
一、实验原理1. 溶解度:溶解度是指单位溶剂中在一定温度下可以溶解的溶质的最大量。
当溶质的浓度超过其溶解度时,会发生沉淀现象。
2. 化学反应:化学反应中的生成物可能会由于溶解度的变化而形成沉淀。
例如,两种溶液中的阳离子和阴离子结合生成的盐类,当溶液中的阳离子和阴离子的浓度达到一定程度时,会形成沉淀。
二、实验步骤1. 准备试剂:准备两种溶液,分别为A溶液和B溶液。
A溶液中含有阳离子和阴离子,B溶液中含有与A溶液中的阳离子和阴离子可以反应的物质。
2. 将A溶液慢慢滴加到B溶液中,同时观察溶液的变化。
记录滴加的过程和观察到的沉淀形成情况。
三、实验结果与讨论在实验过程中,我们发现当A溶液滴加到B溶液中时,溶液的颜色会发生变化,同时会观察到沉淀的生成。
根据实验结果,我们可以得出以下结论:1. 沉淀的生成与溶液中阳离子和阴离子的浓度有关。
当阳离子和阴离子的浓度达到一定程度时,会超过其溶解度,从而形成沉淀。
2. 沉淀的生成还与化学反应有关。
当溶液中的阳离子和阴离子可以发生反应时,生成物的溶解度可能会发生变化,从而导致沉淀的生成。
四、沉淀对环境和人体的影响1. 环境影响:沉淀的生成可能会导致水体中的污染。
一些金属离子的沉淀物可能会对水生生物造成毒性影响,破坏生态平衡。
2. 人体影响:一些沉淀物可能会对人体健康产生负面影响。
例如,重金属离子的沉淀物可能会引起中毒,对人体的神经系统和内脏器官造成损害。
结论:通过本次实验,我们深入了解了沉淀的生成原理与条件,并分析了其对环境和人体的影响。
进一步研究沉淀的生成机制,可以帮助我们更好地理解溶液中的化学反应过程,为环境保护和人体健康提供科学依据。
沉淀生成和溶解的条件

沉淀生成和溶解的条件沉淀生成和溶解是化学反应中常见的现象,涉及到物质的相互转化。
本文将从化学反应条件的角度对沉淀生成和溶解进行探讨。
一、沉淀生成的条件1. 反应物浓度:沉淀生成的条件之一是反应物浓度的变化。
当溶液中的反应物浓度超过溶解度时,就会发生沉淀生成。
反之,如果溶解度高于反应物浓度,则不会形成沉淀。
2. 温度:温度也是影响沉淀生成的重要因素。
一般来说,温度升高会促使沉淀生成反应进行得更快。
这是因为温度升高会增加反应物的活动性,使反应物之间的碰撞频率增加,从而加速反应速率。
3. pH值:pH值是指溶液的酸碱性程度,也会影响沉淀生成的过程。
不同的物质在不同的pH值下具有不同的溶解度。
当溶液的pH值发生变化时,可能会导致物质的溶解度发生改变,进而影响沉淀生成的过程。
4. 反应时间:反应时间是指反应物发生化学反应所需要的时间。
有些沉淀生成反应是需要一定时间的,而有些反应则可以迅速生成沉淀。
反应时间的长短取决于反应物的性质以及反应条件。
二、溶解的条件1. 温度:与沉淀生成类似,溶解也受到温度的影响。
一般来说,溶解度随温度的升高而增加。
这是因为温度升高会增加溶质分子的平均动能,使其更容易克服吸引力而脱离溶剂分子,从而增加溶解度。
2. 压力:压力对溶解度的影响相对较小,但在某些情况下也是重要的。
例如,气体溶解在液体中时,压力的增加会使溶解度增加。
这是因为增加压力会增加气体分子与液体分子之间的碰撞频率,从而促进溶解过程。
3. 溶剂性质:溶解的条件还与溶剂的性质有关。
不同的溶剂对溶质的溶解度有不同的影响。
溶剂的极性、溶剂与溶质之间的相互作用力等因素都会影响溶解度。
4. 溶质的性质:溶质的性质也是影响溶解度的重要因素。
溶质的极性、分子大小、电荷等特性都会对溶解度产生影响。
溶质分子越小、极性越大,溶解度通常会越高。
沉淀生成和溶解是化学反应中常见的现象。
沉淀生成的条件包括反应物浓度、温度、pH值和反应时间;溶解的条件包括温度、压力、溶剂性质和溶质性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新知初探自主学习(前
业)3.沉淀的生成
(1)应用:在涉及无机制备、提纯工艺的生产、科研、废水处理等领域中,常利用生成沉淀来达到分离或除去某些离子的目的。
(2)方法
①调节pH法:例如除去氯化铵中的杂质氯化铁,可加入氨水调节pH至7~8,使Fe3+生成Fe(OH)3沉淀而除去,反应的离子方程式:。
②加沉淀剂法:例如以Na2S等作沉淀剂,使Cu2+、Hg2+生成极难溶的硫化物CuS、HgS沉淀,反应的离子方程式:Cu2++S2-CuS↓、Hg2++S2-HgS↓。
4.沉淀的溶解
(1)原理:根据平衡移动原理,对于在水中难溶的电解质,只要不断移去溶解平衡体系中的相应离子,平衡就向沉淀溶解的方向移动,就可以使沉淀溶解。
实验现象
实验结论
沉淀
不溶解 Mg(OH)2不溶于水,能溶于
盐酸,也能溶于NH 4Cl 溶液
沉淀
溶解
沉淀
溶
解 沉淀溶解的方法:
1.加入足量的水
2.使沉淀转化为气体
3.使沉淀转化为弱电解质 4
氧
化
还
原
法
适用于具有明显氧化性或还原性的难溶物
5.使沉淀转化为配合物 AgCl
Ag
+
+Cl -
(AgCl 加氨水生成银氨离子可溶) 6.使沉淀转化为其他沉淀
淀的溶解就要从沉淀向溶解方向移动考虑。
【提问】:结合以前的知识,如果想溶解碳酸钙,可以用什么方法?为什么?
【拓展】:阅读课本67页第二部分后分析:
溶解
在CaCO3(s) Ca2+(aq)+CO32—(aq),当加入盐酸
沉淀
时发生CO32—+2H+H2O+CO2↑
c(CO32—)减小,上述平衡向溶解方向移动,CaCO3便逐渐溶解。
