第四章 第一节 原电池
合集下载
选修四-第四章第一节-原电池

(-) G (+)
Zn
Pt
G
(-)
Zn
盐桥
(+)
C
FeCl3 溶液
ZnCl2溶液
FeCl3溶液
负极(Zn):Zn-2e-=Zn2+(氧化反应)
正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
请将氧化还原反应 Cu+2Ag+ = Cu2++2Ag
设计成一个能产生持续、稳定电流的原电池装 置。
发生的电极反应为__A_g_+_+__e_-__=__A_g____
X电极上发生的电极反应为
___C__u_-_2_e_-__=_C__u_2+_____________;
(3)外电路中的电子是从_负__(C__u_)_电极流向
_正__(_A__g_) _电极。
强调:原电池的设计
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设 计一个单液原电池,一个双液原电池(使用盐 桥),画出原电池的示意图,并写出电极反应。
二、原电池的发展 1. 单液单池原电池 单液单池的缺点:
A
Zn
Cu
1.效率不高(有热量损失) 2.电流不稳定(短时间内衰减)
CuSO4
3.外电路断开仍在反应。
问题在哪儿? 如何改进?
Zn与CuSO4接触 使Zn与CuSO4分开
二、原电池的发展
2.双液双池原电池
盐桥:装有饱和KCl溶液和琼 脂制成的胶冻(胶冻的作用 是防止管中溶液流出)
I:向B杯内逐滴加入浓盐酸,发现微安表指针偏转;
II: 若改向B烧杯中滴加40%NaOH溶液,发现微安表
指针与(I)实验的反向偏转。
人教化学选修4第四章第一节 原 电 池(共19张PPT)

离子方程式Cu+ 2 Fe3+ = Cu2+ + 2Fe2+
思考讨论:利用该反应设计原电池
化合价升高失2e-
Cu+ 2 AgNO3 = Cu(NO3)2 + 2Ag
化合价降低得2e-
电极反应式:
负极:Cu – 2e- = Cu2+ 正极:2Ag+ + 2e- = 2 Ag
电极:负极是Cu,正极可以是Ag或C等。
根据电子流动方向或电流方向或电解质溶液内离子的定向移动方向判断负极电子流出极电流流入极或阴离子定向移向极正极电子流入极电流流出极或阳离子定向移向极3
第四章 电化学基础
第一节 原 电 池
一、原电池的工作原理 1.构成条件 (1)具有两个 活泼性 不同的电极。 (2)合适的 电解质 溶液。 (3)形成 闭合 回路(外电路用导线相连或互相接触并 将两电极插入电解质溶液中)。 (4)能自发地发生 氧化还原 反应。
负极——电子流出极,电流流入极或阴离子定向 移向极
正极——电子流入极,电流流出极或阳离子定向 移向极
3.根据两极发生的变化判断
负极——失去电子,化合价升高,发生氧化反应 正极——得到电子,化合价降低,发生还原反应
4.根据反应现象判断 负极——会逐渐溶解,质量减小 正极——有气泡逸出或质量增加
♨特别提示:原电池正负极判断的基础是氧化 还原反应。如果给出一个方程式让判断正、负极,可 以直接根据化合价的升降变化来判断,发生氧化反应 的一极为负极,发生还原反应的一极为正极。
电解液: AgNO3 或者: Cu(NO3)2 、AgNO3
总结
❖ 1、复习回忆了原电池的形成。 ❖ 2、进一步了解原电池的反应原理,
思考讨论:利用该反应设计原电池
化合价升高失2e-
Cu+ 2 AgNO3 = Cu(NO3)2 + 2Ag
化合价降低得2e-
电极反应式:
负极:Cu – 2e- = Cu2+ 正极:2Ag+ + 2e- = 2 Ag
电极:负极是Cu,正极可以是Ag或C等。
根据电子流动方向或电流方向或电解质溶液内离子的定向移动方向判断负极电子流出极电流流入极或阴离子定向移向极正极电子流入极电流流出极或阳离子定向移向极3
第四章 电化学基础
第一节 原 电 池
一、原电池的工作原理 1.构成条件 (1)具有两个 活泼性 不同的电极。 (2)合适的 电解质 溶液。 (3)形成 闭合 回路(外电路用导线相连或互相接触并 将两电极插入电解质溶液中)。 (4)能自发地发生 氧化还原 反应。
负极——电子流出极,电流流入极或阴离子定向 移向极
正极——电子流入极,电流流出极或阳离子定向 移向极
3.根据两极发生的变化判断
负极——失去电子,化合价升高,发生氧化反应 正极——得到电子,化合价降低,发生还原反应
4.根据反应现象判断 负极——会逐渐溶解,质量减小 正极——有气泡逸出或质量增加
♨特别提示:原电池正负极判断的基础是氧化 还原反应。如果给出一个方程式让判断正、负极,可 以直接根据化合价的升降变化来判断,发生氧化反应 的一极为负极,发生还原反应的一极为正极。
电解液: AgNO3 或者: Cu(NO3)2 、AgNO3
总结
❖ 1、复习回忆了原电池的形成。 ❖ 2、进一步了解原电池的反应原理,
人教版 高中化学(选修四) 第四章 第一节《原电池》 (共25张PPT)
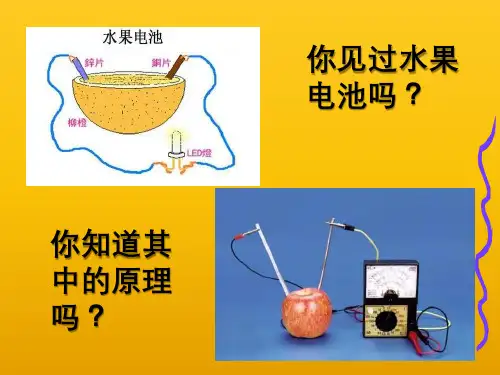
⑵、 将Cu片插入H2SO4溶 液中有什么现象?为什么?
⑶、将一Zn片,Cu片平行插入 稀象H?2为SO什4溶么液?中,有什么现
(4)、若将Zn片,Cu片用一 导线连接,导线间接一电流 计,再浸在稀H2SO4溶液中, 有什么现象?为什么?
原 电 池 的 工 作 原 理
定向移动方向:电子、离子
原电池
盐电池
反应:
Cu2++Zn=Zn2++Cu
根据检流计指针偏转方向 知电流方向: Cu→Zn
盐桥:在U型管中装 满用饱和KCl溶液 和琼胶作成的冻 胶。
盐桥的作用:
使Cl-向锌盐方向移动, K+向铜盐方向移动,使 Zn盐和Cu盐溶液一直保 持电中性,从而使电子 不断从Zn极流向Cu极。
正、负两极分别发 生的反应,称为电 极反应。
小心的向烧杯中央滴入CuSO4溶液,片刻后
可观察到的现象是
A. 铁圈和银圈左右摇
(D )
摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
4、我国发射的神州五号载人飞 船是采用先进的甲烷电池为电能 的,该电池以KOH溶液为电解 质,其总反应的化学方程式为: CH4+2O2+2OH-=CO32-+3H2O
正极(铜电极): Cu2+ + 2e- = Cu 负极(锌电极): Zn = Zn2+ + 2e-
Cu2++Zn=Zn2++Cu
2、原电池形成的条件: 1.两个活泼性不同的电极
2. 电解质溶液 3.能自发地发生氧化还原反应 4.形成闭合回路
3、电极判断:
负极:电子流出的一极,发生氧化反应
⑶、将一Zn片,Cu片平行插入 稀象H?2为SO什4溶么液?中,有什么现
(4)、若将Zn片,Cu片用一 导线连接,导线间接一电流 计,再浸在稀H2SO4溶液中, 有什么现象?为什么?
原 电 池 的 工 作 原 理
定向移动方向:电子、离子
原电池
盐电池
反应:
Cu2++Zn=Zn2++Cu
根据检流计指针偏转方向 知电流方向: Cu→Zn
盐桥:在U型管中装 满用饱和KCl溶液 和琼胶作成的冻 胶。
盐桥的作用:
使Cl-向锌盐方向移动, K+向铜盐方向移动,使 Zn盐和Cu盐溶液一直保 持电中性,从而使电子 不断从Zn极流向Cu极。
正、负两极分别发 生的反应,称为电 极反应。
小心的向烧杯中央滴入CuSO4溶液,片刻后
可观察到的现象是
A. 铁圈和银圈左右摇
(D )
摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
4、我国发射的神州五号载人飞 船是采用先进的甲烷电池为电能 的,该电池以KOH溶液为电解 质,其总反应的化学方程式为: CH4+2O2+2OH-=CO32-+3H2O
正极(铜电极): Cu2+ + 2e- = Cu 负极(锌电极): Zn = Zn2+ + 2e-
Cu2++Zn=Zn2++Cu
2、原电池形成的条件: 1.两个活泼性不同的电极
2. 电解质溶液 3.能自发地发生氧化还原反应 4.形成闭合回路
3、电极判断:
负极:电子流出的一极,发生氧化反应
第四章第一节 原电池全套PPT

将化学能转变为电能的装置。 导线的作用是传递电子,沟通外电路。 该原电池反应原理?电极反应式和总方程式.
Fe Cu+ 2 AgNO3 = Cu(NO3)2 + 2Ag
该原电池反应原理?电极反应式和总方程式. (Cu+ 2 FeCl3 = CuCl2+ 2FeCl2) CuSO4 思考讨论:利用该反应设计原电池 CuSO4 溶液 电解液: AgNO3 或者: Cu(NO3)2 、AgNO3 负极:Cu – 2e- = Cu2+ 正极:2Ag+ + 2e- = 2 Ag 三:组成原电池的条件: 化合价降低 得2e利用刚才Fe + Cu2+=Fe2+ +Cu,设计一个原电池. 1、有两种活泼性不同的金属作电极(或金属与能导电的非金属或化合物) 4 、能自发发生氧化还原反应
液
CuSO4
思考讨论:利用此氧化还原反应
来设计原电池,写出电极反应式。 并画出装置图
化合价升高失2e-
Cu+ 2 Fe3+ = Cu2+ + 2Fe2+
化合价降低得2e-
(Cu+ 2 FeCl3 = CuCl2+ 2FeCl2)
装置图
Cu
C
CuCl2
FeCl3
离子方程式Cu+ 2 Fe3+ = Cu2+ + 2Fe2+
总结
• 1、复习回忆了原电池的形成。
• 2、进一步了解原电池的反应原理,正 确书写电极反应式。
• 3、利用氧化还原反应原理设计了原 电池。
思考讨论:利用该反应设计原电池
化合价升高失2e-
Cu+ 2 AgNO3 = Cu(NO3)2 + 2Ag
Fe Cu+ 2 AgNO3 = Cu(NO3)2 + 2Ag
该原电池反应原理?电极反应式和总方程式. (Cu+ 2 FeCl3 = CuCl2+ 2FeCl2) CuSO4 思考讨论:利用该反应设计原电池 CuSO4 溶液 电解液: AgNO3 或者: Cu(NO3)2 、AgNO3 负极:Cu – 2e- = Cu2+ 正极:2Ag+ + 2e- = 2 Ag 三:组成原电池的条件: 化合价降低 得2e利用刚才Fe + Cu2+=Fe2+ +Cu,设计一个原电池. 1、有两种活泼性不同的金属作电极(或金属与能导电的非金属或化合物) 4 、能自发发生氧化还原反应
液
CuSO4
思考讨论:利用此氧化还原反应
来设计原电池,写出电极反应式。 并画出装置图
化合价升高失2e-
Cu+ 2 Fe3+ = Cu2+ + 2Fe2+
化合价降低得2e-
(Cu+ 2 FeCl3 = CuCl2+ 2FeCl2)
装置图
Cu
C
CuCl2
FeCl3
离子方程式Cu+ 2 Fe3+ = Cu2+ + 2Fe2+
总结
• 1、复习回忆了原电池的形成。
• 2、进一步了解原电池的反应原理,正 确书写电极反应式。
• 3、利用氧化还原反应原理设计了原 电池。
思考讨论:利用该反应设计原电池
化合价升高失2e-
Cu+ 2 AgNO3 = Cu(NO3)2 + 2Ag
人教版高中化学选修4第四章第一节原电池课件

2.工作原理:
锌半电池 负极: Zn -2e - = Zn 2+
铜半电池 正极: Cu2+ + 2e - = Cu
电池反响:Zn + Cu2+ = Zn 2+ + Cu
思考: 1.改进后的装置为什么能够持续、稳定 的产生电流? 2.盐桥在此的作用是什么?
认识盐桥
〔1〕盐桥的成分:饱和的KCl溶液和琼脂 〔2〕盐桥的作用:
练习:
利用Fe + Cu2+=Fe2+ +Cu设计一个原 电池,画出示意图,写出电极反响。
Fe Fe Cu Cu
负极:Fe – 2e- =Fe2+
CuSO4 FeSO4 CuSO4
正极:Cu2+ +2e- =Cu
二、原电池正负极判断
1.由组成原电池的电极材料判断 2.根据电子〔电流〕流动的方向判断 3.根据电极反响类型判断
负极-- 失 电子,发生 氧化 反响
正极-- 得 电子,发生 复原 反响
三、原电池原理的应用
1.设计原电池
2.判断金属的活动性
3. 加快反响速率 (1)实验室制取氢气,用锌与稀硫酸反响。 锌用纯锌好,还是用粗锌好〔杂质为碳〕? (2)如果只有纯锌、稀硫酸和硫酸铜,怎 么4.防办止?金属被腐蚀
例:镀锌铁比镀锡铁耐用
练1.(07海南)依据氧化还原反应: 2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s) 设计的原电池如图所示。
请回答下列问题: (1)电极X的材料是 Cu ;电解质溶液Y是AgNO3溶液 (2)银电极为电池的 正 极,发生的电极反应为2Ag++ 2e- = 2Ag
锌半电池 负极: Zn -2e - = Zn 2+
铜半电池 正极: Cu2+ + 2e - = Cu
电池反响:Zn + Cu2+ = Zn 2+ + Cu
思考: 1.改进后的装置为什么能够持续、稳定 的产生电流? 2.盐桥在此的作用是什么?
认识盐桥
〔1〕盐桥的成分:饱和的KCl溶液和琼脂 〔2〕盐桥的作用:
练习:
利用Fe + Cu2+=Fe2+ +Cu设计一个原 电池,画出示意图,写出电极反响。
Fe Fe Cu Cu
负极:Fe – 2e- =Fe2+
CuSO4 FeSO4 CuSO4
正极:Cu2+ +2e- =Cu
二、原电池正负极判断
1.由组成原电池的电极材料判断 2.根据电子〔电流〕流动的方向判断 3.根据电极反响类型判断
负极-- 失 电子,发生 氧化 反响
正极-- 得 电子,发生 复原 反响
三、原电池原理的应用
1.设计原电池
2.判断金属的活动性
3. 加快反响速率 (1)实验室制取氢气,用锌与稀硫酸反响。 锌用纯锌好,还是用粗锌好〔杂质为碳〕? (2)如果只有纯锌、稀硫酸和硫酸铜,怎 么4.防办止?金属被腐蚀
例:镀锌铁比镀锡铁耐用
练1.(07海南)依据氧化还原反应: 2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s) 设计的原电池如图所示。
请回答下列问题: (1)电极X的材料是 Cu ;电解质溶液Y是AgNO3溶液 (2)银电极为电池的 正 极,发生的电极反应为2Ag++ 2e- = 2Ag
【化学】4-1原电池ppt课件

实验景象:
电极本身溶解的为负极,电极上有金属或气体析出的为正极
1.判别以下图安装,哪些能构成原电池〔 〕 A E F
Fe
Cu
N a C l溶 液
(F)
2.发生原电池C的反D 响通常是放热反响,在实际上可设计成原电池的化学
反响是〔
〕
A、C(s)+H2O(g)=CO(g)+H2(g) △H>0
B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
小结: 将原电池反响中的氧化反 应与复原反响分开在两个不同 区域内进展,再以适当的方式 衔接起来,从而获得了稳定持 续的电流。
一、双液原电池的任务原理
[实验一]按以下图进展实验,留意察看景
象.
G
[实验景象]
盐桥
①电流计指针偏转,并指示电子是
Zn
Cu
由锌片流向铜片;〔向正极偏转〕
②锌片溶解,质量减少;
[小结] 二、原电池的原理及构成条件
1、原电池的定义:化学能转变为电能的安装。
2、构成原电池的条件:两极-液-连线 〔1〕有两种活动性不同的金属〔或金属与非金属〕作电极。 〔2〕电极资料均插入电解质溶液中。 〔3〕两极相连构成闭合电路。 〔4〕氧化复原反响〔前提条件〕 3、原电池的电极: ①资料种类:金属—金属〔活泼性不同〕; 金属—非金属;金属—金属氧化物等。 ②负极:复原剂发生氧化反响的一极; 正极:氧化剂发生复原反响的一极; ③正、负极的判别方法: 电流计指针的偏转方向: 电子流出或电流流入的一极为负极, 电子流入或电流流出的一极为正极
使Zn盐和Cu盐溶液不断坚持电荷平衡,组成内部 闭合回路,从而使电子不断从Zn极流向Cu极。
6、电解质溶液和电极资料的选择
电极本身溶解的为负极,电极上有金属或气体析出的为正极
1.判别以下图安装,哪些能构成原电池〔 〕 A E F
Fe
Cu
N a C l溶 液
(F)
2.发生原电池C的反D 响通常是放热反响,在实际上可设计成原电池的化学
反响是〔
〕
A、C(s)+H2O(g)=CO(g)+H2(g) △H>0
B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
小结: 将原电池反响中的氧化反 应与复原反响分开在两个不同 区域内进展,再以适当的方式 衔接起来,从而获得了稳定持 续的电流。
一、双液原电池的任务原理
[实验一]按以下图进展实验,留意察看景
象.
G
[实验景象]
盐桥
①电流计指针偏转,并指示电子是
Zn
Cu
由锌片流向铜片;〔向正极偏转〕
②锌片溶解,质量减少;
[小结] 二、原电池的原理及构成条件
1、原电池的定义:化学能转变为电能的安装。
2、构成原电池的条件:两极-液-连线 〔1〕有两种活动性不同的金属〔或金属与非金属〕作电极。 〔2〕电极资料均插入电解质溶液中。 〔3〕两极相连构成闭合电路。 〔4〕氧化复原反响〔前提条件〕 3、原电池的电极: ①资料种类:金属—金属〔活泼性不同〕; 金属—非金属;金属—金属氧化物等。 ②负极:复原剂发生氧化反响的一极; 正极:氧化剂发生复原反响的一极; ③正、负极的判别方法: 电流计指针的偏转方向: 电子流出或电流流入的一极为负极, 电子流入或电流流出的一极为正极
使Zn盐和Cu盐溶液不断坚持电荷平衡,组成内部 闭合回路,从而使电子不断从Zn极流向Cu极。
6、电解质溶液和电极资料的选择
高中化学选择性必修一第4章第1节 原电池
7、负极:Al —3e -+4OH-=AlO2-+2H2O 正极: 2e-+2H2O= H2↑+ 2OH―
总反应: 2Al+2OH―+2H2O=2AlO2-+3H2↑
8、负极:Cu —2e -=Cu2+ 正极: 2H++NO3- +e-= H2O+NO2↑
总反应: Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
第一节 原电池
一、原电池的工作原理
(一)定义:将化学能转化为电能的装置 注:原电池中的化学能并非全部转化为电能,有一部分 转化成热能等其他形式的能量
(二)本质:氧化还原反应
(三)工作原理:以铜-锌原电池为例
答:(1)锌铜原电池工作时,电子由锌片沿导线移向铜 片,阴离子(Cl-、SO42-)在电解质溶液中移向锌片,阳 离子(K+、Cu2+)移向铜片。
合OH-→沉淀M(OH)n
、遵守三大守恒:质量守恒、电荷守恒、 转移电子守恒 、两极反应式叠加得总反应式,总反应式减去其中一个
电极反应式,可得另一个电极的反应式 5、规律:①一般来说,金属作负极的原电池
负极:酸性或中性介质中:M—ne-=Mnn+
碱性介质中:M—ne-+nOH-=M(OH)n 正极:酸性介质中:2H++2e-=H2↑
(五)能否构成原电池的判断——四看
1、看电极——两极为导体且存在活泼性差异 (燃料电池的电极一般为惰性电极) 2、看溶液——两极插入电解质溶液中 3、看回路——形成闭合回路或两极直接接触 4、看本质——有无自发的氧化还原反应发生
例题:
总反应: 2Al+2OH―+2H2O=2AlO2-+3H2↑
8、负极:Cu —2e -=Cu2+ 正极: 2H++NO3- +e-= H2O+NO2↑
总反应: Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
第一节 原电池
一、原电池的工作原理
(一)定义:将化学能转化为电能的装置 注:原电池中的化学能并非全部转化为电能,有一部分 转化成热能等其他形式的能量
(二)本质:氧化还原反应
(三)工作原理:以铜-锌原电池为例
答:(1)锌铜原电池工作时,电子由锌片沿导线移向铜 片,阴离子(Cl-、SO42-)在电解质溶液中移向锌片,阳 离子(K+、Cu2+)移向铜片。
合OH-→沉淀M(OH)n
、遵守三大守恒:质量守恒、电荷守恒、 转移电子守恒 、两极反应式叠加得总反应式,总反应式减去其中一个
电极反应式,可得另一个电极的反应式 5、规律:①一般来说,金属作负极的原电池
负极:酸性或中性介质中:M—ne-=Mnn+
碱性介质中:M—ne-+nOH-=M(OH)n 正极:酸性介质中:2H++2e-=H2↑
(五)能否构成原电池的判断——四看
1、看电极——两极为导体且存在活泼性差异 (燃料电池的电极一般为惰性电极) 2、看溶液——两极插入电解质溶液中 3、看回路——形成闭合回路或两极直接接触 4、看本质——有无自发的氧化还原反应发生
例题:
第四章第一节原电池PPT30张
解析 根据已知的氧化还原反应设计原电池的思路:首
课 时
先将已知的反应拆成两个半反应(即氧化反应和还原反
栏 目
应):Cu-2e-===Cu2+,2Fe3++2e-===2Fe2+;然后结合
开
原电池的电极反应特点,分析可知,该电池的负极应该
关
用 Cu 作材料,正极要保证 Fe3+得到负极失去的电子,一
般用不能还原 Fe3+的材料,如 Pt 或碳棒等,电解质溶液
本
负极反应式___________________________________;
课 时
总反应方程式_________________________________。
栏 目
答案 2H++2e-===H2↑ Fe-2e-===Fe2+
开 关
Fe+H2SO4===FeSO4+H2↑
学习·探究区
第一节
做完实验后,在读书卡片上记录如下:
卡片:NO.28 时间:2012.03.20
实验后的记录:
本
①Zn 为正极,Cu 为负极
课
②H+向负极移动
时
栏
③电子流动方向为 Zn―→Cu
目 开
④Cu 极有 H2 产生
关
⑤若有 1 mol 电子流过导线,则产
生的 H2 为 0.5 mol ⑥正极反应式:Zn-2e-===Zn2+
关
为电能
。
学习·探究区
第一节
[归纳总结]
1.原电池原理是把 氧化反应和还原反应分开 进行,还原
剂在 负 极上失去电子发生 氧化 反应,电子通过导线流向
正 极,氧化剂在 正 极上得到电子发生还原 反应。
本
课 时
2.原电池电极及电极反应特点
人教化学选修4第四章第一节 原 电 池(共21张PPT)
N a C l溶 液
Zn C u Zn Cu
Fe
Cu
Zn
Cu
√E
F
M
N
CCuu2SSOO 44
酒精
N a C l溶 液
H2SO4 H2SO4
三.简单原电池的工作原理:
外电路
负极
电子沿导线传递,产生电流 正极
活泼金属
A
失去电子 Zn-
不活泼金属或石墨
Cu 溶液中阳离子
氧化反应
得到电子
Zn- 2e- = Zn2+
相同点:电极反应本质相同 不同点: 构造不同
优点: 1.有效避免了电极材料与电解质溶液的直接反应, 增加了原电池的使用寿命。
2.离子在盐桥中作定向移动,使离子移动更加有序, 电流持续稳定 ,提高了原电池的使用效率。
练习三
(高考真题)依据氧化还原反应: 2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)
第四章 电化学基础
第1节 原电池
• 实验:将锌片和铜片用导线连接(导线中间 接入一个电流表),平行插入盛有稀硫酸 的烧杯中,观察现象
[实验现象]:铜片上有气泡产生,锌片不断溶解 ,电流表的指针发生偏转。 [实验结论]:导线中有电流通过
为什么会出现上面的现象?
一、原电池: 是将化学能转化为电能的装置
1、构成原电池的条件 2、探究“单液电池”,寻找 改进方法—“双液电池” 3、具有盐桥原电池的反应原 理作用
二、原电池的构成条件
1.两种不同的金属 (或一种金属与石墨或金属氧化物) 做电极
2.用导线相连(或直接接触)形成闭合回路
3.电极插入电解质溶液里
选修4-原电池-课件
(或传导离子的介质) ③ 两极相连形成闭合电路。
④ 一个自发的氧化还原反应。
讨论1:以下哪些装置可以形成原电池?
Pt
Zn
Cu Fe
Fe Fe
C
H2
Pt O2
CuSO4溶液 A
Mg
Al
稀硫酸 B
Zn
NaCl溶液 C
Cu
KOH溶液 D
Fe
C
NaOH溶液 E
稀硫酸 稀硫酸 F
纯酒精 G
讨论:原电池的电极名称不仅与电极的性质有关,也与电解质 溶液有关,下列说法中不正确的是 ( ) A.由 Al、Cu、稀H2SO4组成原电池,其负极反应式为:
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中溶入FeCl2固体,乙中 石墨电极为负极
练习4:反应AsO43-+2I-+2H+⇌
AsO33-+I2+H2O,现设计如下实验 装置,进行下述操作:
I:向B杯内逐滴加入浓盐酸,发现微安表指针偏转; II: 若改向B烧杯中滴加40%NaOH溶液,发现微安表 指针与(I)实验的反向偏转。
科学探究
基于盐桥的作用,你知道上述原电池装置还可以怎 么改进?
思考:原电池的设计
利用Fe + Cu2+=Fe2+ +Cu,设计一个原电池.
Fe
Cu
FeSO4
CuSO4
课堂练习: 利用此氧化还原反应来设计原电池,写
出电极反应式,并画出装置图。
Cu+ 2 Fe3+ = Cu2+ + 2Fe2+
Cu
A
Zn
Cu
CuSO4
④ 一个自发的氧化还原反应。
讨论1:以下哪些装置可以形成原电池?
Pt
Zn
Cu Fe
Fe Fe
C
H2
Pt O2
CuSO4溶液 A
Mg
Al
稀硫酸 B
Zn
NaCl溶液 C
Cu
KOH溶液 D
Fe
C
NaOH溶液 E
稀硫酸 稀硫酸 F
纯酒精 G
讨论:原电池的电极名称不仅与电极的性质有关,也与电解质 溶液有关,下列说法中不正确的是 ( ) A.由 Al、Cu、稀H2SO4组成原电池,其负极反应式为:
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中溶入FeCl2固体,乙中 石墨电极为负极
练习4:反应AsO43-+2I-+2H+⇌
AsO33-+I2+H2O,现设计如下实验 装置,进行下述操作:
I:向B杯内逐滴加入浓盐酸,发现微安表指针偏转; II: 若改向B烧杯中滴加40%NaOH溶液,发现微安表 指针与(I)实验的反向偏转。
科学探究
基于盐桥的作用,你知道上述原电池装置还可以怎 么改进?
思考:原电池的设计
利用Fe + Cu2+=Fe2+ +Cu,设计一个原电池.
Fe
Cu
FeSO4
CuSO4
课堂练习: 利用此氧化还原反应来设计原电池,写
出电极反应式,并画出装置图。
Cu+ 2 Fe3+ = Cu2+ + 2Fe2+
Cu
A
Zn
Cu
CuSO4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一节原电池
[核心素养发展目标] 1.宏观辨识与微观探析:以铜锌原电池为例,从宏观和微观的角度,分析理解原电池的工作原理,能正确判断原电池的正极和负极,会书写其电极反应式。
2.变化观念与平衡思想:进一步理解化学能与电能的相互转化,认识从简单原电池发展到带有盐桥原电池的过程变化,并能理解带有盐桥原电池的实用性。
一、原电池的工作原理
1.原电池的构成条件
(1)定义:能把化学能转化为电能的装置。
(2)构成条件:
2.原电池的工作原理
3.原电池正极和负极的判断。
