常见酸碱的电离常数(解离常数)
常见酸的电离平衡常数比较

常见酸的电离平衡常数比较酸的电离平衡常数是描述酸在溶液中电离程度的重要参数。
它反映了酸分子与水分子之间的相互作用强弱,通过衡量酸的强弱程度来判断酸的电离程度。
常见酸的电离平衡常数各不相同,下面我们将对几种常见酸的电离平衡常数进行比较。
我们来看一下硫酸(H2SO4)的电离平衡常数。
硫酸是一种强酸,其电离平衡常数非常大,约为10的三次方。
这意味着硫酸在水中几乎完全电离,生成大量的氢离子(H+)和硫酸根离子(SO4^2-)。
因此,硫酸溶液呈酸性。
与之相比,乙酸(CH3COOH)的电离平衡常数较小,约为10的负六次方。
乙酸是一种弱酸,其在水中只有部分电离,生成少量的氢离子(H+)和乙酸根离子(CH3COO-)。
因此,乙酸溶液呈弱酸性。
另一个常见的酸是盐酸(HCl),其电离平衡常数约为10的负一次方。
盐酸是一种强酸,但其电离平衡常数相对较小,这是因为盐酸在水中完全电离,生成大量的氢离子(H+)和氯离子(Cl-)。
虽然电离程度很高,但由于盐酸的浓度较低,所以电离平衡常数较小。
除了硫酸、乙酸和盐酸,还有一种常见的酸是碳酸(H2CO3)。
然而,碳酸是一种相对较弱的酸,其电离平衡常数约为10的负四次方。
碳酸在水中只有部分电离,生成少量的氢离子(H+)和碳酸根离子(CO3^2-)。
由于碳酸的电离程度较低,碳酸溶液呈弱酸性。
还有一种常见的酸是硝酸(HNO3)。
硝酸是一种强酸,其电离平衡常数约为10的负一次方。
硝酸在水中完全电离,生成大量的氢离子(H+)和硝酸根离子(NO3-)。
因此,硝酸溶液呈酸性。
常见酸的电离平衡常数各不相同,与酸的强弱有关。
强酸的电离平衡常数较大,几乎完全电离,生成大量的氢离子和相应的酸根离子;而弱酸的电离平衡常数较小,只有部分电离。
了解酸的电离平衡常数有助于我们理解酸的性质和溶液的酸碱性质,对于化学实验和工业生产中的酸碱反应也有重要的指导意义。
常见酸碱的电离常数(2)

44
苯甲酸
C6H5COOH
×10-5
45
水杨酸
C6H4(OH)COOH
×10-3(K1)
×10-13(K2)
46
邻硝基苯甲酸
(o)NO2C6H4COOH
×10-3
47
间硝基苯甲酸
(m)NO2C6H4COOH
×10-4
48
对硝基苯甲酸
(p)NO2C6H4COOH
×10-4
49
邻苯二甲酸
(o)C6H4(COOH)2
C6(COOH)6
×10-1(K1)
×10-3(K2)
×10-4(K3)
×10-6(K4)
×10-7(K5)
×10-8(K6)
54
癸二酸
HOOC(CH2)8COOH
×10-5(K1)
×10-6(K2)
55
乙二胺四乙酸(EDTA)
CH2—N(CH2COOH)2
∣
CH2—N(CH2COOH)2
×10-2(K1)
NH2OH+H2O
×10-9
7
氢氧化铅
Pb(OH)2
×10-4(K1)
×10-8(K2)
8
氢氧化锌
Zn(OH)2
×10-4
有机碱在水溶液中的解离常数(25oC)
Dissociation Constants of Organic Bases in Aqueous Solution (25oC)
序号(No.)
×10-4(K1)
×10-7(K2)
31
谷氨酸
HOCOCH2CH2CH(NH2)COOH
×10-3(K1)
×10-5(K2)
电离常数与水解常数的关系

电离常数与水解常数的关系1. 前言嘿,大家好,今天咱们来聊聊一个听起来有点复杂但其实很有趣的话题——电离常数和水解常数的关系。
别急,听我说完,你会发现,这东西就像在喝茶一样,有些苦,但喝久了就上瘾了。
咱们生活中常见的许多酸碱反应,其实都跟这两个常数密切相关。
简单来说,它们就像是化学世界里的小伙伴,一个负责“分家”,一个负责“调解”,两者缺一不可。
2. 电离常数(Ka)2.1 什么是电离常数?首先,咱们来捋一捋电离常数Ka。
这个东西其实就是用来衡量一种酸在水中有多“乖乖”的。
如果酸在水中越容易分开,生成的氢离子(H⁺)越多,那么这个Ka值就越大。
打个比方,就像你吃到一块特别好吃的蛋糕,越是好吃,越想一口气吃光,那你对这个蛋糕的评价肯定高得不得了,对吧?2.2 为什么重要?那么,电离常数为啥这么重要呢?想象一下,如果你在做菜,调味品的酸碱度可影响整道菜的味道。
就拿醋来说,它是酸的,放多了可能让菜变得酸到不敢吃;放少了又没味道。
Ka值就能帮助你掌握这个“酸”的程度,帮助你调配出完美的菜肴。
3. 水解常数(Kb)3.1 水解常数的基本概念接下来,我们聊聊水解常数Kb。
这可是电离常数的另一半。
水解常数主要用来衡量碱在水中的“表现”。
如果一个碱能在水中迅速和水反应,产生氢氧根离子(OH⁻),那么Kb值就会高。
这就像是有些人喝酒特别能喝,喝一口就能把酒杯空掉,留下的就是一堆笑声和醉意。
3.2 水解的实际应用水解常数也非常重要,尤其是在制造清洁剂和肥料的时候。
比如说,氨水就是一个水解非常好的例子。
它不仅能有效清洁,还能给植物提供氮元素,促进生长。
这个Kb 值就是它“清洁能力”的直观体现。
所以说,这两个常数就像是化学界的“双子星”,相辅相成。
4. 电离常数与水解常数的关系4.1 两者的关系现在问题来了,电离常数和水解常数到底是什么关系呢?其实,它们之间有一个非常简单又美妙的关系。
根据化学原理,酸和碱可以互相转化,电离常数Ka和水解常数Kb之间有个公式:Ka × Kb = Kw(Kw是水的离子积,值为1.0 × 10⁻¹⁴)。
高中化学酸碱电离常数解题技巧

高中化学酸碱电离常数解题技巧高中化学中,酸碱电离常数是一个重要的概念,它能够帮助我们理解酸碱溶液的性质和反应。
在解题过程中,掌握一些解题技巧可以帮助我们更好地理解和应用酸碱电离常数。
本文将介绍一些常见的酸碱电离常数解题技巧,并通过具体的题目进行说明,希望对高中学生和他们的父母有所帮助。
一、酸碱电离常数的定义和计算首先,我们需要明确酸碱电离常数的定义和计算方法。
酸碱电离常数(Ka和Kb)描述了酸和碱在溶液中电离的程度,它们的大小与酸碱的强弱有关。
对于酸来说,电离常数(Ka)等于酸解离度(α)与酸浓度(C)的比值:Ka = [H+][A-]/[HA],其中[H+]表示氢离子浓度,[A-]表示酸根离子浓度,[HA]表示未电离酸的浓度。
对于碱来说,电离常数(Kb)等于碱解离度(α)与碱浓度(C)的比值:Kb = [OH-][B+]/[BOH],其中[OH-]表示氢氧根离子浓度,[B+]表示碱阳离子浓度,[BOH]表示未电离碱的浓度。
二、常见的酸碱电离常数解题技巧1. 判断酸碱强弱:根据酸碱电离常数的大小可以判断酸碱的强弱。
一般来说,电离常数越大,酸碱越强。
例如,若两个酸的电离常数分别为Ka1和Ka2,若Ka1 > Ka2,则可以判断Ka1对应的酸比Ka2对应的酸更强。
2. 计算电离度:电离度是指酸或碱在溶液中电离的程度,可以通过电离常数计算得到。
对于酸来说,电离度(α)等于[H+]浓度与酸浓度(C)的比值:α =[H+]/C。
对于碱来说,电离度(α)等于[OH-]浓度与碱浓度(C)的比值:α = [OH-]/C。
3. 求解pH或pOH:pH和pOH是描述溶液酸碱性的指标,可以通过酸碱电离常数计算得到。
pH等于负log[H+]浓度,pOH等于负log[OH-]浓度。
根据酸碱电离常数和电离度的关系,可以通过计算得到[H+]或[OH-]浓度,进而求解pH或pOH。
三、例题解析1. 已知一种酸的电离常数Ka为1.8×10^-5,求该酸的电离度。
酸碱中的电离度和电离常数

酸碱中的电离度和电离常数在化学中,酸碱是我们经常接触到的概念。
酸碱的性质与其电离度和电离常数密切相关。
本文将探讨酸碱中的电离度和电离常数,以及它们的重要性。
一、电离度和电离常数的概念1. 电离度:指在溶液中,酸或碱分子中发生电离的程度。
电离度可以用α表示,取值范围为0到1之间。
当α为1时,表示酸或碱完全电离,溶液中几乎没有未电离的酸或碱分子;当α为0时,表示酸或碱没有电离,溶液中只存在未电离的酸或碱分子。
2. 电离常数:表示酸碱溶液中酸碱电离的程度。
电离常数通常用Ka值表示酸的电离程度,用Kb值表示碱的电离程度。
Ka和Kb值越大,表示酸或碱的电离程度越大,溶液中的酸碱性越强。
二、酸中的电离度和电离常数对于酸溶液,电离度和电离常数可以通过酸的强弱来衡量。
1. 强酸:强酸在水中离子化的程度很高,几乎所有的酸分子都电离成离子。
强酸的电离度接近于1,电离常数Ka的值通常很大。
例如,硫酸(H2SO4)是一种强酸,其电离度很高,大部分的硫酸分子都会电离成H+和HSO4-离子。
2. 弱酸:弱酸在水中离子化的程度较低,只有少部分的酸分子会电离成离子。
弱酸的电离度远小于1,电离常数Ka的值通常较小。
例如,乙酸(CH3COOH)是一种弱酸,大部分的乙酸分子都不会电离,只有少部分的乙酸分子会电离成H+和CH3COO-离子。
三、碱中的电离度和电离常数与酸类似,碱溶液中的电离度和电离常数也可以用碱的强弱来衡量。
1. 强碱:强碱在水中电离程度高,几乎所有的碱分子都电离成离子。
强碱的电离度接近于1,电离常数Kb的值通常很大。
例如,氢氧化钠(NaOH)是一种强碱,大部分氢氧化钠分子都会电离成Na+和OH-离子。
2. 弱碱:弱碱在水中电离程度较低,只有少部分碱分子会电离成离子。
弱碱的电离度远小于1,电离常数Kb的值通常较小。
例如,氨水(NH3·H2O)是一种弱碱,大部分氨水分子不会电离,只有少部分氨水分子会电离成NH4+和OH-离子。
最新常见弱酸弱碱的电离平衡常数

名称
化学式
Ka
砷酸
H3AsO4
6.2X10-3(Ka1)
1.2X10-7(Ka2)
3.1X10-12(Ka3)
亚砷酸
H3AsO3
5.1X10-10
硼酸
H3BO3
5.8X10-10
次溴酸
HBrO
2.3X10-9
氢氰酸
HCN
6.2X10-10
氰酸
HCNO
3.3X10-4
碳酸
H2CO3
1.6X10-12(Ka2)
甲酸
HCOOH
1.80X10-4
草酸
HOOC-COOH
5.60X10-2(Ka1)
5.42X10-5(Ka2)
乙酸
CH3COOH
1.75X10-5
丙酸
C2H5COOH
1.34X10-5
乳酸(D-2-羟基丙酸)
CH3CH(OH)COOH
1.38X10-4
苯酚
C6H5OH
1.0X10-10
氢硫酸
H2S
1.3X10-7(Ka1)
7.1X10-15(Ka2)
硫酸
H2SO4
1.02X10-2(Ka2)
亚硫酸
H2SO3
1.23X10-2(Ka1)
5.6X10-8(Ka2)
硫氰酸
HSCN
0.13
硫代硫酸
H2S2O3
0.25(Ka1)
1.9X10-2(Ka2)
偏硅酸
H2SiO3
1.7X10-10(Ka1)
次磷酸
HPO3
5.9X10-2
磷酸
H3PO4
7.11X10-3(Ka1)
解离平衡常数

解离平衡常数解离平衡常数(dissociation constant)是指一种物质在溶液中的解离程度,它表示溶液中物质的离解状态所占的比例。
解离平衡常数可以用来衡量一种物质在溶液中的溶解度,也可以用来衡量一种化合物的稳定性。
常见的解离平衡常数包括酸碱平衡常数(pH值)、离子解离常数(离子解离度)和离子解离平衡常数(离子解离程度)等。
解离平衡常数的大小可以通过实验测定,也可以用理论方法计算。
解离平衡常数在化学、生物学、药学等领域都有广泛的应用。
酸碱平衡常数(pH值)是衡量溶液中酸性或碱性程度的常数,它的大小可以反映溶液中的氢离子浓度。
pH值是以负数为单位表示的,常用pH计测定。
当pH值在7左右时溶液是中性的,pH值小于7时溶液是酸性的,pH值大于7时溶液是碱性的。
pH值对于生命的重要性是不言而喻的,它会影响生物体内的代谢过程,并且对人体的健康也有很大的影响。
离子解离常数(离子解离度)是衡量溶液中某种离子的解离程度的常数。
离子解离度的大小可以反映溶液中离子的溶解度,也可以反映溶液的电离度。
离子解离度是以正数为单位表示的,它的大小可以通过实验测定,也可以用理论方法计算。
离子解离度在化学、生物学、药学等领域都有广泛的应用。
离子解离平衡常数(离子解离程度)是衡量溶液中某种化合物的离解程度的常数。
离子解离程度的大小可以反映溶液中化合物的稳定性,也可以反映溶液的pH值。
离子解离程度是以正数为单位表示的,它的大小可以通过实验测定,也可以用理论方法计算。
离子解离程度在化学、生物学、药学等领域都有广泛的应用。
总之,解离平衡常数是衡量溶液中物质的解离程度的常数,它可以用来衡量物质的溶解度、电离度和稳定性。
解离平衡常数在化学、生物学、药学等领域都有广泛的应用。
常见弱酸弱碱的电离平衡常数
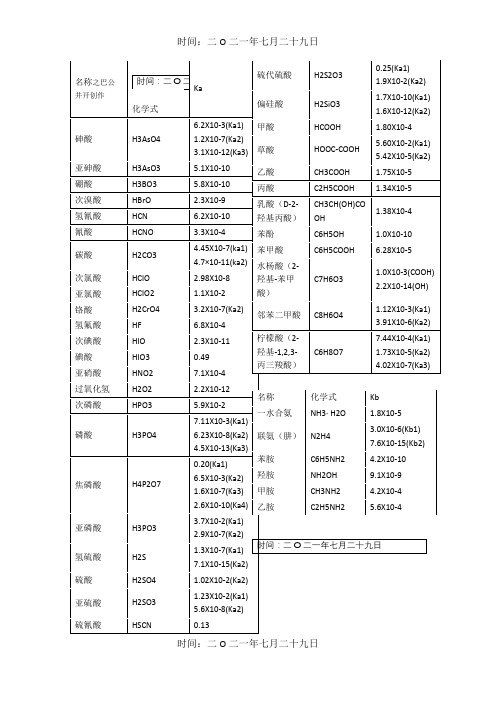
H2S
1.3X10-7(Ka1)
7.1X10-15(Ka2)
硫酸
H2SO4
1.02X10-2(Ka2)
亚硫酸
H2SO3
1.23X10-2(Ka1)
5.6X10-8(Ka2)
硫氰酸
HSCN
0.13
硫代硫酸
H2S2O3
0.25(Ka1)
1.9X10-2(Ka2)
偏硅酸
H2SiO3
1.7X10-10(Ka1)
1.6X10-12(Ka2)
甲酸
HCOOH
1.80X10-4
草酸
HOOC-COOH
5.60X10-2(Ka1)
5.42X10-5(Ka2)
乙酸
CH3COOH
1.75X10-5
丙酸
C2H5COOH
1.34X10-5
乳酸(D-2-羟基丙酸)
CH3CH(OH)COOH
1.38X10-4
苯酚
C6H5OH
1.0X10-10
苯甲酸
C6H5COOH
6.28X10-5
水杨酸(2-羟基-苯甲酸)
C7H6O3
1.0X10-3(COOH)
2.2X10-14(OH)
邻苯二甲酸
C8H6O4
1.12X10-3(Ka1)
3.91X10-6(Ka2)
柠檬酸(2-羟基-1,2,3-丙三羧酸)
C6H8O7
7.44X10-4(Ka1)
1.73X10-5(Ka2)
名称化学式ka62x103ka112x107ka231x1012ka3h3aso351x1010硼酸58x1010次溴酸hbro23x109氢氰酸hcn62x1010氰酸hcno33x104碳酸445x107ka1471011ka2次氯酸hclo298x108亚氯酸hclo11x10232x107ka2氢氟酸hf68x104次碘酸hio23x1011碘酸hio3049亚硝酸hno71x104过氧化氢h2o222x1012次磷酸hpo59x102磷酸h3po711x103ka1623x108ka245x1013ka3焦磷酸h4p2o7020ka165x103ka216x107ka326x1010ka4亚磷酸37x102ka129x107ka2氢硫酸h2s13x107ka171x1015ka2硫酸h2so102x102ka2亚硫酸123x102ka156x108ka2硫氰酸hscn013硫代硫酸025ka119x102ka2偏硅酸h2sio317x1010ka116x1012ka2甲酸hcooh180x104草酸hooccooh560x102ka1542x105ka2乙酸ch3cooh175x105丙酸c2h5cooh134x105乳酸d2基丙酸ch3chohcooh138x104苯酚c6h5oh10x1010苯甲酸c6h5cooh628x105水杨酸基苯甲酸c7h6o310x103cooh22x1014oh邻苯二甲酸c8h6o4112x103ka1391x106ka2柠檬酸744x104ka1173x105ka2402x107ka3名称化学式kb一水合氨nh3h2o18x105n2h430x106kb176x1015kb2苯胺c6h5nh242x1010nh2oh91x109ch3nh242x104乙胺c2h5nh256x104
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
50
间苯二甲酸
(m)C6H4(COOH)2
2.4×10-4(K1)
3.62
2.5×10-5(K2)
4.60
51
对苯二甲酸
(p)C6H4(COOH)2
2.9×10-4(K1)
3.54
3.5×10-5(K2)
4.46
52
1,3,5-苯三甲酸
C6H3(COOH)3
7.6×10-3(K1)
2.12
7.9×10-5(K2)
8.62
6
氢氰酸
HCN
6.2×10-10
9.21
7
碳酸
H2CO3
4.2×10-7(K1)
6.38
5.6×10-11(K2)
10.25
8
次氯酸
HClO
3.2×10-8
7.50
9
氢氟酸
HF
6.61×10-4
3.18
10
锗酸
H2GeO3
1.7×10-9(K1)
8.78
1.9×10-13(K2)
12.72
11
12.38
46
邻硝基苯甲酸
(o)NO2C6H4COOH
6.6×10-3
2.18
47
间硝基苯甲酸
(m)NO2C6H4COOH
3.5×10-4
3.46
48
对硝基苯甲酸
(p)NO2C6H4COOH
3.6×10-4
3.44
49
邻苯二甲酸
(o)C6H4(COOH)2
1.1×10-3(K1)
2.96
4.0×10-6(K2)
4.10
6.6×10-6(K3)
5.18
53
苯基六羧酸
C6(COOH)6
2.1×10-1(K1)
0.68
6.2×10-3(K2)
2.21
3.0×10-4(K3)
3.52
8.1×10-6(K4)
5.09
4.8×10-7(K5)
6.32
3.2×10-8(K6)
7.49
54
癸二酸
HOOC(CH2)8COOH
4.27
5
甘氨酸
CH2(NH2)COOH
1.7×10-10
9.78
6
一氯乙酸
CH2ClCOOH
1.4×10-3
2.86
7
二氯乙酸
CHCl2COOH
5.0×10-2
1.30
8
三氯乙酸
CCl3COOH
2.0×10-1
0.70
9
丙酸
CH3CH2COOH
1.35×10-5
4.87
10
丙烯酸
CH2═CHCOOH
2.6×10-5(K1)
20
3-丁烯酸
CH2═CHCH2COOH
2.1×10-5
4.68
21
异丁烯酸
CH2═C(CH2)COOH
2.2×10-5
4.66
22
反丁烯二酸(富马酸)
HOCOCH═CHCOOH
9.3×10-4(K1)
3.03
3.6×10-5(K2)
4.44
23
顺丁烯二酸(马来酸)
HOCOCH═CHCOOH
1.2×10-2(K1)
无机酸在水溶液中的解离常数(25oC)
Dissociation Constants of Mineral Acids in Aqueous Solution(25oC)
序号
(No.)
名称(Name)
化学式(Chemical formula)
Ka
pKa
1
偏铝酸
HAlO2
6.3×10-13
12.20
2
亚砷酸
4.19
35
二苯胺
(C6H5)2NH
7.94×10-14
13.1
36
联苯胺
H2NC6H4C6H4NH2
5.01×10-10(K1)
9.30
4.27×10-11(K2)
10.37
有机酸在水溶液中的解离常数(25oC)
Dissociation Constants of Organic Acids in Aqueous Solution(25oC)
序号(No.)
名称(Name)
化学式
(Chemical formula)
Ka
pKa
1
甲酸
HCOOH
1.8×10-4
3.75
2
乙酸
CH3COOH
1.74×10-5
4.76
3
乙醇酸
CH2(OH)COOH
1.48×10-4
3.83
4
草酸
(COOH)2
5.4×10-2(K1)
1.27
5.4×10-5(K2)
4.76
4.0×10-7(K3)
6.40
38
苯酚
C6H5OH
1.1×10-10
9.96
39
邻苯二酚
(o)C6H4(OH)2
3.6×10-10
9.45
1.6×10-13
12.8
40
间苯二酚
(m)C6H4(OH)2
3.6×10-10(K1)
9.30
8.71×10-12(K2)
11.06
41
对苯二酚
(p)C6H4(OH)2
7.74
无机碱在水溶液中的解离常数(25oC)
Dissociation Constants of Mineral Bases in Aqueous Solution(25oC)
序号(No.)
名称(Name)
化学式
(Chemical formula)
Kb
pKb
1
氢氧化铝
Al(OH)3
1.38×10-9(K3)
3.35
20
苯胺
C6H5NH2
3.98×10-10
9.40
21
苄胺
C7H9N
2.24×10-5
4.65
22
环己胺
C6H11NH2
4.37×10-4
3.36
23
吡啶
C5H5N
1.48×10-9
8.83
24
六亚甲基四胺
(CH2)6N4
1.35×10-9
8.87
25
2-氯酚
C6H5ClO
3.55×10-6
1.1×10-10
9.96
42
2,4,6-三硝基苯酚
2,4,6-(NO2)3C6H2OH
5.1×10-1
0.29
43
葡萄糖酸
CH2OH(CHOH)4COOH
1.4×10-4
3.86
44
苯甲酸
C6H5COOH
6.3×10-5
4.20
45
水杨酸
C6H4(OH)COOH
1.05×10-3(K1)
2.98
4.17×10-13(K2)
2.7×10-3(K1)
2.57
2.5×10-7(K2)
6.60
23
硒酸
H2SeO4
1×103(K1)
-3.0
1.2×10-2(K2)
1.92
24
硅酸
H2SiO3
1.7×10-10(K1)
9.77
1.6×10-12(K2)
11.80
25
亚碲酸
H2TeO3
2.7×10-3(K1)
2.57
1.8×10-8(K2)
12.36
16
焦磷酸
H4P2O7
3.0×10-2(K1)
1.52
4.4×10-3(K2)
2.36
2.5×10-7(K3)
6.60
5.6×10-10(K4)
9.25
17
氢硫酸
H2S
1.3×10-7(K1)
6.88
7.1×10-15(K2)
14.15
18
亚硫酸
H2SO3
1.23×10-2(K1)
1.91
15
丙酮酸
CH3COCOOH
3.2×10-3
2.49
16
-丙胺酸
CH3CHNH2COOH
1.35×10-10
9.87
17
-丙胺酸
CH2NH2CH2COOH
4.4×10-11
10.36
18
正丁酸
CH3(CH2)2COOH
1.52×10-5
4.82
19
异丁酸
(CH3)2CHCOOH
1.41×10-5
4.85
7.4×10-3(K1)
2.13
4.9×10-5(K2)
4.31
4.4×10-10(K3)
9.358
32
正己酸
CH3(CH2)4COOH
1.39×10-5
4.86
33
异己酸
(CH3)2CH(CH2)3—COOH
1.43×10-5
4.85
34
(E)-2-己烯酸
H(CH2)3CH═CHCOOH
1.8×10-5
H3AsO3
6.0×10-10
9.22
3
砷酸
H3AsO4
6.3×10-3(K1)
2.20
1.05×10-7(K2)
6.98
3.2×10-12(K3)
11.50
4
硼酸
H3BO3
5.8×10-10(K1)
9.24
1.8×10-13(K2)
