第1章 电极的界面双电层性质汇总
双电层及其结构课件PPT

23
三、电毛细曲线法和微分电容法比较
求q :电毛细曲线法利用σ~φ曲线的斜率求q
d/dq
微分电容法是利用Cd~φ 曲线下方的面积求q,
微分电容法:根据微分电容曲线所提供的 信息来研究界面结构与性质的实验方法。
2021/3/10
20
微 分 电 容 曲 线
图4-6滴汞电极在不同浓度氯化钾溶液中的微分电容曲线
2021/3/10
21
微分电容曲线的应用:
利用 判断0 q正负 ;
研究界面吸附 ;
求剩余电荷q、积分电容Ci (从φ0到某一电位φ之间
2021/3/10
2
第一节 概述
一、研究电极/溶液界面性质的意义
界面的结构和性质对电极反应的影响: (1)界面电场对电极反应速度的影响
通过控制电极电位有效地、连续地改变电 极反应速度 (2)电解液性质和电极材料及其表面状态的 影响
2021/3/10
3
二、研究界面结构的基本方法
1、电极/溶液界面、界面结构和性质
恒定一个电位,通过
调节贮汞瓶高度使弯月
面保持不变,从而求
得。
Hale Waihona Puke 图4-2 毛细管静电计示意图
2021/3/10
10
思考:电极电位变化怎么能导致界面张力发生变化呢?
电毛细曲线:
图4-3电毛细曲线(Ⅰ)与表面电荷剩余电荷密度与电位曲线(Ⅱ)
2021/3/10
11
3、电毛细曲线微分方程
理想极化电极表面电毛细曲线的微分方程:
根据一定的界面结构模型来推算界面参数 , 根据实验测量数据来检验模型。
研究的基本方法:充电曲线法 、微分电容曲线 法、电毛细曲线法
双电层理论

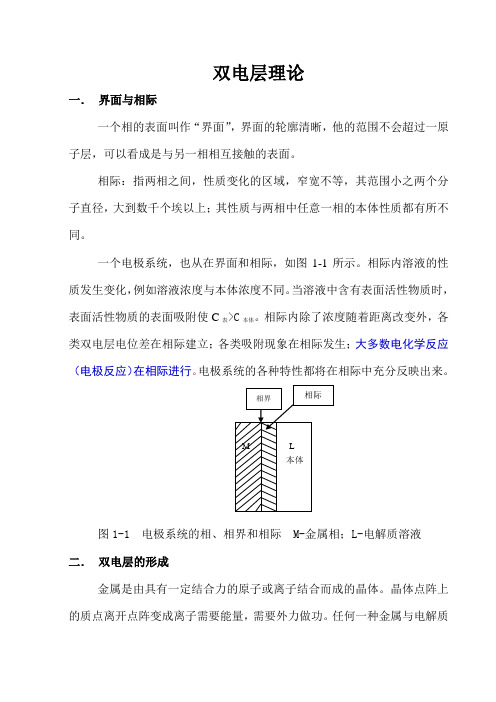
双电层理论一.界面与相际一个相的表面叫作“界面”,界面的轮廓清晰,她的范围不会超过一原子层,可以瞧成就是与另一相相互接触的表面。
相际:指两相之间,性质变化的区域,窄宽不等,其范围小之两个分子直径,大到数千个埃以上;其性质与两相中任意一相的本体性质都有所不同。
一个电极系统,也从在界面与相际,如图1-1所示。
相际内溶液的性质发生变化,例如溶液浓度与本体浓度不同。
当溶液中含有表面活性物质时,表面活性物质的表面吸附使C表>C本体。
相际内除了浓度随着距离改变外,各类双电层电位差在相际建立;各类吸附现象在相际发生;大多数电化学反应(电极反应)在相际进行。
电极系统的各种特性都将在相际中充分反映出来。
图1-1 电极系统的相、相界与相际 M-金属相;L-电解质溶液二.双电层的形成金属就是由具有一定结合力的原子或离子结合而成的晶体。
晶体点阵上的质点离开点阵变成离子需要能量,需要外力做功。
任何一种金属与电解质溶液接触时,其界面上的原子(或离子)之间必然发生相互作用,形成双电层。
1、界面电荷层(1)当性质不同的相接触时,在相界面上形成了不同性质的电势差。
(2)出现电势差的原因就是带电粒子或偶极子在界面层中的非均匀分布 双电层:由于电极与溶液界面带有的电荷符号相反,故电极/溶液界面上的荷电物质能部分地定向排列在界面两侧。
2、界面电荷层的形成 (1)自发形成的双电层(a)离子双电层 (b)吸附双电层 (c)偶极双电层 (2)强制形成的双电层金属电极与电解质溶液接触,可以自发形成双电层,也可以在外电源作用下强制形成双电层。
以如下电极反应为例:+++++M M2Hg–2e- = Hg22+ ,φ =0、1 VK+ + e- = K , φ= -1、6V 理想极化电极:在一定的电势范围内,可以借助外电源任意改变双电层的带电状况(因而改变界面区的电势差),而不致引起任何电化学反应的电极。
如KCl溶液中的汞电极。
不极化电极:指有电流通过时,电极与溶液界面间电势差不发生任何变化的电极。
双电层理论
双电层理论一.界面与相际一个相的表面叫作“界面”,界面的轮廓清晰,他的范围不会超过一原子层,可以看成是与另一相相互接触的表面。
相际:指两相之间,性质变化的区域,窄宽不等,其范围小之两个分子直径,大到数千个埃以上;其性质与两相中任意一相的本体性质都有所不同。
一个电极系统,也从在界面和相际,如图1-1所示。
相际内溶液的性质发生变化,例如溶液浓度与本体浓度不同。
当溶液中含有表面活性物质时,表面活性物质的表面吸附使C表>C本体。
相际内除了浓度随着距离改变外,各类双电层电位差在相际建立;各类吸附现象在相际发生;大多数电化学反应(电极反应)在相际进行。
电极系统的各种特性都将在相际中充分反映出来。
图1-1 电极系统的相、相界和相际 M-金属相;L-电解质溶液二.双电层的形成金属是由具有一定结合力的原子或离子结合而成的晶体。
晶体点阵上的质点离开点阵变成离子需要能量,需要外力做功。
任何一种金属与电解质溶液接触时,其界面上的原子(或离子)之间必然发生相互作用,形成双电层。
1.界面电荷层(1)当性质不同的相接触时,在相界面上形成了不同性质的电势差。
(2)出现电势差的原因是带电粒子或偶极子在界面层中的非均匀分布 双电层:由于电极和溶液界面带有的电荷符号相反,故电极/溶液界面上的荷电物质能部分地定向排列在界面两侧。
2.界面电荷层的形成 (1)自发形成的双电层(a )离子双电层 (b )吸附双电层 (c )偶极双电层 (2)强制形成的双电层金属电极与电解质溶液接触,可以自发形成双电层,也可以在外电源作用下强制形成双电层。
以如下电极反应为例:+++++M M2Hg–2e- = Hg22+ ,φ =0.1 VK+ + e- = K , φ= -1.6V 理想极化电极:在一定的电势范围内,可以借助外电源任意改变双电层的带电状况(因而改变界面区的电势差),而不致引起任何电化学反应的电极。
如KCl溶液中的汞电极。
不极化电极:指有电流通过时,电极与溶液界面间电势差不发生任何变化的电极。
双电层及其结构专业内容

φ=φ0时q=0:
q
q
dq
0
0 Cd d
(4-6)
高等教育
21
电极电位 为φ时的q 的数值相 当于图4.7 中的阴影 部分的面 积。
图4.7利用微分电容曲线计算电极表面剩余电荷密度q值
高等教育
22
三、电毛细曲线法和微分电容法比较
求q :电毛细曲线法利用σ~φ曲线的斜率求q
d / d q
高等教育
15
交流电桥法测定微分电容的基本线路:
直流极 化回路
交流信 号源
交流电桥
电极电位测量 回路
图4-4 交流电桥测量微分的基本电路
高等教育
16
电解池等效等效电路:
Cd
Rl
a
b
图4-5 时电解池等效电路
测量方法:测量时,小振幅的交流电压由交流信号 发生器G加到电桥的1、2两端。调节Rs和Cs,使 之分别等于电解池等效电路的电阻和电容部分时, 电桥3、4两端点的电位相等,电桥平衡,示波器 O示零。
定义:在一定电位范 围内,有电量通过时 不发生电化学反应的 电极体系称为理想极 化电极。
C
理想极化电极等效电路
高等教育
6
常用的理想极化电极——滴汞电极
Hg Hg e 0.1V
K e K Hg 1.6V
在+0.1~-1.6V之间可以认为该电 极是理想极化电极。
高等教育
7
第二节 电毛细现象 和双电层微分电容
高等教育
25
3、零电荷电位的用途
零电荷电位与电极电位联合用于处理电极过程的 动力学问题的几个作用:
通过零电荷电位判断电极表面剩余电荷的符号 和数量。例判断q的符号:
例:对于体系 Hg KCl 0 0.19V
双电层及其结构

第一节 概述 一、研究电极/溶液界面性质的意义
界面的结构和性质对电极反应的影响: (1)界面电场对电极反应速度的影响
通过控制电极电位有效地、连续地改变电 极反应速度
(2)电解液性质和电极材料及其表面状态的 影响
3
二、研究界面结构的基本方法
1、电极/溶液界面、界面结构和性质
“电极/溶液界面”:指两相之间的一个界面层, 即与任何一相基体性质不同的相间过渡区域。 界面结构:指在电极/溶液界面过渡区域中剩余电 荷和电位的分布以及它们与电极电位的关系。 界面性质:指界面层的物理化学特性,尤其是电 性质。
零电荷电位概念两种定义: 电极表面剩余电荷为零时的电极电位
电极/溶液界面不存在离子双电层时的电极电位
对零电荷电位的理解:零电荷电位仅仅表示电极 表面剩余电荷为零时的电极电位,而不表示电 极/溶液相间电位或绝对电极电位的零点。
25
2、零电荷电位的测定
通过测量电毛细曲线,求得与最大界面张力所 对应的电极电位值,即为零电荷电位,此方法 比较准确,但只适用于液态金属,如汞、汞齐 和融熔态金属 根据稀溶液的微分电容曲线最小值确定φ0,此 方法可用于固态金属,溶液越稀,微分电容最 小值越明显。
Hg Hg
K
e
0 . 1V
1 . 6V
e K Hg
在+0.1~-1.6V之间可以认为该电 极是理想极化电极。
8
第二节 电毛细现象 和双电层微分电容 一、电毛细曲线
1、电毛细现象和电毛细曲线概念
视频1 视频2
电毛细现象:界面张力σ随电极电位变化的 现象。
电毛细曲线:界面张力与电极电位的关系曲 线。
应于图4-3中电毛细曲线的最高点
双电层理论——精选推荐

双电层理论表面物理化学所涉及的内容非常宽广,固体在溶液中的荷电性质,实际上影响着固体表面性质和界面区的电荷转移反应及其进行的速度。
由于多种极其重要的表面电化学效应的发现,表面电化学引起了许多种科学家的重视和研究。
第一节 双 电 层2.1.1 双电层的产生在自然界中,固体与液体接触时,固体表面的荷电现象实际上是普遍存在的。
它导致了固—液界面的液体一侧带着相反电荷,这种界面电荷影响界面周围介质中的离子分布,与界面电荷符号相反的介质中的离子被吸向界面(这种离子称为反离子Counter -ions ),而相同符号的离子(称为同离子Co -ions )则被排离界面。
与此同时,离子的热运动又促使它们均匀混合在一起。
因此,在带电界面上形成一个扩散双电层(diffuse double layer )。
所谓扩散,就是界面周围介质中的反离子的过量是以扩散形式分布的,而不是非常整齐地集中排列在带电界面的周围。
例如,人体内与血液接触的动静脉壁和血液中胶粒等界面区都存在双电层结构,致使血液在血管中畅通无阻地流动以输送全身新陈代谢的营养而不产生血栓。
双电层理论研究反离子的扩散分布和带电界面的性质。
固体在溶液中荷电而构成双电层的原因,除了外加电场之外,大致上可归纳为以下几种情况: ① 电离作用固体表面在溶液中产生电离或溶液中的电离成分依靠某种结合力与固体表面结合而使其荷电。
例如,玻璃与水接触时,玻璃中的硅酸盐可电离出钾离子、钠离子或氢离子等,于是使玻璃带负电性而溶液带正电性;蛋白质分子具有的羧基(—COOH)和胺基(—NH 2)官能团,当pH 值降低时(酸性),溶液中电离的H +与胺基以氢键结合,从而使蛋白质带正电,-NH 2+H 2O -NH 3++OH -,而溶液一侧带负电,即在羧酸介质中—COOH 的电离被高氢浓度离子所抑制:—COOH+H 2O -COO -+H 3O+ 当pH 值升高时(碱性),蛋白质的羧基电离而使其带负电。
界面现象与双电层结构全解

有机分子的吸附规律
电极/溶液界面上的吸附与在一般表面上的吸附都 服从某些共同规律
电极/溶液界面具有可在一定范围内连续变化的电 场而又存在某些特殊规律
有机表面活性分子在电极表面的吸附行为,除了 与其本身的化学性质和浓度有关外,电极表面电 荷密度和电极表面的化学性质也能影响其吸附行 为
同一有机表面活性分子在不同的电极表面上以及 在不同电势下的吸附行为也可以极不相同
某些粒子在界面上发生吸附时其吸附量、界面张 力和化学势三者具有如下关系:
d i di
李普曼(Lippman)公式的推导
当电极表面上的剩余电荷密度为q时,电子的表面
吸附量为θe=-q/F,而电子向界面移动的化学
势变化为dμe=-Fdφ, 电子的吸附量与化学势
的乘积为:
i di
q F
( Fd )
若推算的界面参数与实验测得的界面参数吻合, 则假设的界面双电层结构模型反映了界面的真实 结构
电毛细曲线方法和微分电容方法
理想极化电极与理想非极化电极 电毛细曲线方法 微分电容法 电毛细曲线法与微分电容法的比较
外电路流向电极/溶液界面电荷的作用
对于任何电化学体系,通过外电路流向电极/溶 液界面的电荷可能参加两种不同的过程
双电层结构理论的发展
博克里斯(Bockris)的新双电层模型认为双电层 结构必须考虑到双电层内存在着离子的特性吸附 和水分子的定向排列
紧靠电极表面的第一层水分子全部都定向排列, 这层水的相对介电常数ε降至6~7(称之为介电饱 和)
第二层水分子是部分定向排列,其中有些水分子 是离子的初级水化水,它的相对介电常数ε为30~ 40,少于正常水的ε=78.5
由外电源提供的电荷电量全部用于电化学反应而 电极电势不变的电极体系称之为“理想非极化电 极”
(完整word版)双电层理论
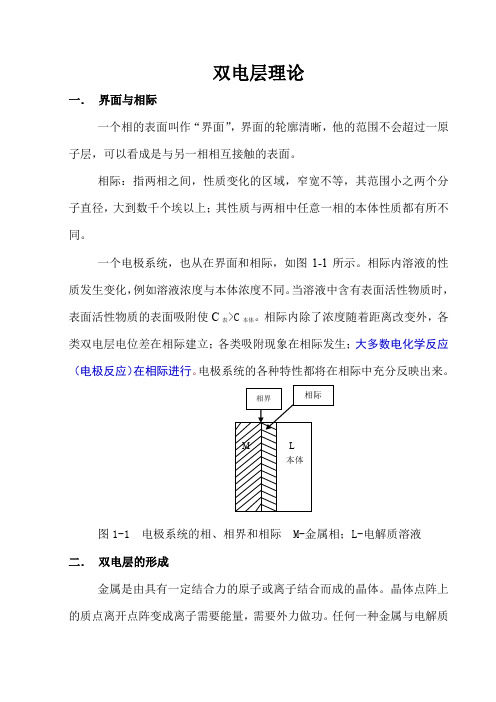
双电层理论一.界面与相际一个相的表面叫作“界面”,界面的轮廓清晰,他的范围不会超过一原子层,可以看成是与另一相相互接触的表面。
相际:指两相之间,性质变化的区域,窄宽不等,其范围小之两个分子直径,大到数千个埃以上;其性质与两相中任意一相的本体性质都有所不同。
一个电极系统,也从在界面和相际,如图1-1所示。
相际内溶液的性质发生变化,例如溶液浓度与本体浓度不同。
当溶液中含有表面活性物质时,表面活性物质的表面吸附使C表>C本体。
相际内除了浓度随着距离改变外,各类双电层电位差在相际建立;各类吸附现象在相际发生;大多数电化学反应(电极反应)在相际进行。
电极系统的各种特性都将在相际中充分反映出来。
图1-1 电极系统的相、相界和相际 M-金属相;L-电解质溶液二.双电层的形成金属是由具有一定结合力的原子或离子结合而成的晶体。
晶体点阵上的质点离开点阵变成离子需要能量,需要外力做功。
任何一种金属与电解质溶液接触时,其界面上的原子(或离子)之间必然发生相互作用,形成双电层。
1.界面电荷层(1)当性质不同的相接触时,在相界面上形成了不同性质的电势差。
(2)出现电势差的原因是带电粒子或偶极子在界面层中的非均匀分布 双电层:由于电极和溶液界面带有的电荷符号相反,故电极/溶液界面上的荷电物质能部分地定向排列在界面两侧。
2.界面电荷层的形成 (1)自发形成的双电层(a )离子双电层 (b )吸附双电层 (c )偶极双电层 (2)强制形成的双电层金属电极与电解质溶液接触,可以自发形成双电层,也可以在外电源作用下强制形成双电层。
以如下电极反应为例:+++++M M2Hg–2e- = Hg22+ ,φ =0.1 VK+ + e- = K , φ= -1.6V 理想极化电极:在一定的电势范围内,可以借助外电源任意改变双电层的带电状况(因而改变界面区的电势差),而不致引起任何电化学反应的电极。
如KCl溶液中的汞电极。
不极化电极:指有电流通过时,电极与溶液界面间电势差不发生任何变化的电极。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-0.557
0.098
1.2 非法拉第过程及电极-溶液界面的特性
1. 法拉第过程和非法拉第过程
法拉第过程:电荷经过金属-溶液界面进行的传递过程。 (这种电子传递引起氧化还原反应的发生)
非法拉第过程:在某一给定的电势范围内,不发生电荷传 递反应的过程。 (如吸附和脱附这样一类过程)
2. 理想极化电极
理论电化学
主要参考书
1. 2. 《电化学基础》高颖, 邬冰,化学工业出版社 《电化学方法 原理及应用》A. J. 巴德,化学工业出版社
绪论
• 电化学研究对象 • 电化学的发展 • 电化学的应用
电化学
化学:研究物质变化极其伴随现象的规律和关系,物 质的量(浓度、摩尔)、变化的快慢(速度)、变化的 程度(平衡)、变化的条件….
标准氢电极是最重要的参比电极,因为它是定义标
准电极电势标度的一种电极。它的重现性非常好,在不
同的氢电极上只相差10μV.
Pt,H2(p=p)|H+(aH+=1) 电极电势规定为零
存在很多不同的镀铂的方法,但通常是在3%的氯铂酸 (H2PtCl6)溶液中含有少量的醋酸盐(0.005%)用来延
长电极的寿命。
须研究这一界面层的结构和性质。
在下面的讨论中,假定电极体系为理想极化电极。
当理想极化电极的电势改变时,由于电荷不能穿 过其界面,所以电极-溶液界面的行为就类似于电 容器。
q C E
q是电容器的电量,E是电容器两端的电位
双电层的产生: 当金属和其金属离子溶液接触时,视溶液中离子浓度不 同,可产生两种不同现象: ⑴ 金属电极把离子 送入溶液,它本 身带负电荷
电化学的发展史
• Butler(1924)提出电化学反应速度,并用动力 学公式推导出Nernst关系式(电极过程动力学) • Warburg(1899)提出了用等效电路描述电极反应, Dolin、Frumkin(1940)提出第一个等效电路 • Dolin、Frumkin(1940)提出了交换电流密度 的概念 • Gurney(1931)对电子通过相界面的传递进行了量 子力学的探讨,并提出了电子的隧道传输机理 (量子电化学) • Hush、Marcus、Gerischer等发展了严格的量子 电化学观点(量子电化学)
电化学的应用
• • • • • • • • 电冶金 电镀 电合成 化学电源 电化学加工 化学传感器 电化学分析 金属的防腐
第一章 电极的界面双电层性质
1.1 电化学的基本概念和基础知识
1. 导体
能导电的物质称为导体。 第一类导体:电子导体。 金属、石墨、某些金属化合物,如 WC等。
特点:温度升高,电阻增大
•
•
正极:发生还原反应
Cu2+ +2e Cu
电解池(electrolytic cell):若在外电路中
并联一个有一定电压的外加电源,则将有电 流从外加电源流入电池,迫使电池中发生化 学变化,此时电能就转变为化学能,该电池 就称为电解池。
图1.2 原电池和电解池 (a)原电池 (b)电解池
Nafion膜
电荷密度是与双电层所产生的界面电位差V成正比 q = CdV Cd为双电层电容。
Helmholtz双电层模型
电容随所加电势的变化
q C E
在浓溶液中,特别是在电势差较大时,用 Holmholtz模型计算的电容值能较好地符合实验 结果,所以这一模型在一定条件下也反映了双电 层的真实结构。
但这个模型有两个主要缺点,首先他只考虑
电极反应是施加影响的,电极表面可以与溶液中的组分形成化
学键(形成氧化物或吸附等面的电子传递引起的)这一部分将在
后面的章节中进一步讨论。
氧化还原电极最初使用的材料是贵金属,如铂和金,还有汞 。目前使用的惰性电极材料有很多种,如玻璃碳,不同形式的 石墨,还有半导体氧化物,只要在所应用的电势范围内,电极 材料表面本身不发生反应。 如: Pt | Sn4+, Sn2+
原电池的构成
电解质溶液
两个半电池(电极)
原电池 盐桥 外接电路
金属导体 固体电子导体 惰性固体导体
原电池将分子之间直接发生的氧化还原反应,通过电 极间接完成。每个电极上发生一个半反应—半电池反应 (或电极反应)。
如:Zn + Cu2+
•
•
Zn 2+ + Cu
负极:发生氧化反应
Zn -2e Zn2 +
碱性溶液中常用的参比电极是 Hg-HgO|OH-
图 1.4 甘汞电极
图 1.5 银-氯化银电极
氧化还原电极或惰性电极。 这一类电极是一个电子源或电子
接收器,允许电子的传输而自身并不象第一类和第二类电极那
样参与反应。 这也是之所以称为氧化还原电极或惰性电极的 原因。事实上惰性电极的概念是理想化的,因为电极的表面对
⑵金属离子转移 到金属电极上去, 使它带正电荷;
在金属表面和靠近金属表面的薄层溶液中,各带符号相反、数 量相同的过剩电荷,这就形成了双电层。
4 双电层结构的理论模型
(1) 平行板电容器模型
关于金属-溶液界面双电层结构的第一个模型是 Helmholtz(1853)提出的,双电层类似于平行板电容器。
双电层的厚度d(即平板电容器的面间距)被认为是离子 半径 r 过剩电荷密度: qM = - qs
RT ln aM n nF
(b)非金属与其离子 例如:Pt, H2 (p)| H+(a) Pt, Cl2 (p) | Cl (a)
图1.3 氢电极
电极反应为:
1 H 2 ( p ) e H ( aH ) 2
2 p1/ H2
电极电势为: RT ln
F
aH
p 是氢气的分压
第二类电极:金属与其金属离子可以形成难溶盐的 溶液相接触。例如, Hg-Hg2Cl2|Cl-, 也称为甘汞电极 (图1.4)。
电极反应:
1 Hg 2Cl2 e Hg Cl 2
RT 电极电势: ln aCl F
这一类电极常用于参比电极,因为这种难溶盐参与电极反应, 使电极电势非常稳定。 另一个常用的参比电极的例子是 Ag-AgCl|Cl-,
第二类导体:离子导体,它依靠离子的定向运动而导电。 电解质溶液,熔融电解质,固体电解质(Nafion膜)。
特点:温度升高,电阻减小,电导增大。
2.
电池
(1)电池的概念 第一类导体作为电极( electrode ),浸入第二类导体 中。当电流流过第二类导体时,正负离子分别向两极移 动,同时在电极上有氧化还原反应发生。若用第一类导
(4)半电池的表示法,半电池电极反应的写法
电池
Zn(s) ∣ZnSO4(a1) || H2SO4(a2) ∣H2 (p),Pt 半电池 Zn(s) ∣ZnSO4(a1) Pt,H2 (p)∣H2SO4(a2) 电极反应写还原反应形式
Zn ─→ Zn2+(a1) + 2e
H2 (p) ─→ 2H+ (a2) + 2e CH3OH + H2O → CO2 + 6H+ + 6e-
体联结两个电极并使电流在两极间通过,则构成外电路
,这种装置就叫做电池(cell)。
电池过程
1.1 V
阳极 Zn
盐 桥
阴极 Cu
ZnSO4
CuSO4
电池
电解池
原电池
原电池:若电池能自发地在两极上发生化 学反应,并产生电流,此时化学能转化为电
能,则该电池就称为原电池(primary cell)。
实用的原电池称为化学电源。
(6) 参比电极
电势只能记录相对于所选择参比值下的电势差。
条件: 相对时间和温度有稳定电势值的电极,且电势不 会随体系小的振动所改变(例如体系有很小的电流通过等) 第一类型:标准氢电极 第二类型:常用的参比电极 甘汞电极(Hg/Hg2Cl2), 银-氯化银电极(Ag/AgCl) 汞-硫酸亚汞电极(Hg/Hg2SO4) 其它: 玻璃电极,上节中第三类电极等。
物理化学:是以物理的原理和实验技术为基础,研究所 有 物质体系的化学行为的原理、规律和方法的 学科。
电化学:相界面上伴随电子转移的化学变化
3
电化学的研究对象
电化学系统的构成 • 第一类导体(物理学)
• 第二类导体(离子学)
• 界面问题 (电极学,电极过程动力学)
电化学的发展史
• 伽伐尼(1791年发现电化学现象、伏打(1800 年建立伏打电堆) • 法拉第1834年提出了法拉定律(电流与物质之 间的作用) • 吉布斯(1873)和亥姆荷茨(1882)(电动势 与热力学) • 阿累尼乌斯(1887)、德拜和尢格尔(1923- 1925)(电解质导电理论) • 塔菲尔(1905)塔菲尔方程(电极动力学经验 公式)
电极与吸附层之间的相互作用,而忽略了它的其 它作用;其次它没有考虑电解质溶液浓度的影响 。
对Helmholtz模型的评价
1、利用该模型计算的双电层电容值, 对有机物吸附时是可靠的,但对水可 靠性差。但数量级对; 2、该模型与实验事实定性符合; 3、该模型不能对解释电容、表面张 力与溶液浓度及与温度的关系
(5)电极的分类 我们这里介绍的是比较经典的分类。电极材料和与之相接 触的溶液分成四类:
第一类电极:电极与它的离子溶液相接触。这类电极可分 为两种情况:
(a)金属与它的阳离子,一般表示为M|Mn+
例如:Zn|Zn2+
相应的电极反应为: M → M n++ne Fe → Fe2+ + 2e 电极电势为: Cu → Cu2+ + 2e
在-2.1-0.25的电势范围内,无电荷传递反应发生。
