配制一定的物质的量浓度溶液中的误差分析
一定物质的量浓度溶液配制的误差分析方法

一定物质的量浓度溶液配制的误差分析方法物质的量浓度溶液配制是化学实验中常见的操作步骤。
为了保证实验结果的准确性和可靠性,必须对配制过程中的误差进行分析。
下面将介绍一种常用的方法来分析配制误差。
1.称量误差:称量过程中天平的分度值和读数的精度都会影响实际称取物质的准确性。
2.体积误差:液体的体积测量通常使用体积瓶、移液管等器具,其刻度精度和读数准确性会影响实际加入的溶剂体积。
3.化学反应误差:在配制溶液的化学反应过程中,反应的理论计算与实际反应可能存在差异,导致最终浓度与理论浓度有偏差。
二、误差评估方法1.称量误差评估:称量误差可以通过重复称量测量来评估,根据多次称量结果的数值差异,可计算出平均值和标准偏差,进而确定称量的相对误差。
相对误差(%)=(标准偏差/平均值)×100%2.体积误差评估:体积误差可以通过重复测量溶剂体积并计算平均值和标准偏差来评估。
与称量误差评估类似,体积误差的相对误差也可以计算得出。
3.化学反应误差评估:化学反应误差的评估可以通过理论计算与实际实验结果进行比对。
根据反应物的量,计算出理论生成物的量,然后与实际生成物的量进行对比,计算出相对误差。
三、误差控制方法1.使用精确的量具:选择分辨率高、读数准确的天平、体积瓶等量具,减小称量和体积测量误差。
2.重复测量和称量:多次进行称量和体积测量,计算平均值和标准偏差,以提高准确性。
3.控制反应条件:实验过程中,应注意控制反应条件,如温度、压力、反应时间等,以减小化学反应误差。
4.由实测值反推理论量:可以根据实测值和浓度的关系,反推出理论计算值,然后与实际实验结果进行比对,以评估误差。
四、误差处理在实验结果上报时,通常会将误差附加在结果的后面,以体现实验的可靠性。
误差一般以相对误差的形式给出,并考虑到测量的可信度,给出误差范围。
一定物质的量浓度的配置常见的误差分析

一定物质的量浓度的配置常见的误差分析一、配制的主要步骤计算→称量(或取液)→溶解(或稀释)→转移→定容→摇匀→装入试剂瓶→贴标签等。
二、应注意的问题1.配制一定物质的量浓度的溶液是将一定质量或体积的溶质按所配溶液的体积在选定的容量瓶中定容,因而不需要计算水的用量。
2.不能配制任意体积的一定物质的量浓度的溶液。
这是因为在配制的过程中是用容量瓶来定容的,而容量瓶的规格又是有限的,常用的有50mL、100mL、250mL、500mL和1000mL等。
所以只能配制体积与容量瓶容积相同的一定物质的量浓度的溶液。
3.在配制一定物质的量浓度的溶液时,不能直接将溶质放入容量瓶中进行溶解,而要在烧杯中溶解,待烧杯中溶液的温度恢复到室温时,才能将溶液转移到容量瓶中。
这是因为容量瓶的容积是在20℃时标定的,而绝大多数物质溶解时都会伴随着吸热或放热过程的发生,引起温度的升降,从而影响到溶液的体积,使所配的溶液的物质的量浓度不准确。
4.定容后的容量瓶在反复颠倒、振荡后,会出现容量瓶中的液面低于容量瓶刻度线的情况,这时不能再向容量瓶中加入蒸馏水。
这是因为容量瓶是属于“容纳量”式的玻璃仪器(指注入量器的液体的体积等于容器刻度所示的体积)。
用滴管定容到溶液的凹面与容量瓶的刻度线相切时,液体的体积恰好为容量瓶的标定容积。
将容量瓶反复颠倒、振荡后,出现容量瓶中的液面低于容量瓶刻度线的情况,主要是部分溶液在润湿容量瓶磨口时有所损失。
三、误差分析1.使所配溶液的物质的量浓度偏高的主要原因:⑴天平的砝码沾有其他物质或已锈蚀;⑵试剂砝码的左右位置颠倒;⑶调整天平零点时,游码放在了刻度线的右端;⑷用量筒量取液体时,仰视读数,使所读液体的体积偏大;⑸容量瓶内溶液的温度高于20℃,造成所量取的溶液的体积小于容量瓶上所标注的液体的体积,致使溶液浓度偏高;⑹给容量瓶定容时,俯视标线会使溶液的体积减小,致使溶液浓度偏高。
2.使所配溶液的物质的量浓度偏低的主要原因:⑴直接称热的物质;⑵砝码有残缺;⑶在敞口容器中称量易吸收空气中其他成分或易于挥发的物质时的动作过慢;⑷用量筒量取液体时,俯视读数,使所读液体的体积偏小;⑸用于溶解稀释溶液的烧杯,未用蒸馏水洗涤,使溶质的物质的量减少,致使溶液浓度偏低;⑹转移或搅拌溶液时,有部分液体溅出,致使溶液浓度偏低;⑺给容量瓶定容时,仰视标线,会使溶液的体积增大,致使溶液浓度偏低。
配一定物质的量浓度溶液的误差分析

《配一定物质的量浓度溶液的误差分析》测试【课标要求】了解物质的量浓度的含义及有关计算。
【考向瞭望】一定物质的量浓度的溶液的误差分析。
【知识梳理】每空2分,共100分根据c =n /V =m B /M B V 判断,误差来源的根本原因是:溶质的质量m B 和溶液的体积V ,若在操作中造成m B 偏大或V 偏小,则c ;若造成m B 偏小或V 偏大,则c 。
一、称量误差分析(一)天平的砝码沾有其他物质或生锈。
(m B ,c B )(二)调整“0”点时,游码在大于0的位置。
(m B ,c B )(三)在敝口容器中称量NaOH 、CaCl 2、CuSO 4粉末、MgCl 2等易吸收水的物质。
(m B ,c B )(四)称量已部分风化的Na 2CO 3·10H 2O 、CuSO 4·5H 2O 等。
(m B ,c B )(五)用量筒量取浓溶液时,仰视读数。
(m B ,c B )二、配制过程误差分析(一)称好后的药品放入烧杯时,有少量洒在烧杯外。
(m B ,c B )(二)溶解搅拌时有部分液体溅出。
(m B ,c B )(三)转移时有部分液体溅出。
(m B ,c B )(四)未洗涤烧杯和玻璃棒2次~3次。
(m B ,c B )(五)溶解时放热,且未冷却至室温(20℃)(V ,c B );溶解时吸热,且未恢复到室温(20℃)(V ,c B )(六)在定容时,仰视读数(V ,c B ),俯视读数(V ,c B )(七)在定容时加水超过刻度线,再用胶头滴管吸出多余部分。
(V ,c B )(八)加水至刻度线后,摇匀过程中,发现液面低于刻度线。
( )(九)洗涤容量瓶后,未干燥,瓶中有少量蒸馏水。
( )三、俯视、仰视的分析如右图结果:仰视时,容器内液面 刻度线;俯视时,容器内液面 刻度线。
(选填高于、低于)【思考感悟】溶液有哪些性质?混合溶液的体积将如何改变? (1)溶液具有均一性,即同一溶液,无论取出多大体积,其各种浓度(物质的量浓度、质量分数、离子浓度等)均不变。
配制一定物质的量浓度溶液实验的误差分析(精)

配制一定物质的量浓度溶液实验的误差分析配制一定物质的量浓度溶液试验是中学化学中的一个重要的定量实验,引起所配制溶液浓度不准确的因素很多,现就实验过程中的不规范操作引起的各种误差进行详细讨论。
配制一定物质的量浓度溶液的实验步骤为:计算、称量(或量取、溶解稀释、冷却、转移、洗涤、定容、摇匀。
物质的量浓度的计算公式为:物质的量浓度(c)=溶质的物质的量(moL/溶液的体积(L,每个操作步骤中存在的误差都由溶质的物质的量n和溶液的体积V 引起。
误差分析时,关键要看不规范的操作引起了n和V 的怎样变化。
具体分析如下:1.配制480mL0.1moL /L的氢氧化钠溶液,经计算需用托盘天平称取氢氧化钠固体19. g。
分析:偏小。
容量瓶的规格是固定的(50mL、100mL、250mL、500mL、1000mL),不能用容量瓶配制任意体积的一定物质的量浓度的溶液。
所以,氢氧化钠固体的质量应以500mL溶液计算,为20.0g。
2.配制500mL 0.1moL /L的硫酸铜溶液,需称取胆矾8.0g。
分析:偏小。
胆矾为CuSO 4·5H 2O ,而硫酸铜溶液的溶质是CuSO 4,把硫酸铜的质量误认为就是硫酸铜晶体的质量(CuSO 4·5H 2O 应为12.5g ),导致计算值偏小,所称量溶质偏小。
3.配制硫酸铜溶液时,所用胆矾部分风化。
分析:偏大。
胆矾中结晶水含量减少,但所称胆矾的质量不变,溶质硫酸铜质量偏大。
4.配制氢氧化钠溶液时,称量时间过长。
分析:偏小。
氢氧化钠等物质具有吸湿性,使所称量的溶质氢氧化钠偏小。
所以称量速度要快或放在称量瓶中称量。
5.配制氢氧化钠溶液时,天平的托盘上放两个大小相等的纸片。
分析:偏小。
氢氧化钠具有吸湿性和腐蚀性,要放在玻璃器皿中称量,如表面皿或小烧杯中称量。
若用纸片,吸湿后的氢氧化钠会粘在纸片上,使溶质损失,浓度偏小。
此外,氢氧化钠易腐蚀天平的托盘,不能直接放在托盘上称量.6.称量溶质时,所用小烧杯不干燥。
配制一定的物质的量浓度溶液中的误差分析

2.转移时,不小心将溶液溅出一些:
m ↓ ,C ↓
(原因:造成少量溶质溅出)
3.洗涤时:
} (1)忘记洗涤:
(原因:造成少量溶质残留在烧杯或玻璃棒
)
(2)洗涤后忘记把洗涤液倒入容量瓶
m↓ , C↓
(原因:造成少量溶质被倒掉了)
实用文档
{ 4.定容时
仰视:V ,C ↓
(原因:蒸馏↑水加多了)
俯视:V ↓ ,C ↓
实用文档
(原因:蒸馏水加少了)
加蒸馏水时超过了刻度线,用吸管吸出一部份:
V ↑, C ↓
(原因:蒸馏水加多了)
实用文档
5.未冷却就转移:V ↓ ,C
(原因:根据热胀冷缩的原理,未↑冷却时液
体体积膨胀,造成定容时所需水的体积偏小 ,配得的溶液C偏大)
实用文档
6.摇匀后容量瓶的液面下降,又加
水至刻度线V :↑C ↓ (原因:不应,再加水,水加多了,造成溶液
V偏大)
实用文档
7.容量瓶未干燥,瓶中有少量的蒸馏水:
对浓度无影响 。
(因为在配制过程中,要往容量瓶里加蒸 馏水)
实用文档
相关练习:
下列配制的溶液浓度偏高的是( ) A、配制盐酸溶液用量筒量取盐酸时俯视刻 度线 B、配制盐酸溶液定容时,仰视容量瓶刻度 线 C、称量11.7gNaCl配制0.2mol/LNacl溶液 1000mL,砝码错放在左盘 D、NaOH溶解后未经冷却即注入容量瓶定容 至刻度线。
一定物质的量浓度溶液 的配制实验的误差分析
实用文档
实用文档
实用文档
可能出现误差的情况:
{{{ 1.称量或量取
(1)右物左码: m ↓,C ↓
重难点十二配制一定物质的量浓度溶液的误差分析
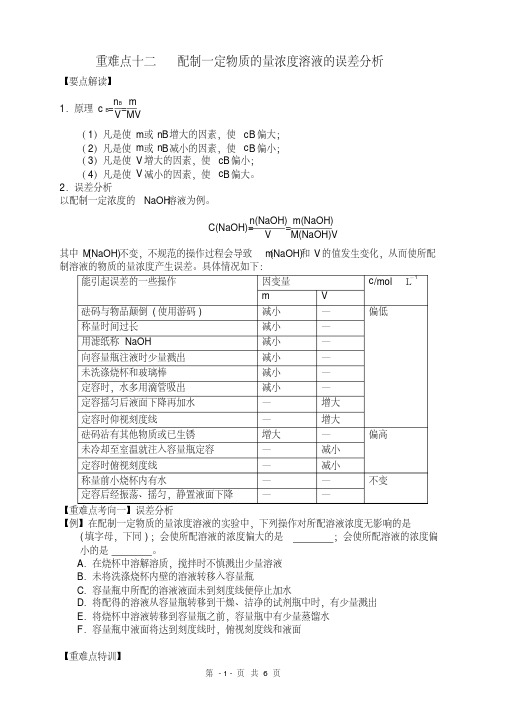
重难点十二配制一定物质的量浓度溶液的误差分析【要点解读】1.原理 c B =n B V =mMV(1)凡是使m 或nB 增大的因素,使cB 偏大;(2)凡是使m 或n B 减小的因素,使c B 偏小;(3)凡是使V 增大的因素,使c B 偏小;(4)凡是使V 减小的因素,使c B 偏大。
2.误差分析以配制一定浓度的NaOH 溶液为例。
C(NaOH)=n(NaOH)V =m(NaOH)M(NaOH)V其中M (NaOH)不变,不规范的操作过程会导致m (NaOH)和V 的值发生变化,从而使所配制溶液的物质的量浓度产生误差。
具体情况如下:能引起误差的一些操作因变量c /mol ·L-1mV 砝码与物品颠倒(使用游码) 减小—偏低称量时间过长减小—用滤纸称NaOH 减小—向容量瓶注液时少量溅出减小—未洗涤烧杯和玻璃棒减小—定容时,水多用滴管吸出减小—定容摇匀后液面下降再加水—增大定容时仰视刻度线—增大砝码沾有其他物质或已生锈增大—偏高未冷却至室温就注入容量瓶定容—减小定容时俯视刻度线—减小称量前小烧杯内有水——不变定容后经振荡、摇匀,静置液面下降——【重难点考向一】误差分析【例】在配制一定物质的量浓度溶液的实验中,下列操作对所配溶液浓度无影响的是(填字母,下同);会使所配溶液的浓度偏大的是;会使所配溶液的浓度偏小的是。
A .在烧杯中溶解溶质,搅拌时不慎溅出少量溶液B .未将洗涤烧杯内壁的溶液转移入容量瓶C .容量瓶中所配的溶液液面未到刻度线便停止加水D .将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出E .将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水F .容量瓶中液面将达到刻度线时,俯视刻度线和液面【重难点特训】1.下列对实验操作分析错误的是()A.配制0.1 mol/L NaCl溶液时,若没有洗涤烧杯和玻璃棒,则所得溶液物质的量浓度偏低B.NH4NO3溶解吸热,若配制0.5mol/L NH4NO3溶液时直接将溶解后的溶液转移到容量瓶中,则所得溶液的物质的量浓度偏高C.配制一定物质的量浓度溶液时,若所用砝码已经生锈,则所得溶液的物质的量浓度偏高D.配制一定物质的量浓度溶液时,若定容中不小心加水超过刻度线,立刻将超出的水吸出,则所得溶液的物质的量浓度偏低2.使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了②有些固体溶解会放热,若未经冷却即转移至容量瓶③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤④转移溶液前容量瓶内有少量蒸馏水⑤定容时,仰视容量瓶的刻度线⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线A.①③⑤⑥ B.①②⑤⑥ C.②③④⑥ D.③④⑤⑥3.用98%浓硫酸配制2mol/L的稀硫酸,下列情况会使所配溶液浓度偏低的是A.未冷却就转移、定容 B.容量瓶原有少量蒸馏水C.定容时俯视刻度线观察液面 D.量筒取浓盐酸时,俯视读数4.配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是()A.容量瓶中原有少量的蒸馏水 B.移液时,不慎将液体流到瓶外C.容量瓶盛过KOH溶液,使用前未洗涤 D.定容时俯视刻度线和液面5.用质量分数为36.5%的盐酸(密度为 1.16g?cm﹣3)配制1mol?L﹣1的稀盐酸.现实验室仅需要这种盐酸220mL,试回答下列问题:(1)配制稀盐酸时,除了用到量筒、烧杯、玻璃棒、胶头滴管,还需使用的玻璃仪器有。
配制物质的量浓度溶液应注意的问题及误差分析

▁▂▃▄▅▆▇█▉▊▋▌精诚凝聚 =^_^= 成就梦想 ▁▂▃▄▅▆▇█▉▊▋▌▃ ▄ ▅ ▆ ▇ █ █ ■ ▓点亮心灯 ~~~///(^v^)\\\~~~ 照亮人生 ▃ ▄ ▅ ▆ ▇ █ █ ■ ▓ 配制物质的量浓度溶液应注意的问题及误差分析1.配制一定物质的量浓度的溶液时应注意的问题(1)配制一定物质的量浓度的溶液是将一定质量或体积的溶质按所配溶液的体积在选定的容量瓶中定容,因而不需要计算水的用量。
(2)不能配制任意体积的一定物质的量浓度的溶液。
这是因为在配制的过程中是用容量瓶来定容的,而容量瓶的规格又是有限的,常用的有50 mL 、100 mL 、250 mL 、500 mL 、和1000 mL 等。
所以只能配制体积与容量瓶容积相同的一定物质的量浓度的溶液。
(3)在配制一定物质的量浓度的溶液时,不能直接将溶质放入容量瓶中进行溶解,而要在烧杯中溶解,待烧杯中溶液的温度恢复到室温时,才能将溶液转移到容量瓶中。
这是因为容量瓶的容积是在20℃时标定的,而绝大多数物质溶解时都会伴着吸热或放热过程的发生,引起温度的升降,从而影响到溶液的体积,使所配制的溶液的物质的量浓度不准确。
(4)定容后的容量瓶在反复颠倒、振荡后,会出现容量瓶中的液面低于容量瓶刻度线的情况,这时不能再向容量瓶中加入蒸馏水。
这是因为容量瓶是属于“容纳量”式的玻璃仪器(指注入量器的液体的体积等于容器刻度所示的体积)。
用滴管定容到溶液的凹面与容量瓶的刻度线相切时,液体的体积恰好为容量瓶的标定容积。
将容量瓶反复颠倒、振荡后,出现容量瓶中的液面低于容量瓶刻度线的情况,主要是部分溶液的润湿容量瓶磨口时有所损失,以及粒子间隔减小造成的。
2.配制一定体积、一定物质的量浓度的溶液实验误差的主要原因(1)称量或量取时所引起的误差使所配溶液的物质的量浓度偏高的主要原因:①天平的砝码沾有其他物质或已锈蚀,导致称量物质的实际值是大于称量值;②称量时游码忘记归零;③调整天平零点时,游码放在了刻度线的右端;④用滴定管量取..液体时,开始时平视读数,结束时俯视读数,使所量取的液体的体积偏大,等等。
一定物质的量浓度溶液的配制实验误差分析

D.称取12.5g胆矾配成500mL溶液
用 已 经 准 确 称 量 过 的 NaCl 固 体 配 制 500mL0.5mol/L 的 NaCl 溶液,下列哪些 仪器是必须用到的:①玻璃棒②分液漏 斗③胶头滴管④容量瓶⑤烧杯⑥烧瓶 (C )
A. ②③④ C. ①③④⑤ B. ①④⑤ D. ③④⑤⑥
配制 100mL 1.0mol· L-1 的 NaOH 溶液, 下列会导致溶液浓度偏高的是( C )
试分析下列操作会引起所配制溶液的物 质的量浓度偏高还是偏低? (1)天平的砝码已经锈蚀 偏高
(2)称取NaOH时动作过慢 偏低 (3)溶解NaOH后未等溶液冷却就转移 至容量瓶中 偏高 (4)烧杯未用蒸馏水洗涤 偏低 (5)转移溶液时有液体溅出 偏低 (6)定容时仰视刻度线 偏低
(7)定容时加水超过刻度线,又取出部 分溶液使液面降至刻度线 偏低 (8)容量瓶未干燥,事先有少量蒸馏水 无影响 (9)定容完毕后,当倒转振荡几次后, 再竖直容量瓶,发现瓶颈处的液面低 于刻度,又向容量瓶中加水至刻度 偏低
H2SO4。可供选择的仪器有:①玻璃棒 ②
⑦托盘天平 ⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到 的有 ②⑦⑧ (填代号)。
(2)经计算,需浓H2SO4的体积为 5.4mL 。
现有①10 mL ②50 mL ③100 mL三种 规格的量筒,你选用的量筒是 ① (填代 号 )。
( 3) 在 配 制 过 程 中 , 下 列 操 作 中 : 错 误 的 是 ,能引起误差偏高的有 (填代号)。 ①洗涤量取浓H2SO4后的量筒,将洗涤液转移到容 量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容 量瓶中 ③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏 水稀释浓H2SO4 ④定容时,加蒸馏水超过刻度线,又用胶头滴管 吸出
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.转移时,不小心将溶液溅出一些:
m ↓ ,C ↓
(原因:造成少量溶质溅出)
3.洗涤时:
} (1)忘记洗涤:
(原因:造成少量溶质残留在烧杯或玻璃棒
)
(2)洗涤后忘记把洗涤液倒入容量瓶
m↓ , C↓
(原因:造成少量溶质被倒掉了)
实用文档
{ 4.定容时
仰视:V ,C ↓
(原因:蒸馏↑水加多了)
俯视:V ↓ ,C ↓
实用文档
一定物质的量浓度溶液 的配制实验的误差分析
实用文档
实用文档
实用文档
可能出现误差的情况:
{{{ 1.称量或量取
(1)右物左码: m ↓,C ↓
称量
{ (2)砝码
生锈:m ↑ ,C ↑
缺块: m ↓ ,C ↓
(1)仰视:m ↑,C ↑
量取 (溶质取多了)
(2)俯视:m ↓,C ↓
(溶质取少了)
蒸馏水:
对浓度无影响 。
(因为在配制过程中,要往容量瓶里加蒸 馏水)
实用文档
相关练习:
下列配制的溶液浓度偏高的是( ) A、配制盐酸溶液用量筒量取盐酸时俯视刻 度线 B、配制盐酸溶液定容时,仰视容量瓶刻度 线 C、称量11.7gNaCl配制0.2mol/LNacl溶液 1000mL,砝码错放在左盘 D、NaOH溶解后未经冷却即注入容量瓶定容 至刻度线。
(原因:蒸馏水加少了)
加蒸馏水时超过了刻度线,用吸管吸出一部份:
V ↑, C ↓
(原因:蒸馏水加多了)
实用文档
5.未冷却就转移:V ↓ ,C
(原因:根据热胀冷缩的原理,未↑冷却时液
体体积膨胀,造成定容时所需水的体积偏小 ,配得的溶液C偏大)
实用文档
6.摇匀后容量瓶的液面下降,又加
水至刻度线V :↑C ↓ (原因:不应,再加水,水加多了,造成溶液
