高考化学中常考的有机化学方程式
高考化学基础方程式大全

高考化学基础方程式大全化学方程式是化学学习中的重要内容,对于高考来说更是重中之重。
熟练掌握基础化学方程式,不仅有助于理解化学反应的本质,还能在解题时提高效率和准确性。
以下为大家整理了一份高考化学基础方程式大全。
一、金属及其化合物1、钠及其化合物(1)钠在空气中燃烧:2Na + O₂= Na₂O₂(条件:点燃)(2)钠与水反应:2Na + 2H₂O = 2NaOH + H₂↑(3)过氧化钠与水反应:2Na₂O₂+ 2H₂O = 4NaOH + O₂↑(4)过氧化钠与二氧化碳反应:2Na₂O₂+ 2CO₂= 2Na₂CO₃+ O₂2、铝及其化合物(1)铝与氧气反应:4Al + 3O₂= 2Al₂O₃(条件:点燃)(2)铝与盐酸反应:2Al + 6HCl = 2AlCl₃+ 3H₂↑(3)铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H₂O =2NaAlO₂+ 3H₂↑(4)氧化铝与盐酸反应:Al₂O₃+ 6HCl = 2AlCl₃+ 3H₂O(5)氧化铝与氢氧化钠溶液反应:Al₂O₃+ 2NaOH = 2NaAlO₂+ H₂O(6)氢氧化铝与盐酸反应:Al(OH)₃+ 3HCl = AlCl₃+ 3H₂O (7)氢氧化铝与氢氧化钠溶液反应:Al(OH)₃+ NaOH =NaAlO₂+ 2H₂O3、铁及其化合物(1)铁与氧气反应:3Fe + 2O₂= Fe₃O₄(条件:点燃)(2)铁与盐酸反应:Fe + 2HCl = FeCl₂+ H₂↑(3)铁与硫酸铜溶液反应:Fe + CuSO₄= FeSO₄+ Cu(4)氧化铁与盐酸反应:Fe₂O₃+ 6HCl = 2FeCl₃+ 3H₂O(5)氯化亚铁与氯气反应:2FeCl₂+ Cl₂= 2FeCl₃(6)氯化铁与氢氧化钠溶液反应:FeCl₃+ 3NaOH = Fe(OH)₃↓ + 3NaCl二、非金属及其化合物1、氯及其化合物(1)氯气与氢气反应:H₂+ Cl₂= 2HCl(条件:点燃)(2)氯气与水反应:Cl₂+ H₂O = HCl + HClO(3)次氯酸光照分解:2HClO = 2HCl + O₂↑(条件:光照)(4)氯气与氢氧化钠溶液反应:Cl₂+ 2NaOH = NaCl + NaClO+ H₂O(5)氯气与氢氧化钙溶液反应:2Cl₂+ 2Ca(OH)₂= CaCl₂+Ca(ClO)₂+ 2H₂O2、硫及其化合物(1)硫在氧气中燃烧:S + O₂= SO₂(条件:点燃)(2)二氧化硫与水反应:SO₂+ H₂O ⇌ H₂SO₃(3)二氧化硫与氧气反应:2SO₂+ O₂⇌ 2SO₃(条件:催化剂、加热)(4)三氧化硫与水反应:SO₃+ H₂O = H₂SO₄(5)浓硫酸与铜反应:Cu + 2H₂SO₄(浓) = CuSO₄+ SO₂↑ +2H₂O(条件:加热)3、氮及其化合物(1)氮气与氧气反应:N₂+ O₂= 2NO(条件:放电)(2)一氧化氮与氧气反应:2NO + O₂= 2NO₂(3)二氧化氮与水反应:3NO₂+ H₂O = 2HNO₃+ NO(4)氨气与水反应:NH₃+ H₂O ⇌ NH₃·H₂O(5)氨气与氯化氢反应:NH₃+ HCl = NH₄Cl(6)氯化铵受热分解:NH₄Cl = NH₃↑ +HCl↑(条件:加热)(7)碳酸氢铵受热分解:NH₄HCO₃= NH₃↑ + H₂O↑ + CO₂↑(条件:加热)三、有机化学基础方程式1、烃类(1)甲烷燃烧:CH₄+ 2O₂= CO₂+ 2H₂O(条件:点燃)(2)乙烯与溴水反应:CH₂=CH₂+ Br₂ → CH₂Br—CH₂Br(3)乙烯与氢气加成:CH₂=CH₂+ H₂ → CH₃—CH₃(条件:催化剂、加热)(4)乙烯与氯化氢加成:CH₂=CH₂+HCl → CH₃—CH₂Cl(条件:催化剂)(5)苯燃烧:2C₆H₆+ 15O₂= 12CO₂+ 6H₂O(条件:点燃)(6)苯与液溴反应:+ Br₂ → Br + HBr(条件:FeBr₃作催化剂)2、烃的衍生物(1)乙醇与钠反应:2CH₃CH₂OH +2Na → 2CH₃CH₂ONa +H₂↑(2)乙醇的催化氧化:2CH₃CH₂OH + O₂ 2CH₃CHO + 2H₂O (条件:Cu 或 Ag 作催化剂、加热)(3)乙酸与乙醇的酯化反应:CH₃COOH + C₂H₅OHCH₃COOC₂H₅+ H₂O(条件:浓硫酸、加热)四、化学反应类型相关方程式1、置换反应(1)锌与稀硫酸反应:Zn + H₂SO₄= ZnSO₄+ H₂↑(2)铁与硫酸铜溶液反应:Fe + CuSO₄= FeSO₄+ Cu2、复分解反应(1)盐酸与氢氧化钠反应:HCl + NaOH = NaCl + H₂O(2)碳酸钠与盐酸反应:Na₂CO₃+ 2HCl = 2NaCl + H₂O +CO₂↑3、分解反应(1)氯酸钾受热分解:2KClO₃ 2KCl + 3O₂↑(条件:MnO₂作催化剂、加热)(2)碳酸钙高温分解:CaCO₃ CaO + CO₂↑(条件:高温)以上只是高考化学中部分基础方程式,同学们在学习过程中要理解每个方程式的含义和反应条件,通过多做练习加深记忆,从而在高考中取得好成绩。
高三化学有机方程式汇总

学习好资料欢迎下载
高三有机方程式汇总
、烷烃反应类型反应方程式
取代反应
匕%+% " 9凡⑦+十方同时生成CH2c^、CHC^、CCl4
二、烯烃
反应类型反应方程式
加成反应
①能与H2、
HX、X2、
H2O加成 2 ②与X2加
成不需要
催化剂CH2=也+凡:、%巩
CHEHbErL CH2- CH2 Br B L
=强 + HX 催可剂》CHW% X
CH2 = CH2 + H20 催7剂1 CH3CH2OH
吗~CH= CH2 +期催?剂》风照萍或CH^CHCH^ X M
CHkCH —CH=CH2+E门-C1H2-CH-CH=CH3(1, 2 加成)
Er Br
CH L CH CH-CH2+Br2^ CH2 CH-CH /(L 4 加成)
Br Br
一吒CH,C也士聚乙烯
加聚反应
催化剂
“CH- - CH = CH^ -- 受上工——H CH—CH2七
3 2加蛰、加压 | "
匕*
的为=CH—CH= CH2催化剂、y H「UA=CH—C%上
三、芳香烃
四、炔烃
五、卤代烃
六、醇
七、苯酚
八、醛
九、酮
十、羧酸
十一、酯
十二、油脂
十三、糖类
十四、氨基酸
十五、蛋白质。
2022年高考化学有机转化关系及反应方程式书写
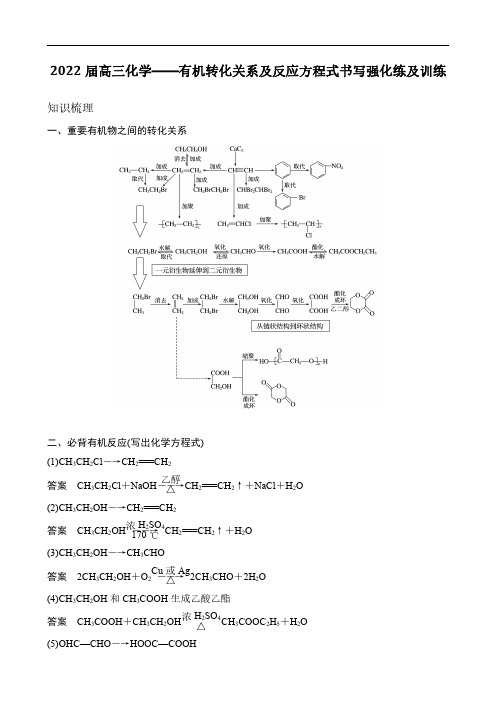
2022届高三化学——有机转化关系及反应方程式书写强化练及训练知识梳理一、重要有机物之间的转化关系二、必背有机反应(写出化学方程式)(1)CH 3CH 2Cl ―→CH 2===CH 2答案CH 3CH 2Cl +NaOH ――→乙醇△CH 2===CH 2↑+NaCl +H 2O(2)CH 3CH 2OH ―→CH 2===CH 2答案CH 3CH 2OH ――→浓H 2SO 4170℃CH 2===CH 2↑+H 2O (3)CH 3CH 2OH ―→CH 3CHO 答案2CH 3CH 2OH +O 2――→Cu 或Ag △2CH 3CHO +2H 2O(4)CH 3CH 2OH 和CH 3COOH 生成乙酸乙酯答案CH 3COOH +CH 3CH 2OH浓H 2SO 4△CH 3COOC 2H 5+H 2O (5)OHC—CHO ―→HOOC—COOH答案OHC—CHO +O 2――→催化剂△HOOC—COOH(6)乙二醇和乙二酸生成聚酯答案n HOCH 2—CH 2OH +n HOOC—COOH――→一定条件+(2n -1)H 2O (7)乙醛和银氨溶液的反应答案CH 3CHO +2Ag(NH 3)2OH ――→△CH 3COONH 4+2Ag ↓+3NH 3+H 2O(8)乙醛和新制Cu(OH)2悬浊液的反应答案CH 3CHO +2Cu(OH)2+NaOH ――→△CH 3COONa +Cu 2O ↓+3H 2O(9)答案(10)答案(11)和饱和溴水的反应答案(12)和溴蒸气(光照)的反应答案(13)和HCHO 的反应答案+(n -1)H 2O(14)酯在碱性条件的水解(以乙酸乙酯在NaOH 溶液中为例)答案CH 3COOC 2H 5+NaOH ――→△CH 3COONa +C 2H 5OH (15)和NaOH 的反应三、常考有机物的检验1.卤代烃中卤素的检验取样,滴入NaOH 溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO 3溶液,观察沉淀的颜色,确定是何种卤素。
高三化学高考必记的化学方程式

高三化学高考必记的化学方程式一、非金属元素的反应1. 卤族元素(1)氯气H 2+Cl 2=====点燃2HCl2Fe +3Cl 2=====点燃2FeCl 3Cl 2+H 2O===HCl +HClO2NaOH +Cl 2===NaClO +NaCl +H 2O2Ca(OH)2+2Cl 2===Ca(ClO)2+CaCl 2+2H 2O6FeBr 2+3Cl 2===4FeBr 3+2FeCl 3(氯气少量)2FeBr 2+3Cl 2===2FeCl 3+2Br 2(氯气过量)[活学巧用] 氯水成分复杂,性质多样:强酸性——H +的性质;杀菌、漂白性——HClO 的性质;强氧化性——Cl 2的性质。
氯气溶于水,但不溶于饱和食盐水,因此可用饱和食盐水除去Cl 2中的HCl 。
Cl 2与NaOH 溶液的反应被用于实验室除去多余的Cl 2,常出现在框图推断中。
[易错警示] 氯气与FeBr 2溶液反应时,一定要注意二者量的关系,Cl 2首先氧化的是Fe 2+,然后氧化Br -;但Cl 2与FeI 2溶液反应时,首先氧化的是I -,然后氧化Fe 2+。
根据得失电子守恒可得出相应反应的离子方程式,如等物质的量的Cl 2与FeBr 2在溶液中反应时,其离子方程式为2Fe 2++2Cl 2+2Br -===2Fe 3++4Cl -+Br 2。
(2)含氯化合物2HClO=====光照2HCl +O 2↑Ca(ClO)2+CO 2+H 2O===CaCO 3↓+2HClONaClO +2HCl===NaCl +Cl 2↑+H 2OMnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O[活学巧用] HClO 可作漂白剂和杀菌剂是由于HClO 具有强氧化性,长时间放置的氯水易变质是由于HClO 在光照条件下极易分解,所以新制的氯水需避光保存。
(3)卤素单质间的置换反应Cl 2+2NaBr===Br 2+2NaClCl 2+2NaI===I 2+2NaClBr 2+2KI===2KBr +I 2[活学巧用] 以上反应可用于比较Cl 2、Br 2、I 2氧化性(非金属性)的强弱或与CCl 4、淀粉溶液相结合用于溶液中Br -、I -的检验。
高考常考的化学方程式

..高考常考化学方程式〔一〕【说明】化学方程式是最重要的化学用语,每套高考试卷中都会考察。
本辑收录了高考无机化学方程式、离子反响方程式和有机反响方程式近300个,全面具体、书写准确、排版工整、方便记忆。
第一局部常考的无机化学方程式碱金属(钠、氧化钠、过氧化钠、氢氧化钠、钠盐)1、4Na+O2══2Na2O2、2Na + O2点燃Na 2O23、2Na+ Cl2点燃2NaCl4、2Na + S △Na2S〔爆炸〕5、2Na +2H2O══2NaOH + H2↑6、Na2O + H2O===2NaOH7、2Na2O +O2△2Na2O28、Na2O+ CO2══Na2CO39、Na2O+ 2HCl══2NaCl+ H2O10、2Na2O2 +2H2O══4NaOH + O2↑11、2Na2O2+2CO2══2Na2CO3+O212、2Na2O2+2H2SO4(冷、稀)══2Na2SO4+O2↑+2H2O13、2NaHCO3△Na2CO3+CO2+H2O14、NaHCO3+ NaOH══Na2CO3+ H2O15、Na2CO3+CO2+H2O══2NaHCO316、4Na+TiCl4(熔融)=4NaCl+Ti17、2Na+2NH3=2NaNH2+H218、NaH+H2O=NaOH+H2↑NaOH19、2NaOH+Si+H2O=Na2SiO3+2H2↑20、6NaOH+3S△2Na2S+Na2SO3+3H2O21、2NaOH+2Al+2H2O=2NaAlO2+3H2↑22、2NaOH(过量)+CO2=Na2CO3+H2O23、NaOH+CO2(过量)=NaHCO324、2NaOH+SiO2=Na2SiO3+H2O〔常温下强碱缓慢腐蚀玻璃〕25、2NaOH+Al2O3=2NaAlO2+H2O26、2NaOH+Cl2=NaCl+NaClO+H2O27、NaOH+HCl=NaCl+H2O28、NaOH+H2S(足量)=NaHS+H2O29、2NaOH+H2S(少量)=Na2S+2H2O30、3NaOH+AlCl3=Al(OH)3↓+3NaCl31、NaOH+Al(OH)3=NaAlO2+2H2O32、NaOH+NH4Cl△NaCl+NH3↑+H2O 33、2NaOH+P2O5=2NaPO3+H2O34、6NaOH+P2O5=2Na3PO3+3H2ONaAlO235、2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO336、3NaAlO2+AlCl3+6H2O=4Al(OH)3↓NaCl、NaClO、NaBr、NaI37、NaCl+H2SO4(浓)△NaHSO4+HCl↑38、H2SO4(浓)+2NaCl Na2SO4+2HCl39、2NaI+Cl2=2NaCl+I240、NaBr+H3PO4(浓)=NaH2PO4+HBr41、NaI+H3PO4(浓)=NaH2PO4+HI补充:2Na2O2+2H2O=4NaOH+O2↑(此反响分两步Na2O2+2H2O=2NaOH+H2O2;2H2O2=2H2O+O2↑。
(word完整版)高考必记的重要的有机化学方程式(精校版).doc

高考必记的重要的有机化学方程式一、烃1.甲烷▲ 烷烃通式: C n H 2n+2 ( n ≥1)( 1)氧化反应点燃CO 2+2H 2O甲烷的燃烧: CH 4+2O 2 甲烷(烷烃)不可使酸性高锰酸钾溶液及溴水褪色。
( 2)取代反应 光一氯甲烷: CH 4+Cl 2 CH 3Cl+HCl(一氯甲烷呈气态,其余三种均为油状液体)光二氯甲烷: CH 3Cl+Cl CH 2Cl 2+HCl2光CHCl 3+HCl ( CHCl 3 又叫氯仿)三氯甲烷: CH 2Cl 2+Cl 2四氯甲烷: CHCl 3+Cl 光CCl 4+HCl ( CCl 4 又叫四氯化碳,可作灭火剂,是一种重要的有机溶剂)2 2.乙烯浓硫酸乙烯的制取: CH 3CH 2OHH 2C=CH 2↑ +H 2O (浓硫酸作催化剂、脱水剂)170℃▲单烯烃通式: C n H 2n ( n ≥2)( 1)氧化反应点燃乙烯的燃烧: H 2 C=CH 2+3O 2 +2H 2 O2CO 2 乙烯(烯烃)可以使酸性高锰酸钾溶液褪色,发生氧化反应。
( 2)加成反应Ni与溴水加成: H 2 C=CH 2+Br 2 CH 2Br — CH 2Br CH 3CH 3与氢气加成: H 2C=CH 2+H 2与氯化氢加成: H 2C=CH 2+HClCH 3CH 2Cl△与水加成: H 2C=CH 2 +H 2O 催化剂 CH 3 C H 2OH加热、加压 ( 3)聚合反应一定条件乙烯加聚,生成聚乙烯: n H 2C=CH 2CH 2- CH 2 nn C H 2=CH — CH=CH 一定条件— CH=CH —CH 2 n2 CH 2 3.乙炔乙炔的制取: CaC 2+2H 2OCH CH ↑+ Ca( OH) 2( 1)氧化反应点燃4CO+2H 2O 乙炔的燃烧: 2HC CH+5O 2 2乙炔(炔烃)可以使酸性高锰酸钾溶液褪色,发生氧化反应。
( 2)加成反应与溴水加成: HC CH+Br 2HC=CHBr BrCHBr=CHBr+Br2 CHBr — CHBr22HC CH+2Br2 CHBr — CHBr22与氢气加成: HC CH+H 2NiH 2C=CH 2△HC CH+2H 2NiH 3 C —CH 3 △与氯化氢加成: HC CH+HCl CH 2=CHClCl( 3)聚合反应一定条件nCH 2=CHCl CH 2— CH n氯乙烯加聚,得到聚氯乙烯:图 1 乙烯的制取图 2 乙炔的制取一定条件乙炔加聚,得到聚乙炔: n HC CH CH=CHn4.苯▲ 苯及其苯的同系物通式: C n H 2n-6( n ≥6) ( 1)氧化反应点燃苯的燃烧: 2C 6H 6+15O12CO 2+6H 2O2苯不能使溴水和酸性高锰酸钾溶液褪色。
高考化学方程式大全(非常完全版)
高考化学方程式大全(非常完全版)一、无机反应方程式1. ↑+=+22222H NaOH O H Na↑+=+22222H KOH O H K 2. ↑+=+2222422O NaOH O H O Na 3. 232222222O CO Na CO O Na +=+4. 氢氧化钠和碳酸钠在溶液中反应的离子方程式OH -+HCO 3-=CO 32-+H 2O5. 氯气溶于水(新制的氯水中含Cl 2,HClO,H 2O,H +,Cl -,ClO -,OH -)HClO HCl O H Cl +=+226. O H NaCl NaClO NaOH Cl 222++=+7. 次氯酸见光分解(强氧化剂,杀菌消毒,漂白剂)222O HCl HClO +光照8. HClO CaCO O H CO ClO Ca 23222+↓=++)( 9. ↑++∆+22222)(4Cl O H MnCl MnO HCl 浓 10.222422O HF O H F +=+HClO HCl O H Cl +=+22 HBrO HBr O H Br +=+2211.↑+=++22232222H NaAlO O H NaOH AlO H NaAlO NaOH O Al 223222+=+O H NaAlO NaOH OH Al 2232+=+)(12.双氧水分解:22222022O H MnO O H +13.32222SO O SO ∆−−→←+催化剂14.O H SO CuSO SO H Cu 2244222+↑++△(浓) 15.O H SO CO △SO H C 22242222+↑+↑+(浓)16.O H SO SO H S 2242232+↑+△(浓) 17.↑++CO Si C SiO 222高温18.322NH 2H N 催化剂高温高压−−−→←+19.NO O N 222放电+ 20.2222NO O NO =+21.NO HNO O H NO +=+3222322.O H NO O NH 2236454+−−→−+∆催化剂23.用浓盐酸检验氨气(白烟生成):Cl NH HCl NH 43=+ 24.O H SO Na NH NaOH SO NH 2423424222++↑+△)( 25.O H NaNO NH NaOH NO NH 23334++↑+△ 26.O H O NO HNO 2223244++↑光或热27.O H NO NO Cu HNO Cu 22233224+↑+=+)((浓) 28.O H NO NO Cu HNO Cu 223342383+↑+=+)((稀) 29.O H NO CO HNO C 222324)(4+↑+↑=+浓 30.FeCl 3+3KSCN 3KCl+Fe(SCN)331.盐类水解: 32.CH 3COO -+H 2OCH 3COOH +OH --23CO +H 2O HCO 3-+ OH-HCO 3-+H 2O H 2CO 3+OH - NH 4+ + H 2ONH 3·H 2O + H + Fe 3++3H 2O Fe (OH )3+3H +33.铝热反应:Fe O Al O Fe Al 223232++高温Mn O Al O Al 323Mn 4322++高温34.C MgO CO Mg ++222点燃35.424323342326SO NH OH Al O H NH SO Al )()()(+↓=⋅+ 36.NaAlO 2+HCl+H 2O=Al(OH)3↓+NaClNaAlO 2+CO 2+H 2O=Al(OH)3↓+NaHCO 337.高温下铁与水反应:2432443H O Fe O H Fe ++高温(气)38.NaCl OH Fe NaOH FeCl 3333+↓=+)(39.3222424)()(OH Fe O H O OH Fe =++ 40.3222Cl 2FeCl Cl Fe =+ 41.233Cl 2FeCl Fe Fe =+42.氯化铁溶液中加入铜粉:2232Cl 2CuCl FeCl Cu Fe +=+ 43.金属的冶炼:232323CO Fe CO O Fe ++高温CO C O ++Cu Cu 高温↑↑+−−→−23234O Al O Al 通电熔融44.铜锌原电池:正极:2H ++2e -=H 2↑负极:Zn-2e -=Zn 2+45.钢铁的吸氧腐蚀:正极:O 2 + 4e - + 2H 2O == 4OH -负极:Fe -2e -==Fe 2+46.Fe(OH)3胶体的制备:Cl OH Fe FeCl H 3O H 3323++(胶体))(加热 47.电解CuCl 2溶液: 阳极2Cl --2e -=Cl 2↑阴极Cu 2+ +2e - = Cu总反应 CuCl 2 电解Cu+Cl 2↑48.铜的电解精炼:阳极Cu -2e - = Cu 2+阴极Cu 2++2e - = Cu49.电镀铜:阳极Cu -2e - = Cu 2+阴极Cu 2++2e - = Cu50.电解饱和食盐水:阳极2Cl --2e -=Cl 2↑阴极2H ++2e -=H 2↑总反应2NaCl+2H 2O=H 2↑+Cl 2↑+2NaOH51.黄铁矿的燃烧:4FeS 2+11O 2高温 2Fe 2O 3+8SO 2 52.氨水吸收少量的SO 2:2NH 3+H 20+SO 2=(NH 4)2SO 3 53.CO H C O H ++22高温↑二、有机化学反应方程式1. O H CH CH OH CH CH 222C17023+↑=−−→−--。
高考必背化学方程式大全
中学化学方程式大全一、非金属单质F2、Cl2、O2、S、N2、P、C、Si1、氧化性F2+H2=2HF冷暗处爆炸F2+Xe过量=XeF2产物为白色2F2过量+Xe=XeF4产物为白色nF2+2M=2MFn表示大部分金属2F2+2H2O=4HF+O2F2+2NaX=2NaX+Cl2熔融,不能是溶液Cl2+H2=2HCl光照或点燃3Cl2+2P 点燃2PCl3Cl2+PCl3△PCl5Cl2+2Na 点燃2NaCl3Cl2+2Fe 点燃2FeCl3Cl2+2FeCl2=2FeCl3Cl2+Cu 点燃CuCl22Cl2+2NaBr=2NaCl+Br2Cl2+2NaI=2NaCl+I25Cl2+I2+6H2O=2HIO3+10HCl Cl2+Na2S=2NaCl+S↓Cl2+H2S=2HCl+S↓Cl2+SO2+2H2O=H2SO4+2HCl Cl2+H2O2=2HCl+O22O2+3Fe 点燃Fe3O4O2+K △2S+H2△2S2S+C △CS2S+Fe △FeSS+2Cu △Cu2S3S+2Al △2S3S+Zn △ZnSN2+3H2催化剂高温高压2NH3N2+3Mg △Mg3N2N2+6Na=2Na3N P4+6H2△32、还原性S+O2点燃SO2S+6HNO3浓=H2SO4+6NO2↑+2H2O3S+4HNO3稀=3SO2↑+4NO↑+2H2ON2+O2=2NO放电4P+5O2点燃P4O10常写成P2O52P+3X2=2PX3X表示F2、Cl2、Br2PX3+X2=PX5P4+20HNO3浓==H3PO4+20NO2+4H2OC+2F2=CF4C+2Cl2=CCl42C+O2少量点燃2COC+O2足量点燃CO2C+CO2△2COC+H2O高温CO+H2生成水煤气2C+SiO2△制得粗硅Si粗+2Cl2△4SiCl4+2H2△纯+4HClSi粉+O2△SiO2Si+C△金刚砂Si+2NaOH+H2O=Na2SiO3+2H2↑3、歧化Cl2+H2O=HCl+HClO加酸抑制歧化、加碱或光照促进歧化Cl2+2NaOH=NaCl+NaClO+H2O3Cl2+6NaOH=5NaCl+NaClO3+3H2O2Cl2+2CaOH2=CaCl2+CaClO2+2H2O3Cl2+6KOH热、浓=5KCl+KClO3+3H2O3S+6NaOH△2S+Na2SO3+3H2O4P+3KOH浓+3H2O=PH3+3KH2PO211P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO43C+CaO电炉CaC2+CO↑3C+SiO2电炉SiC+2CO↑二、金属单质Na、Mg、Al、Fe1、还原性2Na+H2=2NaH4Na+O2=2Na2O2Na2O+O2△2O22Na+O2=Na2O22Na+S=Na2S爆炸2Na+2H2O=2NaOH+H2↑2Na+2NH3=2NaNH2+H24Na+TiCl4熔融=4NaCl+TiMg+Cl2=MgCl2Mg+Br2=MgBr22Mg+O2点燃2MgOMg+S=MgSMg+2H2O=MgOH2+H2↑2Mg+TiCl4熔融=Ti+2MgCl2Mg+2RbCl熔融=MgCl2+2Rb2Mg+CO2点燃2MgO+C2Mg+SiO2点燃2MgO+SiMg+H2S=MgS+H2Mg+H2SO4=MgSO4+H2↑2Al+3Cl2△2AlCl34Al+3O2点燃2Al2O3钝化4AlHg+3O2+2xH2O=2+4Hg4Al+3MnO2高温2Al2O3+3Mn2Al+Cr2O3高温Al2O3+2Cr2Al+Fe2O3高温Al2O3+2Fe2Al+3FeO△Al2O3+3Fe2Al+6HCl=2AlCl3+3H2↑2Al+3H2SO4=Al2SO43+3H2↑2Al+6H2SO4浓△Al2SO43+3SO2↑+6H2OAl、Fe、C在冷、浓的H2SO4、HNO3中钝化Al+4HNO3稀=AlNO33+NO↑+2H2O2Al+2NaOH+2H2O=2NaAlO2+3H2↑2Fe+3Br2=2FeBr3Fe+I2△2Fe+S△FeS3Fe+4H2Og高温Fe3O4+4H2Fe+2HCl=FeCl2+H2↑Fe+CuCl2=FeCl2+CuFe+SnCl4=FeCl2+SnCl2铁在酸性环境下、不能把四氯化锡完全还原为单质锡Fe+SnCl2=FeCl2+Sn三、非金属氢化物HF、HCl、H2O、H2S、NH31、还原性4HCl浓+MnO2△MnCl2+Cl2+2H2O4HClg+O2△2+2H2O16HCl+2KMnO4=2KCl+2MnCl2+5Cl2+8H2O14HCl+K2Cr2O7=2KCl+2CrCl3+3Cl2+7H2O2H2O+2F2=4HF+O22H2S+3O2足量=2SO2+2H2O2H2S+O2少量=2S+2H2O2H2S+SO2=3S+2H2OH2S+H2SO4浓=S↓+SO2+2H2O3H2S+2HNO3稀=3S↓+2NO+4H2O 5H2S+2KMnO4+3H2SO4=2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4=Cr2SO43+K2SO4+3S+7H2OH2S+4Na2O2+2H2O=Na2SO4+6NaOH2NH3+3CuO △2+3H2O2NH3+3Cl2=N2+6HCl 8NH3+3Cl2=N2+6NH4Cl4NH3+3O2纯氧点燃2N2+6H2O4NH3+5O2催化剂△4NO+6H2O4NH3+6NO 催化剂△5N2+6HO用氨清除NONaH+H2O=NaOH+H24NaH+TiCl4=Ti+4NaCl+2H2 CaH2+2H2O=CaOH2+2H2↑2、酸性4HF+SiO2=SiF4+2H2O 此反应广泛应用于测定矿样或钢样中SiO2的含量2HF+CaCl2=CaF2↓+2HClH2S+Fe=FeS+H2↑H2S+CuCl2=CuS↓+2HClH2S+2AgNO3=Ag2S↓+2HNO3H2S+HgCl2=HgS↓+2HClH2S+PbNO32=PbS↓+2HNO3H2S+FeCl2=不反应2NH3+2Na=2NaNH2+H2NaNH2+H2O=NaOH+NH33、碱性NH3+HCl=NH4Cl白烟NH3+HNO3=NH4NO3白烟2NH3+H2SO4=NH42SO4NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl侯氏制碱法此反应用于工业制备小苏打、苏打4、不稳定性2HI△H2+I22H2O电解2H2↑+O2↑2H2O2=2H2O+O2↑H2S△2+S四、非金属氧化物1、低价态的还原性2SO2+O2△2SO32SO2+O2+2H2O=2H2SO4这是SO2在大气中缓慢发生的环境化学反应SO2+Cl2+2H2O=H2SO4+2HClSO2+Br2+2H2O=H2SO4+2HBrSO2+I2+2H2O=H2SO4+2HISO2+NO2=SO3+NO2NO+O2=2NO2NO+NO2+2NaOH=2NaNO2+H2O用于制硝酸工业中吸收尾气中的NO和NO22CO+O2点燃2CO2CO+CuO△Cu+CO23CO+Fe2O3△2Fe+3CO2CO+H2O催化剂△CO2+H22、氧化性SO2+2H2S=3S+2H2OSO3+2KI=K2SO3+I2NO2+2KI+H2O=NO+I2+2KOH不能用淀粉KI溶液鉴别溴蒸气和NO24NO2+H2S=4NO+SO3+H2O2Mg+CO2点燃2MgO+CCO2不能用于扑灭由Mg、Ca、Ba、Na、K等燃烧的火灾SiO2+2H2△2OSiO2+2Mg△2MgO+Si3、与水的作用SO2+H2O=H2SO3SO3+H2O=H2SO43NO2+H2O=2HNO3+NON2O5+H2O=2HNO3P2O5+H2O冷=2HPO3P2O5+3H2O热=2H3PO4P2O5极易吸水、可作气体干燥剂P2O5+3H2SO4浓=2H3PO4+3SO3CO2+H2O=H2CO34、与碱性物质的作用SO2+2NH3+H2O=NH42SO3SO2+NH42SO3+H2O=2NH4HSO3这是硫酸厂回收SO2的反应.先用氨水吸收SO2、再用H2SO4处理2NH4HSO3+H2SO4=NH42SO4+2H2O+2SO2↑生成的硫酸铵作化肥、SO2循环作原料气SO2+CaOH2=CaSO3↓+H2O不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别SO3+MgO=MgSO4SO3+CaOH2=CaSO4+H2OCO2+2NaOH过量=Na2CO3+H2OCO2过量+NaOH=NaHCO3CO2+CaOH2过量=CaCO3↓+H2O2CO2过量+CaOH2=CaHCO32CO2+2NaAlO2+3H2O=2AlOH3↓+Na2CO3 CO2+C6H5ONa+H2O=C6H5OH+NaHCO3SiO2+CaO 高温CaSiO3SiO2+2NaOH=Na2SiO3+H2O 常温下强碱缓慢腐蚀玻璃SiO2+Na2CO3高温Na2SiO3+CO2↑SiO2+CaCO3高温CaSiO3+CO2↑五、金属氧化物1、低价态的还原性6FeO+O2△2Fe3O4FeO+4HNO3=FeNO33+NO2↑+2H2O2、氧化性Na2O2+2Na=2Na2O此反应用于制备Na2OMgO、Al2O3几乎没有氧化性、很难被还原为Mg、Al.一般通过电解熔融态的MgCl2和Al2O3制Mg和Al.Fe2O3+3H2=2Fe+3H2O制还原铁粉Fe3O4+4H2△2O3、与水的作用Na2O+H2O=2NaOH2Na2O2+2H2O=4NaOH+O2↑此反应分两步Na2O2+2H2O=2NaOH+H2O2;2H2O2=2H2O+O2↑.H2O2的制备可利用类似的反应BaO2+H2SO4稀=BaSO4+H2O2MgO+H2O=MgOH2缓慢反应4、与酸性物质的作用Na2O+SO3=Na2SO4Na2O+CO2=Na2CO3Na2O+2HCl=2NaCl+H2O2Na2O2+2CO2=2Na2CO3+O2Na2O2+H2SO4冷、稀=Na2SO4+H2O2MgO+SO3=MgSO4MgO+H2SO4=MgSO4+H2OAl2O3+3H2SO4=Al2SO43+3H2OAl2O3是两性氧化物Al2O3+2NaOH=2NaAlO2+H2OFeO+2HCl=FeCl2+3H2OFe2O3+6HCl=2FeCl3+3H2OFe3O4+8HCl浓△FeCl2+2FeCl3+4H2O六、含氧酸1、氧化性4HClO3+3H2S=3H2SO4+4HClHClO3+HI=HIO3+HCl3HClO+HI=HIO3+3HClHClO+H2SO3=H2SO4+HClHClO+H2O2=HCl+H2O+O2↑氧化性HClO>HClO2>HClO3>HClO4、但浓、热的HClO4氧化性很强2H2SO4浓+C△CO2↑+2SO2↑+2H2O2H2SO4浓+S=3SO2↑+2H2OH2SO4浓、HNO3浓+FeAl室温或冷的条件下钝化6H2SO4浓+2Fe==Fe2SO43+3SO2↑+6H2O2H2SO4浓+Cu△CuSO4+SO2↑+2H2OH2SO4浓+2HBr△2+Br2+2H2OH2SO4浓+2HI△SO2+I2+2H2OH2SO4稀+Fe=FeSO4+H2↑2H2SO3+2H2S=3S↓+2H2O4HNO3浓+C△CO2↑+4NO2↑+2H2O6HNO3浓+S=H2SO4+6NO2↑+2H2O5HNO3浓+P=H3PO4+5NO2↑+H2O6HNO3+Fe=FeNO33+3NO2↑+3H2O4HNO3+Fe=FeNO33+NO↑+2H2O30HNO3+8Fe=8FeNO33+3N2O↑+15H2O36HNO3+10Fe=10FeNO33+3N2↑+18H2O30HNO3+8Fe=8FeNO33+3NH4NO3+9H2O2、还原性H2SO3+X2+H2O=H2SO4+2HXX表示Cl2、Br2、I22H2SO3+O2=2H2SO4H2SO3+H2O2=H2SO4+H2O5H2SO3+2KMnO4=2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O=H2SO4+2FeCl2+2HCl3、酸性H2SO4浓+CaF2=CaSO4+2HF↑H2SO4浓+NaCl△NaHSO4+HCl↑H2SO4浓+2NaCl Na2SO4+2HClH2SO4浓+NaNO3△NaHSO4+HNO3↑微热3H2SO4浓+Ca3PO42=3CaSO4+2H3PO42H2SO4浓+Ca3PO42=2CaSO4+CaH2PO423HNO3+Ag3PO4=H3PO4+3AgNO32HNO3+CaCO3=CaNO32+H2O+CO2↑用HNO3和浓H2SO4不能制备H2S、HI、HBr、SO2等还原性气体4H3PO4+Ca3PO42=3CaH2PO42重钙H3PO4浓+NaBr=NaH2PO4+HBrH3PO4浓+NaI=NaH2PO4+HI4、不稳定性2HClO=2HCl+O2↑见光或受热分解4HNO3=4NO2↑+O2↑+2H2O见光或受热分解H2SO3=H2O+SO2H2CO3=H2O+CO2H4SiO4=H2SiO3+H2O七、碱1、低价态的还原性4FeOH2+O2+2H2O=4FeOH32、与酸性物质的作用2NaOH+SO2少量=Na2SO3+H2ONaOH+SO2足量=NaHSO32NaOH+SiO2=Na2SiO3+H2O2NaOH+Al2O3=2NaAlO2+H2O强热2NaOH+Cl2=NaCl+NaClO+H2O NaOH+HCl=NaCl+H2ONaOH+H2S足量=NaHS+H2O2NaOH+H2S少量=Na2S+2H2O3NaOH+AlCl3=A l O H3↓+3NaCl NaOH+AlOH3=NaAlO2+2H2ONaOH+NH4Cl △NaCl+NH3↑+H2OMgOH2+2NH4Cl=MgCl2+2NH3+H2O AlOH3+NH4Cl不溶解3、不稳定性MgOH2△2O2AlOH3△Al2O3+3H2O2FeOH3△Fe2O3+3H2OCuOH2△2O八、盐1、氧化性2FeCl3+Fe=3FeCl22FeCl3+Cu=2FeCl2+CuCl2用于雕刻铜线路版2FeCl3+Zn=2FeCl2+ZnCl2Fe2SO43+2Ag=FeSO4+Ag2SO4较难反应FeNO33+Ag不反应2FeCl3+H2S=2FeCl2+2HCl+S↓2FeCl3+2KI=2FeCl2+2KCl+I2FeCl2+Mg=Fe+MgCl22、还原性2FeCl2+Cl2=2FeCl33Na2S+8HNO3稀=6NaNO3+2NO+3S↓+4H2O3Na2SO3+2HNO3稀=3Na2SO4+2NO↑+H2O 2Na2SO3+O2=2Na2SO43、与碱性物质的作用MgCl2+2NH3·H2O=MgOH2↓+NH4ClAlCl3+3NH3·H2O=AlOH3↓+3NH4Cl FeCl3+3NH3·H2O=FeOH3↓+3NH4Cl4、与酸性物质的作用Na3PO4+HCl=Na2HPO4+NaCl Na2HPO4+HCl=NaH2PO4+NaClNaH2PO4+HCl=H3PO4+NaClNa2CO3+HCl=NaHCO3+NaClNaHCO3+HCl=NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O=2AlOH3↓+3CO2↑+6NaCl3Na2CO3+2FeCl3+3H2O=2FeOH3↓+3CO2↑+6NaCl3NaHCO3+AlCl3=AlOH3↓+3CO2↑3NaHCO3+FeCl3=FeOH3↓+3CO2↑3Na2S+Al2SO43+6H2O=2AlOH3↓+3H2S↑3NaAlO2+AlCl3+6H2O=4AlOH3↓5、不稳定性Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O NH4Cl=NH3+HClNH4HCO3=NH3+H2O+CO22KNO3=2KNO2+O22CuNO32△2CuO+4NO2↑+O2↑2KMnO4△K2MnO4+MnO2+O2↑2KClO3△2KCl+3O2↑2NaHCO3△2CO3+H2O+CO2↑CaHCO32△CaCO3+H2O+CO2↑CaCO3高温CaO+CO2↑MgCO3高温MgO+CO2↑九、其他方程式AlCl3+4NaOH=NaAlO2+3NaCl+2H2OAl4C3+12H2O=4AlOH3↓+3CH4↑3K2MnO4+2CO2=2KMnO4+MnO2↓+ 2K2CO3 AgNO3+NaCl=AgCl↓+NaNO32AgCl=2Ag+Cl2↑见光或受热2Br2+3Na2CO3+H2O=2NaHCO3+2NaBrO+2NaBr+CO2↑Br2+NaHCO3==NaBr+HBrO+CO2↑2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl BaCl2+H2SO4=BaSO4↓+2HCl CaH2PO42+2CaOH2=Ca3PO42↓+4H2O4KO2+2CO2=2K2CO3+3O2SOCl2+H2O=2HCl+SO2↑HIO+HCl=ICl+H2OHIO+NaOH=NaIO+H2ONH2Cl+H2O=NH3+HClOCu2OH2CO3+4CH3COOH =2CH3COO2Cu+CO2↑+ 3H2OCH3COO2Cu+Fe=Cu+CH3COO2Fe6NO+4NH3催化剂△5N2+6H2O3BrF3+5H2O =9HF+HBrO3+O2↑+ Br2As2O3+6Zn+12HCl==2AsH3↑+6ZnCl2+3H2O3As2S3+28HNO3+4H2O=6H3AsO4+9H2SO4+28NO↑Na2SO3+SO2+H2O=2NaHSO32NaHSO3△Na2SO3+SO2↑+H2O P2O5+2NaOH=2NaPO3+H2OP2O5+6NaOH=2Na3PO3+3H2O 3Na2S+As2S5=2Na3AsS4Na2S+SnS2=Na2SnS3SCN2+2NaOH=NaSCN+NaSCNO+H2OHCl+KOH=KCl+H2O2HI+PbO=PbI2+H2O3Fe2++NO3―+4H+=3Fe3++NO↑+2H2O2S2―+SO32―+6H+=3S↓+3H2OSiO32―+2NH4+=H2SiO3↓+2NH33H2O2+2C rO2―+2OH―=2CrO42―+4H2OAl3++2SO42―+2Ba2++4OH―=2BaSO4↓+AlO2―+2H2OFe2O3+6H++2I―=2Fe2++I2+3H2OAl3++3HCO3―=AlOH3↓+3CO2↑2H++AgNH32+=Ag++2NH4+HS―+OH―=S2―+H2OAsO43―+2I―+2H+=AsO33―+I2+H2OCr2O72―+6Fe2++14H+=2Cr3++6Fe3++7H2O2I―+Cl2=2Cl―+I2I2+SO2+2H2O=SO42―+2I―+4H+SO42―+Ba2+=BaSO4↓2I―+2ClO―+4H+=I2+Cl2↑+2H2OI2+SO32―+H2O =SO42―+2H++2I―2Fe2++4Br―+3Cl2=2Fe3++2Br2+6Cl―2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑3S2―+16BrO3―+24OH―=15SO42―+16Br―+12H2O3Ca2++6H2PO4―+12OH―=Ca3PO42↓+12H2O+4PO43―4H++NO3―+3Fe2+=3Fe3++NO↑+2H2OFe3++SCN―=FeSCN2+2Na+2H2O =2Na++2OH―+H2↑Fe2++2OH―=FeOH2↓4FeOH2+O2+2H2O=4FeOH3S2O32―+2H+=S↓+SO2+H2OKAlSO42==K++Al3++2SO42―NaHSO4=Na++HSO4―NH4HS=NH4++HS―对KCl溶液,阳极:2Cl-2e=Cl2↑阴极:2H+2e=H2↑对CuSO4溶液,阳极:4OH-4e=2H2O+O2↑阴极:2Cu2++4e=2Cu负极:2H2–4e=4H+正极:O2+2H2O+4e=4OH―负极:2Zn–4e=2Zn2+正极O2+2H2O+4e=4OH―4OH―+4H+=H2O负极:Zn–2e=Zn2+正极:Ag2O+H2O+2e=2Ag+2OH―2NaCl+2H 2O电解2NaOH+H2↑+Cl2↑2NO+O2=2NO22H2O22H2O+O2↑有机化学反应方程式:1、甲烷的主要化学性质1氧化反应CH4g+2O2g−−→−点燃CO2g+2H2Ol2取代反应2、乙烯的乙烯的主要化学性质1氧化反应:C2H4+3O2−−→−点燃2CO2+2H2O2加成反应乙烯还可以和氢气、氯化氢、水等发生加成反应;CH2=CH2+H2CH3CH3CH2=CH2+HCl CH3CH2Cl一氯乙烷CH2=CH2+H2O CH3CH 2OH乙醇3聚合反应:3、苯的主要化学性质(1)氧化反应2C6H6+15O2−−→−点燃12CO2+6H2O(①+Br2−→−3+HBr②苯与硝酸用HONO2表示发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯;+HONO2浓硫酸△+H2O(3)加成反应用镍做催化剂,苯与氢发生加成反应,生成环己烷;+3H2−−→−催化剂4、乙醇的重要化学性质(1)乙醇与金属钠的反应2CH3CH2OH+2Na2CH3CH2ONa+H2↑(2)乙醇的氧化反应①乙醇的燃烧:CH3CH2OH+3O2−−→−点燃2CO2+3H2O②乙醇的催化氧化反应2CH3CH2OH+O2−−→−AgCu或2CH3CHO+2H2O乙醛③乙醇在常温下的氧化反应CH3CH2OH−−−−−−−−→−或酸性重铬酸钾溶液酸性4KMnOCH3COOH5、乙酸的重要化学性质(1)乙酸的酸性①乙酸能使紫色石蕊试液变红②乙酸能与碳酸盐反应,生成二氧化碳气体利用乙酸的酸性,可以用乙酸来除去水垢主要成分是CaCO3:2CH3COOH+CaCO3CH3COO2Ca+H2O+CO2↑乙酸还可以与碳酸钠反应,也能生成二氧化碳气体:2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑上述两个反应都可以证明乙酸的酸性比碳酸的酸性强;(2)乙酸的酯化反应①反应原理乙酸与乙醇反应的主要产物乙酸乙酯是一种无色、有香味、密度比水的小、不溶于水的油状液体;6、C12H22O11+H2O→C6H12O6+C6H12O67、油脂的重要化学性质——水解反应(1)油脂在酸性条件下的水解BrNO2油脂+H2O−→−酸甘油+高级脂肪酸(2)油脂在碱性条件下的水解又叫皂化反应油脂+H2O−→−碱甘油+高级脂肪酸蛋白质+H2O−−→−酶等各种氨基酸1苯与溴单质反应见前2、3.高中化学中各种颜色所包含的物质1.红色:铜、Cu2O、品红溶液、酚酞在碱性溶液中、石蕊在酸性溶液中、液溴深棕红、红磷暗红、苯酚被空气氧化、Fe2O3、FeSCN2+血红2.橙色:、溴水及溴的有机溶液视浓度,黄—橙3.黄色1淡黄色:硫单质、过氧化钠、溴化银、TNT、实验制得的不纯硝基苯、2黄色:碘化银、黄铁矿FeS2、磷酸银Ag3PO4工业盐酸含Fe3+、久置的浓硝酸含NO23棕黄:FeCl3溶液、碘水黄棕→褐色4.棕色:固体FeCl3、CuCl2铜与氯气生成棕色烟、NO2气红棕、溴蒸气红棕5.褐色:碘酒、氢氧化铁红褐色、刚制得的溴苯溶有Br26.绿色:氯化铜溶液、碱式碳酸铜、硫酸亚铁溶液或绿矾晶体浅绿、氯气或氯水黄绿色、氟气淡黄绿色7.蓝色:胆矾、氢氧化铜沉淀淡蓝、淀粉遇碘、石蕊遇碱性溶液、硫酸铜溶液8.紫色:高锰酸钾溶液紫红、碘紫黑、碘的四氯化碳溶液紫红、碘蒸气高中化学之最1、常温下其单质有颜色气体的元素是F、Cl2、单质与水反应最剧烈的非金属元素是F3、其最高价氧化物的水化物酸性最强的元素是Cl4、其单质是最易液化的气体的元素是Cl5、其氢化物沸点最高的非金属元素是O6、其单质是最轻的金属元素是Li7、常温下其单质呈液态的非金属元素是Br8、熔点最小的金属是Hg9、其气态氢化物最易溶于水的元素是N10、导电性最强的金属是Ag11、相对原子质量最小的原子是H12、人体中含量最多的元素是O13、日常生活中应用最广泛的金属是Fe14、组成化合物种类最多的元素是C15、天然存在最硬的物质是金刚石16、金属活动顺序表中活动性最强的金属是K17、地壳中含量最多的金属元素是Al18、地壳中含量最多的非金属元素是O19、空气中含量最多的物质是氮气20、最简单的有机物是甲烷21、相同条件下密度最小的气体是氢气22、相对分子质量最小的氧化物是水COONa。
高考化学必考题型方程式及答题技巧(精选3篇)
高考化学必考题型方程式及答题技巧(精选3篇)高考化学必考题型方程式及答题技巧(篇1)常见气体的制取和检验⑴氧气制取原理——含氧化合物自身分解制取方程式——2KClO32KCl+3O2↑装置——略微向下倾斜的大试管,加热检验——带火星木条,复燃收集——排水法或向上排气法⑵氢气制取原理——活泼金属与弱氧化性酸的置换制取方程式——Zn+H2SO4===H2SO4+H2↑装置——启普发生器检验——点燃,淡蓝色火焰,在容器壁上有水珠收集——排水法或向下排气法点击查看:高考常见化学方程式归纳总结⑶氯气制取原理——强氧化剂氧化含氧化合物制取方程式——MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O装置——分液漏斗,圆底烧瓶,加热检验——能使湿润的蓝色石蕊试纸先变红后褪色;除杂质——先通入饱和食盐水(除HCl),再通入浓H2SO4(除水蒸气) 收集——排饱和食盐水法或向上排气法尾气回收——Cl2+2NaOH===NaCl+NaClO+H2O⑷硫化氢①制取原理——强酸与强碱的复分解反应②制取方程式——FeS+2HCl===FeCl2+H2S↑③装置——启普发生器④检验——能使湿润的醋酸铅试纸变黑⑤除杂质——先通入饱和NaHS溶液(除HCl),再通入固体CaCl2(或P2O5)(除水蒸气)⑥收集——向上排气法⑦尾气回收——H2S+2NaOH===Na2S+H2O或H2S+NaOH===NaHS+H2O⑸二氧化硫①制取原理——稳定性强酸与不稳定性弱酸盐的复分解②制取方程式——Na2SO3+H2SO4===Na2SO4+SO2↑+H2O③装置——分液漏斗,圆底烧瓶④检验——先通入品红试液,褪色,后加热又恢复原红色;⑤除杂质——通入浓H2SO4(除水蒸气)⑥收集——向上排气法⑦尾气回收——SO2+2NaOH===Na2SO3+H2O⑹二氧化碳①制取原理——稳定性强酸与不稳定性弱酸盐的复分解②制取方程式——CaCO3+2HClCaCl2+CO2↑+H2O③装置——启普发生器④检验——通入澄清石灰水,变浑浊⑤除杂质——通入饱和NaHCO3溶液(除HCl),再通入浓H2SO4(除水蒸气)⑥收集——排水法或向上排气法⑺氨气①制取原理——固体铵盐与固体强碱的复分解②制取方程式——Ca(OH)2+2NH4ClCaCl2+NH3↑+2H2O③装置——略微向下倾斜的大试管,加热④检验——湿润的红色石蕊试纸,变蓝⑤除杂质——通入碱石灰(除水蒸气)收集——向下排气法⑻氯化氢①制取原理——高沸点酸与金属氯化物的复分解②制取方程式——NaCl+H2SO4Na2SO4+2HCl↑③装置——分液漏斗,圆底烧瓶,加热④检验——通入AgNO3溶液,产生白色沉淀,再加稀HNO3沉淀不溶⑤除杂质——通入浓硫酸(除水蒸气)⑥收集——向上排气法⑼二氧化氮①制取原理——不活泼金属与浓硝酸的氧化—还原;②制取方程式——Cu+4HNO3===Cu(NO3)2+2NO2↑+2H2O③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——红棕色气体,通入AgNO3溶液颜色变浅,但无沉淀生成⑤收集——向上排气法⑥尾气处理——3NO2+H2O===2HNO3+NONO+NO2+2NaOH===2NaNO2+H2O⑩一氧化氮①制取原理——不活泼金属与稀硝酸的氧化—还原;②制取方程式——Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——无色气体,暴露于空气中立即变红棕色⑤收集——排水法⑾一氧化碳①制取原理——浓硫酸对有机物的脱水作用②制取方程式——HCOOHCO↑+H2O③装置——分液漏斗,圆底烧瓶④检验——燃烧,蓝色火焰,无水珠,产生气体能使澄清石灰水变浑浊⑤除杂质——通入浓硫酸(除水蒸气)⑥收集——排水法⑿甲烷①制取方程式——CH3COONa+NaOHCH4↑+Na2CO3②装置——略微向下倾斜的大试管,加热③收集——排水法或向下排空气法⒀乙烯①制取原理——浓硫酸对有机物的脱水作用②制取方程式——CH3CH2OHCH2=CH2↑+H2O③装置——分液漏斗,圆底烧瓶,加热④除杂质——通入NaOH溶液(除SO2,CO2),通入浓硫酸(除水蒸气) 收集——排水法⒁乙炔①制取原理——电石强烈吸水作用②制取方程式——CaC2+2H2OCa(OH)2+CHCH↑③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——无色气体,能燃烧,产生明亮的火焰,并冒出浓的黑烟⑤除杂质——通入硫酸铜溶液(除H2S,PH3),通入浓硫酸(除水蒸气)收集——排水法或向下排气法高考化学必考题型方程式及答题技巧(篇2)1、高考化学答题技巧——审题型:是指要看清题目属于辨析概念类型的还是计算类型的,属于考查物质性质的,还是考查实验操作的等等。
2023届高考化学重难点化学方程式(有机)
2023届高考化学重难点化学方程式(有机)七、有机反应方程式㈠、(取代反应)1.烷烃卤代(与氯气) :CH4 + Cl2CH3Cl + HCl2.卤代烃卤代:CH3Cl + Cl2CH2Cl2 + HCl ……3.苯的卤代(与液溴):+Br2+ HBr4.苯的硝化:+HNO3+ H2O5.工业制TNT :+3HNO3+3H2O6.溴乙烷水解:CH3CH2Br + NaOH CH3CH2OH + NaBr7.乙醇脱水成乙醚:2CH3CH2OH C2H5OC2H5 + H2O8.乙醇与浓氢溴酸反应:CH3CH2OH +HBr CH3CH2 Br +H2O9.苯酚与浓溴水:+3Br2↓ +3HBr10.乙酸与乙醇的酯化反应:CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O11.乙酸乙酯水解(酸催化):CH3COOCH2CH3 + H2O CH3COOH +CH3CH2OH12.乙酸乙酯水解(碱催化):CH3COOCH2CH3 + NaOH CH3COONa +CH3CH2OH13.乙酸苯酚酯碱性条件下水解:CH3COOC6H5+ 2NaOHCH3COONa + C6H5ONa + H2O14.皂化反应(以硬脂酸甘油酯为例): + 3NaOH3C17H35COONa +15.纤维素与硝酸的酯化:[C6H7O2(OH)3]n+ 3n HNO3[C6H7O2(ONO2)3]n + 3 n H2O16.两分子乳酸自身成环反应:2 + 2H2O 17.5 —羟基戊酸自身形成环酯:HO — CH2CH2CH2CH2COOH+ H2O18.乙二酸和乙二醇形成环酯(1:1):++ 2H2O19 .两个丙氨酸自缩合形成二肽:2+ H2O㈡、加成反应(与氢气的加成反应也是还原反应)1.乙烯使溴水褪色:H2C = CH2 + Br2CH2BrCH2Br2.乙烯与氢气加成:H2C = CH2 + H2CH3CH33.乙烯与溴化氢加成:H2C = CH2 + HBr CH3CH2Br4.乙烯与水加成 (工业制乙醇) :H2C = CH2 + H2O CH3CH2OH 5.苯与氢气加成: +3H26.乙炔与氯化氢 (1:1):CH≡CH + HCl CH2 = CHCl7.乙炔与足量溴水:CH≡CH + 2Br2CHBr2— CHBr28.1,3 —丁二烯与溴水完全加成:CH2 = CH — CH = CH2+ 2Br29.1,3 —丁二烯与溴水(1,4 —加成):CH2 = CH — CH = CH2 + Br2 10.1,3 —丁二烯与溴水(1,2 —加成):CH2 = CH — CH = CH2 + Br211.乙醛与氢气加成:CH3CHO + H2CH3CH2OH㈢、消去反应1.溴乙烷消去:CH3CH2Br + NaOH CH2 = CH2↑ + NaBr + H2O2.1,2 —二溴乙烷消去:CH2BrCH2Br + 2NaOHCHCH↑+ 2NaBr + 2H2O3.乙醇消去(实验室制乙烯) :CH3CH2OHCH2 = CH2↑ + H2O㈣、氧化反应1.烃的含氧衍生物的燃烧通式:C x H y Oz + (x + y/4 - z/2)O2 xCO2 + y/2H2O 2.乙醇的催化氧化:2CH3CH2OH + O2 CH3CHO + 2H2O3.2 —丙醇的催化氧化:2CH3CH(OH)CH3 + O22CH3COCH3 + 2H2O4.乙醛的催化氧化:2CH3CHO + O22CH3COOH5.乙醛的银镜反应:CH3CHO + 2Ag(NH3)2OH CH3COONH4+ 2Ag↓ +3NH3 + H2O乙醛银镜反应的离子方程式:CH3CHO +2Ag(NH3)2++2 OH-CH3COO-+ NH4++2Ag↓ + 3NH3 + H2O6.甲醛的银镜反应:HCHO + 4Ag(NH3)2OH(NH4)2CO3+ 4Ag↓ + 6NH3 + 2H2O7.乙醛与新制氢氧化铜反应:CH3CHO + 2Cu(OH)2+NaOH CH3COONa + Cu2O↓+3H2O8.甲醛与新制氢氧化铜反应:HCHO + 4Cu(OH)2CO2↑ + 2Cu2O↓ + 5H2O ㈤、聚合反应1.乙烯生成聚乙烯:nCH2 = CH22.氯乙烯生成聚氯乙烯:nCH2 = CHCl3.制顺丁橡胶:nCH2=CH—CH=CH24.制丁苯橡胶:nCH2=CH—CH=CH2+n5.由单体形成天然橡胶: n6.乙二醇的自身缩聚:nHO—CH2CH2—OH+ (n - 1) H2O7.酚醛树脂的生成:n + nHCHO + (n - 1)H2O8.制涤纶:n + nHOCH2CH2OH+ (2n - 1)H2O㈥、其它反应1.实验室制乙炔:CaC2 + 2H2O Ca(OH)2 +CHCH ↑2.葡萄糖发酵制酒精:C6H12O6(葡萄糖)2C2H5OH + 2CO2↑3.证明醋酸强于碳酸(有气体生成):CH3COOH + NaHCO3CH3COONa + CO2↑+ H2O4.碳酸强于苯酚(溶液变浑浊):CO2 + H2O + C6H5ONa NaHCO3 + C6H5OH5.丙氨酸与盐酸:+ HCl6.丙氨酸与氢氧化钾:+ KOH+ H2O 7.乙醇和钠反应:2CH3CH2OH + 2 Na 2CH3CH2ONa + H2↑。
