金属和化合物化学方程式
金属与金属化合物溶液的化学方程式

金属与金属化合物溶液的化学方程式
金属与金属化合物溶液是一种常见的化学反应,它可以用来制造各种金属化合物,如金属氧化物、金属氢化物和金属硫化物等。
金属与金属化合物溶液的化学方程式可以用来描述这种反应的化学变化。
金属与金属化合物溶液的化学方程式可以表示为:M + H2O → M(OH)2 + H2。
其中,M表示金属,H2O表示水,M(OH)2表示金属氧化物,H2表示氢气。
这个方程式表明,当金属接触到水时,金属会与水反应,产生金属氧化物和氢气。
金属与金属化合物溶液的化学方程式也可以用来描述金属与金属氢化物的反应,即M +
H2O → M(H2)2 + H2O。
其中,M表示金属,H2O表示水,M(H2)2表示金属氢化物,
H2O表示水。
这个方程式表明,当金属接触到水时,金属会与水反应,产生金属氢化物和水。
金属与金属化合物溶液的化学方程式还可以用来描述金属与金属硫化物的反应,即M +
H2O → M(S)2 + H2O。
其中,M表示金属,H2O表示水,M(S)2表示金属硫化物,H2O表示水。
这个方程式表明,当金属接触到水时,金属会与水反应,产生金属硫化物和水。
以上就是金属与金属化合物溶液的化学方程式,它可以用来描述金属与金属氧化物、金属氢化物和金属硫化物的反应。
这些反应可以用来制造各种金属化合物,为我们的生活提供便利。
高一上四大基本金属元素钠镁铝铁单质及其化合物化学和对应离子方程式总结
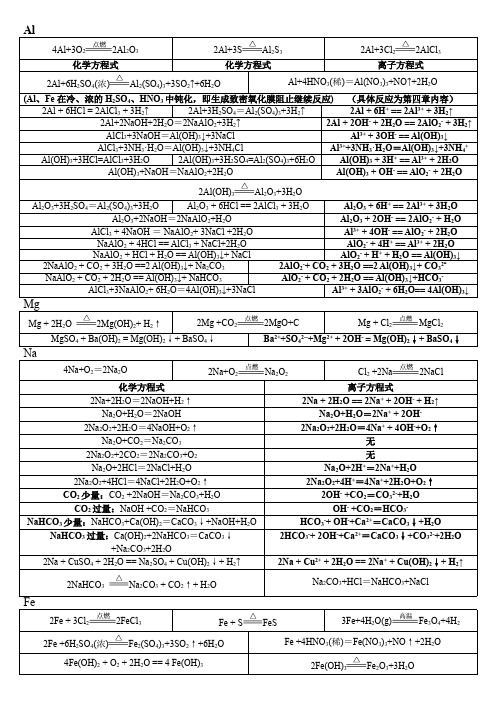
NO3- + 2+
Fe3+ + 3H2O
Fe(OH)3(胶体) + 3H+
Cl2 少量: 6FeBr2 + 3Cl2 == 2FeCl3 +4FeBr3 Cl2 过量:2FeBr2+ 3Cl2 == 2FeCl3 + 2Br2
2Fe2+ + Cl2 == 2Fe3+ + 2Cl2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl-
Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3+2NaOH=2NaAlO2+H2O Al2O3 + 2OH- == 2AlO2- + H2O AlCl3 + 4NaOH = NaAlO2+ 3NaCl +2H2O Al3+ + 4OH- == AlO2- + 2H2O NaAlO2 + 4HCl == AlCl3 + NaCl+2H2O AlO2- + 4H+ == Al3+ + 2H2O NaAlO2 + HCl + H2O == Al(OH)3↓+ NaCl AlO2- + H+ + H2O == Al(OH)3↓ 2NaAlO2 + CO2 + 3H2O ==2 Al(OH)3↓+ Na2CO3 2AlO2-+ CO2 + 3H2O ==2 Al(OH)3↓+ CO32NaAlO2 + CO2 + 2H2O == Al(OH)3↓+ NaHCO3 AlO2- + CO2 + 2H2O == Al(OH)3↓+HCO3AlCl3+3NaAlO2+ 6H2O=4Al(OH)3↓+3NaCl Al3+ + 3AlO2- + 6H2O== 4Al(OH)3↓
铁及其化合物的化学方程式和离子方程式答案

铁及其化合物的化学方程式和离子方程式答案铁及其化合物的化学方程式和离子方程式总结铁是一种常见的金属元素,它在不同条件下可以与氧气、氯气、硫、水蒸气等反应。
其中,铁在氧气中燃烧的化学方程式为3Fe+2O2→2Fe3O4,而在氯气中燃烧的方程式为2Fe+3Cl2→2FeCl3.此外,常温条件下铁锈的形成是由4Fe+3O2+2H2O→2Fe2O3·H2O引起的。
氧化亚铁是铁的一种氧化物,它也可以与一氧化碳、铝粉等物质发生反应。
例如,氧化亚铁在空气中加热会发生6FeO +O2→2Fe3O4的反应,而与一氧化碳高温反应的方程式为FeO+CO→Fe+CO2.此外,氧化亚铁与铝粉在高温下反应的方程式为3FeO+2Al→Al2O3+3Fe。
铁和硫的共热反应的方程式为Fe+S→FeS,而铁和水蒸气在高温条件下反应的方程式为3Fe+4H2O→Fe3O4+4H2.铁还可以与稀硫酸、浓硫酸、稀硝酸、浓硝酸等酸性物质反应,生成不同的产物和离子。
例如,铁与稀硫酸反应的方程式为Fe+H2SO4→FeSO4+H2↑,而少量的铁与浓硝酸共热的方程式为Fe+6HNO3(浓)→Fe(NO3)3+3NO2↑+3H2O。
需要注意的是,有些段落中出现了格式错误和明显有问题的内容,需要删除或修改。
例如,第10段中的化学方程式和离子方程式之间的符号错误,需要进行修改。
铁的化学性质1.氢氧化亚铁与浓硫酸反应,生成二价铁离子和二氧化硫气体,反应式为:2Fe(OH)2 + 4H2SO4 → Fe2+ + 2H2O +4SO2↑。
2.氢氧化亚铁与浓硝酸反应,生成二价铁离子和一氧化氮气体,反应式为:Fe(OH)2 + 4HNO3 → Fe2+ + 2NO↑ + 3H2O。
3.氢氧化亚铁与稀硝酸反应,生成二价铁离子和一氧化氮气体,反应式为:3Fe(OH)2 + 10HNO3 → 3Fe2+ + 2NO↑ +8H2O。
4.氢氧化亚铁在空气中被氧化,生成三价铁离子和水,反应式为:4Fe(OH)2 + O2 + 2H2O → 4Fe3+ + 4OH^-。
高一必修一铁及其化合物的化学反应方程式

高一必修一铁及其化合物的化学反应方程式
铁及其化合物是当今世界中相当重要的物质,自史前以来就被大量使用。
这种稀有金属由于其易于锻造及耐腐蚀而十分受人们欢迎,用于建造桥梁和房屋,也曾在很多国家发行货币。
铁在单质状态下是黑色的,与氧及其他元素化合会形成有色,重量较轻的化合物。
铁及其化合物的化学反应方程式主要有以下几种:
1、铁与硫化氢的反应:Fe + H2S → FeS + H2
2、铁与四氧化三铁的反应:Fe + Fe2O3 → 3FeO
3、铁与硫酸的反应:Fe + H2SO4 → FeSO4 + H2
4、铁与氧气的反应:4Fe + 3O2 → 2Fe2O3
5、铁与氧的反应:4Fe + 3O2 → 2Fe2O3
铁及其化合物在人们的生活中占据了非常重要的地位,它们可以高效地把资源转化为实用的物资。
通过上述化学反应方程式可以看出,铁与其他元素在反应中表现出了明显的不同性质。
实验表明,铁是一种非常可靠的建造材料,因此,它在建筑、桥梁、货币制作和发电等领域都有着极大的应用价值。
铁铜及其化合物重要方程式汇总

铁铜及其化合物重要方程式汇总金属及其化合物重要方程式汇总(三)铁、铜及其化合物1、铁与非金属单质反应:(1)Fe在纯O2中燃烧:化学方程式:;(2)Fe与S的反应:化学方程式:(3)Fe与Cl2点燃:化学方程式:;(4)Fe与I2的反应:化学方程式:;2、铁与水反应:(1)与水蒸汽反应:化学方程式:;(2)常温下,铁与水不起反应,但潮湿的空气里形成原电池,铁易被腐蚀,最终形成铁锈。
原电池反应:负极:正极:总反应:后续反应:3、铁与酸反应:(1)与非氧化性酸①铁和稀盐酸:化学方程式:;②铁和稀硫酸:化学方程式:;离子方程式:;(2)与氧化性酸(与浓硫酸、稀硝酸、浓硝酸)①常温下,浓硫酸和浓硝酸会使、钝化,加热反应。
②铁与浓硫酸:化学方程式:;③铁与足量浓硝酸:化学方程式:;离子方程式:;④少量铁与稀硝酸:化学方程式:;离子方程式:;⑤过量Fe与稀硝酸:化学方程式:;离子方程式:;4.铁与盐溶液反应:(1)铁和氯化铜溶液:化学方程式:离子方程式:;(2)除去FeCl2溶液中的FeCl3:化学方程式:;离子方程式:;第1页,共2页5.Fe3O4粉末和稀盐酸:化学方程式:;离子方程式:;6.CO还原磁性氧化铁(工业炼铁):化学方程式:;7.CO还原氧化铁(工业炼铁):化学方程式:;8.氧化铁和Al做铝热剂的铝热反应:化学方程式:9.向FeCl2溶液中通Cl2:化学方程式:;离子方程式:;10.向Fe(NO3)2溶液中滴加稀硝酸:化学方程式:;离子方程式:;11.向硫酸亚铁溶液滴加过量氨水,生成白色沉淀,迅速变灰绿色,最终变成红褐色:生成白色沉淀化学方程式:;离子方程式:;白色沉淀迅速变灰绿色最终变成红褐色,化学方程式_______________________________12.用氯化铁溶液制作铜制印刷电路板:化学方程式:;离子方程式:;13.Fe3+和I-不能大量共存,离子方程式_____________________________________________14.Fe3+和S2-不能大量共存,离子方程式____________________________________________15.Fe3+的检验:(1)常用硫氰化钾溶液:离子方程式:;(2)高浓度时加氢氧化钠溶液:离子方程式:;16.Fe2+的检验:(1)常用:先滴加硫氰化钾溶液,观察后,再加氯水:现象:;化学方程式:①;②;离子方程式:①;②;(2)高浓度时可以加氢氧化钠溶液:现象:;化学方程式:①;②;(3)当Fe2+和Fe3+共存时,用酸性高锰酸钾,现象是_______________________配平离子方程式:Fe2++MnO4-+H+=Fe3++Mn2++H2O第2页,共2页。
常见金属非金属及其化合物的化学方程式

常见金属非金属及其化合物的化学方程式好嘞,今天我们来聊聊那些常见的金属和非金属,还有它们的化合物。
这些东西可真是咱们日常生活中随处可见,搞得我一想到就忍不住想笑。
先说说金属吧,听起来高大上,其实它们在我们生活中可真是亲民啊。
比如说铁,咱们的“铁哥们”,不管是做成铁钉还是锅,都是陪伴着我们。
铁和氧气一旦碰上,哎呀,锈就来了,这可不是好事。
我们说“铁锈生锈”,这个道理大家都懂。
化学方程式上写成这样:4Fe + 3O₂ →2Fe₂O₃,听起来挺复杂,其实就是铁在空气中和氧气玩捉迷藏,最后变成了铁锈。
再说说铝,很多人都知道铝箔吧,包食物、烤东西,真是个好帮手。
铝和氧气结合成氧化铝,这可真是个有趣的过程。
化学方程式是4Al + 3O₂ → 2Al₂O₃。
铝在高温下和氧气反应,就像在炫技一样,真是个调皮捣蛋的小家伙。
然后是铜,铜的电线可是咱们家电的“命根子”。
铜和氧结合后也能产生氧化铜,这化学式写成2Cu + O₂ →2CuO。
真是简单明了,铜就像是在和氧气进行一场“贴贴”的游戏。
转过头来聊聊非金属,别看它们不如金属那样“闪闪发光”,其实也是个“厉害角色”。
像氯,这家伙可真调皮,单独一个氯气是绿色的,跟小绿人似的。
氯跟钠结合成氯化钠,就是咱们平常用的盐,听说过“盐能治百病”吧,这可不是说说而已。
氯和钠反应的方程式是2Na + Cl₂ → 2NaCl。
简简单单就把两个元素结合在一起,成就了咱们的美味。
还有硫,硫可是一位“火山之神”,在自然界中可是个大忙人。
硫和氧反应,生成了二氧化硫,这化学方程式是S + O₂ → SO₂。
听说这个东西一多就会造成酸雨,大家可得注意,别让它把咱们的屋顶给腐蚀了。
然后再说说碳,碳是个万用的元素,能跟很多东西“搭伙”。
比如说,碳和氧结合成二氧化碳,化学式是C + O₂ → CO₂。
这个小家伙可是我们呼吸时的“老朋友”,虽然有时候也被人说成“坏蛋”,但其实它在植物的光合作用中可是个“大功臣”。
元素(金属、非金属)及其化合物化学方程式
金属及其化合物1、钠放置在空气中 4Na + O2 = 2Na2O2、钠在空气中燃烧(黄色的火焰)2Na + O2 Na2O2(淡黄色固体)3、铝箔被氧气氧化 4Al + 3O2 △2O34、钠与水反应(浮、熔、游、响、红)2Na + 2H2O = 2NaOH + H2↑【2Na + 2H2O = 2Na+ + 2OH - + H2 ↑】5、高温下铁与水反应 3Fe + 4H2O(g) 高温Fe3O4 + 4H26、铝片与稀盐酸反应 2Al + 6HCl = 2AlCl3 + 3H2↑【2Al + 6H+ = 2Al3+ +3H2↑】7、铝与氢氧化钠溶液反应(实际是钠和水反应) 2Al + 2NaOH + 2H2O = 2NaAlO2(偏铝酸钠) + 3H2↑【2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑】8、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O = 4NaOH + O2↑【2Na2O2 + 2H2O = 4Na+ + 4OH - +O2↑】9、过氧化钠可用在呼吸面具和潜水艇中作为【供氧剂】,原因是:2Na2O2 + 2CO2 = 2Na2CO3 + O210、苏打(纯碱)与盐酸反应 Na2CO3 +2HCl=2NaCl+H2O +CO2↑【 CO32- + 2H+ = H2O + CO2↑】11、小苏打(碳酸氢钠)溶液与盐酸反应 NaHCO3 + HCl= NaCl+H2O +CO2↑【HCO3- + H+ = H2O + CO2↑】12、小苏打受热分解 2NaHCO3△Na2CO3 + H2O +CO2 ↑13、小苏打和氢氧化钠溶液溶液反应NaHCO3+NaOH= Na2CO3 + H2O 【HCO3-+ OH - = H2O + CO32- 】14、氧化铝溶于氢氧化钠溶液Al2O3 + 2NaOH ===2NaAlO2 +H2O 【Al2O3 + 2OH - === 2AlO2- + H2O】15、氧化铝溶于硫酸Al2O3+ 3H2SO4==Al2(SO4)3+3H2O 【Al2O3 +6H+ = 2Al3+ +3H2O】16、硫酸铝溶液中滴加过量氨水Al2(SO4)3 +6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4【Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+】17、氢氧化铝中加盐酸 Al(OH)3 + 3HCl = AlCl3 + 3H2O 【Al(OH)3 + 3H+ = Al3+ + 3H2O】18、Al(OH)3与NaOH溶液反应: Al(OH)3 + NaOH NaAlO2 +2H2O【Al(OH)3 + OH - = AlO2- +2H2O】19、氢氧化铝受热分解 2Al(OH)3△Al2O3+3H2O20、铁与盐酸反应 Fe + 2HCl = FeCl2 + H2↑【Fe + 2H+ = Fe2+ + H2↑】21、氧化铁溶于盐酸中 Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O 【Fe 2O 3 + 6H + = 2Fe 3++ 3H 2O 】 22、氧化亚铁溶于盐酸中 FeO + 2HCl = FeCl 2 + H 2O 【FeO + 2H += Fe 2++ H 2O 】 23、氯化铁溶液中滴入氢氧化钠溶液 FeCl 3 + 3NaOH = Fe(OH)3↓+ 3NaCl【Fe 3++ 3OH - = Fe(OH)3 ↓(红褐色沉淀)】 24、硫酸亚铁溶液中滴加氢氧化钠溶液Fe SO 4+ 2NaOH = Fe(OH)2↓+ Na 2SO 4 【Fe 2++ 2OH - = Fe(OH)2 ↓(白色沉淀)】25、氢氧化亚铁在空气中被氧化(白色沉淀迅速变为灰绿色,最后变为红褐色沉淀) 4Fe(OH)2 + O 2 +2H 2O = 4Fe(OH)3 26、氢氧化铁受热分解 2Fe(OH)3△Fe 2O 3+3H 2O27、氯化亚铁溶液中通入氯气 2FeCl 2 + Cl 2 = 2FeCl 3 【2Fe 2++ Cl 2 = 2Fe 3++ 2Cl - 】 28、氯化铁溶液中加入铁粉2FeCl 3 + Fe =3FeCl 2 【2Fe 3++ Fe =3Fe 2+】非金属及其化合物1、硅及其化合物的转化关系※ ①SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)※ ②SiO 2+2NaOH = Na 2SiO 3+H 2O( SiO 2+2OH -= SiO 32-+H 2O )※ ③Na 2SiO 3+2HCl = H 2SiO 3(胶体)+2NaCl ( SiO 32-+2H += H 2SiO 3(胶体))④ SiO 2+CaO 高温 CaSiO 32、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3②Cu +Cl 2 点燃CuCl 2③2FeCl 3+Cu = 2FeCl 2+CuCl 2(2Fe 3++Cu = 2Fe 2++Cu 2+)④H 2+Cl 2 2HCl ※⑤MnO 2+4HCl(浓)△MnCl 2+Cl 2↑+2H 2O(MnO 2+4H ++2Cl -△Mn 2++Cl 2↑+2H 2O) ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑(不稳定性)(Cl 2+H 2O = H ++Cl -+HclO) (2HClO 2H ++2Cl -+O 2↑)※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2O (工业制漂白粉) Ca(ClO)2+CO 2+H 2O = CaCO 3↓+2HClO(漂白原理)3、硫及其化合物的转化关系Na 2SiO 3 SiF 4 SiO 2 H 2SiO 3CaSiO 3 ① ② ③④ CuCl 2 HClO HCl Cl 2 FeCl 3 NaClO Ca(ClO)2 ① ② ③④ ⑤ ⑥ ⑦ ⑧ ⑨点燃或光照 光照光照①S +O 2 点燃 SO 2 ※②SO 2+O 2 催化剂 加热 2SO 3③SO 3+H 2O = H 2SO 4(工业制硫酸) ④SO 2+H 2O H 2SO 3⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O(SO 2+Ca 2++2OH -=CaSO 3↓+H 2O )⑥SO 3+CaO = CaSO 4 或 SO 3+Ca(OH)2 = CaSO 4+H 2O※⑦Cu+2H 2SO 4(浓) △ CuSO 4+SO 2↑+2H 2O ※⑧C +2H 2SO 4(浓) △CO 2↑+2SO 2↑+2H 2O4、氮及其化合物的转化关系※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2 ※③3NO 2+H 2O = 2HNO 3+NO ( 3NO 2+H 2O =2H ++2NO 3-+NO)※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O (Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O)※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂高温高压 2NH 3 (3Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O ) (工业制氨气)⑦NH 3+HCl = NH 4Cl NH 4HCO 3 △NH 3↑+H 2O+CO 2↑(铵盐受热易分解)⑧NH 4Cl△NH 3↑+HCl ↑(水溶液中)( NH 3+H += NH 4+) ⑧NH 4Cl +NaOH △ NaCl+NH 3↑+H 2O (NH 4++OH-△NH 3↑+H 2O) ※⑧2NH 4Cl +2Ca(OH)2 △ CaCl 2+2NH 3↑+2H 2O⑨4NH 3+5O 2 催化剂△ 4NO +6H 2OSO 42 3 CaSO 3 4① ⑨ ⑧⑦ ⑥ ④ ③ N 2 NH 3 NH 4Cl NO 3② ③高温或放电。
金属和化合物化学方程式
★☆钠及其重要化合物☆★一、金属钠1。
钠与氧气反应常温: 4Na + O2 = 2Na2O (白色)点燃: 2Na + O2Na2O2(淡黄色)或:2Na + O2Na2O2(淡黄色) 2。
钠与氯气反应2Na + Cl22NaCl(剧烈燃烧,大量白烟)3。
钠与硫的反应2Na + S = Na2S (直接化合,甚至爆炸)4。
钠与熔融盐(如TiCl4)的反应:4Na + TiCl44NaCl + Ti5。
钠与水的反应2Na + 2H2O = 2NaOH + H2↑2Na + 2H2O = 2Na++2OH— + H2↑6.钠与盐酸的反应2Na + 2HCl = 2NaCl + H2↑2Na + 2H+ = 2Na+ + H2↑7。
钠与硫酸铜等盐溶液的反应2Na +2H2O = 2NaOH + H2↑2NaOH+CuSO4 = Cu(OH)2↓+ Na2SO4总反应:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑二、氧化钠—碱性氧化物:能与酸反应生成盐和水的氧化物1.碱性氧化物+水→碱(碱可溶才易反应)Na2O + H2O = 2NaOHNa2O + H2O = 2Na+ + 2OH—2.碱性氧化物+酸性氧化物→盐Na2O + CO2 = Na2CO33.碱性氧化物+酸→盐+水Na2O + 2HCl = 2NaCl + H2ONa2O + 2H+ = 2Na+ + H2O三、过氧化钠—不是碱性氧化物1.过氧化钠与水反应2Na2O2 + 2H2O = 4NaOH + O2↑2Na2O2 + 2H2O = 4Na++4OH- + O2↑2.过氧化钠与二氧化碳反应2Na2O2 + 2CO2 = 2Na2CO3 + O23.过氧化钠与酸反应2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑2Na2O2 + 4H+ = 4Na+ + 2H2O + O2↑四、碳酸钠(纯碱、苏打)1.碳酸钠与酸的反应⑴碳酸钠溶液分别与少量盐酸、足量盐酸反应Na2CO3 + HCl = NaHCO3 + NaClCO32— + H+ = HCO3-Na2CO3 + 2HCl = 2NaCl +CO2↑+ H2OCO32— + 2H+ = CO2↑+ H2O⑵碳酸钠溶液与足量醋酸反应Na2CO3+2CH3COOH=2CH3COONa+CO2↑+H2OCO32—+2CH3COOH=2CH3COO-+CO2↑+H2O⑶碳酸钠溶液中通入二氧化碳气体Na2CO3 + H2O + CO2 = 2NaHCO3CO32- + H2O + CO2 = 2HCO3-过量....CO2通入饱和..Na2CO3溶液:析出NaHCO3晶体*Na2CO3 + H2O + CO2 = 2NaHCO3↓2Na++CO32- + H2O + CO2 = 2NaHCO3↓⑷***碳酸钠溶液中通入二氧化碳气体*Na2CO3 + SO2 = Na2SO3 + CO2↑*Na2CO3 + H2O + 2SO2 = 2NaHSO3 + CO2↑2。
al及其化合物的化学方程式
al及其化合物的化学方程式aluminum (Al)是一种常见的金属元素,化学符号为Al,原子序数为13。
它是一种轻质、耐腐蚀和导电性能良好的金属,广泛应用于工业和日常生活中。
在化学方程式中,Al通常以离子的形式存在,即Al3+。
Al3+是一种具有3个正电荷的阳离子,它与其他阴离子或分子结合形成化合物。
其中,最常见的化合物是氧化铝(aluminum oxide,Al2O3)。
氧化铝是一种白色固体,具有高熔点和高硬度,被广泛用作陶瓷材料、砂纸和研磨剂等。
氧化铝的化学方程式为:2Al + 3O2 → 2Al2O3这个方程式表示了氧化铝的合成反应,其中2个Al原子与3个O2分子反应生成2个Al2O3分子。
这个反应是一个氧化反应,Al原子失去电子形成Al3+离子,而氧气分子接受电子形成氧化物离子(O2-)。
Al2O3是一种离子化合物,其中Al3+离子和O2-离子通过离子键结合在一起。
Al还可以与非金属元素形成其他化合物,如与氯(Cl)形成氯化铝(aluminum chloride,AlCl3)。
氯化铝是一种白色晶体,具有强烈的吸湿性,可用作催化剂和制造其他化学品的原料。
氯化铝的化学方程式为:2Al + 3Cl2 → 2AlCl3这个方程式表示了氯化铝的合成反应,其中2个Al原子与3个Cl2分子反应生成2个AlCl3分子。
这个反应是一个氧化还原反应,Al 原子失去电子形成Al3+离子,而氯气分子接受电子形成氯离子(Cl-)。
AlCl3是一种离子化合物,其中Al3+离子和Cl-离子通过离子键结合在一起。
Al还可以与氧气和盐酸等物质反应生成不同的化合物。
例如,当Al 与氧气反应时,可以生成氧化铝(Al2O3),而当Al与盐酸反应时,可以生成氯化铝(AlCl3)。
这些化合物在工业生产和实验室研究中都有广泛的应用。
总结起来,Al及其化合物的化学方程式描述了Al原子与其他元素或化合物之间的反应过程,通过失去或接受电子形成不同的离子化合物。
高三化学元素及化合物所有化学方程式
高中化学元素及化合物所有化学方程式非金属单质(F2 ;Cl2 ; O2 ; S; N2 ; P ; C ; Si)1;氧化性:F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属)2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2OF2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HClCl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HClCl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3N2+3Mg===Mg3N2N2+3Ca===Ca3N2N2+3Ba===Ba3N2N2+6Na===2Na3NN2+6K===2K3NN2+6Rb===2Rb3NP2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2;Cl2;Br2)PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2OC+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23;(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化;加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热;浓)===5KCl+KClO3+3H2O3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO3C+SiO2===SiC+2CO二;金属单质(Na;Mg;Al;Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al;Fe在冷;浓的H2SO4;HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下;不能把四氯化锡完全还原为单质锡 Fe+SnCl2==FeCl2+Sn)三;非金属氢化物(HF;HCl;H2O;H2S;NH3) 1;还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O2H2O+2F2===4HF+O22H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2O2H2S+SO2===3S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H24NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H22;酸性:4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2H2S+CuCl2===CuS+2HClH2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HClH2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2===2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3)3;碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(此反应用于工业制备小苏打;苏打)4;不稳定性:2HF===H2+F22HCl===H2+Cl22H2O===2H2+O22H2O2===2H2O+O2H2S===H2+S2NH3===N2+3H2四;非金属氧化物低价态的还原性:2SO2+O2===2SO32SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HClSO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HISO2+NO2===SO3+NO2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2CO+H2O===CO2+H2氧化性:SO2+2H2S===3S+2H2OSO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg;Ca;Ba;Na;K等燃烧的火灾) SiO2+2H2===Si+2H2OSiO2+2Mg===2MgO+Si3;与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O===2HPO3P2O5+3H2O===2H3PO4(P2O5极易吸水;可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34;与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2;再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥;SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3CO2+C6H5ONa+H2O===C6H5OH+NaHCO3SiO2+CaO===CaSiO3SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2SiO2+CaCO3===CaSiO3+CO2五;金属氧化物1;低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2O2;氧化性:Na2O2+2Na===2Na2O(此反应用于制备Na2O)MgO;Al2O3几乎没有氧化性;很难被还原为Mg;Al. 一般通过电解制Mg和Al.Fe2O3+3H2===2Fe+3H2O (制还原铁粉)Fe3O4+4H2===3Fe+4H2O3;与水的作用:Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;2H2O2===2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2)MgO+H2O===Mg(OH)2 (缓慢反应)4;与酸性物质的作用:Na2O+SO3===Na2SO4Na2O+CO2===Na2CO3Na2O+2HCl===2NaCl+H2O2Na2O2+2CO2===2Na2CO3+O2Na2O2+H2SO4(冷;稀)===Na2SO4+H2O2MgO+SO3===MgSO4MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O(Al2O3是两性氧化物:Al2O3+2NaOH===2NaAlO2+H2O)FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2OFe2O3+3H2S(g)===Fe2S3+3H2OFe3O4+8HCl===FeCl2+2FeCl3+4H2O六;含氧酸1;氧化性:4HClO3+3H2S===3H2SO4+4HClHClO3+HI===HIO3+HCl3HClO+HI===HIO3+3HClHClO+H2SO3===H2SO4+HClHClO+H2O2===HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4;但浓;热的HClO4氧化性很强)2H2SO4(浓)+C===CO2+2SO2+2H2O2H2SO4(浓)+S===3SO2+2H2OH2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O2H2SO4(浓)+Cu===CuSO4+SO2+2H2OH2SO4(浓)+2HBr===SO2+Br2+2H2OH2SO4(浓)+2HI===SO2+I2+2H2OH2SO4(稀)+Fe===FeSO4+H22H2SO3+2H2S===3S+2H2O4HNO3(浓)+C===CO2+4NO2+2H2O6HNO3(浓)+S===H2SO4+6NO2+2H2O5HNO3(浓)+P===H3PO4+5NO2+H2O6HNO3+Fe===Fe(NO3)3+3NO2+3H2O4HNO3+Fe===Fe(NO3)3+NO+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O2;还原性:H2SO3+X2+H2O===H2SO4+2HX(X表示Cl2;Br2;I2)2H2SO3+O2===2H2SO4H2SO3+H2O2===H2SO4+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl3;酸性:H2SO4(浓) +CaF2===CaSO4+2HFH2SO4(浓)+NaCl===NaHSO4+HClH2SO4(浓) +2NaCl===Na2SO4+2HClH2SO4(浓)+NaNO3===NaHSO4+HNO33H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)23HNO3+Ag3PO4===H3PO4+3AgNO32HNO3+CaCO3===Ca(NO3)2+H2O+CO2(用HNO3和浓H2SO4不能制备H2S;HI;HBr;(SO2)等还原性气体)4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr===NaH2PO4+HBrH3PO4(浓)+NaI===NaH2PO4+HI4;不稳定性:2HClO===2HCl+O24HNO3===4NO2+O2+2H2OH2SO3===H2O+SO2H2CO3===H2O+CO2H4SiO4===H2SiO3+H2O七;碱低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)3与酸性物质的作用:2NaOH+SO2(少量)===Na2SO3+H2ONaOH+SO2(足量)===NaHSO32NaOH+SiO2===NaSiO3+H2O2NaOH+Al2O3===2NaAlO2+H2O2NaOH+Cl2===NaCl+NaClO+H2ONaOH+HCl===NaCl+H2ONaOH+H2S(足量)===NaHS+H2O2NaOH+H2S(少量)===Na2S+2H2O3NaOH+AlCl3===Al(OH)3+3NaClNaOH+Al(OH)3===NaAlO2+2H2O(AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl===NaCl+NH3+H2OAl(OH)3+NH4Cl 不溶解3;不稳定性:Mg(OH)2===MgO+H2O2Al(OH)3===Al2O3+3H2O2Fe(OH)3===Fe2O3+3H2OCu(OH)2===CuO+H2O八;盐1;氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)Fe(NO3)3+Ag 不反应2FeCl3+H2S===2FeCl2+2HCl+S2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl22;还原性:2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O2Na2SO3+O2===2Na2SO43;与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4ClAlCl3+3NH3.H2O===Al(OH)3+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl4;与酸性物质的作用:Na3PO4+HCl===Na2HPO4+NaClNa2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaClNa2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl 3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl 3NaHCO3+AlCl3===Al(OH)3+3CO23NaHCO3+FeCl3===Fe(OH)3+3CO23Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S3NaAlO2+AlCl3+6H2O===4Al(OH)35;不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2+H2ONH4Cl===NH3+HClNH4HCO3===NH3+H2O+CO22KNO3===2KNO2+O22Cu(NO3)3===2CuO+4NO2+O22KMnO4===K2MnO4+MnO2+O22KClO3===2KCl+3O22NaHCO3===Na2CO3+H2O+CO2Ca(HCO3)2===CaCO3+H2O+CO2CaCO3===CaO+CO2MgCO3===MgO+CO2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
★☆钠及其重要化合物☆★一、金属钠1.钠与氧气反应常温:4Na + O2 = 2Na2O (白色)点燃:2Na + O2 Na2O2(淡黄色)或:2Na + O2 Na2O2 (淡黄色) 2.钠与氯气反应2Na + Cl22NaCl(剧烈燃烧,大量白烟)3.钠与硫的反应2Na + S = Na2S (直接化合,甚至爆炸)4.钠与熔融盐(如TiCl4)的反应:4Na + TiCl44NaCl + Ti5.钠与水的反应2Na + 2H2O = 2NaOH + H2↑2Na + 2H2O = 2Na++2OH- + H2↑6.钠与盐酸的反应2Na + 2HCl = 2NaCl + H2↑2Na + 2H+ = 2Na+ + H2↑7.钠与硫酸铜等盐溶液的反应2Na +2H2O = 2NaOH + H2↑2NaOH+CuSO4 = Cu(OH)2↓+ Na2SO4总反应:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑二、氧化钠—碱性氧化物:能与酸反应生成盐和水的氧化物1.碱性氧化物+水→碱(碱可溶才易反应)Na2O + H2O = 2NaOHNa2O + H2O = 2Na+ + 2OH-2.碱性氧化物+酸性氧化物→盐Na2O + CO2 = Na2CO33.碱性氧化物+酸→盐+水Na2O + 2HCl = 2NaCl + H2ONa2O + 2H+ = 2Na+ + H2O三、过氧化钠—不是碱性氧化物1.过氧化钠与水反应2Na2O2 + 2H2O = 4NaOH + O2↑2Na2O2 + 2H2O = 4Na++4OH- + O2↑2.过氧化钠与二氧化碳反应2Na2O2 + 2CO2 = 2Na2CO3 + O23.过氧化钠与酸反应2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑2Na2O2 + 4H+ = 4Na+ + 2H2O + O2↑四、碳酸钠(纯碱、打)1.碳酸钠与酸的反应⑴碳酸钠溶液分别与少量盐酸、足量盐酸反应Na2CO3 + HCl = NaHCO3 + NaClCO 32- + H + = HCO 3-Na 2CO 3 + 2HCl = 2NaCl +CO 2↑+ H 2OCO 32- + 2H + = CO 2↑+ H 2O⑵碳酸钠溶液与足量醋酸反应Na 2CO 3+2CH 3COOH=2CH 3COONa+CO 2↑+H 2OCO 32-+2CH 3COOH=2CH 3COO -+CO 2↑+H 2O ⑶碳酸钠溶液入二氧化碳气体Na 2CO 3 + H 2O + CO 2 = 2NaHCO 3CO 32- + H 2O + CO 2 = 2HCO 3-过量..CO 2通入饱和..Na 2CO 3溶液:析出NaHCO 3晶体.. *Na 2CO 3 + H 2O + CO 2 = 2NaHCO 3↓ 2Na ++CO 32- + H 2O + CO 2 = 2NaHCO 3↓ ⑷***碳酸钠溶液入二氧化碳气体*Na 2CO 3 + SO 2 = Na 2SO 3 + CO 2↑*Na 2CO 3 + H 2O + 2SO 2 = 2NaHSO 3 + CO 2↑2.碳酸钠与某些盐(CaCl 2、BaCl 2、AgNO 3、NaHSO 4)的反应Na 2CO 3+ CaCl 2=CaCO 3↓+2NaClCO 32-+ Ca 2+=CaCO 3↓Na 2CO 3+ 2AgNO 3=Ag 2CO 3↓+2NaNO 3CO 32-+ 2Ag +=Ag 2CO 3↓*Na 2CO 3+ 2NaHSO 4=2Na 2SO 4+CO 2↑+H 2O CO 32-+ 2H +=CO 2↑+H 2O3.碳酸钠溶液与某些碱[Ca(OH)2、Ba(OH)2]溶液的反应Na 2CO 3+ Ca(OH)2=CaCO 3↓+2NaOHCO 32-+ Ca 2+=CaCO 3↓Na 2CO 3+ Ba(OH)2=BaCO 3↓+2NaOHCO 32-+ Ba 2+=BaCO 3↓五、碳酸氢钠(小打)1.碳酸氢钠受热分解2NaHCO 3Na 2CO 3+H 2O+CO 2↑2.碳酸氢钠分别与盐酸、醋酸的反应NaHCO 3 + HCl = NaCl+CO 2↑+ H 2OHCO 3-+H+ =CO 2↑+H 2ONaHCO 3+CH 3COOH=CH 3COONa+CO 2↑+H 2O HCO 3-+CH 3COOH=CH 3COO -+CO 2↑+H 2O3.用饱和..NaHCO 3溶液除去CO 2中混有的SO 2气体:*2NaHCO 3 + SO 2 = Na 2SO 3 + 2CO 2↑+H 2O4.碳酸氢钠溶液与某些碱的反应NaHCO 3 + NaOH = Na 2CO 3 + H 2OHCO 3-+OH-=CO 32-+H 2O*** NaHCO 3溶液与Ca(OH)2溶液的反应: *a .足量NaHCO 3溶液与少量澄清石灰水时: 2NaHCO 3+Ca(OH)2=CaCO 3↓+Na 2CO 3+2H 2O 2HCO 3-+Ca 2++2OH -=CaCO 3↓+CO 32-+2H 2O*b.少量NaHCO3溶液与足量澄清石灰水时:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2OHCO3-+Ca2++OH-=CaCO3↓+2H2O5.碳酸氢钠与某些盐的反应NaHCO3 + NaHSO4 = Na2SO4 + CO2↑+H2OHCO3-+H+=CO2↑+H2O六、氢氧化钠(烧碱、火碱、苛性钠)1.氢氧化钠与酸性氧化物(CO2、SO2)的反应2NaOH + CO2 = Na2CO3 + H2O2OH- + CO2 = CO32- + H2ONa2CO3 + H2O + CO2 = 2NaHCO3CO32-+ H2O + CO2 = 2HCO3-总反应:NaOH + CO2 = NaHCO3OH- + CO2 = HCO3-2.氢氧化钠分别与盐酸、醋酸的反应NaOH +HCl =NaCl+ H2OOH-+H+=H2ONaOH + CH3COOH = CH3COONa+H2OOH- + CH3COOH = CH3COO-+H2O3.氢氧化钠与某些盐的反应2NaOH+CuSO4=Na2SO4+ Cu(OH)2↓2OH-+Cu2+=Cu(OH)2↓*** NaOH溶液与Ca(HCO3)2溶液的反应:*a.少量NaOH溶液与足量Ca(HCO3)2溶液时:Ca(HCO3)2+NaOH=CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-=CaCO3↓+H2O*b.足量NaOH溶液与少量Ca(HCO3)2溶液时:Ca(HCO3)2+2NaOH=CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O七、氯化钠1.氯化钠与某些盐的反应NaCl+AgNO3=AgCl↓+ NaNO3Cl-+Ag+=AgCl↓2.氯化钠固体与浓硫酸反应NaCl + H2SO4(浓)NaHSO4+HCl↑2NaCl + H2SO4(浓)Na2SO4+2HCl↑3.电解熔融的氯化钠2NaCl(熔融)2Na+Cl2↑★☆镁及其重要化合物☆★1.镁与氧气反应2Mg + O22MgO(耀眼白光、大量白烟)2.镁与氯气反应Mg + Cl2MgCl23.镁与氮气反应3Mg + N2Mg3N24.镁与CO2反应2Mg + CO22MgO +C5.镁与H2O反应(与冷水很缓慢、与沸水较迅速反应)Mg + 2H2O = Mg(OH)2 +H2↑6.镁与盐酸反应Mg + 2HCl =MgCl2 +H2↑Mg + 2H+=Mg2+ +H2↑7.镁与某些盐的反应Mg + CuCl2 = MgCl2 + CuMg + Cu2+ = Mg2+ + Cu8.氧化镁与酸反应MgO + 2HCl =MgCl2 + H2OMgO + 2H+=Mg2+ + H2O9.氢氧化镁与酸反应Mg(OH)2 + 2HCl =MgCl2 + 2H2OMg(OH)2 + 2H+=Mg2+ + 2H2O10.氢氧化镁受热分解Mg(OH)2MgO + H2O11.氯化镁与碱反应⑴氯化镁溶液与氢氧化钠溶液反应MgCl2 + 2NaOH = Mg(OH)2↓+ 2NaClMg2+ + 2OH- = Mg(OH)2↓⑵氯化镁溶液与氨水反应MgCl2 + 2NH3·H2O = Mg(OH)2↓+ 2NH4ClMg2+ + 2NH3·H2O = Mg(OH)2↓+ 2NH4+12.氯化镁与某些盐(Na2CO3)的反应MgCl2 + Na2CO3 = MgCO3↓+ 2NaClMg2+ + CO32- = MgCO3↓13.电解熔融的氯化镁MgCl2(熔融)Mg+Cl2↑★☆铝及其重要化合物☆★一、金属铝1.铝与氧气反应4Al + 3O22Al2O32.铝与氯气反应2Al + 3Cl22AlCl33.铝与硫的反应2Al + 3SAl2S34.铝热反应2Al+Fe2O3Al2O3+2Fe(剧烈反应,火星四射,有红热的熔融物生成)5.铝与强酸的反应2Al + 6HCl = 2AlCl3 + 3H2↑2Al + 6H+ = 2Al3+ + 3H2↑6.铝与强碱的反应2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑或:2Al+2NaOH+6H2O = 2Na[Al(OH)4] + 3H2↑2Al+2OH-+6H2O = 2[Al(OH)4]- + 3H2↑四羟基合铝酸钠7.铝与某些盐的反应2Al + 3CuSO4 = Al2(SO4)3 + 3Cu2Al + 3Cu2+ = 2Al3+ + 3Cu二、氧化铝1.与强酸反应:Al2O3+6HCl=2AlCl3+3H2OAl2O3+6H+=2Al3++3H2O2.与强碱反应:Al2O3+2NaOH=2NaAlO2+H2OAl2O3+2OH-=2AlO2-+H2O三、氢氧化铝1.Al(OH)3的两性:①与强酸反应:Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O②与强碱反应:Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+OH-=AlO2-+2H2O2.Al(OH)3的不稳定性: 受热易分解2Al(OH)3Al2O3+3H2O四、氯化铝1.氯化铝溶液与氢氧化钠溶液反应氢氧化钠不足时:AlCl3+3NaOH = Al(OH)3↓+3NaClAl3++3OH- = Al(OH)3↓氢氧化钠过量后:Al(OH)3+NaOH = NaAlO2+2H2OAl(OH)3+OH- = AlO2-+2H2O ☆总反应:AlCl3+4NaOH = NaAlO2+3NaCl +2H2OAl3++4OH- = AlO2-+2H2O2.氯化铝溶液与氨水反应AlCl3+3NH3·H2O=Al(OH)3↓+ 3NH4ClAl3++3NH3·H2O=Al(OH)3↓+ 3NH4+3.氯化铝溶液与偏铝酸钠溶液反应3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl3AlO2-+Al3++6H2O=4Al(OH)3↓五、偏铝酸钠1.偏铝酸钠溶液与盐酸的反应盐酸不足时:NaAlO2+HCl+H2O=Al(OH)3↓+NaClAlO2-+H++H2O=Al(OH)3↓盐酸过量后:Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O☆总反应:NaAlO2+4HCl=AlCl3+NaCl +2H2OAlO2-+4H+=Al3++2H2O2.偏铝酸钠溶液与CO2的反应NaAlO2溶液入少量CO2气体:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-NaAlO2溶液入过量CO2气体:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-3.偏铝酸钠溶液与氯化铝溶液的反应3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl3AlO2-+Al3++6H2O=4Al(OH)3↓六、硫酸铝钾—KAl(SO4)2——复盐明矾:KAl(SO4)2·12H2O(十二水合硫酸铝钾)明矾净水:溶于水时产生Al(OH)3胶体,能吸附水中悬浮的杂质而沉淀。
