Fe标准曲线
分光光度法测铁含量 -回复

分光光度法测铁含量-回复要使用分光光度法测量铁含量,我们需要先了解铁的化学性质、分光光度法的原理和操作步骤。
下面将详细介绍。
一、铁的化学性质铁是常见的金属元素之一,在地壳中含量丰富。
它常以两种价态存在:二价铁(Fe2+)和三价铁(Fe3+)。
铁在水溶液中容易发生氧化还原反应,使其价态发生变化。
这使得测定铁含量时需要注意其价态的控制。
二、分光光度法原理分光光度法是利用物质对特定波长的光吸收的定量分析方法。
在分光光度法测铁含量时,我们常使用巴西红(1,10-菲罗啉)作为指示剂。
巴西红与Fe3+形成显色络合物,这是一种具有可见光吸收的化合物。
通过测量该络合物的吸光度,可以间接测定溶液中的Fe3+含量。
三、操作步骤1. 制备标准曲线首先,我们需要制备一系列已知铁含量的标准溶液。
可以通过称取一定量的无水硫酸亚铁(FeSO4)加入适量的盐酸后稀释至一定体积。
这些标准溶液的铁含量应当覆盖预期测量的样品中铁含量的范围。
2. 处理样品取一定量的待测样品,加入足够的盐酸,使得样品中的所有铁都被还原为二价铁离子。
这可以通过加热使溶液中产生大量氢气来促进还原反应。
然后冷却并定容至一定体积。
3. 测量样品吸光度将处理后的样品溶液转移至分光光度计量池中。
在使用分光光度计之前,应先调节仪器光程、波长并进行零点检测。
选择特定的波长(常见为510 nm)后,读取样品吸光度(A)值。
4. 绘制标准曲线将标准溶液分别进行类似的操作,测量其吸光度(A)值。
然后,根据标准溶液铁含量与吸光度的关系,绘制出标准曲线。
5. 测量样品铁含量通过读取样品溶液的吸光度(A)值,并使用标准曲线进行插值计算,可以得出样品中的铁含量。
除了以上的基本操作步骤,还需要注意以下几点:- 操作时要注意安全,避免与化学试剂接触皮肤和吸入气体。
- 所有玻璃仪器要事先用盛有浓硝酸的容器清洗,并用去离子水彻底漂洗干净。
- 待测样品需要按照操作要求进行预处理,例如还原铁的价态。
铁含量的测定.

铁含量的测定一、实验原理铁的吸光光度法所用的显色剂较多,有邻二氮菲(又称邻菲罗啉、邻菲绕啉)及其衍生物、磺基水杨酸、硫氰酸盐等。
其中邻二氮菲分光光度法的灵敏度高,稳定性好,干扰容易消除,是较普遍采用的一种方法。
在pH值为2—9的溶液中,Fe2+可与邻二氮菲生成极稳定的橙红色络合物[Fe(Phen)3]2+该络合物在波长510mm处有最大吸收,其吸光度与铁含量成正比,可用比色法测定。
二、试剂和器材10%盐酸羟胺溶液(用时配制);0.12%邻菲罗啉显色剂;乙酸钠溶液(1mol/L);HCl溶液(2mol/L);HCl溶液(1:1)。
铁标准储备液;铁标准使用液;比色管(50ml),电子天平,分光光度计。
三、实验步骤1、样品处理精确称取样品3~5g,用干灰化法灰化后,加少量水润湿,加盐酸溶液(1:1)10mL 溶解,移入100mL容量瓶中,用水冲洗坩埚3~4次,并入容量瓶中,用水定容后过滤。
2、标准曲线的绘制吸取10ug/mL的铁标准使用液0、1.0mL、2.0mL、3.0mL、4.0mL、5.0mL,置于6个50mL比色管中,分别加入1mL盐酸羟胺溶液、2mL邻菲罗啉显色剂、5mL乙酸钠溶液,每加入一种试剂都要摇匀。
然后用水稀释至刻度。
10min后,用1cm比色皿,以不加铁标准使用液的试剂空白作参比,在510nm波长处测定各溶液的吸光度。
以铁含量为横坐标,吸光度为纵坐标,绘制标准曲线。
3、测定准确吸取上述待测溶液1~5mL于50mL比色管中,按标准曲线的绘制步骤,加入各种试剂,测定吸光度,在标准曲线上查出相应的铁含量(ug)。
4、结果计算x=m0/(m× V 1/ V2) ×100x—样品中铁的含量,ug/100g;m0—从标准曲线上查得测定用样液相应的铁含量,ug;V 1—测定用样液的体积,ml;V2—样液定容的总体积,ml;m—样品质量,g四、注意事项1. 应该注意显色时所加试剂的顺序不能改变,否则影响测定结果2. 由于高氯酸对显色剂有干扰,故不能采用硝酸-高氯酸体系消化样品,可采用硝酸-盐酸体系。
铁标准曲线的绘制

铁标准曲线的绘制方法1.方法原理亚铁在pH3~9之间的溶液中,可与邻菲啰啉生成很稳定的橙红色络合物。
高铁离子可以通过还原剂还原成亚铁进行测定。
测量波长在510nm处,用邻菲啰啉分光光度法可测量Fe2+、Fe3+及总铁含量。
2.方法适用范围此方法适用于一般环境水和废水中铁的监测,最低检出浓度为0.03mg/L,测定上限为5.00 mg/L。
对铁离子大于5.00 mg/L的水样,可适当稀释后再按照本方法进行测定。
3.仪器及试剂3.1使用仪器分光光度计,10mm比色皿3.2试剂3.2.1铁标准贮备溶液称取0.7020g硫酸亚铁铵,溶于 (1+1)硫酸50mL中,转移至1000mL容量瓶中,用水稀释至刻度,摇匀。
此溶液含铁浓度为100μg/mL。
3.2.2 铁标准使用液准确移取标准贮备溶液25.00mL置于100mL容量瓶中,加水至标线,摇匀。
此溶液含铁浓度为25.0μg/mL。
3.2.3盐酸(ρ1.19g/mL),(1+3)盐酸溶液3.2.4盐酸羟胺溶液OH·HCl)=100g/L]:称取10g盐酸羟胺溶于水中,稀盐酸羟胺溶液[ρ(NH2释至100mL。
3.2.5 缓冲溶液:40g乙酸铵加50mL冰乙酸用水稀释至100mL。
3.2.6邻菲啰啉溶液:邻菲啰啉溶液:称取0.5g邻菲啰啉溶于水中,加数滴盐酸帮助溶解,稀释至100mL。
3.2.7饱和乙酸钠溶液4.铁标准曲线的绘制方法4.1 标准曲线的绘制将25.0μg/mL的铁标准溶液稀释5倍,变成5mg/L的铁标准溶液。
再依次移取铁标准液0、2.00、4.00、6.00、8.00、10.00mL置于50mL比色管中,加(1+3) 盐酸1mL,100g/L盐酸羟胺溶液2~3mL,再加适量蒸馏水,在水浴中加热。
然后冷却至室温,加一小片刚果红试纸,滴加饱和乙酸钠溶液至刚果红试纸刚刚变红,加入5mL缓冲溶液和邻菲啰啉溶液2mL,加水至标线,摇匀。
显色15min后,用10mm 比色皿,以空白调零,在510nm处测量吸光度。
标准曲线的意义

标准曲线的意义标准曲线是科学实验中常用的一种图表,它能够直观地展示出实验数据的规律性和趋势,为科研工作者提供了重要的参考依据。
标准曲线通常是通过一系列实验数据绘制而成,它可以用来分析和比较不同样本的浓度、含量等物质特征,具有非常重要的意义。
首先,标准曲线可以用来定量分析样本中的物质含量。
通过在实验中制备一系列不同浓度的标准溶液,并对这些标准溶液进行检测,我们可以得到一组实验数据。
将这些数据绘制成标准曲线后,我们就可以通过待测样品的检测数值,根据标准曲线得出样品中物质的含量。
这种方法可以非常准确地确定样品中目标物质的浓度,对于化学分析和生物实验等领域具有非常重要的意义。
其次,标准曲线可以用来验证实验方法的准确性和可靠性。
在科学研究中,我们经常需要对新的实验方法进行验证和比对。
通过制备标准溶液,我们可以对新的实验方法进行测试,然后将实验数据绘制成标准曲线,与已有的标准曲线进行比对。
如果两条曲线吻合度高,那么就说明新的实验方法是准确可靠的;反之,如果吻合度低,就需要重新检查实验方法,找出问题所在。
此外,标准曲线还可以用来评估实验数据的可信度。
在科学研究中,我们经常会遇到一些异常数据或者误差较大的数据。
通过绘制标准曲线,我们可以直观地看出实验数据的分布情况,判断数据的可信度。
如果实验数据点分布在标准曲线附近,并且符合曲线的趋势,那么说明实验数据是可靠的;反之,如果数据点偏离曲线或者出现异常情况,就需要重新检查实验过程,找出问题所在。
总的来说,标准曲线在科学研究中具有非常重要的意义。
它不仅可以用来定量分析样品中的物质含量,还可以用来验证实验方法的准确性和可靠性,评估实验数据的可信度。
因此,科研工作者在进行实验过程中,应该重视标准曲线的绘制和分析,以确保实验结果的准确性和可靠性。
无定形铁、铝、硅的测定方法

无定形铁、铝、锰、硅的测定1 原理无定形(非晶质)氧化物是指不产生X射线的胶体氧化物。
由于酸性H2C2O4-(NH4)2C2O4溶液具有pH缓冲性能极强的特点,对于酸性和中性土壤浸出液的酸度可稳定在pH3.2左右,即使碱土(土壤pH达10),经测定证实,pH仍能稳定在3.3~3.4。
草酸-草酸铵缓冲也中草酸根可将土壤中非晶质氧化铁中的铁、非晶质氧化铝中的铝以及非晶质氧化硅中的硅络合成水溶性的络合物进入提取液。
因此一般用于浸提活性较大的Fe、Al、Mn、Si等氧化物。
2 试验2.1 样品待测液的制备用H2C2O4-(NH4)2C2O4溶液,一次性振荡提取土壤,使Fe、Al、Mn和Si 等无定形水合氧化物提取到溶液中,然后用同一特测液分别测定。
2.1.1 主要仪器振荡机、三角瓶(250ml)、胶塞、布袋、离心机(最大转速5000r/min,附100ml 离心管)、烧杯(200ml)2.1.2 试剂(1) 酸性H2C2O4-(NH4)2C2O4提取剂:称取25.20g草酸(H2C2O4,分析纯)和49.68g草酸铵((NH4)2C2O4,分析纯),加水后加热溶解,用水定容到2升(pH 应为3.2,必要时可在pH计上用稀H2C2O4和NH4OH调节)。
(2) H2SO4:硫酸(H2SO4,分析纯);(3) H2O2:过氧化氢(H2O2,分析纯);2.1.3 操作步骤(1) 样品待测液的提取称取通过0.25mm的风干土样2.00g,置于250 ml三角瓶中,在20-25℃时,按1:50土液比加入l00 ml H2C2O4-(NH4)2C2O4提取液,加塞,将三角瓶放入布袋中,在振荡机上遮光振荡2小时,然后将混合液转入100ml离心管中,于3000-4000r/min的离心机中离心,离心后的上清液可直接转入塑料瓶或三角瓶中,加塞备用,若上清液中仍有浑浊,则可用干的定性滤纸过滤,滤液作为活性Fe和Si的待测液。
Fe、Mn、Zn、Cu的标准曲线
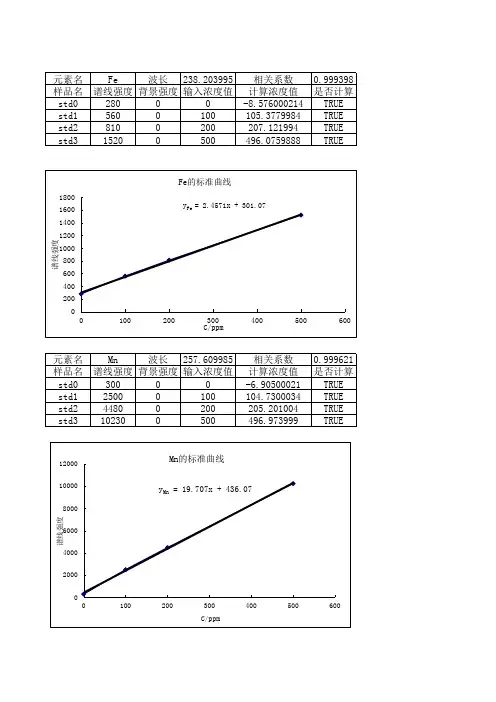
相关系数 计算浓度值 -8.576000214 105.3779984 207.121994 496.0759888
0.998347 是否计算 TRUE TRUE TRUE TRUE
Zn的标准曲线
2000 1800 1600 1400 谱线强度 1200 1000 800 600
400
yZn = 2.9429x + 318.93
200 0 0 100 200 300 C/ppm 400 500 600
元素名 样品名 std波长 324.753998 相关系数 0.999879 谱线强度 背景强度 输入浓度值 计算浓度值 是否计算 300 0 0 -3.565000057 TRUE 700 0 100 101.5009995 TRUE 1090 0 200 203.9400024 TRUE 2210 0 500 498.1239929 TRUE
相关系数 计算浓度值 -6.90500021 104.7300034 205.201004 496.973999
0.999621 是否计算 TRUE TRUE TRUE TRUE
12000
Mn的标准曲线
yMn = 19.707x + 436.07
10000 8000 谱线强度 6000 4000
2000
0.999398 是否计算 TRUE TRUE TRUE TRUE
Fe的标准曲线
1800
1600 yFe = 2.4571x + 301.07
对总铁标准曲线绘制和测定准确度影响因素的探讨
关键词 : 抗坏血酸溶液 ; 总铁测定; 有效期 ; 保存条件; 过硫酸钾 ; 振摇
中图分 类号 : 3 5 TE 4 文献 标 识码 : A 文 章编号 :o6 7 8 (O 1 1一 o3— 0 10— 9 12 1) 4 09 4
1 2 试 剂 .
1 2 1 刚果 红试 纸 :mm .. l 1 2 2 硫 酸 : 8 l1 .. 1mo/
二钠和 甲酸虽然能防止其被微量的铜氧化但在常温 下也只能保存一个月 , 邻啡 罗啉在室 温下保存时间
收稿 日期 :0 1 5 O 2 1 —0 —1
12 3 硫 酸 : 1 3 : 取 1 . . ( + )移 O毫 升 的 浓 硫 酸 (8 o/ 和 3 毫升的蒸馏水混合。 1t l ) 0 o 1
H8 ) ] , 络 合 物 在 p - 3 . N。 )此 H- —4 5时最 稳 定 , - 在
,
该 方 法 准确 度好 , 密度 高 。但是 在 绘制 标准 曲 精
线有时曲线的截距和相关系数是受很多种因素的影 响, 致使标准 曲线的截距很大 , 相关系数不好, 测定
准确度降低 。从总铁 曲线制作和测定过程中使用的
升的蒸馏水混合均匀 。 12 6 乙酸一乙酸钠缓冲溶液 (H一4 5 : . . p . )称取 3 2
克 乙酸 钠 ( Ac 3 O) 解 在 适 量 的 蒸 馏 水 中再 Na . H。 溶 加入 6mo/ 的 乙酸 ( ll HAC) 溶液 6 升 , 8毫 稀释 定 容
工作曲线法测定Fe含量
分光光度法(四)实验内容:工作曲线法测定试液中的铁含量复习工作曲线的概念:根据朗伯-比耳定律,溶液的吸光度值与溶液的浓度和液层的厚度呈正比:A=εbC ,当液层的厚度一定时,b 是常数,溶液的吸光度值只与溶液的浓度呈正比:令K /=εb ,A=K /C ,这时,溶液的A 与C 的函数关系是正比例函数,在直角坐标系上,A~C 的关系曲线应该是一条通过原点的直线,这就是工作曲线。
工作曲线是描述溶液的吸光度值与溶液浓度关系的曲线。
操作步骤1、工作曲线的绘制(1)配制一系列浓度不同的铁标准溶液,浓度由低到高,显色。
容量瓶只mL505⎯→⎯,按照下表加入mL mg Fe /10.03+⎯→⎯,摇匀,各加入盐酸羟胺mL 00.1%10⎯→⎯mL 00.2%15.0,各加入邻二氮菲⎯→⎯,摇匀,各加入mL L mol NaAc 00.5/1⎯→⎯定容 标准溶液 未知溶液 1 2 3 4 5V/mL 0.20 0.40 0.60 0.80 1.0 10.0 Fe/mg 0.02 0.04 0.06 0.08 0.10 0.05 A(2)在510nm 波长下,用1cm 的比色皿,以蒸馏水为参比溶液,测定A 。
(3)绘制标准曲线(A~C 曲线)绘图时,尽量使各点均匀地分布在直线的两边。
曲线应该是一条过原点的直线。
直线的斜率就是K /=εb 。
本实验中,工作曲线的横坐标是每份溶液中含有铁的质量,单位是mg 。
纵坐标是A 。
2、铁含量的测定(1)配制溶液试液mL 00.10⎯→⎯容量瓶mL50⎯→⎯,摇匀,加入盐酸羟胺mL 00.1%10⎯→⎯mL00.2%15.0,加入邻二氮菲⎯→⎯,摇匀,加入mL L mol NaAc 00.5/1⎯→⎯定容 (2)在510nm 波长下,用1cm 的比色皿,以蒸馏水为参比溶液,测定试液A 。
(3)在标准曲线上查出10mL 试液中铁的质量,计算出试液中铁的含量(mg/mL )。
计算方法,查工作曲线得到,在10.00mL 的试液中含有X mg 铁,所以试液中铁含量为:Fe 含量 == mLXmg 0.10cA。
实验四 邻菲罗啉分光光度法测定铁的含量
实验四邻菲罗啉分光光度法测定铁的含量实验四邻菲罗啉分光光度法测定水样中的铁一、实验目的:1、掌握邻菲罗啉分光光度法测定微量铁的原理和方法;2、学会标准曲线的绘制方法及其使用。
二、原理:亚铁离子(Fe)在pH=3~9时与邻菲罗啉生成稳定的橙红色络合物,应用此反应可用比色法测定铁。
橙红色络合物的吸光度与浓度的关系符合朗伯-比耳定律。
若用还原剂(如盐酸羟胺)把高铁离子还原为亚铁离子,则此法还可测定水中的高价铁和总铁的含量。
三、仪器:721型分光光度计、1cm比色皿、具赛比色管(50ml)、移液管、吸量管、容量瓶等。
四、试剂:1、铁贮备液(100μg/mL):准确称取0.7020克分析纯硫酸亚铁铵[(NH4)2Fe(SO4)2・6H2O]于100毫升烧怀中(或0.8640g分析纯的NH4Fe(SO4)2・12H2O,其摩尔质量为2+482.18g/mol),加50毫升1+1 H2SO4,完全溶解后,移入1000ml的容量瓶中,并用水稀释到刻度,摇匀,此溶液中Fe的质量浓度为 100.0μg/mL。
(实验室准备好)2、铁标准使用液(20μg/mL):准确移取铁贮备液20.00ml于100ml容量瓶中,用水稀释至刻度,摇匀。
此溶液中Fe的质量浓度为20.0μg/mL。
(学生配制)3、0.5%邻菲罗啉水溶液:配制时加数滴盐酸能助溶液或先用少许酒精溶解,再用水稀释至所需体积。
(临用时配制) 4、10%盐酸羟胺水溶液:5、醋酸-醋酸钠缓冲溶液(pH=4.6):称取40克纯醋酸铵加到50毫升冰醋酸中,加水溶解后稀释至100毫升。
五、测定步骤: 1、标准曲线的绘制:(1)分别吸取铁的标准溶液0.00、1.00、2.00、4.00、6.00、8.00、10.00ml于7支50ml比色管中,加水至刻度;(2)依次分别加入10%盐酸羟胺溶液1ml,混匀,加入5ml醋酸-醋酸铵缓冲溶液,摇匀,加入0.5%邻菲罗啉溶液2ml,摇匀,(3)放置15分钟后,在510nm波长处,用1cm比色皿,以空白作为参比,测定各溶液的吸光度。
无定形铁、铝、硅的测定方法
无定形铁、铝、锰、硅的测定1 原理无定形(非晶质)氧化物是指不产生X射线的胶体氧化物。
由于酸性H2C2O4-(NH4)2C2O4溶液具有pH缓冲性能极强的特点,对于酸性和中性土壤浸出液的酸度可稳定在左右,即使碱土(土壤pH达10),经测定证实,pH仍能稳定在~。
草酸-草酸铵缓冲也中草酸根可将土壤中非晶质氧化铁中的铁、非晶质氧化铝中的铝以及非晶质氧化硅中的硅络合成水溶性的络合物进入提取液。
因此一般用于浸提活性较大的Fe、Al、Mn、Si等氧化物。
2 试验样品待测液的制备用H2C2O4-(NH4)2C2O4溶液,一次性振荡提取土壤,使Fe、Al、Mn 和Si等无定形水合氧化物提取到溶液中,然后用同一特测液分别测定。
2.1.1 主要仪器振荡机、三角瓶(250ml)、胶塞、布袋、离心机(最大转速5000r/min,附100ml离心管)、烧杯(200ml)2.1.2 试剂(1) 酸性H2C2O4-(NH4)2C2O4提取剂:称取25.20g草酸(H2C2O4,分析纯)和49.68g草酸铵((NH4)2C2O4,分析纯),加水后加热溶解,用水定容到2升(pH应为,必要时可在pH计上用稀H2C2O4和NH4OH调节)。
(2) H2SO4:硫酸(H2SO4,分析纯);(3) H2O2:过氧化氢(H2O2,分析纯);2.1.3 操作步骤(1) 样品待测液的提取称取通过0.25mm的风干土样2.00g,置于250 ml三角瓶中,在20-25℃时,按1:50土液比加入l00 ml H2C2O4-(NH4)2C2O4提取液,加塞,将三角瓶放入布袋中,在振荡机上遮光振荡2小时,然后将混合液转入100ml离心管中,于3000-4000r/min的离心机中离心,离心后的上清液可直接转入塑料瓶或三角瓶中,加塞备用,若上清液中仍有浑浊,则可用干的定性滤纸过滤,滤液作为活性Fe和Si的待测液。
在加入H2C2O4-(NH4)2C2O4提取液前即将布袋套上,直到离心时将布袋取下。
