高中化学方程式钠,铝,铁全部
高中化学方程式大全

高中化学方程式大全标题:高中化学方程式大全一、钠及其化合物的性质及化学方程式1、钠在空气中燃烧(黄色的火焰)2、钠与水反应(浮在水面四处游动)3、钠与硫酸铜溶液反应(蓝色沉淀)4、钠与氯气反应(白烟)5、钠与硫反应(浅黄色固体)二、镁及其化合物的性质及化学方程式1、镁在空气中燃烧(白光)2、镁与二氧化碳反应(白色固体)3、镁与稀硫酸反应(大量气泡)4、镁与氯化铵溶液反应(刺激性气味)5、镁与氧气反应(白色固体)三、铝及其化合物的性质及化学方程式1、铝在空气中燃烧(明亮的白光)2、铝与三氧化二铁反应(熔化,不滴落)3、铝与稀盐酸反应(剧烈的冒出气泡)4、铝与氢氧化钠溶液反应(生成偏铝酸钠和氢气)5、铝与冷水不反应,但遇热水生成氢氧化铝沉淀。
四、铁及其化合物的性质及化学方程式1、铁在氧气中燃烧(火星四射,生成四氧化三铁)2、铁与盐酸稀硫酸或稀盐酸硝酸反应(生成亚铁盐和氢气)3、铁与硫酸铜溶液反应(红色物质表面覆盖一层银白色物质,混合物颜色由蓝色逐渐变为浅绿色)4、铁在氯气中燃烧(棕黄色烟)铁的氧化物。
5、与盐酸一氧化碳反应(工业上用此反应炼铁)6、与盐酸稀盐酸硫酸反应(生成硫酸亚铁和氢气)7、与氢氧化钠溶液反应(生成氢氧化亚铁和氢气)8、与水蒸气反应(水煤气制取氢气)生成四氧化三铁和氢气。
高中化学方程式大全化学方程式是化学学科中的重要组成部分,是描述化学反应过程和结果的重要工具。
对于高中生来说,掌握化学方程式的书写和理解是非常重要的。
下面,我们将列举一些常见的高中化学方程式,帮助大家更好地理解和记忆。
1、酸与碱的反应酸与碱的反应是化学反应中的基本类型之一。
例如,盐酸(HCl)与氢氧化钠(NaOH)反应生成氯化钠(NaCl)和水(H2O):HCl + NaOH → NaCl + H2O类似的反应还有硫酸与氢氧化钡的反应:H2SO4 + Ba(OH)2 → BaSO4 + 2H2O2、氧化还原反应氧化还原反应是化学反应中常见的类型之一。
高一上四大基本金属元素钠镁铝铁单质及其化合物化学和对应离子方程式总结
NO3- + 2+
Fe3+ + 3H2O
Fe(OH)3(胶体) + 3H+
Cl2 少量: 6FeBr2 + 3Cl2 == 2FeCl3 +4FeBr3 Cl2 过量:2FeBr2+ 3Cl2 == 2FeCl3 + 2Br2
2Fe2+ + Cl2 == 2Fe3+ + 2Cl2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl-
Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3+2NaOH=2NaAlO2+H2O Al2O3 + 2OH- == 2AlO2- + H2O AlCl3 + 4NaOH = NaAlO2+ 3NaCl +2H2O Al3+ + 4OH- == AlO2- + 2H2O NaAlO2 + 4HCl == AlCl3 + NaCl+2H2O AlO2- + 4H+ == Al3+ + 2H2O NaAlO2 + HCl + H2O == Al(OH)3↓+ NaCl AlO2- + H+ + H2O == Al(OH)3↓ 2NaAlO2 + CO2 + 3H2O ==2 Al(OH)3↓+ Na2CO3 2AlO2-+ CO2 + 3H2O ==2 Al(OH)3↓+ CO32NaAlO2 + CO2 + 2H2O == Al(OH)3↓+ NaHCO3 AlO2- + CO2 + 2H2O == Al(OH)3↓+HCO3AlCl3+3NaAlO2+ 6H2O=4Al(OH)3↓+3NaCl Al3+ + 3AlO2- + 6H2O== 4Al(OH)3↓
高中化学方程式总结(共325个)

高中化学方程式化学 第一册第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃3、32FeCl 2Cl 3Fe 2−−→−+点燃4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()(9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 412、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢14、↑+→+HCl NaHS O S O H NaCl 442(浓) 15、↑+−→−+∆HCl S O Na NaCl NaHS O 42416、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324S O H 15PO H 6P Cu 5O H 24CuS O 15P 11++→++ 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓)26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀)27、O H 31S O K S O Fe 9S O Cr S O H 31O Fe 6O Cr K 2423423424243722+++→++)()( 28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃 43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆ 48、S H H S 22−→−+∆49、2CS C S −−→−+高温50、22S O O S −−→−+点燃51、O H 3S O K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物52、↓+−→−∆S H S H 2253、2222S O 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足)55、↓+−−→−+S 3O H 2S O S H 2222点燃56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224S O H CuS S H CuS O +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合)63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeS O FeS S O H 2442(稀) 65、3222S O H O H S O ⇔+66、3O V 22SO 2O SO 252∆−−→←+ 67、4223S O H O H S O →+68、↑++→+22424232S O O H S O Na S O H S O Na69、O H S O Na NaOH 2S O 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2S O 2322+↓→+)( 72、23232HS O Ca O H CaS O S O )(→++73、O H 2S 3S H 2S O 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222S O 8O Fe 2O 11FeS 4高温78、3O V 22SO 2O SO 252∆−−→←+ 79、4232S O H S O O H →+第四节 硫酸 硫酸盐80、O H 2S O 2CO S O H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2S O 3S O H 2S 2242+↑−→−+∆(浓) 82、O H 2S O PO H S O H P 224342+↑+−→−+∆(浓) 83、O H 2S O S S O H S H 22422++−→−+∆(浓) 84、O H 2S O CuS O S O H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaS O S O H BaCl 4422+↓→+86、NaCl 2BaS O S O Na BaCl 4422+↓→+87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na S O H CO Na91、42232S O H 2O S O H 2→+92、42232S O Na 2O S O Na 2→+93、423CaSO 2O CaSO 2→+94、O H 6SO 3S O Fe S O H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H S O Na S O Br S O H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓) 97、O H 11C 12O H C 2SO H 11221142+−−−→−浓第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃2102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuS O O H 2Na 2)( 第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)( 120、O H S O NaCl HCl NaHS O 223+↑+→+第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃22123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素) 124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
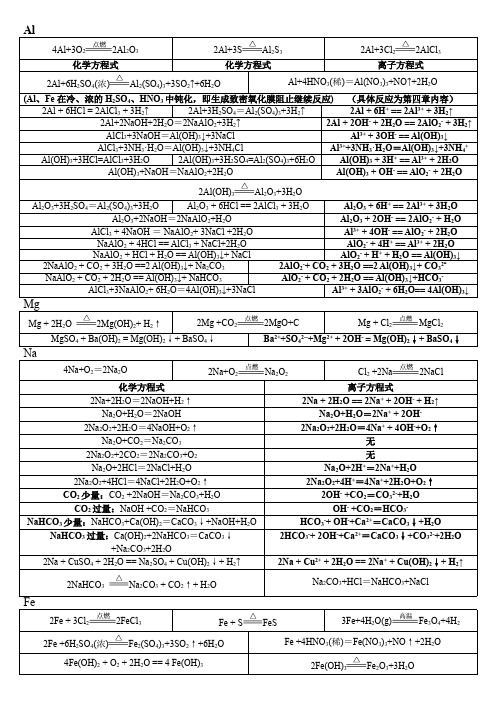
钠镁铝铁及其化合物方程式和离子方程式锦集

Na、Mg、Al、Fe及其化合物的化学方程式和离子方程式一、Na及其化合物的化学方程式和离子方程式(1)Na的反应1、钠和水反应:方程式: 2Na+2H2O=2NaOH+H2↑ 离子方程式: 2Na+2H2O=2Na+2OH-+H2↑2.钠分别和氧气、硫、氯气:2Na+O2点燃Na2O2 (或加热) 4Na+O2=2Na2O2Na+S=Na2S 2Na+Cl2点燃2NaCl3.钠分别和盐酸(或硫酸)、醋酸方程式: 2Na+2HCl=2NaCl+H2↑ 离子方程式: 2Na+2H+=2Na++H2↑方程式: 2Na+H2SO4=Na2SO4+H2↑ 离子方程式: 2Na+2H+=2Na++H2↑方程式:2Na+2CH3COOH=2CH3COONa+H2↑离子方程式: 2Na+2CH3COOH=2CH3COO-+2Na++H2↑4.钠分别和硫酸铜溶液、氯化铁溶液方程式:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑离子方程式: 2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑方程式: 6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑离子方程式:6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na++3H2↑(2)Na的氧化物反应1.氧化钠分别与水、盐酸方程式: Na2O+H2O=2NaOH 离子方程式: Na2O+H2O=2Na++2OH-方程式: Na2O+2HCl=2NaCl+H2O 离子方程式: Na 2O+2H+=2Na++H2O2.过氧化钠分别与盐酸、水方程式: 2Na2O2+4HCl=4NaCl+2H2O+O2↑离子方程式: 2Na2O2+4H+ =4Na++2H2O+O2↑方程式: 2Na2O2+2H2O=4NaOH+O2↑离子方程式: 2Na2O2+2H2O=4Na++4OH-+O2↑3.过氧化钠分别与二氧化碳:2Na2O2+2CO2=2Na2CO3+O2(3)Na2CO3、NaHCO3盐的反应1.分别加热碳酸钠和碳酸氢钠固体(鉴别固体Na2CO3、NaHCO3的方法)碳酸钠受热不分解2NaHCO3△Na2CO3+H2O+CO2↑2.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的盐酸反应少量的盐酸时:Na2CO3+HCl=NaHCO3 +NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+CO2↑+H2O HCO3-+H+=CO2↑+H2O过量的盐酸时:Na2CO3+2HCl=2NaCl+CO2↑+H2O CO32-+2H+=CO2↑+H2ONaHCO3+HCl=NaCl+CO2↑+H2O HCO3-+H+=CO2↑+H2O3.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的醋酸反应少量的醋酸时:Na2CO3+CH3COOH=NaHCO3+CH3COONaCO32-+ CH3COOH=HCO3-+ CH3COO-NaHCO3+CH3COOH=CH3COONa+CO2↑+H2OHCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-过量的醋酸时:Na2CO3+2CH3COOH=2CH3COONa+ CO2↑+H2OCO32-+ 2CH3COOH=2CH3COO-+CO2↑+H2ONaHCO3+CH3COOH=CH3COONa+CO2↑+H2OHCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-4.二氧化碳通入到碳酸钠溶液中(或通入到饱和的碳酸钠溶液中)CO2+Na2CO3+H2O=2 NaHCO3CO2+CO32-+H2O=2 HCO3-或CO2+Na2CO3+H2O=2 NaHCO3↓ CO2+2Na++CO32-+H2O=2 NaHCO3↓5.碳酸钠溶液与澄清石灰水(或氢氧化钠溶液)混合方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH离子方程式: CO32-+ Ca2+=CaCO3↓碳酸钠溶液与氢氧化钠溶液混合不发生反应6. 碳酸氢钠与少量(或过量)的澄清石灰水混合(类似:澄清石灰水可以改为氢氧化钡溶液)少量澄清石灰水:2NaHCO3+Ca(OH)2=2H2O+CaCO3↓+ Na2CO32 HCO3-+Ca2++2OH-=2H2O+CaCO3↓+ CO32-过量澄清石灰水:NaHCO3+Ca(OH)2=H2O+CaCO3↓+ NaOHHCO3-+Ca2++OH-=H2O+CaCO3↓7.碳酸氢钠与氢氧化钠溶液混合方程式: NaHCO3+ NaOH=Na2CO3+ H2O 离子方程式: HCO3-+OH-=H2O+CO32-8.电解熔融状态的氯化钠、电解饱和食盐水(注意电极反应式的书写)2NaCl(熔融)=Na+Cl2↑2NaCl+2H2O电解Cl2↑+H2↑+2NaOH2Cl-+2H2O电解Cl2↑+H2↑+2OH-9.碳酸钠溶液、碳酸氢钠溶液滴2滴酚酞试液都呈色,为什么?(用方程式或离子方程式表示) 溶液呈红色CO32-+H2O HCO3-+OH-溶液呈碱性HCO3-+H2O H2CO3 + OH-溶液呈碱性二、Mg 、Al 及其化合物的化学方程式和离子方程式 (1)Mg 的反应1.镁在空气中燃烧2Mg + O 2 2MgO 3Mg +N 2 Mg 3N 2 2Mg + CO 2 2MgO + C 2.镁能溶解在氯化铵溶液中Mg + 2NH 4Cl = MgCl 2 + H 2↑+ NH 3↑ Mg + 2NH 4+ = Mg 2+ + H 2↑+ NH 3↑ (2) Al 的反应3.铝是活泼金属,为什么可以直接存放在空气中,用简单的文字和方程式说明:4Al+3O 2=2Al 2O 3 在铝的表面形成致密的氧化铝薄膜,将铝和空气隔绝。
知识归纳高中化学钠铝铁及化合物思维导图与化学方程式总结

知识归纳:高中化学钠铝铁及化合物思维导图与化学方程式总结今天给大家分享钠、铝、铁的化合物相关知识~一、钠的化合物1. Na2O(1)Na2O与水的反应Na2O+H2O==2NaOH(2)Na2O与CO2的反应Na2O+CO2==Na2CO3(3)Na2O + SO2= Na2SO3(4)与酸发生反应Na2O+2HCl==2NaCl+H2O2. Na2O2中氧元素为-1价,Na2O2既有氧化性又有还原性。
(1)过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,可用于漂白)2Na2O2+2H2O==4NaOH+O2↑NaOH溶液反应HCO3-+OH-==H2O+CO32-与Ca(OH)2溶液反应Ca(OH)2+Na2CO3==CaCO3↓+2NaOH也能反应生成CaCO3沉淀Ca2++CO32-==CaCO3↓与CaCl2溶液反应不反应有CaCO3沉淀用途发酵粉、灭火剂、治疗胃酸过多(有胃溃疡时不能用)发酵粉、灭火剂、治疗胃酸过多(有胃溃疡时不能用)相互转化Na2CO3+CO2+H2O==2NaHCO32NaHCO3==Na2CO3+H2O+CO2↑NaHCO3+NaOH==Na2CO3+H2ONaHCO3+NaOH==Na2CO3+H2O附:钠及其化合物思维导图二、铝的化合物1.Al2O3的性质Al2O3俗名矾土,氧化铝是一种白色难溶物,其熔点很高,可用来制造耐火材料如坩锅、耐火管、耐高温的实验仪器等。
Al2O3是两性氧化物,既能与强酸反应,又能与强碱反应Al2O3+ 6HCl====2AlCl3+3H2O(Al2O3+6H+====2Al3++3H2O)Al2O3+ 2NaOH====2NaAlO2+H2O(Al2O3+2OH-====2AlO2-+H2O)2. 氢氧化铝 Al(OH)3氢氧化铝是典型的两性氢氧化物,它既能溶于强酸生成铝盐溶液,又能溶于强碱生成偏铝酸盐溶液。
氢氧化铝可用来制备铝盐,作吸附剂等的原料。
钠及铝化学方程式

1、钠在空气中燃烧(黄色的火焰) 2Na + O2点燃Na2O2(淡黄色)钠块在空气中变暗 4Na+O2=2Na2O钠与水反应(浮、熔、游、响、红)2Na + 2H2O=2NaOH + H2↑2、氧化钠在空气中加热(变黄) 2Na2O+O2=2Na2O2氧化钠与水的反应 Na2O+H2O=2NaOH氧化钠与二氧化碳的反应Na2O + CO2=Na2CO33、过氧化钠与水的反应(放热反应、过氧化钠是强氧化剂,用于漂白)2Na2O2+ 2H2O=4NaOH + O2↑过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2+ 2CO2=2Na2CO3+ O25、苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3+2HCl=2NaCl+ H2O+CO2↑ CO32-+ 2H+=H2O + CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+ HCl=NaHCO3+ NaCl CO32-+ H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+=H2O +CO2↑纯碱与二氧化碳反应 Na2CO3 + CO2 + H2O=2NaHCO36、小苏打受热分解 2NaHCO3△Na2CO3+ H2O +CO2 ↑小苏打离子既能与酸也能与碱反应NaHCO3 + HCl=NaCl +H2O + CO2↑(HCO3-+ H+=H2O + CO2↑)NaHCO3 + NaOH=Na2CO3 + H2O (HCO3-+ OH - =H2O + CO32-) 7、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+ NaOH △2CO3+ H2ONaOH露置在空气中变质 2NaOH + CO2=Na2CO3 + H2O1、铝箔在氧气中剧烈燃烧 4Al + 3O 2点燃2Al 2O 3铝片与稀盐酸反应 2Al + 6HCl =2AlCl 3 + 3H 2↑ 铝与氢氧化钠溶液反应 2Al +2NaOH +2H 2O =2NaAlO 2 +3H 2↑ 铝与三氧化二铁高温下反应(铝热反应) 2Al + Fe 2O 3高温2Fe + Al 2O 32、氧化铝与氢氧化钠反应 Al 2O 3 + 2NaOH =2NaAlO 2 +H 2O 氧化铝与盐酸反应 Al 2O 3 + 6HCl =2AlCl 3 +3H 2O3、氢氧化铝溶液中加盐酸 Al(OH)3 + 3HCl =AlCl 3 + 3H 2O 氢氧化铝溶液与加入氢氧化钠溶液 Al(OH)3 + NaOH =NaAlO2 + 2H 2O4、氯化铝溶液中滴过量氨水 AlCl3 + 3NH3·H2O =Al(OH)3↓+ 3NH4Cl氯化铝溶液中滴少量氢氧化钠溶液 AlCl 3 + 3NaOH =Al(OH)3↓+ 3NaCl 氯化铝溶液中滴过量氢氧化钠溶液 AlCl 3 + 4NaOH =NaAlO 2 + 3NaCl +2H 2O 5、偏铝酸钠溶液中通入少量二氧化碳 2NaAlO 2+CO 2 +3H 2O =Na 2CO 3+2Al(OH)3↓ 偏铝酸钠溶液中通入过量二氧化碳 2NaAlO 2+2CO 2 +4H 2O =2NaHCO 3+2Al(OH)3↓ 偏铝酸钠溶液中通入少量盐酸 NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 偏铝酸钠溶液中通入过量盐酸 NaAlO 2+4HCl =AlCl 3+NaCl + 2H 2O。
高一期末化学方程式默写(钠、铝、铁、硅)
重要化学方程式默写1、钠与水反应的离子方程式:;2、过氧化钠与CO2反应化学方程式;此反应的用途: ;3、过量CO2通入NaOH溶液(化学方程式):;4、向Na2CO3溶液中滴加少量稀盐酸(化学):;5、除去NaHCO3溶液中混有的Na2CO3(化学):;6、除去Na2CO3溶液中混有的NaHCO3(离子):;7、除去Na2CO3固体中混有的NaHCO3(化学):;8、检验Na2CO3溶液和NaHCO3溶液不能用(填“CaCl2”或“Ca(OH)2”)NaHCO3与足量澄清石灰水的反应(化学):;足量NaHCO3与澄清石灰水的反应(离子):;9、Al、 Al2O3溶于NaOH溶液(化学):;;10、除去氢氧化铝中的氢氧化镁:选用试剂,再过滤,取;向其中加入足量后再过滤、、干燥;涉及离子方程式为:;;11、用硫酸铝制备氢氧化铝(化学):;12、偏铝酸钠中加入少量稀盐酸(离子):;13、氯化铝中加入足量NaOH溶液(离子):;14、氧化铝制备铝(化学)::;灼烧氢氧化铝::;15、铁和水蒸气高温反应:;16、过量铁在氯气中点燃:;铁与硫加热反应:;17、含FeCl3和CuCl2的溶液中加入足量铁粉:先发生的反应是(离子):;后发生的反应是(化学):;18、除去FeCl3溶液中混有的FeCl2:可以选择氯水(化学):;为了不带入新的杂质,还可以选择双氧水(离子)::;19、检验三价铁离子,最好选用溶液,其离子反应为:;还可以选用淀粉KI,现象为:溶液;发生的离子反应为:;若无Fe3+,检验是否含Fe2+,应先加入溶液,观察到;再通入;20、氢氧化亚铁转化成氢氧化铁的化学方程式:;若参与反应的氧气为1mol,则转移的电子数为:。
21、单质硅能用作;其可与氢氧化钠发生反应(化):;22、SiO2是氧化物,也是玻璃的主要成分,所以是碱性试剂储存是不能使用,原因:;(写离子方程式)23、刻蚀玻璃应该用,反应的化学方程式为:;24、含SiO2的矿石叫做,例如:水晶、玛瑙、石英沙子的主要成分也是SiO2,可以用于制造玻璃,需要的原料还有石灰石和;涉及的主要反应方程式为:;。
高中化学方程式大全(最最完整版)
.第一章卤素第一节氯气1、2Na Cl点燃2NaCl 22、Cu Cl 2点燃CuCl 23、2Fe3Cl 2点燃2FeCl34、H2Cl 2点燃(光照)2HCl5、2P3Cl点燃2PCl326、PCl3Cl 2PCl 57、Cl2H 2 O HCl HClO8、2Ca(OH)22Cl 2Ca( ClO )2CaCl 22H 2O9、Ca(ClO)2CO2 H 2O CaCO 32HClO10、2NaOH Cl 2NaClO NaCl H 2 O11、4HCl MnO 2MnCl 2 2H 2 O Cl 212、2KMnO416HCl (浓)2MnCl 22KCl5Cl 28H 2 O13、2HClO见光2HCl O 2第二节氯化氢14、NaCl H 2SO(4浓)NaHSO 4HCl15、NaHSO4NaCl Na 2SO4HCl16、2NaCl H 2SO(4浓)Na 2 SO42HCl( 14、15 联合)17、HCl AgNO 3AgCl HNO 318、NaCl AgNO 3AgCl NaNO 319、KCl AgNO 3AgCl KNO 320、2HCl CaCO 3CaCl 2H 2 O CO 2第三节氧化复原反响.21、CuO H 2Cu H 2O22、C4HNO 3CO 24NO 22H 2O23、4Zn(极稀)4Zn()NH 4NO 3 3H2O 10HNO3NO3 224、11P15CuSO424H2O5Cu 3 P6H 3PO415H 2SO 425、KClO36HCl (浓)3Cl 2KCl3H 2O26、4Mg10HNO (极稀)4Mg()NH 4NO 3 3H 2O 3NO3 227、K2Cr2O76Fe3O 431H 2SO 4Cr(2 SO 4)39Fe(2 SO4)3 K 2 SO4 31H 2O28、2KNO33C S K 2S N 23CO 2第四节卤族元素29、H2F22HF30、H2Br22HBr31、H2I 22HI32、2NaBr Cl 22NaCl Br 233、2KI Cl34、2KI Br 222KCl I2KBr I2235、NaBr AgNO 3 AgBrNaNO 336、KI AgNO 3AgI KNO 337、2AgBr光照2Ag Br 2第二章摩尔反响热第一节摩尔38、C O 2CO 239、Mg2HCl MgCl 2H 2第二节气体摩尔体积40、Zn2HCl ZnCl 2H 2.第三节物质的量浓度41、2NaOH H 2SO4Na 2SO 42H 2O第四节反响热42、C(固)O(气)2点燃CO(气)2393.5kJ43、2H(气)2O(气)22H 2 O(气) 483.6kJ44、2H(气)2O(气)22H 2 O(液) 571.6kJ45、C(固)H2O(气)CO(气)H (2气)131.3kJ第三章硫硫酸第一节硫46、2Cu S Cu 2S47、Fe S FeS48、S H 2H 2S49、S C 高温CS250、S O 2点燃SO251、3S6KOH2K 2S K 2SO43H 2O 第二节硫的氢化物和氧化物52、H2S H 2S53、2H2S3O 2 (足)点燃2H 2O2SO 254、2H2S O 2( 不足)点燃2H 2O2S55、2H2S SO 2点燃2H 2O 3S56、H2S Br 2S2HBr57、FeS 2HCl FeCl 2H 2 S58、CuSO4H2S CuS H 2SO459、PbAc2H 2S PbS2HAc60、H S NaOH NaHS H O61、 NaHS NaOH Na 2 S H 2 O62、 H 2S2NaOH Na 2S 2H 2 O ( 60、61 联合) 63、 H 2S 2FeCl 3S2FeCl 2 2HCl 64、 H 2SO (4稀) FeS FeSO 4H 2 S65、 SO 2 H 2OH 2SO 366、 2SO 2 O 2 V 2O 52SO 367、 SO 3H 2O H 2SO 468、 Na 2SO3H 2SO 4 Na 2SO 4 H 2O SO 269、 SO 2 2NaOH Na 2SO 3 H 2O70、 SO 2 CaOCaSO 371、 SO 2 2Ca ( OH )CaSO3H 2O272、 SO 2 CaSO 3 H 2O Ca ( HSO 3)2 73、 SO 2 2H 2S 3S2H 2O74、 SO 2 Cl 2 2H 2O 2HCl H 2SO 4 75、 SO 2 Br 22H 2O2HBrH 2SO 476、 5SO 2 2H 2O 2KMnO 4MnSO 4K 2SO 4 2H 2SO 4第三节硫酸的工业制法77、 4FeS 2 11O 2 高温2Fe 2O 3 8SO 278、 2SO 2O 2V 2O 52SO 379、 H 2O SO 3 H 2SO 4第四节 硫酸 硫酸盐80、 C 2H 2SO (4 浓) CO 2 2SO 2 2H 2O81、 S2H 2 SO (4浓)3SO 22H 2O(浓)H 3PO4SO 22H 2O82、P H2SO483、H2S H2SO(4浓)S SO22H 2O84、Cu 2H2SO(4浓)CuSO 4SO22H 2O85、BaCl2H 2SO4BaSO 42HCl86、BaCl2Na 2 SO4BaSO42NaCl87、BaCl2Na 2 CO3BaCO 32NaCl88、BaCO32HCl BaCl 2H2O CO289、BaCO32HNO 3Ba( NO 3)2H 2O CO 290、Na2CO3H 2SO3Na 2 S H 2 O CO 291、2H2SO3O 22H 2SO 492、2Na2SO3O 22Na 2 SO493、2CaSO3O 22CaSO494、2Fe6H(浓)()2SO4Fe2 SO4 3 3SO26H 2O95、2NaBr2H 2 SO(4浓)Br 2SO2Na 2SO4 H 2O96、2NaCl H 2SO(4浓)Na 2 SO 4 2HCl97、C11H22O浓H2SO412C11H 2O 11第四章碱金属第一节钠98、4Na O 22Na 2 O99、2Na O 2Na 2O 2 100、2Na Cl 2点燃2NaCl101、2Na S 研磨Na 2S102、2Na2H 2O 2NaOH H 2103、2Na2H 2O CuSO 4Cu( OH )2 Na 2 SO4H 2第二节钠的氧化物104、Na2O H 2 O2NaOH105、2Na2O22H 2O4NaOH O 2106、Na2O CO 2Na 2 CO 3107、2Na 2O 22CO 22Na 2CO 3O 2108、Na2O2HCl2NaCl H 2 O109、Na2O24HCl4NaCl2H 2O O 2110、Na2CO32HCl2NaCl CO 2H 2 O111、NaHCO3HCl NaCl CO 2H 2 O112、2NaHCO3Na 2 CO 3CO 2H 2 O113、NaHCO3NaOH Na 2 CO 3H 2 O114、2NaHCO3Ca( OH)(少许)CaCO3Na2CO32H O22115、NaHCO3Ca( OH )(足量)2CaCO 3NaOH H 2 O 116、Na2CO3BaCl 2BaCO 32NaCl117、Na2CO3CaCl 2CaCO 32NaCl118、Ca(HCO)2HCl CaCl22CO22H2O32119、Ca(HCO3)22NaOH CaCO 3Na 2CO 32H2O 120、NaHSO3HCl NaCl SO2H 2 O第三节碱金属元素121、4Li O 2点燃2Li 2 O122、K O 2点燃KO 2123、2M X 22MX (M表示氧族元素,X代表卤族元素)124、 2M H 2 2MH125、 2M2H 2O2MOH H 2第五章 物质构造 元素周期律本章内容、性质特别,全部化学反响方程式均融在其余章节中。
高中_高一_必修一_必修二_苏教版_化学方程式整理_化学方程式
化学反应方程式必修1第一部分:金属元素 钠、镁、铝、铁、铜1 钠、镁、铝、铁、铜的制备 2NaCl (熔融)2Na+Cl 2↑ MgCl 2(熔融)Mg+Cl 2↑ 2Al 2O 34Al+3O 2↑yCO+Fe x O y ===xFe+yCO 2 (H 2、C 、Al 也可还原铁、铜等较活泼金属的氧化物)2 钠、镁、铝、铁及其化合物钠:1) 4Na+O 2=2Na 2O (白色固体) 2Na+O 2Na 2O 2 (淡黄色固体)2) 2Na+2H 2O =2NaOH+H 2↑(浮熔游响红) 离子反应方程式:2Na+2H 2O =2Na ++OH -+H 2↑ Na 投入CuSO 4溶液:2Na+Cu 2++2H 2O =2Na ++Cu(OH)2↓+H 2↑ Na 投入FeCl 3溶液:6Na+2Fe 3++6H 2O =6Na ++2Fe(OH)3↓+3H 2↑ Na 投入NH 4Cl 溶液:2Na+2NH 4+=2Na ++2NH 3↑+ H 2↑3) 4Na+TiCl 4 Ti+4NaCl (熔融情况下Na 可冶炼贵重金属)4) Na 2O+H 2O =2NaOH 2Na 2O 2+2H 2O =4NaOH +O 2↑(Na 2O 2既是氧化剂,又是还原剂)Na 2O+CO 2=Na 2CO 3 2Na 2O 2+2CO 2=2Na 2CO 3+O 2↑(Na 2O 2是供氧剂,又可作漂白剂) 5) Na 2CO 3+2HCl =2NaCl+H 2O+CO 2↑ 离子反应方程式:CO 32-+2H +=H 2O+CO 2↑NaHCO 3+ HCl =NaCl+H 2O+CO 2↑ 离子反应方程式:HCO 3-+H +=H 2O+CO 2↑ 6) 2NaHCO 3Na 2CO 3+H 2O+CO 2↑(NaHCO 3固体转化为Na 2CO 3固体)7) NaHCO 3+NaOH =Na 2CO 3+H 2O (NaHCO 3溶液转化为Na 2CO 3溶液) 离子反应方程式:HCO 3-+OH -=CO 32-+H 2O类比:NaHCO 3与澄清石灰水反应(不可用来鉴别NaHCO 3溶液与Na 2CO 3溶液) ①NaHCO 3过量:2NaHCO 3+Ca(OH)2=CaCO 3↓+ Na 2CO 3+2H 2O 离子反应方程式:2HCO 3-+Ca 2++2OH -=CaCO 3↓+CO 32-+2H 2O ②澄清石灰水过量:NaHCO 3+Ca(OH)2=CaCO 3↓+ NaOH+H 2O 离子反应方程式: HCO 3-+Ca 2++OH -=CaCO 3↓+H 2O8) CO 2 +H 2O+Na 2CO 3=2NaHCO 3 (饱和NaHCO 3溶液可除CO 2中的HCl )离子反应方程式:CO 2 +H 2O+CO 32-=2HCO 3-饱和碳酸钠中通CO 2: CO 2 +H 2O+Na 2CO 3=2NaHCO 3↓ 离子方程式:CO 2 +H 2O+2Na ++CO 32-=2NaHCO 3↓点燃通电 700~800℃通电通电高温9) CO 2+2NaOH =Na 2CO 3+H 2O (少量CO 2) CO 2+NaOH =NaHCO 3(足量CO 2) 10) 侯氏制碱:NH 3+NaCl+H 2O+CO 2==NaHCO 3↓+NH 4Cl 2NaHCO 3Na 2CO 3+H 2O+CO 2↑离子反应方程式:NH 3+Na ++H 2O+CO 2==NaHCO 3↓+NH 4+镁:1) 3Mg+N 2Mg 3N 2 2Mg+O 22MgO (Mg 在空气中燃烧的主要反应)2) 2Mg+CO 22MgO+C (金属单质置换出非金属单质典型反应)3) Mg+2H 2O (热)Mg(OH)2+H 2↑铝:1) 2Al+Fe 2O 3 Al 2O 3+2Fe (利用铝热反应可把其他难熔金属从它们的氧化物中还原来)2) 2Al+6HCl= 2AlCl 3+3H 2↑离子反应方程式:2Al+6H += 2Al 3++3H 2↑ (遇冷浓硫酸、冷浓硝酸钝化)2Al+2NaOH+2H 2O= 2NaAlO 2+3H 2离子反应方程式:2Al+2OH -+2H 2O= 2AlO 2-+3H 2↑ 3) Al 2O 3+6HCl = 2AlCl 3+3H 2O 离子反应方程式:Al 2O 3+6H += 2Al 3++3H 2O Al 2O 3+2NaOH =2NaAlO 2+H 2O 离子反应方程式:Al 2O 3+2OH -=2AlO 2-+H 2O 4) Al(OH)3+3HCl =AlCl 3+3H 2O 离子反应方程式:Al(OH)3+3H +=Al 3++3H 2O Al(OH)3+NaOH =NaAlO 2+2H 2O 离子反应方程式:Al(OH)3+OH -=AlO 2-+2H 2O5) AlCl 3+3NaOH (少量)=Al(OH)3↓+3NaCl 离子方程式:Al 3++3OH -=Al(OH)3↓AlCl 3+4NaOH(过量)=NaAlO 2+3NaCl+2H 2O 离子方程式:Al 3++4OH -(过量)=AlO 2-+2H 2O 6) NaAlO 2+HCl (少量)+H 2O =Al(OH)3↓+ NaCl 离子方程式:AlO 2-+H ++H 2O =Al(OH)3↓NaAlO 2+4 HCl (过量) =AlCl 3+ NaCl+2H 2O 离子方程式: AlO 2-+4 H +=Al 3++2H 2O 7) 制备氢氧化铝最佳方案:从铝盐制备:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH 4+从偏铝酸盐:AlO 2-+CO 2+2H 2O=Al(OH)3↓+HCO 3-(足量CO 2)2AlO 2-+CO 2+3H 2O=2Al(OH)3↓+CO 32-(少量CO 2)8) 明矾净水原理 :KAl(SO 4)2•12H 2O===K ++Al 3++2SO 42-+12H 2OAl 3++3H 2O===Al(OH)3(胶体)+3H +提升:明矾溶液中加入Ba(OH)2溶液①恰好使SO 42-完全沉淀:Al 3++2SO 42-+ 2Ba 2++4OH -===AlO 2-+2BaSO 4↓+2H 2O ②恰好使Al 3+完全沉淀:2Al 3++3SO 42-+ 3Ba 2++6OH -===2Al(OH)3↓+3BaSO 4↓铁:1) Fe 2+的检验:Fe 2++2OH -=Fe(OH)2↓ 4Fe(OH)2+O 2+2H 2O =4Fe(OH)3↓(白色沉淀迅速变成灰绿色最后变成红褐色) 2FeCl 2+Cl 2=2FeCl 3 (先加KSCN 再加氯水,通过检验Fe 3+的存在证明Fe 2+)点燃点燃点燃高温 两性氧化物两性氢氧化物2) Fe 3+的检验: Fe 3++3SCN -=Fe(SCN)3 (血红色) Fe 3++3OH -=Fe(OH)3↓(红褐色) 3) Fe 2+→Fe 3+: 2Fe 2++X 2=2Fe 3++2X -(X=Cl 、Br) 4) Fe 3+→Fe 2+: 2Fe 3++Fe =3Fe2+2Fe 3++Cu =2Fe 2++Cu 2+(印刷电路板的反应)【强弱氧化剂氧化Fe 的总结】第二部分:非金属元素 氯、溴、碘、硅、硫 1氯、溴、碘:1) 氯碱工业:2NaCl+2H 2O 2NaOH+H 2↑+Cl 2↑(工业制氯气)离子反应方程式:2Cl -+2H 2O2OH -+H 2↑+Cl 2↑ (阳极产生氯气,阴极产生氢气和OH -)2) 实验室制氯气:MnO 2+4HCl(浓) MnCl 2+Cl 2↑+2H 2O离子反应方程式:MnO 2+4H ++Cl -Mn 2++Cl 2↑+2H 2O (用饱和NaCl 除HCl 气体,浓硫酸除H 2O ) 3)2Fe+3Cl 22FeCl 3 (棕褐色的烟)Cu+Cl 2CuCl 2 (棕黄色的烟)H 2+Cl 22HCl(苍白色火焰) 4)Cl 2+H 2OHCl+HClO 离子反应方程式:Cl 2+H 2OH ++Cl -+HClO5) Cl 2+2NaOH =NaCl+NaClO+H 2O (Cl 2尾气吸收)离子反应方程式:Cl 2+2OH -=Cl -+ClO -+H 2O 6)工业制漂白粉:2Cl 2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H 2O 主要成分CaCl 2和Ca(ClO)2有效成份Ca(ClO)27) 漂白粉漂白原理:Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO (水溶液中的反应)离子反应方程式:Ca 2++2ClO -+H 2O+CO 2=CaCO 3↓+2HClO Ca(ClO)2溶液中通过量CO 2:ClO -+H 2O+CO 2=HCO 3-+HClO 8) 漂白粉失效:Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO 2HClO2HCl+O 2↑9) Cl 2+2NaBr =2NaCl+Br 2 Cl 2+2NaI =2NaCl+I 2 湿润的淀粉碘化钾试纸可检验Cl 2Br 2+2KI =2KBr+I 2离子反应方程式:Cl 2+2Br -=2Cl -+Br 2 Cl 2+2I -=2Cl -+I 2 Br 2+2I-=2Br -+I 2 (氧化性Cl 2﹥Br 2﹥I 2 还原性I —﹥Br —﹥Cl —)点燃点燃通电通电光照点燃10) Br -的检验:Br — +Ag +=AgBr ↓(淡黄色沉淀) I -的检验: I —+Ag +=AgI ↓(黄色沉淀)2硅、硫:硅:1) 工业制粗硅:SiO 2+2CSi+2CO ↑ 提纯:Si+2Cl 2SiCl 4SiCl 4+2H 2Si+4HCl2) SiO 2+CaO CaSiO 33) 硅酸的制备:(SiO 2与水不反应,只能用可溶性硅酸盐与酸反应制得) SiO 2+2NaOH =Na 2SiO 3+H 2O (氢氧化钠试剂瓶不用玻璃塞) Na 2SiO 3+CO 2+H 2O =Na 2CO 3+H 2SiO 3↓4) SiO 2+4HF =SiF 4↑+2H 2O (用于雕刻玻璃,因此氢氟酸保存在塑料瓶中) 5) 普通玻璃的制备 SiO 2+CaCO 3 CaSiO 3+ CO 2↑ SiO 2+ Na 2CO 3Na 2SiO 3+CO 2↑6) Si+2NaOH+H 2ONa 2SiO 3+2H 2↑硫:1) 硫酸型酸雨的形成:液相:SO 2+H 2OH 2SO 3 2H 2SO 3+O 2=2H 2SO 4 气相:2SO 2+O 22SO 3 SO 3+H 2O =H 2SO 42) SO 2+2NaOH =Na 2SO 3+H 2O (少量SO 2) SO 2+NaOH =NaHSO 3(足量SO 2)2Na 2SO 3+O 2=2Na 2SO 4 (Na 2SO 3溶液变质)3) SO 2的还原性:SO 2+Cl 2+2H 2O =H 2SO 4+2HCl 离子反应方程式:SO 2+Cl 2+2H 2O =4H ++SO 42-+2Cl -SO 2+Br 2+2H 2O =H 2SO 4+2HBr SO 2+H 2O 2=H 2SO 4 (SO 2与酸性KMnO 4、Fe 3+反应同样体现还原性) 4) 工业制硫酸:4FeS 2+11O 22Fe 2O 3+ 8SO 2↑ SO 2+O 22SO 3 SO 3+H 2O =H 2SO 45) 实验室制取SO 2:Na 2SO 3+H 2SO 4(浓)=Na 2SO 4+H 2O+SO 2↑6) SO 2+2NaHCO 3=Na 2SO 3+ H 2O +2CO 2 (用饱和的NaHCO 3溶液除CO 2中SO 2) 7) Na 2SO 3+2HCl =2NaCl+H 2O+SO 2↑ NaHSO 3+HCl =NaCl+H 2O+SO 2↑ 8) Cu+2H 2SO 4(浓)CuSO 4+ SO 2↑+2H 2O (也可用于实验室制备SO 2) C+2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O9) Na 2SO 3+BaCl 2=BaSO 3↓+2NaCl 10) S+ FeFeS S+ 2CuCu 2S S+ Hg =HgS3氮族元素:① 工业制备硝酸:4NH 3+ 5O 24NO+6H 2O (氨的催化氧化)2NO+O 2=2NO 2 3NO 2+H 2O =2HNO 3+NO (NO 与NO 2的相互转化)② 氨气使湿润的红色石蕊试纸变蓝:NH 3+H 2ONH 3·H 2O NH 4++OH -催化剂 △高温高温高温高温高温高温催化剂催化剂点燃③ 氨气的制备:N 2 + 3 H 2 2NH 3 (工业合成氨,条件不可省)2NH 4Cl+Ca(OH)2CaCl 2+2NH 3↑+2H 2O (实验室制氨气干燥用碱石灰)NH 3·H 2ONH 3↑+H 2O (浓氨水受热或加CaO 快速制氨气)④ 硝酸强氧化性与酸性的体现:(Fe 、Al 遇冷的浓硝酸、或冷的浓硫酸钝化) Cu+4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O Cu+4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO ↑+4H 2O 3Cu+8H ++2 NO 3- =3Cu 2++2NO ↑+4H 2O ⑤ 硝酸强氧化性的体现:C+4HNO 3(浓) 4NO 2↑+CO 2↑+2H 2O⑥ 浓硝酸久置显黄色:4HNO 34NO 2↑+O 2↑+2H 2O第二部分:元素周期表A 、B 、C 为元素周期表第三周期的元素,A 是除稀有气体外,原子半径最大的元素;B 元素的最高价氧化物对应的水化物呈两性;C 元素形成的气态氢化物最稳定。
必修二全部化学方程式及其离子反应式
必修二全部化学方程式及其离子反应式1.镁与盐酸响应:Mg +2H+ = Mg2+ + H2↑2.铝与盐酸响应2Al + 6H+ = 2Al3+ +3H2↑3.锌与盐酸响应Zn + 2H+ = Zn2+ + H2↑4.铁与稀硫酸响应Fe + 2H+ = Fe2+ + H2↑5.氧化镁与稀硫酸响应MgO + 2H+ = Mg2+ + H2O6.氧化铁与稀盐酸响应Fe2O3 + 6H+ = 2Fe3+ + 3H2O7.氢氧化钠与稀硫酸响应OH-+ H+ = H2O8.氢氧化镁与稀盐酸响应Mg(OH)2 + 2H+ = Mg2+ + 2H2O9.硝酸银与稀盐酸响应Ag+ + Cl-= AgCl↓10.氯化钡与稀硫酸响应Ba2+ + SO42-= BaSO4↓11.氢氧化钡与稀硫酸响应Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O 12.氯化镁与氢氧化钠溶液响应Mg2+ +2OH-= Mg(OH)2↓13.二氧化碳与氢氧化钠溶液响应CO2 + 2OH-== CO32-+ H2O14.过量的二氧化碳与氢氧化钠溶液响应CO2 + OH-== HCO3-15.二氧化硫与氢氧化钠溶液响应SO2 + 2OH-== SO32-+ H2O16.过量的二氧化硫与氢氧化钠溶液响应SO2 + OH-== HSO3-17.二氧化碳与澄清的石灰水响应CO2 + Ca2+ +2OH-== CaCO3↓+ H2O18.氢氧化钙溶液与纯碱溶液响应Ca2+ + CO32-== CaCO3↓19.氢氧化钡溶液与碳酸钠溶液响应Ba2+ + CO32-== BaCO3↓20.硫酸铜溶液与氢氧化钾溶液响应Cu2+ + 2OH-== Cu(OH)2↓一.物质与氧气的响应:(一)单质与氧气的响应:1.镁在空气中燃烧:2Mg+O2点燃2MgO2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O43.铜在空气中受热:2Cu+O2加热2CuO4.铝在空气中燃烧:4Al+3O2点燃2Al2O35.氢气中空气中燃烧:2H2+O2点燃2H2O6.红磷在空气中燃烧:4P+5O2点燃2P2O57.硫粉在空气中燃烧:S+O2点燃SO28.碳在氧气中充分燃烧:C+O2点燃CO29.碳在氧气中不充分燃烧:2C+O2点燃2CO(二)化合物与氧气的响应:10.一氧化碳在氧气中燃烧:2CO+O2点燃2CO211.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O12.酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O二.几个分解响应:13.水在直流电的作用下分解:2H2O通电2H2↑+O2↑14.加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO+H2O+CO2↑15.加热氯酸钾(有少量的二氧化锰):2KClO3MnO22KCl+3O2↑16.加热高锰酸钾:2KMnO4加热K2MnO4+MnO2+O2↑17.碳酸不稳定而分解:H2CO3===H2O+CO2↑18.高温煅烧石灰石:CaCO3高温CaO+CO2↑三.几个氧化还原响应:19.氢气还原氧化铜:H2+CuO加热Cu+H2O20.木炭还原氧化铜:C+2CuO高温2Cu+CO2↑21.焦炭还原氧化铁:3C+2Fe2O3高温4Fe+3CO2↑22.焦炭还原四氧化三铁:2C+Fe3O4高温3Fe+2CO2↑23.一氧化碳还原氧化铜:CO+CuO加热Cu+CO224.一氧化碳还原氧化铁:3CO+Fe2O3高温2Fe+3CO225.一氧化碳还原四氧化三铁:4CO+Fe3O4高温3Fe+4CO2 四.单质、氧化物、酸、碱、盐的互相关系(一)金属单质+酸盐+氢气(置换响应)26.锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑27.铁和稀硫酸Fe+H2SO4=FeSO4+H2↑28.镁和稀硫酸Mg+H2SO4=MgSO4+H2↑29.铝和稀硫酸2Al+3H2SO4=Al2(SO4)3+3H2↑30.锌和稀盐酸Zn+2HCl===ZnCl2+H2↑31.铁和稀盐酸Fe+2HCl===FeCl2+H2↑32.镁和稀盐酸Mg+2HCl===MgCl2+H2↑33.铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑(二)金属单质+盐(溶液)另一种金属+另一种盐34.铁和硫酸铜溶液响应:Fe+CuSO4===FeSO4+Cu35.锌和硫酸铜溶液响应:Zn+CuSO4===ZnSO4+Cu36.铜和硝酸汞溶液响应:Cu+Hg(NO3)2===Cu(NO3)2+Hg(三)碱性氧化物+酸盐+水37.氧化铁和稀盐酸响应:Fe2O3+6HCl===2FeCl3+3H2O38.氧化铁和稀硫酸响应:Fe2O3+3H2SO4===Fe2(SO4)3+3H2O39.氧化铜和稀盐酸响应:CuO+2HCl====CuCl2+H2O40.氧化铜和稀硫酸响应:CuO+H2SO4====CuSO4+H2O41.氧化镁和稀硫酸响应:MgO+H2SO4====MgSO4+H2O42.氧化钙和稀盐酸响应:CaO+2HCl====CaCl2+H2O(四)酸性氧化物+碱盐+水43.苛性钠暴露在空气中变质:2NaOH+CO2====Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH+SO2====Na2SO3+H2O 45.苛性钠吸收三氧化硫气体:2NaOH+SO3====Na2SO4+H2O 46.消石灰放在空气中变质:Ca(OH)2+CO2====CaCO3↓+H2O 47.消石灰吸收二氧化硫:Ca(OH)2+SO2====CaSO3↓+H2O(五)酸+碱盐+水48.盐酸和烧碱起响应:HCl+NaOH====NaCl+H2O49.盐酸和氢氧化钾响应:HCl+KOH====KCl+H2O50.盐酸和氢氧化铜响应:2HCl+Cu(OH)2====CuCl2+2H2O51.盐酸和氢氧化钙响应:2HCl+Ca(OH)2====CaCl2+2H2O52.盐酸和氢氧化铁响应:3HCl+Fe(OH)3====FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3====AlCl3+3H2O54.硫酸和烧碱响应:H2SO4+2NaOH====Na2SO4+2H2O55.硫酸和氢氧化钾响应:H2SO4+2KOH====K2SO4+2H2O56.硫酸和氢氧化铜响应:H2SO4+Cu(OH)2====CuSO4+2H2O57.硫酸和氢氧化铁响应:3H2SO4+2Fe(OH)3====Fe2(SO4)3+6H2O58.硝酸和烧碱响应:HNO3+NaOH====NaNO3+H2O(六)酸+盐另一种酸+另一种盐59.大理石与稀盐酸响应:CaCO3+2HCl===CaCl2+H2O+CO2↑60.碳酸钠与稀盐酸响应:Na2CO3+2HCl===2NaCl+H2O+CO2↑61.碳酸镁与稀盐酸响应:MgCO3+2HCl===MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液响应:HCl+AgNO3===AgCl↓+HNO363.硫酸和碳酸钠响应:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑64.硫酸和氯化钡溶液响应:H2SO4+BaCl2====BaSO4↓+2HCl(七)碱+盐另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH+CuSO4====Cu(OH)2↓+Na2SO4 66.氢氧化钠与氯化铁:3NaOH+FeCl3====Fe(OH)3↓+3NaCl 67.氢氧化钠与氯化镁:2NaOH+MgCl2====Mg(OH)2↓+2NaCl68.氢氧化钠与氯化铜:2NaOH+CuCl2====Cu(OH)2↓+2NaCl69.氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3===CaCO3↓+2NaOH (八)盐+盐两种新盐70.氯化钠溶液和硝酸银溶液:NaCl+AgNO3====AgCl↓+NaNO3 71.硫酸钠和氯化钡:Na2SO4+BaCl2====BaSO4↓+2NaCl五.其它响应:72.二氧化碳溶解于水:CO2+H2O===H2CO373.生石灰溶于水:CaO+H2O===Ca(OH)274.氧化钠溶于水:Na2O+H2O====2NaOH75.三氧化硫溶于水:SO3+H2O====H2SO476.硫酸铜晶体受热分解:CuSO4?5H2O加热CuSO4+5H2O 77.无水硫酸铜作干燥剂:CuSO4+5H2O====CuSO4?5H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钠及其化合物的化学方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOH2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO45、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6、向氯化铝溶液中加过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO39、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO311、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO324、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaCl26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaCl27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO335、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO32、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOH2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaCl3、碳酸钠溶液呈碱性:Na 2CO3+H2O NaHCO3+NaOH4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaCl5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO38、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO39、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO 3+H2O H2CO3+NaOH2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O铝及其化合物的化学方程式一、铝1、铝在氧气中燃烧:4Al +3O 22Al 2O 32、铝在氯气中燃烧:2Al +3Cl 22AlCl 33、铝和硫共热:2Al +3S Al 2S 34、铝与稀硫酸反应:2Al +3H 2SO 4Al 2(SO 4)3 +3H 2 ↑5、铝和氢氧化钠溶液反应:2Al +2NaOH +2H 2O 2NaAlO 2+3H 2 ↑6、铝和浓硫酸共热:2Al +6H 2SO 4Al 2(SO 4)3 +3SO 2 ↑+6H 2O7、铝和浓硝酸共热:Al +6HNO 3Al(NO 3)3 +3NO 2 ↑+3H 2O8、铝和稀硝酸反应:Al +4HNO 3Al(NO 3)3 +NO ↑+2H 2O8、铝和硝酸银溶液反应:Al +3AgNO 3Al(NO 3)3 +3Ag9、铝与硫酸铜溶液反应:2Al +3CuSO 4Al 2(SO 4)3 +3Cu10、铝和氧化铁高温下反应:2Al +Fe 2O 3Al 2O 3+2Fe11、铝和四氧化三铁高温共热:8Al +3Fe 3O 44Al 2O 3+9Fe12、铝和氧化铜高温共热:2Al +3CuO Al 2O 3+3Cu13、铝和二氧化锰高温共热:4Al +3MnO 22Al 2O 3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO 4Al 2(SO 4)3 +3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH 2NaAlO 2+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O冰晶石电解四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3+3BaCl22AlCl3+3BaSO4↓2、硫酸铝的水溶液呈酸性:Al 2(SO4)3+6H2O2Al(OH)3+3H2SO43、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO48、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO410、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO 2+2H2O AI(OH)3+NaOH2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaCl↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO35、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO36、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓7、向偏铝酸钠溶液中加氯化铵:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl铁及其化合物的化学方程式一、铁1、铁在氧气中燃烧:3Fe+2O2Fe3O42、铁在氯气中燃烧:2Fe+3Cl22FeCl33、常温条件下铁锈的形成:4Fe+3O2+2H2O2[Fe2O3·H2O]4、高温条件铁与氧气反应:2Fe+O22FeO5、铁和硫共热:Fe+S FeS6、铁与水蒸气在高温条件下反应:3Fe+4H2O Fe3O4+4H27、铁与稀硫酸反应:Fe+H2SO4FeSO4+H2↑8、少量的铁与浓硫酸共热:2Fe+6H2SO4Fe2(SO4)3+3SO2↑+6H2O9、过量的铁与浓硫酸共热:Fe+2H2SO4FeSO4+SO2↑+2H2O10、少量的铁与浓硝酸共热:Fe+6HNO3Fe(NO3)3+3NO2↑+3H2O11、过量的铁与浓硝酸共热:Fe+4HNO3Fe(NO3)2+2NO2↑+2H2O12、少量的铁与稀硝酸反应:Fe+4HNO3Fe(NO3)3+NO↑+2H2O13、过量的铁与稀硝酸反应:3Fe+8HNO33Fe(NO3)2+2NO ↑+4H2O14、铁与硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu15、铁与硝酸银溶液反应:Fe+2AgNO3Fe(NO3)2+2Ag16、铁与氯化铁溶液反应:Fe+2FeCl33FeCl2二、氧化亚铁1、氧化亚铁在空气中加热:6FeO+O22Fe3O42、氧化亚铁与一氧化碳高温反应:FeO+CO Fe+CO23、氧化亚铁与铝粉在高温下反应:3FeO+2Al Al2O3+3Fe4、氧化亚铁与稀硫酸反应:FeO+H2SO4FeSO4+H2O5、氧化亚铁与浓硫酸反应:2FeO+4H2SO4Fe2(SO4)3+SO2↑+4H2O6、氧化亚铁与浓硝酸反应:FeO+4HNO3Fe(NO3)3+NO2↑+2H2O7、氧化亚铁与稀硝酸反应:3FeO+10HNO33Fe(NO3)3+NO ↑+5H2O三、四氧化三铁1、四氧化三铁与铝粉高温下反应:8Al+3Fe3O44Al2O3+9Fe2、四氧化三铁与一氧化碳高温下反应:Fe3O4+4CO3Fe+4CO23、四氧化三铁溶于稀盐酸:Fe3O4+8HCl FeCl2+2FeCl3+4H2O4、四氧化三铁溶于浓硫酸:2Fe3O4+10H2SO43Fe2(SO4)3+SO2↑+10H2O5、四氧化三铁溶于浓硝酸:Fe3O4+10HNO33Fe(NO3)3+NO2↑+5H2O6、四氧化三铁溶于稀硝酸:3Fe3O4+28HNO39Fe(NO3)3+NO ↑+14H2O6、四氧化三铁溶于氢碘酸:Fe3O4+8HI3FeI2+I2+4H2O四、氧化铁1、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe2、一氧化碳和氧化铁高温下反应:Fe2O3+3CO2Fe+3CO23、氧化铁溶液稀盐酸:Fe2O3+6HCl2FeCl3+3H2O4、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2O五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:Fe(OH)2+H2SO4FeSO4+2H2O2、氢氧化亚铁与浓硫酸反应:2Fe(OH)2+4H2SO4Fe2(SO4)3+SO2↑+6H2O3、氢氧化亚铁与浓硝酸反应:Fe(OH)2+4HNO3Fe(NO3)3+NO2↑+3H2O4、氢氧化亚铁与稀硝酸反应:3Fe(OH)2+10HNO33Fe(NO3)3+NO↑+8H2O5、氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O4Fe(OH)36、氢氧化亚铁隔绝空气加热:Fe(OH)2FeO+H2O7、氢氧化亚铁在空气中加热:4Fe(OH)2+O22Fe2O3+4H2O六、氢氧化铁1、氢氧化铁与稀硫酸反应:2Fe(OH)3+3H2SO4Fe2(SO4)3+6H2O2、氢氧化铁溶于氢碘酸:2Fe(OH)3+6HI2FeI2+I2+6H2O3、加热氢氧化铁:2Fe(OH)3Fe2O3+3H2O七、氯化亚铁1、铝与氯化亚铁溶液反应:2Al+3FeCl22AlCl3+3Fe2、锌与氯化亚铁反应:Zn+FeCl2ZnCl2+Fe3、氯化亚铁暴露在空气中变质:12FeCl2+3O2+6H2O8FeCl3+4Fe(OH)3↓4、酸化的氯化亚铁溶液中通入氧气:4FeCl2+O2+4HCl4FeCl3+2H2O5、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl36、氯化亚铁溶液中加入溴水:6FeCl2+3Br24FeCl3+2FeBr37、氯化亚铁溶液呈酸性:FeCl 2+2H2O Fe(OH)2+2HCl8、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH Fe(OH)2↓+2NaCl9、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O Fe(OH)2↓+2NH4Cl10、氯化亚铁溶液中加入偏铝酸钠溶液:FeCl2+2NaAlO2+4H2O Fe(OH)2↓+2Al(OH)3↓+2NaCl11、氯化亚铁溶液中加入硝酸银溶液:FeCl2+2AgNO3Fe(NO3)2+2AgCl↓12、氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaCl13、硫酸亚铁溶液与浓硫酸反应:2FeSO4+2H2SO4Fe2(SO4)3+SO2↑+2H2O14、硝酸亚铁溶液与浓硝酸反应:Fe(NO3)2+2HNO3Fe(NO3)3+NO2↑+H2O15、硝酸亚铁溶液与稀硝酸反应:3Fe(NO3)2+10HNO33Fe(NO3)3+NO ↑+5H2O16、酸化的氯化亚铁被过氧化氢所氧化:2FeCl2+H2O2+2HCl2FeCl3+2H2O17、过氧化钠与氯化亚铁溶液反应:4Na2O2+4FeCl2+6H2O4Fe(OH)3↓+8NaCl+O2↑18、次氯酸钠溶液与氯化亚铁溶液反应2FeCl2+5NaClO+5H2O2Fe(OH)3↓+5NaCl+4HClO八、氯化铁1、少量的锌和氯化铁溶液反应:Zn+2FeCl32FeCl2+ZnCl22、过量的锌与氯化铁溶液反应:3Zn+2FeCl33ZnCl2+2Fe3、铁与氯化铁溶液反应:Fe+2FeCl33FeCl24、铜和氯化铁溶液反应:Cu+2FeCl32FeCl2+CuCl25、向氯化铁溶液中通入二氧化硫:2FeCl3+SO2+2H2O2FeCl2+H2SO4+2HCl6、氯化铁溶液呈酸性:FeCl 3+3H2O Fe(OH)3+3HCl7、氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaCl8、向氯化铁溶液中加入氨水:FeCl3+3NH3·H2O Fe(OH)3↓+3NH4Cl9、向氯化铁溶液中加入碳酸钠溶液:2FeCl3+3Na2CO3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑10、向氯化铁溶液中加入碳酸氢钠溶液:FeCl3+3NaHCO3Fe(OH)3↓+3NaCl+3CO2↑11、向氯化铁溶液中加入偏铝酸钠溶液:FeCl3+3NaAlO2+6H2O Fe(OH)3↓+3Al(OH)3↓+3NaCl12、向氯化铁溶液中加入次氯酸钠溶液:FeCl3+3NaClO+3H2O Fe(OH)3↓+3NaCl+3HClO- -.13、向氯化铁溶液中通入硫化氢:2FeCl3+H2S2FeCl2+S↓+2HCl14、向氯化铁溶液中加入氢碘酸:2FeCl3+2HI2FeCl2+I2+2HCl15、向氯化铁溶液中加入少量的硫化钠溶液:2FeCl3+Na2S2FeCl2+S↓+2NaCl16、向氯化铁溶液中加入过量的硫化钠溶液:2FeCl3+3Na2S2FeS↓+S↓+6NaCl17、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2FeCl2+I2+2KCl18、氯化铁溶液与硝酸银溶液混合:FeCl3+3AgNO33AgCl↓+Fe(NO3)319、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN Fe(SCN)3+3KCl20、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)321、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)3- - 总结。
