【新人教版】物质的量PPT课件完美版1
合集下载
课件《物质的量》PPT_完美课件_人教版1

溶液体积
nB: mol V: L
CB: mol/L
第4 页
溶质不是1mol
× 例 判断下列说法是否正确:
1、将1gNaCl溶于水制不成是11LL溶溶液液,则c=1mol/L
2、将1molNaCl溶于1L水中,则c=1mol/L
×
3 、 若从1L 1 mol/L的NaOH溶液中取出20mL,则取出的NaOH溶液
课堂感悟
课堂巩固 1 、 300mL 某 浓 度 的 NaOH 溶 液 中 含 有 60g 溶 质 。 现 要 配 制 1 mol/L
NaOH溶液,应取原溶液与蒸馏水的体积比约为( A ) A. 1∶4 B. 1∶5 C. 2∶1 D. 2∶3 c(NaOH) = (60g÷40g·mol-1)÷0.3 = 5mol·L-1
个数 5mol·L-1×300mL = 1mol·L-1×(300mL+V水)
若由液体配制溶液所需主要仪器
第6 页
二、溶液中微粒的物质的量浓度
第7 页
[练习] 下列各溶液中 1、0.8L 0.4mol/L的NaOH溶液中C(Na+) 2、2L 0.15mol/L的Na3PO4溶液中C(Na+) 3、0.1mol/L Al2(SO4)3中Al3+的物质的量浓度为 4、已知2LAl2(SO4)3溶液中,Al3+为9.03x1023个,则SO42-的物质 的量浓度为
④读数时 ,应平视,使溶液的凹液面正好与刻度相切;不能 作反应容器,不能长期存放溶液,只能用作配制的量具。移 动容量瓶,应手握刻度线以上部分。
三、物质的量在化学实验中的应用
[随堂练习]
容量瓶需标有:
(1)温度
(2)浓度
(3)容积
《物质的量》演示课件-PPT【人教版】1

《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
[例题3] 1 摩尔水分子中有多少摩尔氢原子,多少摩 尔氧原子?
H2O
微粒个数 1 扩大 6.02 ×1023
物质的量 1 mol
2H
2 2 × 6.02 ×1023
化零散为整体
欲测定1个原子的质量,
有什么方法?
?
先测出 N个原子的总质量m总
子
1个原子的质量== m总/N
就是一个
就是一个庞
集合体
大的集合体
你一口气能喝 ?mL H20
17
?
如何简单地来描述粒子的多少呢?
20瓶就是1箱的基准
类似:2只(支)——1双 12个—— 1打
100年——1世纪
一一打双铅筷笔子
[例题1] 1.204×1024个O2中含有的氧分子 解:
mol ?
n(O2) = N(O2) / NA =(1.204 × 1024)/ (6.02 ×1023mol-1) = 2mol
《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
(4)1mol H 的数目约为6.02×1023 (√ )
(5)1mol H2 的数目约为6.02×1023 ( √ ) (6)摩尔是7个基本物理量之一 ( )×
《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
5、2mol CO2中含有 2 mol C和 4 mol O, 含有 1.204 1024 个CO2分子。
《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
[例题3] 1 摩尔水分子中有多少摩尔氢原子,多少摩 尔氧原子?
H2O
微粒个数 1 扩大 6.02 ×1023
物质的量 1 mol
2H
2 2 × 6.02 ×1023
化零散为整体
欲测定1个原子的质量,
有什么方法?
?
先测出 N个原子的总质量m总
子
1个原子的质量== m总/N
就是一个
就是一个庞
集合体
大的集合体
你一口气能喝 ?mL H20
17
?
如何简单地来描述粒子的多少呢?
20瓶就是1箱的基准
类似:2只(支)——1双 12个—— 1打
100年——1世纪
一一打双铅筷笔子
[例题1] 1.204×1024个O2中含有的氧分子 解:
mol ?
n(O2) = N(O2) / NA =(1.204 × 1024)/ (6.02 ×1023mol-1) = 2mol
《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
(4)1mol H 的数目约为6.02×1023 (√ )
(5)1mol H2 的数目约为6.02×1023 ( √ ) (6)摩尔是7个基本物理量之一 ( )×
《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
《物质的 量》演 示课件- PPT【 人教版 】1优秀 课件( 实用教 材)
5、2mol CO2中含有 2 mol C和 4 mol O, 含有 1.204 1024 个CO2分子。
高中化学物质的量课件新人教必修1.ppt

CB
1000mL L1 M
B
3.由物质的量浓度求算子离浓度
(强电解质)
4.由溶解度求算物质的量浓度
化学计算中的守恒法:
1. 化学反应前后: 质量守恒 2. 离子化合物或电解质溶液:电荷守恒 (正离子所带正电荷等于负离子所带负电荷) 3. 溶液稀释或溶液混合前后:溶质的物质 的量守恒
溶液配制:
欲配制 1000 mL 浓度为 0.12 mol·L-1 的 NaOH 溶液,需要
n
2. 标准状况下的气体 M2.2 4Lm o1 l
3. 同温同压下的气体 MA A D MB B
M M AxAM BxB
4.
(十字交叉法的运用)
摩尔质量的有关计算:
练习:用体积为200 mL 的集气瓶收集一 瓶干燥的 HCl 气体,该瓶气体的密度是 相同条件下 O2密度的1.082倍,将此瓶气 体倒立于水中,通过计算判断进入集气瓶 的水的体积。
练习:有一摩尔质量为 a g·mol-1的可溶
性盐,在一定温度下,将 b g该盐完全
溶于 c mL 水中恰好饱和,所得溶液的
密度为 d g·cm-3,则此温度时该盐的溶解
度是(
) ,该溶液中溶质的物质
的量浓度是( )。
物质的量浓度的有关计算公式:
1.定义式CB: nVB (V为溶液的体积)
2.由质量分数求算物量质浓的度:
• 等于 20xymolL1
98
B.小于 2
98
D.无法判断
练习:在NaCl、MgCl2、MgSO4、Na2SO4四种 盐配成的混合溶液中,若C(Na+ )=0.1mol·L-1、 C( Mg2+) =0.25mol·L-1、 C(Cl- ) =0.2mol·L-1 , C(SO42- ) = 0.2mol·L-1
人教版化学《物质的量》PPT精美课件【新教材】

的 最高境 界,也 必然是 书法的 最高境 界。
•
3.历代书家正是在观察、体悟、回归 自然的 过程中 ,提炼 了书法 的点画 样式, 丰富了 书法的 生命意 象,升 华了书 法的审 美境界 ,终将 书法内 化为书 家的人 格修养 和心性 表达。
•
4.由于人的情绪、意志、身体状况等 方面因 素的影 响,有 时会使 测谎仪 发生误 判。为 了弥补 这些细 小的缺 陷,科 学家叉 开始了 新的探 索。
(4)同温同压下,气体的体积只与气体的 分子数目有关,而与气体分子的种类无 关。
人教版化学《物质的量》PPT精美课件 【新教 材】1
人教版化学《物质的量》PPT精美课件 【新教 材】1
1、 CO2 的摩尔体积是22.4L/mol
错 未说标准状况下。
2、标准状况下1molH2O 的体积约是22.4L
6、常温错常压标下准,状1况mo下lC,SO2O的3是体积固约态是。22.4L 错 是24.5L。
7、标准状况下,0.2molN2和0.8molCO2的混 合气体体积约为22.4L
对
8、标准状况下,22.4L的任何气体都约为1mol
对
人教版化学《物质的量》PPT精美课件 【新教 材】1
人教版化学《物质的量》PPT精美课件 【新教 材】1
气体体积
物质的量
等粒子数的气体的体积不是固定不 变的,它取决于什么因素呢?
温度
压强
人教版化学《物质的量》PPT精美课件 【新教 材】1
例如: 标准状况(0℃,101KPa)下, Vm≈22.4 L/mol 常温常压(25℃,101KPa)下, Vm≈24.5 L/mol
气体包括单一纯净气体和混合气体。
人教版化学《物质的量》PPT精美课件 【新教 材】1
•
3.历代书家正是在观察、体悟、回归 自然的 过程中 ,提炼 了书法 的点画 样式, 丰富了 书法的 生命意 象,升 华了书 法的审 美境界 ,终将 书法内 化为书 家的人 格修养 和心性 表达。
•
4.由于人的情绪、意志、身体状况等 方面因 素的影 响,有 时会使 测谎仪 发生误 判。为 了弥补 这些细 小的缺 陷,科 学家叉 开始了 新的探 索。
(4)同温同压下,气体的体积只与气体的 分子数目有关,而与气体分子的种类无 关。
人教版化学《物质的量》PPT精美课件 【新教 材】1
人教版化学《物质的量》PPT精美课件 【新教 材】1
1、 CO2 的摩尔体积是22.4L/mol
错 未说标准状况下。
2、标准状况下1molH2O 的体积约是22.4L
6、常温错常压标下准,状1况mo下lC,SO2O的3是体积固约态是。22.4L 错 是24.5L。
7、标准状况下,0.2molN2和0.8molCO2的混 合气体体积约为22.4L
对
8、标准状况下,22.4L的任何气体都约为1mol
对
人教版化学《物质的量》PPT精美课件 【新教 材】1
人教版化学《物质的量》PPT精美课件 【新教 材】1
气体体积
物质的量
等粒子数的气体的体积不是固定不 变的,它取决于什么因素呢?
温度
压强
人教版化学《物质的量》PPT精美课件 【新教 材】1
例如: 标准状况(0℃,101KPa)下, Vm≈22.4 L/mol 常温常压(25℃,101KPa)下, Vm≈24.5 L/mol
气体包括单一纯净气体和混合气体。
人教版化学《物质的量》PPT精美课件 【新教 材】1
(新教材)物质的量PPT优质课人教版课件

×
××
√
×
12
典例2在下面的横线上填上适当的内容。
10
2.709×1024
0.5
13
提示:
3.下列各组物质中含氧原子的物质的量相同的是( C )
14
5.设NA为阿伏加德罗常数的值。试回答下列问题:(1)3.01×1023个氯气分子的物质的量是 0.5 mol 。
3 mol 1.5 mol9.03×10 (或15NA)24 1∶3 10 mol 0.25
18
19
m(H2SO4)= n(H2SO4 )×M(H2SO4)
[例]
20
÷NA×NA
×M÷M
N、n、m、M之间的相互转化
21
22
1mol不同物质的质量
化学式
相对分子质量
质量
17
1 mol任何粒子或物质的质量以克为单位时,其数值都与该粒子的相对原子质量或相对分子质量相等。单位物质的量的物质所具有的质量叫做摩尔质量 ,
Mg ● mol-1
23 g · mol-1
74.517 g · mol-1
物质的量
1
1
1个水分子的质量约为
×请问36g水大约有多少个水分子?
物质的量
1
联系起来
一.物质的量(n)的单位——摩尔
1
物理量微观单位:摩尔 摩 单位符号:mol
伏加
阿常数
德罗 注意:单位是mol-1。
1
使用时注意:
1
物质的量微观粒子或它们的特定组合种类,即用化学式表明物质的具体符号
1、判断正误,并说明理由。 A、1mol氢
15
1 mol不同物质中所含的粒子数是相同的,但由于不同粒子的质量不同,I mol不同物质的质量也不同。
《物质的量》高中化学ppt优质课件人教版1

加 德
我们把0.012 kg C-12 中所含有的C原子个数叫做
罗 常 数
阿伏加德罗常数。用NA表示 NAN n6.02 12 03mo1 l
阿伏加德罗常数意义:单位物质的量的微粒含有的微粒个数
1 mol 有多大?
已知1粒大米的质量为2×10-5 kg,则1mol 大米的质量为?
m 6 . 0 1 2 2 个 0 3 2 1 5 k 0 / 个 g 1 . 2 1 0 1 k g 9 0 4
规定:以 0.012 kg C-12 中所含有的C原子个数作为 1mo1lmol任何物质中含有的微粒数目与0.012 kg 126C 中 所含有的C原子个数相同
1 mol 有多大?
已知1个C-12原子的质量为1.993 × 10-26
阿 伏
kg Nm m 总 C1 .90 .9 0 1 3 1 k 0 22 g k 6 g 6 .0 2 12 03
0.52_._m_含o__l6_.0,2× CO13022-3的个数Na量+ 的是N__a3_2C_.0_O1_3_×的_ 物10质23的个量是
《物质的量》高中化学ppt优质课件人 教版1
摩尔质量
微粒种类
H2SO4 Fe Na+ Si
《物质的量》高中化学ppt优质课件人 教版1
单个质量
1.628×10-25kg 9.302×10-26kg 3.821×10-26kg 4.651×10-26kg
《物质的量》高中化学ppt优质课件人 教版1
《物质的量》高中化学ppt优质课件人 教版1
物质的量
基本物理量 单位:摩尔 基准:NA
《物质的量》高中化学ppt优质课件人 教版1
本课总结
1、表示一定数目微粒的集体的物理量 2、对象为微观粒子及其特定组合
课件《物质的量》完美版_人教版1
1mol铁原子的质量为56g
0(33×)10单23位个:铁(m3原o)子l-11的m物质o的l 量H__2_S__O_。4中的氧原子数为_____,原子数为_____, 电子数为_____。 8g H2SO4的物质的量______ M(H2SO4)=98g·mol-1
错误,必须指明微粒的种类,是氧原子、氧分子还是氧离子
25g (3)0.25mol CaCO 的质量是_______ (2)1mol NaCl中氯离子数为_______,质子数为______。
1mol钠原子的质量为23g 正确 3mol H2O
3
M(CaCO3)=100g·mol-1
36g (4)2.0mol H O的质量_________ (4)计量对象:分子、原子、离子、中子、电子、
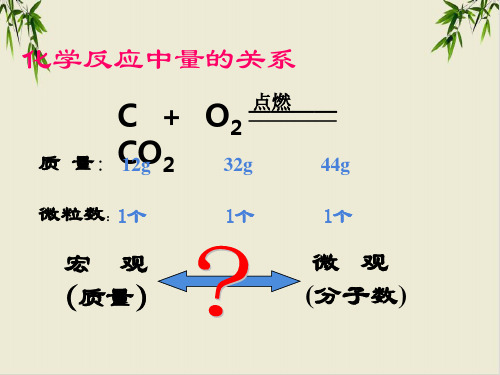
微粒数:1个 C + O2 ———— CO2
8g H2SO4的物质的量______ M(H2SO4)=98g·mol-1 204×1024个水分子的物质的量为_____,水分子个
1个
1个
数约为_____。
(2)1mol NaCl中氯离子数为_______,质子数为______。
宏 观 (3)单位:g·mol-1 或 kg·mol-1
1mol任何微粒的个数都是约为6.02×1023, 那质量呢?
质量和物质的量之间又有怎么样的联系呢?
1mol某微粒集合体中所含的微粒数与0.012kg C-12 中所含的原子数相同。
即: 1mol碳原子的质量为12g
已知:
1mol铁原子的质量为56g 1mol水分子的质量为18g 1mol硫酸分子的质量为98g 1mol钠原子的质量为23g
正确 3mol H2O
8g H2SO4的物质的量______ M(H2SO4)=98g·mol-1
0(33×)10单23位个:铁(m3原o)子l-11的m物质o的l 量H__2_S__O_。4中的氧原子数为_____,原子数为_____, 电子数为_____。 8g H2SO4的物质的量______ M(H2SO4)=98g·mol-1
错误,必须指明微粒的种类,是氧原子、氧分子还是氧离子
25g (3)0.25mol CaCO 的质量是_______ (2)1mol NaCl中氯离子数为_______,质子数为______。
1mol钠原子的质量为23g 正确 3mol H2O
3
M(CaCO3)=100g·mol-1
36g (4)2.0mol H O的质量_________ (4)计量对象:分子、原子、离子、中子、电子、
微粒数:1个 C + O2 ———— CO2
8g H2SO4的物质的量______ M(H2SO4)=98g·mol-1 204×1024个水分子的物质的量为_____,水分子个
1个
1个
数约为_____。
(2)1mol NaCl中氯离子数为_______,质子数为______。
宏 观 (3)单位:g·mol-1 或 kg·mol-1
1mol任何微粒的个数都是约为6.02×1023, 那质量呢?
质量和物质的量之间又有怎么样的联系呢?
1mol某微粒集合体中所含的微粒数与0.012kg C-12 中所含的原子数相同。
即: 1mol碳原子的质量为12g
已知:
1mol铁原子的质量为56g 1mol水分子的质量为18g 1mol硫酸分子的质量为98g 1mol钠原子的质量为23g
正确 3mol H2O
8g H2SO4的物质的量______ M(H2SO4)=98g·mol-1
课件《物质的量》精美PPT课件_人教版1

配制一定体积、一定物质的量浓度的溶液时,下列情况对结果产生偏高影响的是( ) 9、未洗涤烧杯和玻璃棒
超过了刻度线,怎么办?能用胶头滴管
把多余的液体取出吗?只能重新配制
7. 摇匀 盖好瓶塞,把容量瓶倒转和 摇动多次,使得溶液混合均 匀。
思考:
摇匀后发现液面低于刻线,能否补充水?
不能。因为是部分溶液在润湿容量瓶 瓶口磨砂处有所损失所致。
8. 装瓶贴签
容量瓶中不 能存放溶液,因 此要把配制好的 溶液转移到试剂 瓶中,贴好标签, 注明溶液的名称 和浓度。
误差分析:c= n
V
凡是引起n增大或V减小的操作,会 使实际配制的浓度偏高,反之,浓度 偏小。
引发误差的一些操作: 托盘天平:
1、药品、砝码左右位置颠倒(游码不 在零处) 偏低 2、称量易潮解的物质(如NaOH)时 间过长 偏低
②溶解或稀释的操作不能在 容量瓶中进行
1 配制溶液的试验仪器 专用仪器:容量瓶(规格固定)
1. 构造:细颈、平底玻璃瓶, 瓶口配有磨口玻璃塞或塑料塞
2. 特点:①容量瓶上标有温度和容积 ②容量瓶上有刻线而无刻度
3. 使用范围:用来配制一定体积浓度 准确的溶液
(容量瓶是量器不是容器)
容量瓶的规格
常用的有:
⑶ 若称5量0前NamOH已L部分潮,100mL,250mL,500mL,
1000mL
使用注意事项 ①使用前要检查是否漏水 体不②③④能不不 只加能能能热长在 配期容 制存量容放瓶量溶中瓶液溶上或解规进固定行体 容化或 积学稀 的反释 溶应液 液, 因会托容计③配( 411⑤思51查(⑤ ⑤将0溶溶配思使②4111(超1100000mm、 、g23为使盘量算不制3称考漏容称称称质质制考用溶容过硫00000、 、oo)砝砝mmmmmll是 所 天 瓶 : 能 过 量 : : 量 量量 好 ” ” 过 : 范 解 量 了酸定 定//LLLLLL若 码码L部配平中所长程完若往瓶完 完的预预程N围或瓶刻的的容容容容铜容 容及将 沾沾a分溶、进称期中毕量容是毕 毕N溶溶中:稀是度盐硫量量量量,时 时O1烧 有有a溶液量行固存所应取量量应 应””所用释量线酸酸H瓶瓶瓶瓶加, 水0O杯 其其0能液的筒体放用将的瓶器将 将形形用来的器,溶铜H入经 加0,,,,里 他他固否烧烧烧烧在浓、质溶烧砝是中不砝 砝成成烧配操不怎液溶m5振 多的 物物0体直杯杯杯杯L润度烧量液杯码浓加是码 码的的杯制作是么液,荡 了0。溶 质质放接m湿偏杯或或没放硫入容放 放溶溶没一不容办,、,,,,,玻 玻 玻 玻液或 或L入放容小、量进有回酸少器回回液液有定能器?现摇 用水璃璃璃璃转 已已容在量的玻取行洗盒需量)盒 盒与与洗体在)能用匀 滴棒棒棒棒移 腐腐量称瓶是璃液化涤中要水中 中””涤积用5、 管至 蚀蚀0,,,,瓶量瓶棒体学,稀,, ,洗洗浓胶托托托托静 吸0容m中纸口、的反游释塞游 游涤涤度头盘盘盘盘置 出L量,上磨容体应码,好码 码液液滴天天天天容,瓶加称砂量积,归应瓶归 归””管平平平平量。液后入量处瓶。不零如塞零 零相相把瓶,,,,面,胶胶胶胶少?有(能何,比比多进下即头头头头量所加操用余1,,行密密降加0滴滴滴滴水损热作食的配0度 度,水管 管 管 管溶m失才指液制明明再并L解....所是顶体,显显)加定致正住取以不不水容。确瓶出下同同,的塞吗操,,胶此两两?,?作头法部部另正滴配分分一确管制液液只的的体体手是溶在在托(液混混住浓匀匀瓶度前前底)与与_,_混混_把_匀匀_瓶_后后(倒体体偏过积积高来会会、,有 有偏观明明低察显显、瓶偏偏准塞差差确周..)围;是否有水漏出。
超过了刻度线,怎么办?能用胶头滴管
把多余的液体取出吗?只能重新配制
7. 摇匀 盖好瓶塞,把容量瓶倒转和 摇动多次,使得溶液混合均 匀。
思考:
摇匀后发现液面低于刻线,能否补充水?
不能。因为是部分溶液在润湿容量瓶 瓶口磨砂处有所损失所致。
8. 装瓶贴签
容量瓶中不 能存放溶液,因 此要把配制好的 溶液转移到试剂 瓶中,贴好标签, 注明溶液的名称 和浓度。
误差分析:c= n
V
凡是引起n增大或V减小的操作,会 使实际配制的浓度偏高,反之,浓度 偏小。
引发误差的一些操作: 托盘天平:
1、药品、砝码左右位置颠倒(游码不 在零处) 偏低 2、称量易潮解的物质(如NaOH)时 间过长 偏低
②溶解或稀释的操作不能在 容量瓶中进行
1 配制溶液的试验仪器 专用仪器:容量瓶(规格固定)
1. 构造:细颈、平底玻璃瓶, 瓶口配有磨口玻璃塞或塑料塞
2. 特点:①容量瓶上标有温度和容积 ②容量瓶上有刻线而无刻度
3. 使用范围:用来配制一定体积浓度 准确的溶液
(容量瓶是量器不是容器)
容量瓶的规格
常用的有:
⑶ 若称5量0前NamOH已L部分潮,100mL,250mL,500mL,
1000mL
使用注意事项 ①使用前要检查是否漏水 体不②③④能不不 只加能能能热长在 配期容 制存量容放瓶量溶中瓶液溶上或解规进固定行体 容化或 积学稀 的反释 溶应液 液, 因会托容计③配( 411⑤思51查(⑤ ⑤将0溶溶配思使②4111(超1100000mm、 、g23为使盘量算不制3称考漏容称称称质质制考用溶容过硫00000、 、oo)砝砝mmmmmll是 所 天 瓶 : 能 过 量 : : 量 量量 好 ” ” 过 : 范 解 量 了酸定 定//LLLLLL若 码码L部配平中所长程完若往瓶完 完的预预程N围或瓶刻的的容容容容铜容 容及将 沾沾a分溶、进称期中毕量容是毕 毕N溶溶中:稀是度盐硫量量量量,时 时O1烧 有有a溶液量行固存所应取量量应 应””所用释量线酸酸H瓶瓶瓶瓶加, 水0O杯 其其0能液的筒体放用将的瓶器将 将形形用来的器,溶铜H入经 加0,,,,里 他他固否烧烧烧烧在浓、质溶烧砝是中不砝 砝成成烧配操不怎液溶m5振 多的 物物0体直杯杯杯杯L润度烧量液杯码浓加是码 码的的杯制作是么液,荡 了0。溶 质质放接m湿偏杯或或没放硫入容放 放溶溶没一不容办,、,,,,,玻 玻 玻 玻液或 或L入放容小、量进有回酸少器回回液液有定能器?现摇 用水璃璃璃璃转 已已容在量的玻取行洗盒需量)盒 盒与与洗体在)能用匀 滴棒棒棒棒移 腐腐量称瓶是璃液化涤中要水中 中””涤积用5、 管至 蚀蚀0,,,,瓶量瓶棒体学,稀,, ,洗洗浓胶托托托托静 吸0容m中纸口、的反游释塞游 游涤涤度头盘盘盘盘置 出L量,上磨容体应码,好码 码液液滴天天天天容,瓶加称砂量积,归应瓶归 归””管平平平平量。液后入量处瓶。不零如塞零 零相相把瓶,,,,面,胶胶胶胶少?有(能何,比比多进下即头头头头量所加操用余1,,行密密降加0滴滴滴滴水损热作食的配0度 度,水管 管 管 管溶m失才指液制明明再并L解....所是顶体,显显)加定致正住取以不不水容。确瓶出下同同,的塞吗操,,胶此两两?,?作头法部部另正滴配分分一确管制液液只的的体体手是溶在在托(液混混住浓匀匀瓶度前前底)与与_,_混混_把_匀匀_瓶_后后(倒体体偏过积积高来会会、,有 有偏观明明低察显显、瓶偏偏准塞差差确周..)围;是否有水漏出。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
质量分数:单位质量溶液中所含溶质的质量
物质的量浓度
一、定义:以单位体积溶液里所含溶质B的物质的量来
表示溶液组成的物理量,叫做溶质B的物质的量浓度。
二、符号:cB 溶质
溶质的物质的量
三、表达式:物质的量浓度= 溶液的体积
c(B)
nB =
V
四、单位:摩尔/升( mol/L)或摩尔/立方米 (mol/m3)
【新人教版】物质的量PPT课件完美版 1
溶液的稀释定律
原理: 稀释以后,溶液中溶质的量不变。 m (浓溶液) ·ω(浓溶液)=m(稀溶液) ·ω(稀溶液)
检查时间:2010-07-15 10:05 检查医生:XXX
钙: “ ≥400μg/100mL” 酒精度: “五十六度”
的含义是什么?
的含义是什么?
每100mL矿泉水中含钙 每100mL酒中含
的质量≥400微克
有56mL的酒精
共同之处:
n(溶质)
c= V(溶液)
溶质的量 溶液的量
m(溶质)
m(溶液) =ω
C (Na+) = 0. 3 mol/L×2 = 0. 6 mol/L (C) 0. 8L 0. 4 mol/L NaOH 溶液
C (Na+) = 0. 4 mol/L×1 = 0. 4 mol/L (D) 2L 0. 15 mol/L Na3PO4 溶液
C (Na+) = 0. 15 mol/L×3 = 0. 45 mol/L
µmol/L
尿素氮
5.34 2.00—7.14 mmol/L
尿酸
361 140—446 µmol/L
葡萄糖
5.00 3.90—6.40 mmol/L
果糖胺
2.49 1.40—2.95 mmol/L
总胆固醇
4.93 3.10—6.00 mmol/L
高密度脂蛋白胆固醇 1.52 1.00—3.00 mmol/L
【新人教版】物质的量PPT课件完美版 1
【新人教版】物质的量PPT课件完美版 1
3、某溶液中只含Al3+、NO3-、Na+、SO42-、Cl-等五种 离子已知c(NO3-)=0.2mol/L、 c(Na+)= 0.2mol/L、 c(SO42-)=0.1mol/L c(Cl-)=0.1mol/L 、c(Al3+)= mol/L 由溶液电中性原理知,溶液中各离子应该满足下列关系:
D.称取250g胆矾溶于水再稀释到1L。
填空
2、1 mol/L MgCl2 溶液,Mg2+ 的物质的量浓度为 1 mol/L, Cl- 的物质的量浓度为 2 mol/L 。 3、0.5 mol/L H2SO4 溶液,H+ 的物质的量浓度为 1 mol/L, SO42- 的物质的量浓度为 0. 5 mol/L 。 4、0.1 mol/L Al2(SO4)3 溶液,Al3+ 的物质的量浓度为
五、注意:
1、体积指的是溶液的体积,而不是溶剂的体积。 2、溶质用物质的量表示,而不是用质量表示。
有关物质的量浓度的简单计算
cB =
nB V
nB = cB V nB
V= cB
1:1LNaOH溶液里含有O. 5molNaOH,则氢氧化钠溶
液的物质的量浓度为( 0.5mol/L ) 2:2mol/L的NaCl溶液1000ml,含溶质NaCl的物质的
0. 2 mol/L,SO42- 的物质的量浓度为 0. 3 mol/L 。
【新人教版】物质a+ 浓度最大的是 ( B ) (A)4L 0. 5 mol/L NaCl 溶液
C (Na+) = 0. 5 mol/L×1 = 0. 5 mol/L (B)1L 0. 3 mol/L Na2SO4 溶液
【新人教版】物质的量PPT课件完美版 1
【新人教版】物质的量PPT课件完美版 1
例题1、将4gNaOH溶于水配成2L溶液, 其物质的量浓度为多少?
解: n(NaOH)=
c(NaOH)=
m(NaOH) M(NaOH) n(NaOH)
V(aq)
4g = 40g/mol = 0.1mol
0.1mol
=
= 0.05mol/L
2L
答:40克氢氧化钠溶于水配成2L溶液,物质的量浓度为 0.05mol/L
【新人教版】物质的量PPT课件完美版 1
【新人教版】物质的量PPT课件完美版 1
1、将23.4gNaCl溶于水配成250mL 溶液。计算溶液中溶质的物质的量 浓度。 2.将28.4g Na2SO4溶于水配成250mL溶液,计 算溶液中溶质的物质的量浓度,并求出溶液 中Na+和SO42- 的物质的量浓度。
3c(Al3+)+c(Na+)=c(NO3-)+2c(SO42-)+c(Cl-) c(Al3+)=[c(NO3-)+2c(SO42-)+c(Cl-)-c(Na+)]/3 c(Al3+)=(0.2mol/L+2×0.1mol/L+0.1mol/L
-0.2mol/L)÷3
=0.1mol/L
【新人教版】物质的量PPT课件完美版 1
结论:同一溶液,各部分是均一的。所以,无论取多少体 积,溶质的物质的量浓度相同,但溶质的物质的量不同。
填空
1、用胆矾晶体配制1mol/L硫酸铜溶 液的最佳方法是( )
A.称取250g胆矾溶于1L水中; B.称若取是1结6晶0g水胆合矾物溶,于溶1质L为水除中;
去结晶水的化合物。
C.将胆矾加热失水后再称取160g并 溶于水配成1L溶液;
量为( 2mol ) 3:已知某硫酸钠溶液的物质的量浓度为1mol/L,该
溶液中含硫酸钠的物质的量为3moL,则该溶液的体
积为(3L )
讨论1:将342克蔗糖(C12H22O11 )溶解在1L水中,所得 溶液中溶质的物质的量浓度是多少?(M蔗糖=342g/mol)
结论:溶液的体积不等于溶剂的体积,且不同物质(尤 讨论2:从1L1mol/L的C12H22O11溶液中取出100ml,取出 的其C是12状H态22O不11同溶的液物的质物)质的的体量积浓是度没是有多加少和?性溶的质。质量、 溶剂质量、溶质质量分数、溶液密度怎样变化?
【新人教版】物质的量PPT课件完美版 1 【新人教版】物质的量PPT课件完美版 1
武威市医院体检单
项目名称
检查结果 参考值
单位
钾
3.91 3.50-5.50 mmol/L
甘油三脂
0.99 0.56—1.65 mmol/L
低密度蛋白质
2.96 1.45—4.00 mmol/L
直接胆红素
1.9
0—6.0
