物理化学(第五版傅献彩)第10_主要内容
傅献彩《物理化学》第五版课件及习题答案_10电解与极化作用
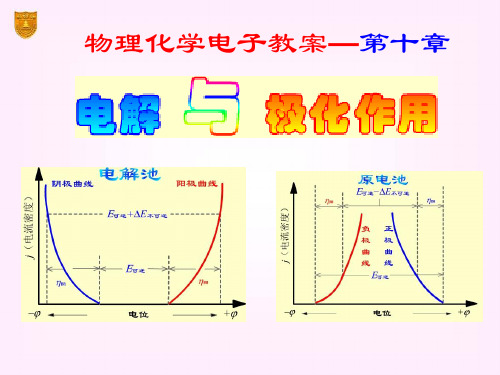
§10.2 极化作用
例如电解一定浓度的硝酸银溶液 阴极反应
Ag + (mAg+ ) e Ag(s)
可逆
电解时
RT 1 Ag |Ag ln F aAg+
阴
可逆 > 不可逆 阳极上有类似的情况,但 可逆 < 不可逆
动势达极大值 Eb,max。
电 流 I
3
再增加电压,使I 迅速增 加。将直线外延至I = 0 处, 得E(分解)值,这是使电解
2 1
池不断工作所必需外加的 最小电压,称为分解电压。
E分解
电压E
测定分解电压时的电流-电压曲线
实际分解电压
要使电解池顺利地进行连续反应,除了克服作
为原电池时的可逆电动势外,还要克服由于极化在
生消耗氧的还原反应:
O2 (g)+4H+ 4e 2H2O
(O2 |H2O,H+ )
RT 1 ln 4 4F aO2 aH +
1.229 V
设 aO2 1, aH+ 107 , 则 (O2 |H2O,H+ ) 0.816V
这时与 E(Fe2+ |Fe) (-0.617V)阳极组成原电池的电动 势为 1.433 V 显然耗氧腐蚀比析氢腐蚀严重得多。
所以铁很快腐蚀形成铁锈。
CO2 SO2
Fe2+
H 2或 H 2O
O2
O2
H
Cu
+
H2 O
Fe
2e-
H2 O
H+
Cu
电化学腐蚀示意图
物理化学傅献彩版知识归纳

物理化学傅献彩版知识归纳一、热力学第一定律1、内容:能量守恒定律在化学反应中的应用,内容为:封闭系统中发生的能量转化等于该系统内所有物体能量的总和。
2、公式:ΔU = Q + W,其中ΔU为系统内能的变化,Q为系统吸收的热量,W为系统对外做的功。
3、应用:判断反应是否自发进行;计算反应过程中的焓变等。
二、热力学第二定律1、内容:熵增加原理,即在一个封闭系统中,自发进行的反应总是向着熵增加的方向进行。
2、公式:ΔS = Σ(δQ/T),其中ΔS为系统熵的变化,δQ为系统热量的变化,T为热力学温度。
3、应用:判断反应是否自发进行;计算反应过程中的熵变等。
三、化学平衡1、定义:在一定条件下,可逆反应达到平衡状态时,反应物和生成物的浓度不再发生变化,各组分的浓度之比等于系数之比。
2、公式:K = [C]^n/[D]^m,其中K为平衡常数,C和D分别为反应物和生成物的浓度,n和m分别为反应物和生成物的系数。
3、应用:判断反应是否达到平衡状态;计算平衡常数;计算反应物的转化率等。
四、电化学基础1、原电池:将化学能转化为电能的装置。
主要由正极、负极、电解质和隔膜组成。
2、电解池:将电能转化为化学能的装置。
主要由电源、电解液、电极和导线组成。
3、电池的电动势:E = E(标准) - (RT/nF)ln(a(正)/a(负)),其中E为电池的电动势,E(标准)为标准状况下的电动势,R为气体常数,T为热力学温度,n为电子转移数,F为法拉第常数,a(正)和a(负)分别为正极和负极的活度。
4、电解的电压:V = (RT/nF)ln[(a(正)·a(阴))/(a(阴)·a(阳))],其中V为电解电压,R为气体常数,T为热力学温度,n为电子转移数,F为法拉第常数,a(正)、a(阴)和a(阳)分别为正极、阴极和阳极的活度。
《物理化学》第五版是南京大学傅献彩等编著的教材,该教材是化学、化工类专业本科生的基础课教材,也可作为从事化学、化工领域科研和工程技术人员的参考书。
(NEW)傅献彩《物理化学》(第5版)笔记和课后习题(含考研真题)详解

目 录第1章 气 体1.1 复习笔记1.2 课后习题详解1.3 名校考研真题详解第2章 热力学第一定律2.1 复习笔记2.2 课后习题详解2.3 名校考研真题详解第3章 热力学第二定律3.1 复习笔记3.2 课后习题详解3.3 名校考研真题详解第4章 多组分系统热力学及其在溶液中的应用4.1 复习笔记4.2 课后习题详解4.3 名校考研真题详解第5章 相平衡5.1 复习笔记5.2 课后习题详解5.3 名校考研真题详解第6章 化学平衡6.1 复习笔记6.2 课后习题详解6.3 名校考研真题详解第7章 统计热力学基础7.1 复习笔记7.2 课后习题详解7.3 名校考研真题详解第8章 电解质溶液8.1 复习笔记8.2 课后习题详解8.3 名校考研真题详解第9章 可逆电池的电动势及其应用9.1 复习笔记9.2 课后习题详解9.3 名校考研真题详解第10章 电解与极化作用10.1 复习笔记10.2 课后习题详解10.3 名校考研真题详解第11章 化学动力学基础(一)11.1 复习笔记11.2 课后习题详解11.3 名校考研真题详解第12章 化学动力学基础(二)12.1 复习笔记12.2 课后习题详解12.3 名校考研真题详解第13章 表面物理化学13.1 复习笔记13.2 课后习题详解13.3 名校考研真题详解第14章 胶体分散系统和大分子溶液14.1 复习笔记14.2 课后习题详解14.3 名校考研真题详解第1章 气 体1.1 复习笔记一、气体分子动理论1.理想气体理想气体:在任何压力、任何温度下都符合理想气体状态方程pV=nRT 的气体。
理想气体状态方程中,p为气体压力,单位是Pa;V为气体的体积,单位是m3;n为物质的量,单位是mol;T为热力学温度,单位是K;R是摩尔气体常数,。
2.气体分子动理论的基本公式(1)气体分子运动的微观模型①气体是大量分子的集合体;②气体分子不断地作无规则的运动,均匀分布在整个容器之中;③分子彼此的碰撞以及分子与器壁的碰撞是完全弹性的。
物理化学(第五版傅献彩)第10_电解与极化作用

无电流
ϕ可逆
= ϕy Ag+ |Ag
−
RT F
ln
1 aAg+
有电流
ϕ不可逆
= ϕy Ag+ |Ag
−
RT F
ln
1 aAg+ , e
η阴
= ϕ可逆
− ϕ不可逆
=
RT F
ln aAg+ aAg+ , e
>0
aAg+ , e < aAg+ ϕ不可逆 < ϕ可逆
阳极上的情况类似,但 ϕ不可逆 > ϕ可逆
的金属先在阴极析出,这在电镀工业上很重要 例如,利用氢的超电势,控制溶液的pH,实
现镀 Zn,Sn,Ni,Cr 等
25
阴极上发生还原反应
发生还原 (1) 金属离子 的物质: (2) 氢离子 (中性水溶液 aH+ = 10−7 ) 判断在阴极上首先析出何种物质,应把各 种可能还原的物质的电极电势求出来(气 体要考虑超电势,金属可不考虑超电势)
2H+ + 2e- = H2
ϕ可逆
=ϕΟ H+ |H2
− RT 2F
ln
pH2 / p Ο a2
H+
= −0.059pH = −0.414V
ϕ不可逆 = ϕ可逆 −η = −0.414V − 0.584V = −0.998V
Zn2+ + 2e- = Zn
ϕ可逆
=ϕΟ Zn2+ |Zn
− RT 2F
1 ln
=−
RT 2F
ln
aH2 a2
H+
−ηH2
设 pH2 = p Ο
物理化学(第五版)傅献彩上册

物理化学(第五版)傅献彩上册第一章引言物理化学是研究物质的性质和变化规律的学科。
它是物理学和化学的交叉学科,采用了物理学的理论和方法来解释和描述化学现象。
本书为《物理化学(第五版)》上册,是傅献彩教授主编的经典教材之一。
第二章热力学热力学是研究热能转化及其与物质性质关系的学科。
本章主要介绍了热力学的基本概念和定律,如热力学第一定律和热力学第二定律。
同时,还涉及了理想气体的状态方程和变动过程,熵的概念和熵变的计算方法等。
第三章热力学函数与熵的计算本章深入介绍了热力学函数的计算方法,包括内能、焓、自由能和吉布斯函数等。
同时,还介绍了熵的计算方法,包括理想气体熵的计算、可逆过程熵变的计算和非可逆过程熵变的计算等。
这些函数和熵的计算方法是研究物质变化和平衡状态的重要工具。
第四章相平衡与相变相平衡是研究不同相之间的平衡条件和相变规律的学科。
本章主要介绍了相平衡的基本概念和条件,如相平衡的条件和相图的表示方法。
同时,还介绍了相变的基本规律和热力学描述,如固液相变和液气相变等。
第五章物理化学平衡常数物理化学平衡常数是研究化学反应平衡的重要参数,也是研究物质变化和平衡状态的重要工具。
本章主要介绍了平衡常数的概念和计算方法,包括平衡常数的定义、计算和影响因素等。
同时,还介绍了化学平衡的基本原理和影响因素。
第六章化学平衡的计算方法本章主要介绍了化学平衡的计算方法,包括平衡计算和平衡常数计算。
平衡计算是将已知条件下,通过平衡条件和平衡常数计算未知物质浓度或压力的过程。
平衡常数计算是通过物质浓度或压力的变化来计算平衡常数的大小,从而判断反应的偏向性和平衡位置。
第七章化学动力学化学动力学是研究化学反应速率及其与反应条件关系的学科。
本章主要介绍了化学反应速率的定义和计算方法,包括反应速率方程的推导和速率常数的计算。
同时,还介绍了影响反应速率的因素和反应机理的研究方法。
第八章电化学与电解,俞允文电化学是研究电能与化学能之间互相转化的学科。
物理化学 傅献彩版 知识归纳

−
E kT
⎞ ⎟⎠
dE
代表分子能量介于
E
~
(E + dE)
之间的分子
占总分子数的分数。
N E1→∞ N
=
exp
⎛ ⎜⎝
−
E1 kT
⎞ ⎟⎠
代表能量超过
E1
的分子占总分子数的分数。
N E2 →∞ N E1→∞
=
exp
⎛ ⎜⎝
−
E2 − kT
E1
⎞ ⎟⎠
代表能量超过
E2
与能量超过
E1
的分子数的比值。
最概然速率: vm =
诀窍:题目若要计算 ∆A ,一般是恒温过程;若不是恒温,题目必然会给出绝对熵。
∂V ∂T
⎞ ⎟⎠ p
6. Gibbs-Helmholtz 方程
5
乐山师范学院 化学与生命科学学院
⎡ ⎢ ⎢
∂
⎛ ⎜⎝
∆G T
⎞ ⎟⎠
⎤ ⎥ ⎥
=
−
∆H
,
⎡ ⎢ ⎢
∂
⎛ ⎜⎝
∆A ⎞ ⎤
T
⎟⎠
⎥ ⎥
= − ∆U
⎢ ∂T ⎥
T 2 ⎢ ∂T ⎥
T2
⎢⎣
⎥⎦ p
⎢⎣
⎥⎦ p
7. 一些基本过程的 ∆S, ∆A, ∆G 的计算
⎞ ⎟
(3β
⎠
−1)
=
8τ
8. 压缩因子
Z = pVm = pV RT nRT
若 Z > 1 ,表明在同温同压下,实际气体的体积大于理想气体的体积,即实际气体难于 压缩。若 Z < 1 ,则情况相反。先求对比压力和对比温度,查压缩因子图得到压缩因子,
物理化学傅献彩(下册)第五版课后习题答案解析

专业技术资料整理分享
word格式可编辑专业技术资料整理分享物理化学傅献彩下册第五版课后习题答案第九章可逆电池的电动势及其应用word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享word格式可编辑专业技术资料整理分享欢迎您的光临word文档下载后可修改编辑
上海交通大学物理化学考研大纲

《物理化学(含实验)》考试大纲适用于报考上海交通大学化学类专业硕士研究生入学考试。
本《物理化学(含实验)》课程的主要内容包括化学热力学、化学动力学、电化学、界面化学与胶体化学和物理化学实验。
要求考生熟练掌握物理化学的基本概念、基本原理及计算方法,具有综合运用所学知识分析和解决实际问题的能力。
掌握基本实验原理和技能、数据处理和误差分析。
主要参考书《物理化学》(第五版),傅献彩、沈文霞、姚天扬等编,高等教育出版社,2005年。
《物理化学实验》(第三版),复旦大学等编,庄继华等修订,高等教育出版社,2004年。
主要题型题型有:填空题、简答题、计算题、综合题等。
基本要求一、热力学第一定律及其应用明确热力学的一些基本概念和功和热正负号的取号惯例。
明确准静态过程与可逆过程的意义。
掌握U及H都是状态函数以及状态函数的特性。
了解摩尔定压、定容热容的概念。
熟练应用热力学第一定律计算理想气体和实际气体在等温、等压、绝热等过程中的Q、W、ΔU和ΔH.熟练应用标准摩尔生成焓、标准摩尔燃烧焓计算不同温度下的化学反应热。
了解节流过程的特点及焦耳-汤姆逊系数的定义与实际应用。
从微观角度了解热力学第一定律的本质。
二、热力学第二定律明确热力学第二定律的意义。
理解克劳修斯不等式的重要性。
熟记热力学函数U、H、S、F、G的定义。
明确ΔG在特殊条件下的物理意义,熟练计算过程的ΔS、ΔF和ΔG 并用于判断变化的方向和限度。
熟练应用克拉贝龙方程式和克劳修斯-克拉贝龙方程式。
明确偏摩尔量和化学势的意义。
了解热力学第三定律的内容,明确规定熵及标准熵值的意义。
初步了解不可逆过程热力学关于熵流和熵产生等基本内容。
三、溶液-多组分体系热力学在溶液中的应用熟悉溶液浓度的各种表示法及其相互关系。
理解理想液态混合物、稀溶液与实际溶液三者的区别和联系。
掌握拉乌尔定律和亨利定律以及它们的应用。
理解理想体系(理想气体、理想液态混合物、理想稀溶液)中各组分化学势的表达式及其应用。
