3-氧化反应
三价砷的氧化数据

三价砷的氧化数据1. 介绍三价砷是一种常见的元素,具有广泛的应用和研究价值。
本文将探讨三价砷的氧化数据,包括其氧化态、氧化反应以及相关的实验数据等内容。
2. 三价砷的氧化态三价砷的氧化态一般为+3,即As(III)。
在这种氧化态下,三价砷的化学性质与其他氧化态有所不同,因此研究其氧化数据对于深入了解三价砷的性质具有重要意义。
3. 氧化反应三价砷可以通过氧化反应转化为其他氧化态。
以下是一些常见的三价砷氧化反应:3.1 氧气氧化三价砷可以与氧气发生氧化反应,生成五价砷(As(V))。
该反应可以用以下方程式表示:2As(III) + 3O2 → 2As(V) + 3O2-3.2 氧化剂氧化除了氧气,一些氧化剂也可以将三价砷氧化为五价砷。
常见的氧化剂包括过氧化氢、高锰酸钾等。
以下是一个过氧化氢氧化三价砷的反应方程式: 2As(III) + 3H2O2 → 2As(V) + 3H2O4. 实验数据研究三价砷的氧化数据需要进行实验来获取相关数据。
以下是一些相关实验数据的例子:4.1 氧化反应速率通过测量三价砷氧化反应的速率,可以获得其氧化动力学数据。
例如,可以使用紫外-可见光谱法跟踪三价砷氧化反应的进程,并根据反应速率得出相关数据。
4.2 氧化产物分析通过对氧化反应产物的分析,可以了解三价砷从三价到五价的转化过程。
例如,可以使用X射线吸收光谱(XAS)等方法对氧化产物进行表征和分析。
5. 结论三价砷的氧化数据对于研究其性质和应用具有重要意义。
通过实验可以获得相关数据,进一步深入了解三价砷的氧化反应和转化机制。
这些数据对于环境污染控制、药物研发等领域都具有重要的应用价值。
通过深入研究三价砷的氧化数据,可以为相关领域的进一步研究和应用提供重要参考依据。
参考文献1.Smith, J. D., & Johnson, T. M. (2018). Arsenic redox dynamics insoils: A review. Environmental pollution, 234, 181-194.2.Manning, B. A., & Fendorf, S. (2004). Reduction of arsenic(V) bydissimilatory iron(III) reducing bacteria. Geochimica etCosmochimica Acta, 68(11), 2467-2478.3.Oremland, R. S., & Stolz, J. F. (2005). Arsenic, microbes andcontaminated aquifers. Trends in microbiology, 13(2), 45-49.。
氧化反应方程式

氧化反应方程式
氧化反应方程式是描述物质在与氧气反应时发生氧化的化学方程式。
具体的反应方程式取决于反应物的种类和反应条件。
以下是一些常见物质的氧化反应方程式的示例:
1.金属的氧化反应方程式(生成金属氧化物):铁+ 氧气->
二氧化铁 4Fe + 3O2 -> 2Fe2O3
2.非金属物质的氧化反应方程式:硫 + 氧气 -> 二氧化硫 S +
O2 -> SO2
3.碳氢化合物的氧化反应方程式:甲烷 + 氧气 -> 二氧化碳 +
水 CH4 + 2O2 -> CO2 + 2H2O
4.无机化合物的氧化反应方程式:二氧化硫+ 氧气-> 三氧
化硫 SO2 + O2 -> SO3
请注意,这些方程式是示例。
氧化反应的方程式会根据具体的反应物和反应条件而有所不同。
此外,方程式中的系数应根据生成物的摩尔比例进行平衡,以确保质量守恒和电荷守恒。
3 氧化还原反应

整体配平:在同一个反应中有多种元素同时失去或获得电
子,则设法将同时得电子或失电子的看成一个整体来处理。 该整体位于方程式的哪一侧,则从哪一侧着手配平。
+1 -2 +5 +2 +6 +2
例: Cu2S+ HNO3— Cu(NO3)2+ H2SO4+
(1×2+8)×3 3×10
NO+ H2O
【真题展现】 信息型氧化还原反应方程式的书写
的浓盐酸反应。
(3) 溶液的酸碱度:一般在酸性环境下,氧化剂的氧化性
较强,如KClO3在酸性条件下能将Cl-氧化成Cl2,在中性
条件下不能氧化Cl-。
6. 根据电化学原理判断: (1) 原电池:两种不同的金属构成原电池的两极(稀硫酸、 稀盐酸等非氧化性酸作电解质),还原性:负极金属>正极
金属。
(2) 电解池:氧化性强的金属阳离子优先在阴极放电,还
MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O
口诀:
还原剂 氧化剂 失(电子) 得(电子) 高(化合价升高) 氧(被氧化) 低(化合价降低) 还(被还原)
2. 氧化还原反应中电子转移的表示方法 (1)双线桥法
失去2e-×2 -2 +4 0
2Na2S+Na2SO3+3H2SO4=3S↓+3Na2SO4+3H2O
FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能
发生的是( A )
A.3Cl2+6FeI2=2FeCl3+4FeI3
B.Cl2+FeI2=FeCl2+I2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
50个氧化还原反应方程式

50个氧化还原反应方程式本文将为您呈现50个氧化还原反应方程式,并对每个反应进行详细解释。
氧化还原反应是化学中最重要的类型之一,在这些反应中,电子的转移导致物质的氧化和还原。
这些反应在生活中随处可见,从燃烧到电池都离不开氧化还原反应的参与。
请阅读以下内容,了解更多关于氧化还原反应的知识。
1. 单质的氧化1.氢气(H2)与氧气(O2)生成水(H2O):2H2+O2→2H2O解释:在这个反应中,氢发生了氧化,由0价变为+1价;而氧发生了还原,由0价变为-2价。
2. 单质的还原2.氯气(Cl2)与钾(K)生成钾氯化合物(KCl):Cl2+2K→2KCl解释:在这个反应中,氯发生了还原,由0价变为-1价;而钾发生了氧化,由0价变为+1价。
3. 非金属元素的氧化3.硫(S)与氧气(O2)生成二氧化硫(SO2):S+O2→SO2解释:在这个反应中,硫发生了氧化,由0价变为+4价;而氧发生了还原,由0价变为-2价。
4. 非金属元素的还原4.氢气(H2)与氟气(F2)生成氢氟酸(HF):H2+F2→2HF解释:在这个反应中,氢发生了还原,由0价变为+1价;而氟发生了氧化,由0价变为-1价。
5. 金属的氧化5.铁(Fe)与氧气(O2)生成铁(III) 氧化物(Fe2O3):4Fe+3O2→2Fe2O3解释:在这个反应中,铁发生了氧化,由0价变为+3价;而氧发生了还原,由0价变为-2价。
6. 金属的还原6.铜(II) 氯酸盐(CuCl2)与锌(Zn)生成铜和锌(II) 氯酸盐(ZnCl2):Zn+CuCl2→ZnCl2+Cu解释:在这个反应中,锌发生了还原,由0价变为+2价;而铜发生了氧化,由+2价变为0价。
7. 氧化物的分解7.二氧化二氮(N2O4)分解成二氧化氮(NO2):N2O4→2NO2解释:在这个反应中,二氧化二氮发生了分解,产物是两个氮原子的含有不同电荷的离子。
8. 氢化物的分解8.氯化铝(AlCl3)与水(H2O)分解成盐酸(HCl)和三氯化铝(AlCl3):AlCl3+H2O→HCl+Al(OH)3解释:在这个反应中,水发生了分解,产生了酸和碱。
水环境化学3---氧化还原反应(11.18)

铁体系的pe-pH图 铁体系的pe-pH图 pe
(s)与 (s)的边界 (5)Fe(OH)2(s)与Fe(OH)3(s)的边界
Fe(OH)3(s)+ 3H+ = Fe3+ + 3H2O K1 Fe(OH)2(s)+ 2H+ = Fe2+ + 2H2O K2 K1 = 9.1×103; K2 = 8.0×1012 pe = 13.05 - lg[Fe2+]/[Fe3+] = 13.05 - lgK2[H+]2 / K1[H+]3 pe = 4.1 - pH
问题: 问题: 近年来,水化学中为何不用E而常用 pe表示氧化还原电位?
解释
(a) pe有明确的物理意义, pe= -lg[e]表示电子 的相对活度。
(b) pe每变化一个单位,[Red]/[Ox]变化10倍 便于比较。 (n=1时) (c) pe把数据拉开了便于比较。
Pe与△G 的关系 与
标准态: △G0=-nFE0 △G0=-2.303nRTpe0 任意态: △G=-nFE △G=-2.303nRTpe ( E0=2.303RT/F · pe0 E=2.303RT/F · pe)
问题:
水中主要还原剂为? 主要氧化剂为?
天然水体的pe 天然水体的pe
水中物质存在的形态
还原态 CH4 H2S Fe2+ S NH4+ NO2- ,有机物等; 氧化态 CO2 Fe(OH)3 SO42- O2 NO3- 等;
天然水体的pe 天然水体的pe
(一)决定电位
若某个单体系的含量比其它体系高得多,则此 时该单体系电位几乎等于混合复杂体系的pe, 称决定电位。 一般情况下,天然水中溶解氧 溶解氧是决定电位,有 溶解氧 机物积累的厌氧环境中,有机物 有机物是决定电位。 有机物
3氧化还原反应、氧化剂、还原剂、氧化产物、还原产物
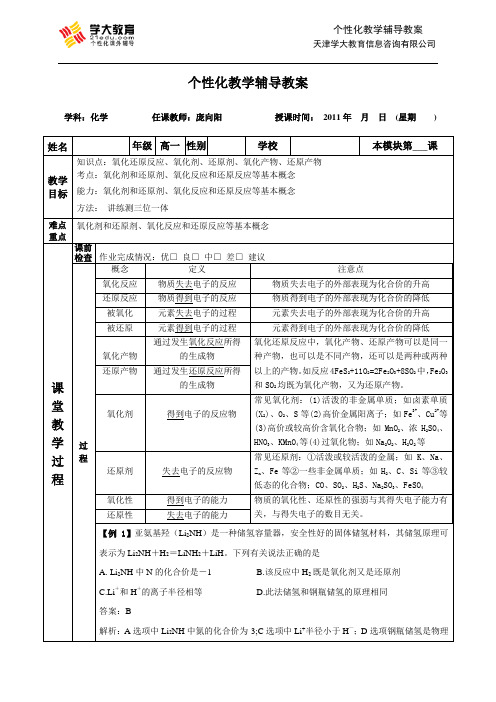
个性化教学辅导教案学科:化学任课教师:庞向阳授课时间:2011年月日(星期) 姓名年级高一性别学校本模块第___课教学目标知识点:氧化还原反应、氧化剂、还原剂、氧化产物、还原产物考点:氧化剂和还原剂、氧化反应和还原反应等基本概念能力:氧化剂和还原剂、氧化反应和还原反应等基本概念方法:讲练测三位一体难点重点氧化剂和还原剂、氧化反应和还原反应等基本概念课堂教学过程课前检查作业完成情况:优□良□中□差□建议__________________________________________过程概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低氧化产物通过发生氧化反应所得的生成物氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。
如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。
还原产物通过发生还原反应所得的生成物氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K、Na、Z n、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4氧化性得到电子的能力物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。
还原性失去电子的能力【例1】亚氨基羟(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。
2023新高考化学总复习知识清单 04 氧化还原反应(通用版)

①电子流出的电极是负极,阳离子移向的电极是正极
②被溶解(质量减小)的电极一般是负极
③质量增加的电极一般是正极
④有气泡产生的电极一般是正极
(2)特殊情况
①强碱性溶液中,Mg-NaOH溶液-Al原电池中,Al是负极
②氧化性溶液中,Cu-浓硝酸-Fe原电池中,Cu是负极
③铅蓄电池,负极质量增加,正极质量增加
(1)比较反应物和生成物的氧化性或还原性:强制弱原理
①氧化性:氧化剂>氧化产物
②还原性:还原剂>还原产物
(2)比较反应物的氧化性或还原性
①氧化性:氧化剂>还原剂
②还原性:还原剂>氧化剂
4.根据反应条件来判断
当不同的氧化剂(或还原剂)与同一还原剂(或氧化剂)反应时,反应越易进行,则对应的氧化剂(或还原剂)的氧化性(或还原性)越强,反之越弱。如:
(1)氧化性:所含元素的化合价降低
(2)还原性:所含元素的化合价升高
(3)酸或碱性:所含元素的化合价不变,有相应的盐生成
(4)具体反应分析
①Zn+2HCl ZnCl2+H2↑,盐酸表现酸性和氧化性
②CuO+2HCl CuCl2+H2O,盐酸表现酸性
③MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,盐酸表现酸性和还原性
(4)氧化前三种:Fe3+
9.强弱规律的两个应用
(1)氧化还原反应发生的先后顺序:强者优先
①向含多种还原剂的溶液中加入一种氧化剂时,还原性强的还原剂(离子)先被氧化
②向含多种氧化剂的溶液中,加入一种还原剂时,氧化性强的氧化剂(离子)先被还原
(2)判断氧化还原反应方向:强制弱原理
[北科大]无机化学实验:3 氧化还原反应(实验报告)
![[北科大]无机化学实验:3 氧化还原反应(实验报告)](https://img.taocdn.com/s3/m/c1e327df804d2b160a4ec049.png)
������⊝(02/H202)=0.68V,小于 MnO2 或 MnO4-,作氧化剂时相应电对的电极电势,则要发
生下列反应:
������������������2 + ������2������2 + ������+ → ������������2+ + ������2 ������������������4− + ������2������ + ������+ → ������������2+ + ������2 上述两个反应可以发生。把 H202 作氧化剂与作还原剂的两个反应合并成一个总反
发生。因为此时������ ⊝ ������������ >0,氧化剂、还原剂浓度或压力的改变不会改变������ ⊝ ������������ 的符 号。
2.H202 的氧化、还原性 H202 中氧的氧化值为-1,它既可作氧化剂,使氧化值降低为-2,生成 H20 或 OH-; 又可作还原剂,使氧化值升高为 0,生成 02。H202 在氧化还原反应中到底起氧化剂 还是还原剂作用,要根据另一个反应物而定。若另一反应物只能作还原剂,如 I-离 子,则 H202 在反应中起氧化剂作用。若另一个反应物只能作氧化剂,如 MnO4-离子, 则 H202 在反应中起还原剂作用。至于反应能否发生,可根据所在两个电对的电极 电势 E 判定。若另一个反应物既可作氧化剂也可作还原剂,如 Fe2+离子,那么可先 写出两个可能发生的反应方程式:
氧化还原反应的产物是由下列两方面决定的。
(1)电极电势 当反应的速率均很快时,由电极电势决定其产物。如 MnO4-在
酸性条件下被 H2SO4 还原,其还原产物由电极电势决定,锰在酸性介质中元素电势
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH2OAc HO C O OH OH
(90%)
F O
0度以下
F O
醋酸去炎松( 醋酸去炎松(Triamcinolne Acetonide) )
2.醇的氧化 醇的氧化
RCH2OH R CHOH R` R R` C OH R`` 不氧化 KMnO4 R C O R` 羧酸 ROOH
二氯铬酰
(一),铬酸 ),铬酸
氧化形式有: 氧化形式有 Na2Cr2O7-H2SO4-H2O ; CrO3-H2O-H2SO4 有时加入HAc 助铬酐解聚 有时加入 铬酸氧化剂显橘红色,氧化后变为 氧化后变为Cr 显绿色,由此控制反 铬酸氧化剂显橘红色 氧化后变为 3+显绿色 由此控制反 应,判断终点 判断终点 1,醇的氧化 1°, 2° 醇 ° ° 醛酮
KMno4,H (热或浓)
反应A介质,可用丙酮,中性水溶液,硫酸镁溶液, 反应A介质,可用丙酮,中性水溶液,硫酸镁溶液,乙醇溶液 以及碱性水溶液. Eg: 以及碱性水溶液. Eg:
7 OH 6 5 10 1 4 8 9 2 3 OH OH
KMnO4,H2O,HgSO4
OH
CH2OAc C O HO
2KMnO4 + H2O
2 MnO2
+ 2KOH + 3[O]
反应中常加中MgSO4,Al2(SO4)3和生成的碱KMnO4 KMnO4可氧化: 烯烃,醇,醛,酮,芳烃侧链及稠环的裂化氧化
1.烯烃的氧化 烯烃的氧化
烯烃 R R` C C R`` H
KMnO4 (冷或热)
C
C
(可用于药物合Leabharlann 中)OH OH R R` O C O + R`` C OH
CrO3,Py rt
CH CH CHO (81%)
C 3. 羰基 ,分子内同时存在的对羧敏感的基团 环氧基等)无影响. (环氧基等)无影响.
O C CH3
O C CH3
CrO3Py HO O O O
4.羟基经缩醛保护后在氧化过程中不受影响 4.羟基经缩醛保护后在氧化过程中不受影响
HO HO HO
2 H2C CH2 + O2
CH3OH + O2
活性银 加热
2 H2C CH2 O
活性银 加热
HCOOH + H2O
还原: 还原:
RCH CHR + R3P O
H2C CH2 + H2 Cat 加热
RCH CHR + R3PO
CH3CH3
二, 氧化反应类型
化学氧化反应: 在化学氧化剂的直接作用完成的氧化反应. 化学氧化反应: 在化学氧化剂的直接作用完成的氧化反应. 化学氧化剂: 化学氧化剂: 无机氧化剂 (KMnO4,K2Cr2O7,H2O2等) 有机氧化剂(异丙醇铝,四醋酸铝,过酸等) 有机氧化剂(异丙醇铝,四醋酸铝,过酸等) 催化氧化: 催化氧化: 反应. 反应. 生物氧化; 生物氧化; 在微生物作用下进行的氧化反应 在催化剂存在下, 在催化剂存在下,使用空气或氧气实现的氧化
2,醛的氧化 ,
醛易被铬酸氧化为RCOOH ,一般不作为合成方法 一般不作为合成方法, 醛易被铬酸氧化为RCOOH ,一般不作为合成方法, 仅用于少数制备. Eg: 仅用于少数制备. Eg:
Na2Cr2O7,H2SO4,H2O O CHO 100度 O COOH (75%)
CH3 CH CH2 CH3 CHCHO CH3
KMnO4,H2O 70-90度 HCl
N
CH3
N COOH 局麻药甲呱卡因( 局麻药甲呱卡因(Mepiracaine)中间体 )
若分子内含有酚羧基和氨基,不能采用KMnO4 若分子内含有酚羧基和氨基,不能采用KMnO4 基团易于氧化
氧化, 氧化,因为这些
5.稠环化合物的氧化 稠环化合物的氧化
氧化, 稠环化合物经 KMnO4氧化,部分芳环开环
(二),二氧化锰 二,
二.铬化合物
两种形式:重铬酸盐和三氧化铬(铬解) 两种形式:重铬酸盐和三氧化铬(铬解) (Na2Cr2O7 氧化反应: 氧化反应: 在水中溶解度比K 较常用) 在水中溶解度比K2Cr2O7 大,较常用)
Na2Cr2O7 + 4H2SO4
Na2SO4 + Cr2(SO4)3 + 4H2O + 3[O]
O
O CH3
O
O O
O CH3
(CrO3)n + CH3 C O C
CH3 C O Cr O C
铬酰醋酐
O (CrO3)n + 3(CH3)COH C(CH3)3 O Cr O C(CH3)3 O
叔丁基铬酸酯
O (CrO3)n + N N Cr O O
三氧化铬吡啶络合物
O (CrO3)n + HCl Cl Cr Cl O
O
KMnO4,H
CH2COOH CH2CH2COOH
4.芳烃 芳烃
芳烃侧链无论链多长,只要有a-H 存在,氧化后得到苯甲酸类 芳烃侧链无论链多长,只要有a 存在, 化合物, Eg: 化合物,药物合成中常用 Eg:
Cl Cl CH3
KMnO4,Py 70度,5h HCl
Cl
COOH
Cl 抗疟疾药米帕林( 抗疟疾药米帕林(Mepacrime)中间体 )
COOH
若芳烃上有 —OH 或—NH2 ,须加保护,否则会氧 OH NH 须加保护, 化为醌类. Eg: 化为醌类. Eg:
NH2 CH3 Na2Cr2O7,H2SO4,H2O O O CH3
若环上存在两个- 若环上存在两个-OH 更容易氧化
CH3 NH2.HCl CH3
或-NH2
,则芳环比侧链
CH3 O CH3 O
CH3 TsOH,CH3CHO
H3C O
O
CH3 CrO3,Py OH2
H 3C O
O
CH3
HO
O
O
TS:对甲苯磺酸酰基 :
CH3
S O O
TSOH:对甲苯磺酸
CH3
S OH O
CH3 N KMnO4,H2O 80-90度 HCl
COOH (81-91%) N (维生素类药烟酸Nicotinic Acid)
第二节
一 , 锰化合物
(一),(KMnO4)高锰酸盐
常用无机氧化剂
一类强氧化剂;常用KMnO4,氧化范围广泛,且可在酸性,碱 性,及中性介质中作用,介质不同,氧化能力不同,以酸性条件 下氧化能力最强.KMnO4的氧化反应常在碱性或中性条 件下进行(因酸性介质中,可选用MnO2,或KCr2O7,反应易控 制,而且更经济),反应为:
CH3CH2COOH CH2CH3
抗菌药羧苄青霉素 (Carbenicillin)中间体 )
仲醇氧化成羧酸产物复杂,无合成价值. 仲醇氧化成羧酸产物复杂,无合成价值.只有当氧化产物 酮的羰基α-C上无H Eg: 酮的羰基 C上无H时,才可得高收率酮 Eg:
O CH OH N
KMnO4
C
N
4-吡啶基苯基甲醇 吡啶基苯基甲醇
O
KMnO4,H2O
C COOH COOH
邻羧基苯乙酮酸
NO2
KMnO4,H2O
NO2 COOH COOH
密度比较高的环上) (氧化发生在e密度比较高的环上) 氧化发生在 密度比较高的环上
Ph
KMnO4,NaOH
Ph COOH
N
N
COOH
N
KMnO4,H2O
N N
COOH COOH
N
以上两个反应中杂环稳定
1.苄醇的- OH氧化为醛基 1.苄醇的-CH2OH氧化为醛基 苄醇的
CH2OH CrO3,Py CHO (63%)
不饱和醇及烯位亚甲基氧化为RCHO 或酮, 2. β,α –不饱和醇及烯位亚甲基氧化为RCHO 或酮, 不饱和醇及烯位亚甲基氧化为 双键不受影响
O CrO3,Py (60%)
CH CH CH2OH
琼斯试剂的特点:有选择性,反应缓和, 琼斯试剂的特点:有选择性,反应缓和,分子中的
C C
C
C
不受影响,反应迅速,收率好, 不受影响,反应迅速,收率好,
eg: :
H3C H3C H3C CrO3,H2SO4,H2O,CH3COCH3 OH H3C (79%) O H3C H3C
COCH3
COCH3
CrO3,H2SO4,H2O,CH3COCH3 0-20度 HO O (89%)
Na2Cr2O7,H2SO4 NH2.HCl CH3 30度
4,多环芳烃的氧化 ,
CrO3,HAc,H2O rt 过夜
O
NH2 Na2Cr2O7,H2SO4 H2O,40-45度
O
O
OH CrO3
O
O
O
三氧化铬—吡啶络合物 (二) 三氧化铬 吡啶络合物
沙瑞特(Sarret)试剂:1份CrO3 缓慢加入10份吡啶中(次序不 能颠倒,否则引起燃烧),升温至30度,得黄色络合物. 康福思(Comforth) 改进方法: 先将CrO3 溶于水(1:1),逐渐 将CrO3 水溶液加至10分量的吡啶中,搅拌并冰冻冷却.(减少 了制备Sarret 试剂的潜在危险) 应用: 用于对酸敏感的底物的氧化,能将1度,2度 醇及烯丙 位亚甲基氧化为醛或酮,对分子 中存在的C = C , 缩醛,缩酮, 环氧基和硫醚无影响.
三氧化铬的制备: 三氧化铬的制备:
Na2Cr2O7 + H2SO4 Na2SO4 + 4H2O + CrO3
三氧化铬是一种多聚体溶于水
O (CrO3)n + nH2O n HO Cr O
