乙烯的性质及加成反应
乙烯

乙烯(不饱和烃)⑴ 分子结构特点分子式:C 2H 4 结构简式:CH 2=CH 2 结构式:⑵ 物理性质:无色、稍有气味的气体,标准状况下密度为1.25g·L -1,比空气略轻,难溶于水。
⑶ 化学性质:易氧化、易加成(加聚)、易分解 ① 氧化反应ⅰ与酸性高锰酸钾反应(特征反应)现象:酸性高锰酸钾溶液褪色。
(乙烯被酸性高锰酸钾氧化成CO 2)ⅱ 可燃性:现象:火焰明亮,伴有黑烟。
② 加成反应:CH 2=CH 2+Br 2CH 2Br ―CH 2Br (1,2—二溴乙烷)加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应。
被加成的试剂如:H 2、X 2(X 为Cl 、Br 或I)、H 2O 、HX 、HCN 等能离解成一价原子或原子团的物质。
通过有机物发生加成反应时反应物之间的量关系,还可定量判断该有机物分子结构中不饱和键的情况:是C =C 键,还是C≡C 键,或是苯环结构,以及它们的个数。
能与Cl 2、H 2 、HX 、H 2O 的加成:CH 2=CH 2+Cl 2CH 2Cl ―CH 2Cl③ 加聚反应CH 2=CH 2+CH 2=CH 2+CH 2=CH 2+···催化剂[―CH 2―CH 2―+―CH 2―CH 2―+―CH 2―CH 2―+···]→[―CH 2―CH 2―CH 2―CH 2―CH 2―CH 2―···]→ⅰ 加聚反应:在聚合反应中,由不饱和(即含碳碳双键或三键)的相对分子质量小的化合物分子通过加成聚合的形式结合成相对分子质量很大的高分子化合物的反应。
ⅱ 聚合反应:相对分子质量小的化合物分子互相结合成相对分子质量很大的高分子化合物的反应。
ⅲ 高分子化合物:相对分子质量很大(1万以上)的物质,简称高分子或高聚物。
聚乙烯,塑料,分子量达几万到几十万,性质坚韧,化学性质稳定,难降解。
乙烯和氢气加成反应条件

乙烯和氢气加成反应条件乙烯和氢气加成反应是一种重要的化学反应,用于生产乙烯的重要原料乙烷。
下面将介绍乙烯和氢气加成反应的条件。
1. 反应物:乙烯(化学式C2H4)和氢气(化学式H2)是乙烯和氢气加成反应的两种重要反应物。
乙烯是一种带有双键的不饱和碳氢化合物,是乙烷的同分异构体。
氢气是一种常见的气体,在化学反应中常用作还原剂。
2. 催化剂:在乙烯和氢气加成反应中,通常需要使用催化剂来促进反应的进行。
常用的催化剂包括铂(Pt)、钯(Pd)、镍(Ni)等。
这些催化剂能够降低乙烯和氢气之间的活化能,提高反应速率。
3. 温度:温度是乙烯和氢气加成反应的一个重要条件。
一般来说,较高的反应温度可以提高反应速率,但是过高的温度可能导致副反应的发生。
乙烯和氢气加成反应的适宜温度范围一般在100-200摄氏度之间。
4. 压力:压力是乙烯和氢气加成反应的另一个关键条件。
在反应过程中,较高的压力可以增加气相的反应物的浓度,从而促进反应的进行。
一般来说,在反应开始时,可以使用较高的压力,然后随着反应的进行逐渐减小压力。
5. 反应时间:乙烯和氢气加成反应的反应时间取决于反应条件和所需的产物。
一般来说,较高的温度和压力可以缩短反应时间,但需要控制反应时间,以获得所需的产物。
6. 反应器:乙烯和氢气加成反应可以在不同类型的反应器中进行,包括批量反应器、连续流动反应器等。
反应器的选择取决于反应条件和需求。
综上所述,乙烯和氢气加成反应的条件包括乙烯和氢气作为反应物、适当的催化剂、适宜的温度和压力、适当的反应时间和适当的反应器。
这些条件的选择将直接影响到乙烯和氢气加成反应的效率和产物的选择。
因此,在实际生产过程中,需要仔细控制这些条件,以获得理想的反应结果。
乙烯的性质

从乙烯的结构式可以看出,乙烯分子里含有C=C双键,链烃分子里含有碳碳双键的不饱和烃叫做烯烃。
乙烯是分子组成最简单的烯烃。
乙烯分子的空间构型为了更简单形象地描述乙烯分子的结构,我们常用分子模型来表示(如下图)。
在下图中,I 的球棍模型里,两个碳原子间用两根可以弯曲的弹性短棍来连接,用它们来表示双键。
在下图中,II 是乙烯分子的比例模型。
乙烯分子的模型实验表明,乙烯分子里的C=C双键的键长是 1.33×10-10m,乙烯分子里的两个碳原子和四个氢原子都处在同一平面上。
它们彼此之间的键角约为120°。
乙烯双键的键能是615kJ/mol,实验测得乙烷C-C单键的键长是1.54×10-10m,键能是348kJ/mol。
这表明C=C双键的键能并不是C-C单键键能的两倍,而是比两倍略少。
因此,只需要较少的能量,就能使双键里的一个键断裂。
这从下面介绍的乙烯的化学性质是可以得到证实。
制取乙烯的原理工业上所用的乙烯,主要是从石油炼制工厂和石油化工厂所生产的气体里分离出来的。
实验室里是把酒精和浓硫酸混合加热,使酒精分解制得。
浓硫酸在反应过程里起催化剂和脱水剂的作用。
制取乙烯的反应属于液——液加热型乙烯能使酸性KMnO4溶液很快褪色,这是乙烯被高锰酸钾氧化的结果,而甲烷等烷烃却没有这种性质。
乙烯的化学性质——加成反应把乙烯通入盛溴水的试管里,可以观察到溴水的红棕色很快消失。
乙烯能跟溴水里的溴起反应,生成无色的1,2-二溴乙烷(CH2Br-CH2Br)液体。
这个反应的实质是乙烯分子里的双键里的一个键易于断裂,两个溴原子分别加在两个价键不饱和的碳原子上,生成了二溴乙烷。
这种有机物分子里不饱和碳原子跟其它原子或原子团直接结合生成别的物质的反应叫做加成反应。
乙烯还能跟氢气、氯气、卤化氢以及水等在适宜的反应条件下起加成反应。
乙烯的化学性质——氧化反应点燃纯净的乙烯,它能在空气里燃烧,有明亮的火焰,同时发出黑烟。
乙烯、苯的理化性质

乙烯的性质一、物理性质通常情况下,乙烯是一种无色稍有气味的气体,密度为1.25g/L,比空气的密度略小,难溶于水,易溶于四氯化碳等有机溶剂。
世界上已将乙烯产量作为衡量一个国家石油化工发展水平的重要标志之一。
二、化学性质①常温下极易被氧化剂氧化。
如将乙烯通入酸性KMnO4溶液,溶液的紫色褪去,乙烯被氧化为二氧化碳,由此可用鉴别乙烯。
②易燃烧,并放出热量,燃烧时火焰明亮,并产生黑烟。
CH2═CH2+3O2→2CO2+2H2O③烯烃臭氧化:CH2=CH2+O3,在锌保护下水解→2HCHO2CH2=CH2+O2—Ag、加热,酸性水解→2CH3—CHO加成反应:CH2═CH2+Br2→CH2Br—CH2Br(常温下使溴水褪色)CH2═CH2+HCl—催化剂、加热→CH3—CH2Cl(制氯乙烷)CH2═CH2+水—催化剂、170℃→CH3CH2OH(制酒精)CH2═CH2+H2—Ni或Pd,加热→CH3CH3CH2═CH2+Cl2→CH2Cl—CH2Cl加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
加聚反应:nCH2═CH2→-(CH2—CH2)- n (制聚乙烯)三、制取酒精硫酸一比三,催化脱水是硫酸。
温度速至一百七,不生乙醚生乙烯。
反应液体呈黑色,酒精炭化硫酸致。
为防暴沸加碎瓷,排水方法集乙烯。
苯的性质一、物理性质常温下为一种无色、有甜味的透明液体,并具有强烈的芳香气味。
苯可燃,有毒,也是一种致癌物质。
苯是一种碳氢化合物也是最简单的芳烃。
它难溶于水,易溶于有机溶剂,本身也可作为有机溶剂。
苯是一种石油化工基本原料。
结构平面正六边形。
溶解性:不溶于水,可与乙醇、乙醚、乙酸、汽油、丙酮、四氯化碳和二硫化碳等有机溶剂互溶。
二、化学性质苯参加的化学反应大致有3种:一种是其他基团和苯环上的氢原子之间发生的取代反应;一种是发生在苯环上的加成反应(注:苯环无碳碳双键,而是一种介于单键与双键的独特的键);一种是普遍的燃烧(氧化反应)(不能使酸性高锰酸钾褪色)。
高中化学人教版 必修第2册第七章 第二节 乙烯与有机高分子材料牛老师

第二节 乙烯与有机高分子材料人非圣贤,孰能无过?过而能改,善莫大焉。
《左传》大地二中 张清泉第1课时 乙烯[核心素养发展目标] 1.掌握乙烯的组成及结构特点,体会结构决定性质的观念,增强“宏观辨识与微观探析”的能力。
2.掌握乙烯的化学性质,认识加成反应的特点,培养“证据推理与模型认知”能力。
3.了解乙烯在生产及生活中的应用,培养“科学态度与社会责任”。
(一)乙烯的分子组成与结构(二)乙烯的性质1.乙烯的物理性质2.乙烯的化学性质(1)氧化反应①燃烧:现象:火焰明亮,伴有黑烟。
化学方程式:C2H4+3O2――→点燃2CO2+2H2O 。
②和酸性KMnO4溶液反应现象:酸性KMnO4溶液褪色。
结论:乙烯能被酸性KMnO4溶液氧化。
(2)加成反应①将乙烯通入溴的四氯化碳溶液中现象:溴的四氯化碳溶液褪色。
化学方程式:。
②加成反应定义:有机物分子中的不饱和碳原子与其他原子或原子团直接结合生新的化合物的反应。
书写下列加成反应的化学方程式:(3)聚合反应①定义:由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应。
②乙烯自身加成生成聚乙烯的方程式:该反应是聚合反应,同时也是加成反应,这样的反应又被称为加成聚合反应,简称加反应。
其中,—CH2—CH2—称为链节,n称为聚合度,小分子乙烯称为聚乙烯的单体。
(三)乙烯的用途1.乙烯是重要的化工原料,在一定条件下用来制聚乙烯塑料、聚乙烯纤维、乙醇等。
乙烯的产量可以用来衡量一个国家的石油化工发展水平。
2.在业生产中用作植物生长调节剂。
(1)乙烯的结构简式可书写为CH2CH2( ×)提示乙烯分子中含有,在书写时,官能团不能省略,应为CH2==CH2。
(2)乙烯是一种无色无味,易溶于水的气体( ×)提示乙是一种稍有气味,难溶水的气体。
(3)乙的化学性质比乙烷活泼( √)(4)乙烯能使酸性KMnO4溶液和溴水褪色,反应原理相同( × )提示 乙烯使酸性KMnO4溶液褪色发生的是氧化反应,乙烯使溴水褪色发生的为加成反应。
乙烯加成反应的教案

乙烯加成反应的教案篇一:乙烯的教案第二节乙烯一、教学设计1、知道乙烯分子的组成和结构特点2、掌握乙烯的典型化学性质,掌握加成反应3、了解乙烯的用途二、教学重、难点重点:乙烯的化学性质难点:乙烯的分子结构和加成反应三、教学过程【导入新课】我们常说煤是工业的粮食,石油是工业的血液,从煤和石油不仅可以得到多种常用燃料,而且可以从中获取大量的基本化工原料。
那么从煤和石油中都能获得哪些重要的化工原料呢?【板书】第二节来自石油和煤的两种基本化工原料――乙烯【过渡】到底乙烯是怎样的物质呢?能否从石油中得到乙烯?从石油分馏中得到的石蜡油进一步加热会得到什么呢?【探究实验】投影教材P67石蜡油的分解实验,将分解产生的气体通入溴水、高锰酸钾溶液、并点燃气体,分别观察现象。
【观察与思考】观看视频并思考:1、实验中看到哪些现象?2、石蜡油分解实验中生成的物质与甲烷的性质比较有什么异同?3、由以上实验我们可以得出什么结论?【归纳】石蜡油分解得到的产物中含有与烷烃性质不同的烃——烯烃【学与问】投影乙烯的球棍模型和比例模型,写出乙烯分子的电子式和结构式和结构简式。
【板书】一、乙烯的分子组成和结构分子式:C2H4,电子式:结构式:结构简式:CH2=CH2【思考与交流】乙烯分子的空间结构有什么特点?学生讨论后回答,由教师补充【归纳】乙烯分子的空间结构的特点:1、碳原子之间以双键结合,其中一根键不稳定。
2、原子之间的夹角均为120°。
3、乙烯分子为平面型结构,所有原子都在同一平面内。
【板书】乙烯分子的空间结构的特点:平面型结构,所有原子都在同一平面内。
【教师】乙烯有哪些物理性质呢?【投影】乙烯的物理性质:无色,稍有气味的气体,难溶于水(排水法收集)【板书】二、乙烯的物理性质【过渡】由于乙烯分子中存在碳碳双键,所以乙烯表现出较活泼的化学性质。
那么乙烯都能发生哪些反应呢?【讲解】在探究实验中体现了乙烯的氧化反应【板书】三、化学性质1、氧化反应:(1)乙烯使酸性高锰酸钾溶液褪色(2)燃烧:C2H4+3O22CO2+2H2O现象:明亮的火焰并伴有黑烟,同时放出大量的热。
21 乙烯
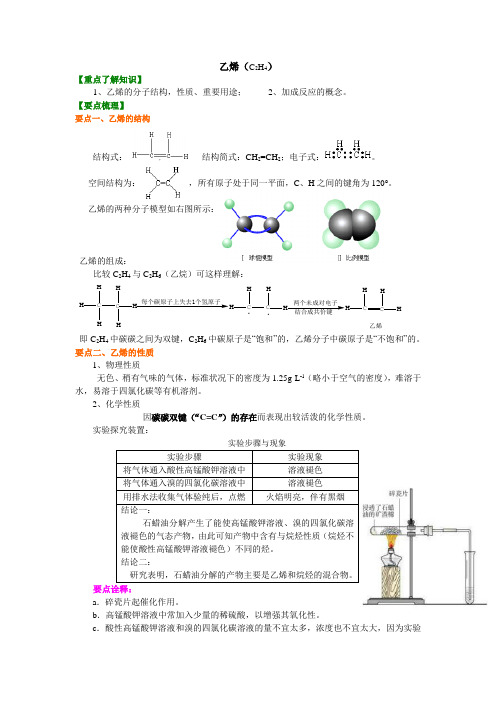
乙烯(C 2H 4)【重点了解知识】1、乙烯的分子结构,性质、重要用途;2、加成反应的概念。
【要点梳理】要点一、乙烯的结构结构式: , 结构简式:CH 2=CH 2;电子式:。
空间结构为: ,所有原子处于同一平面,C 、H 之间的键角为120°。
乙烯的两种分子模型如右图所示:乙烯的组成:比较C 2H 4与C 2H 6(乙烷)可这样理解:C HH HC HH H每个碳原子上失去1个氢原子HH CH .两个未成对电子CHHC HH 乙烯.即C 2H 4中碳碳之间为双键,C 2H 6中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
要点二、乙烯的性质 1、物理性质无色、稍有气味的气体,标准状况下的密度为1.25g·L -1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
2、化学性质因碳碳双键(“C=C ”)的存在而表现出较活泼的化学性质。
实验探究装置:实验步骤与现象要点诠释:a .碎瓷片起催化作用。
b .高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c .酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
d .酸性高锰酸钾、溴的四氯化碳溶液能检验乙烯等不饱和烃。
(1)氧化反应①乙烯被酸性高锰酸钾溶液氧化——使酸性高锰酸钾溶液褪色启示:利用此性质可鉴别CH 4和C 2H 4,但不能除去CH 4中的C 2H 4,原因是:5CH 2=CH 2+12KMnO 4+18H 2SO 410CO 2↑+6K 2SO 4+12MnSO 4+28H 2O 产物中有CO 2↑,仍混在甲烷中,达不到除杂的目的。
②乙烯的燃烧在空气中燃烧,现象:火焰明亮并伴有黑烟,同时放出大量的热。
C 2H 4 + 3O22CO 2 +2H 2O重点提示:a . 产生黑烟:乙烯分子中含碳量较高,燃烧时部分碳并没有完全被氧化,而导致多余的碳析出。
以黑烟的形式冒出。
碳粒本身被烧成炽热的状态,所以乙烯的火焰很明亮,没有被氧化的碳呈游离态 b .乙烯属于易燃易爆的气体,点燃前一定要先验纯。
乙烯----烯烃

5.加热乙醇和浓硫酸混合物170℃,把生成气体通入溴 水中,反应后得到一种无色液体。提纯后,测得该液体 物质的分子量为188,并测得该液体物质含碳12.85%、 氢2.15%、溴85%。求: (1)该液体物质的分子式 (2)写出符合这个分子式可能有的同分异构体 (3)从上述反应确定该液体物质的结构式和名称。
2.要除去甲烷气体中混有的少量乙烯和水蒸气, 先通过______________、再通过______。 3.试用两种不同的方法鉴别甲烷和乙烯,
(1)________________________________ (2)________________________________
四、写出下列各步反应化学方程式并注明反应条件
..
..
H. . C
..
H
六个原子处于同一平面上 含有极性键、非极性键的 非极性分子
不饱和烃
分子里含有碳碳双键或碳碳三键, 碳原子所结合的氢原子数少于饱和链烃的 氢原子数,这样的烃叫做不饱和烃。
二、乙烯的物理性质
1、无色、稍有气味的气体。
2、在标准状况时的密度为1.25克/升, 比空气略小。
3、难溶于水
单烯烃(含一个C=C双键不饱和烃) 分类
二烯烃(含二个C=C双键不饱和烃)
二、通式:
单烯烃 二烯烃
CnH2n CnH2n-2
三、同分异构体
C-C-C=C
位置异构
1-丁烯
碳干异构
C-C=C-C
2-丁烯
类别异构
C4H8
C=C-C
︱
C
2-甲基丙烯
碳干异构
C-C
︱︱
C-C 环丁烷
C C-C-C 甲基环丙烷
聚乙烯的形成.swf
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
已知:乙烯分子内碳碳双键的键能为612KJ/mol 乙烷分子中碳碳单键的键能为384KJ/mol
你能得到什么结论?
结论:碳碳双键不是由两个碳碳单键构成,可以理解为1个 稳定的键和1个活泼的键。所以,乙烯的化学性质比较活泼
精品课件
1、乙烯的氧化反应
⑴、燃烧
乙烯在空气中燃烧,火焰明亮且伴有黑烟。
精品课件
一、乙烯性质
1、氧化反应 (1)燃烧(2)能被KMnO4/H+氧化
2、加成反应 与Br2单质、 H2 、 H2O 、卤化氢
精品课件
• D.乙烯分子为“平面形”结构,乙烷分子为立 体结构
精品课件
1、CH4中混有C2H4, 欲除去C2H4得到干燥的CH4, 最好
依次通过哪一组试剂 ( C )
A. 澄清石灰水、浓硫酸 B. KMnO4酸性溶液、浓硫酸 C. Br2水、浓硫酸 D. 浓硫酸、KMnO4酸性溶液
精品课件
1、关于乙烯分子结构的说法中,错误的是( C ) A.乙烯分子里含有碳碳双键; B.乙烯分子里所有的原子共平面; C.乙烯分子中C=C双键的键能是乙烷分子中C- C单键的2倍。 D.乙烯分子里各共价键之间的夹角为120。
反应类型:
方法二:由CH乙2=烯=C制H备2+氯HC乙l→烷 CH3CH2Cl 加成反应
方程式:
精品课件
• 例1:下列关于乙烯和乙烷相比较的各说法中, 不正确的是( ) C
• A.乙烯能催熟果实,乙烷则不能
• B.乙烯能使高锰酸钾溶液褪色,乙烷则不能
• C.乙烯分子中碳碳双键的键能是乙烷分子中碳 碳单键的键能的两倍,因此乙烯比乙烷稳定
与溴水(或溴的四氯化碳 溶液作用) 现象:红棕色褪去
H HC
H
HH
C H + Br—Br
HC CH Br Br
1, 2 — 二溴乙烷 ,无色液 精品课体件
精品课件
我是 溴分子
精品课件
精品课件
精品课件
精品课件
精品课件
精品课件
反应实质:
C=C断开一个键, 2个Br分别直接与双键两 端的C结合
③
+H 2催 ―化 ―→ 剂 C H 3—C H 2—O H
④C H 3—C H 3+2C l2―光―照→C H 2C l—C H 2C l+2H C l
A.①② B.②③ C.①③ D.②④
精品课件
思考:要获得CH3CH2Cl有两种方法,
方法一:由乙烷制备氯乙烷
方程式:CH3C取H3代+C反l2应→光C照H3CH2Cl+HCl
工业上乙烯水化法制酒精的原理
精品课件
?:你能想出几种方法鉴别乙烯和甲烷
(1)分别点燃两种气体,燃烧时有黑 烟的是乙烯. (2)分别通入酸性高锰酸钾溶液中,能使溶 液褪色的是乙烯
(3)分别通入溴水中,能使溴水褪色的 是乙烯
精品课件
意义 归属 断键规律
产物特点
取代反应与加成反应的比较
பைடு நூலகம்取代反应
加成反应
精品课件
2、能用于鉴别甲烷和乙烯的试剂是 ( AB )
A.溴水
B.酸性高锰酸钾溶液
C.苛性钠溶液
D.四氯化碳溶液
精品课件
3、既要鉴别乙烷和乙烯,又要除去
乙烷中的乙烯, 下列试剂最好的
是( B
)
A.酸性高锰酸钾溶液
B.溴水
C.溴的CCl4溶液
D.NaOH的水精品溶课件液
思考:将乙烯分子中的一个氢原子换成甲 基,乙烯就变成了丙烯(CH3-CH=CH2),他至 少有几个原子共面,最多有几个原子共面?
加成反应:有机物分子中的双键(或三键)
两端的碳原子与其它原子或原子团 直接结合生成新的化合物的反应叫 做加成反应。
精品课件
练一练:
CH2=CH2
+
H—H
催化剂 △
CH3—CH3 (乙烷)
CH2=CH2
+ H—Cl
催化剂 △
CH3—CH2Cl(氯乙烷)
CH2=CH2 + H—OH
催化剂 △
CH3CH2—OH(乙醇)
有进有出,取而代之 有进无出,加之而成
烷烃的特征反应 烯烃的特征反应
C-H 断裂 多种产物,产物复 杂, 为混合物
C-C断裂 一种产物 产物较纯净
精品课件
6.下列各反应中属于加成反应的是
(C )
①C H 2===C H 2+ H—O H 一 ―定 ―― 条→ 件 C H 3C H 2O H
②H 2+C l2=光==照==2H C l
C2H4+3O2
点燃
2CO2+2H2O
思考:为何火焰颜色会明亮并伴有黑烟?
(产生黑烟是因为含碳量高,燃烧不充分)
精品课件
(2)与酸性KMnO4的作用: 将乙烯通入酸性KMnO4溶液中:
现象:紫色褪去
思考:我们可以用什么方法来鉴
别甲烷和乙烯呢?
注意:乙烯和酸性KMnO4反应会生
成CO2。
精品课件
2、加成反应
