怎样区分分子晶体与原子晶体
原子晶体和分子晶体的区别

原子晶体和分子晶体的区别
分子晶体和原子晶体的区别以及区分方法:原子晶体:相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体。
分子晶体:分子间通过分子间作用力(包括范德华力和氢键)构成的晶体。
原子晶体的构型是:原子、共价键、原子。
分子晶体的构型是:(原子、共价键、原子)、分子间作用力、(原子、共价键、原子)。
两个括号中为分子,也就是说原子晶体是原子直接由共价键相连组成的晶体。
分子晶体是原子先通过共价键组成分子,分子再通过分子间作用力(包括范德华力和氢键)组成晶体。
常见原子晶体有:金刚石、硅、碳化硅、氮化硅、氮化硼等。
常见分子晶体有:全部有机物(不包括有机物形成的盐)、双原子单质、双原子气体、无机酸等。
(立体图,好理解)分子晶体与原子晶体

例、如右图所示, 在石墨晶体的层 状结构中,每一 个最小的碳环完 全拥有碳原子数 2 为___,每个C 完全拥有C-C 数为___ 3
石墨中C-C夹 ☉ 角为120 , C-C键长为 1.42×10-10 m 层间距
3.35× 10-10 m
小结:金刚石、石墨的比较
项目 晶体形状 晶体中的键或作用力 由最少碳原子形成环的形状 与个数 碳原子成键数 键的平均数 金刚石 石墨
小结:
1、分子晶体:由分子构成。相邻分子靠分子间作用力 相互吸引。 2、分子晶体特点:低熔点、升华、硬度很小等。 3、常见分子晶体分类:(1)所有非金属氢化物 (2)部分非 金属单质, (3)部分非金属氧化物(4)几乎所有的酸(而碱 和盐则是离子晶体 (5)绝大多数有机物的晶体。 晶体分子结构特征
物质 熔点 沸点
干冰 很低 很低
金刚石 3550℃ 4827℃
二、原子晶体
1、定义:原子间以共价键相结合而形成的 空间网状结构的晶体。
2、构成微粒: 原子
3、微粒之间的作用:共价键 4、气化或熔化时破坏的作用力:共价键 5、物理性质: 熔沸点高,硬度大,难溶于一般溶剂。 (共价键键能越大,熔沸点越高,硬度越大)
(1)只有范德华力,无分子间氢键-分子密堆积(每 个分子周围有12个紧邻的分子,如:C60、干冰 、I2、O2 (2)有分子间氢键-不具有分子密堆积特征 (如:HF 、冰、NH3 )
1996年诺贝尔化学奖授予对发现C60有重大贡献的 三位科学家。C60分子是形如球状的多面体,分子 中每个碳原子只跟相邻的3个碳原子形成化学键; C60分子只含有五边形和六边形;碳与碳之间既有 单键又有双键,每个碳原子仍然满足四个价键饱 和;多面体的顶点数、面数和棱边数的关系,遵 循欧拉定理:顶点数+面数-棱边数=2。 请回答: (1)一个C60分子中有几个五边形和几个六边形? (2)一个C60分子中有多少个C=C? (3)已知C70分子的结构模型也遵循C60的那些规律, 请确定C70分子结构中上述几项参数。
离子晶体、分子晶体、原子晶体

2、物理特性:
(1)较低的熔点和沸点,易升华; (2)较小的硬度; (3)一般都是绝缘体,熔融状态也不导电。
原因:分子间作用力较弱
3、典型的分子晶体:
–非金属氢化物:H2O,H2S,NH3,CH4,HX –酸:H2SO4,HNO3,H3PO4 –部分非金属单质:X2,O2,H2, S8,P4, C60 –部分非金属氧化物: CO2, SO2, NO2, P4O6, P4O10 –大多数有机物:乙醇,冰醋酸,蔗糖
思考1 原子晶体的化学式是否可以代表其分子式?
不能。因为原子晶体是一个三维的网状结构,无 小分子存在。
思考2 以金刚石为例,说明原子晶体的微观结构与分 子晶体有哪些不同? (1)组成微粒不同,原子晶体中只存在原子,没有
分子。 (2)相互作用不同,原子晶体中存在的是共价键。
4、原子晶体熔、沸点比较规律
①二氧化硅中Si原子均以sp3杂化,分别 与4个O原子成键,每个O原子与2个Si原子 成键; ②晶体中的最小环为十二元环,其中有6 个Si原子和6个O原子,含有12个Si-O键; 每个Si原子被12个十二元环共有,每个O原 子被6个十二元环共有,每个Si-O键被6个 十二元环共有;每个十二元环所拥有的Si 原子数为6×1/12=1/2,拥有的O原子数为 6×1/6=1,拥有的Si-O键数为12×1/6=2, 则Si原子数与O原子数之比为1:2。
Na+
(1)NaCl的晶体结构
立方结构(基本结构单元是立方体)
晶胞:
讨论:
晶体中最小的重复单元
6 1、每个Na 离子周围有____个Cl-离子,每 个Cl- 离子周围有____个Na+ 离子。 6
+
2、每个Na+离子周围与Na+最近且等距离的 Na+有____个,每个Cl- 离子周围与Cl-最近且 12 12 等距离的Cl-有____个。
无机化学——原子晶体与分子晶体
B
B
C A
A
面心立方 紧密堆积
六方紧密堆积
Body-centered cubic cell (BCC)
体心立方紧密堆积 CN=12,利用率 =68% K、Rb、Cs、Li、 Na A B
A
体心立方 紧密堆积
7.4.2 金属键 金属键:金属原子的价电子可以完全失去成为自由电子,并在 晶格中运动,自由电子把金属阳离子胶合成金属晶体,这种胶 合作用就叫金属键。金属键无饱和性和方向性。
氯化氢、氨、三氯化磷、冰等由极性键构成的极性分子,晶体 中分子间存在色散力、取向力、诱导力,有的还有氢键,所以 它们的结点上的粒子间作用力大于分子量相近的非极性分子之 间的引力。
分子晶体的特性 分子晶体是以独立的分子出现的 ,化学式就是分子式。
分子晶体可以是非金属单质,如卤素、H2、N2、O2; 非金属化合物,如CO2、H2S、HCl、HN3等 绝大多数有机化合物,稀有气体的晶体
7.6.3 离子极化对物质性质的影响 一、离子的电子构型
外层电子结构 电子构型 阳离子实例
ns2np6
8
Na+, Mg2+,Al3+,Ti4+
ns2np6 nd1-9
9-17
Cr3+,Mn2+,Fe3+,Cu2+
ns2np6 nd10
18
Ag+,Zn2+,Cd2+,Hg2+
s2p6d10ns2
18+2
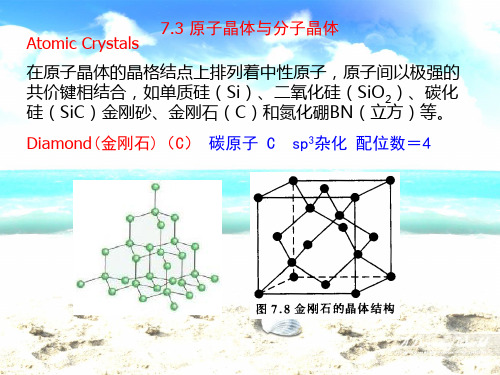
7.3 原子晶体与分子晶体 Atomic Crystals
在原子晶体的晶格结点上排列着中性原子,原子间以极强的 共价键相结合,如单质硅(Si)、二氧化硅(SiO2)、碳化 硅(SiC)金刚砂、金刚石(C)和氮化硼BN(立方)等。
分子晶体与原子晶体

一、分子晶体
回顾:分子间作用力(分子与分子之间的相互作用),存在于分子之间。
分子间作用力
范德华力 氢键
分子间作用力大小的影响因素:
①相对分子质量:同类型分子,相对分子质量越大, 分子间作用力越大。
②分子的极性:分子的极性影响分子间作用力,极性>非极性。
分子通常指的是小分子,不是指高分子。
• 典型的分子晶体:
对于组成和结构相似、晶体中又不含氢键的物质来说,相对分子质量增大, 分子间作用力增强,熔沸点升高。
对于分子间不含氢键的物质来说,由于分子间的作用力无方向性也使得分子 在堆积时会尽可能利用空间并采取紧密堆积方式,这一点与金属晶体和离子晶体 相似,分子的形状、极性以及氢键的存在都会影响分子的堆积方式。
思考与交流
小结:怎么比较晶体的熔点呢?
三、晶体熔、沸点的比较 (1)不同类型晶体熔、沸点的比较: ①不同类型晶体的熔、沸点高低的一般规律:
原__子__晶__体_____>_离__子__晶__体____>_分__子__晶__体____。 ②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点
很高,汞、铯等熔、沸点很低。
晶胞
金刚石中 每个C原子都以SP3杂化轨道与周围4个碳原子以共价键结合,构成正四面体。 C—C键间的夹角为109.5°。因为中心原子周围排列的原子的数目是有限的,所以这 种比较松散的排列与金属晶体和离子晶体中的紧密堆积排列有很大的不同。
(1)每个碳与①________以共价键结合,形成正四面体结构 (2)键角均为②________ (3)最小碳环由③____个C组成且六原子不在同一平面内 (4)每个C参与4条C—C键的形成,C原子数与C—C键之比为④______
阴离子,如金属晶体。 (4)易误认为金属晶体的熔点比分子晶体的熔点高,其实不一定,如Na
怎样区分原子 分子 离子的物质构成类型

怎样区分物质是由离子,原子还是分子构成的?
金属和非金属组成的物质一般是由离子构成的;金属单质是由原子构成的;由不同种非金属构成的物质中,酸是由分子构成的,还有一部分由原子构成的。
离子晶体,如金属和非金属或其他原子团、铵盐一般是离子构成的,大部分盐都是
原子晶体,如二氧化硅、氮化硅、金刚石、碳化硅、硅等由原子构成
分子晶体,如氯化铝(特殊)、非金属组成的(铵盐除外)大多数都是分子晶体
熔融状态下可导电的——由离子组成
水溶液状态下可导电,熔融状态下不导电的——由分子组成都不导电的——由原子组成
离子构成的(也叫离子化合物)有:NaCI、K2CO3、NaOH、NH4CI等,一般是含有金属阳离子(或NH4+)的化合物。
AICI3除外。
它们固体时都叫离子晶体。
分子构成的有:H2O、NH3〃H2O、CH4、CO2、HCI等,一般是除了离子化合物以外的化合物。
和H2、O2、He等大多数非金属单质。
它们固体时都叫分子晶体。
原子构成的有:SiO2、金刚石、SiC、AIN、Si3N4、BN等少数几个物质。
它们固体时都叫原子晶体。
分子晶体与原子晶体

1.晶体类型:原子晶体>分子晶体
2.常温下状态:固态>液态>气态 3.同一类型晶体:
同为原子晶体:原子半径↓,键长↓,键能↑, (共价键强弱) 共价键越稳定,熔沸点↑
a.组成、结构相似:相对分子质量↑,熔沸点↑
同为分子晶体:
(分子间作用力强弱)
b.不相似:分子极性↑,熔沸点↑ c.有氢键:熔沸点↑ d.同分异构体:支链↑,熔沸点↓
1:在SiO2晶体中每个硅原子周围紧邻的氧原 子有多少个?每个氧原子周围紧邻的硅原子有 多少个?在SiO2晶体中硅原子与氧原子个数之 比是多少? 4mol 2:1mol二氧化硅的晶体含几摩尔的Si-O键? 3:在二氧化硅的晶体结构中,最小的环由几个 原子构成? 12
2018年12月15日星期六8时3分4秒
分子的密堆积:
若分子间只存在范德华力,则每个分子周围 通常有12个紧邻的分子,分子晶体的这一特 征称为分子密堆积。
2018年12月15日星期六8时3分4秒
分子的非密堆积:
氢键具有方向性
冰中1个水分子周围有4个水分子
冰的结构
2018年12月15日星期六8时3分4秒
分子晶体结构特征
(1)密堆积
只有范德华力,无分子间氢键——分子 密堆积。这类晶体每个分子周围一般有12个 紧邻的分子,如:C60、干冰 、I2、O2。
B)
B.无色晶体,熔点3 550℃,不导电,质硬,难溶于水
和有机溶剂 C.无色晶体,能溶于水,质硬而脆,熔点为800℃, 熔化时能导电 D.熔点-56.6℃,微溶于水,硬度小,固态
1、依据结构—组成晶体的微粒和微粒间的作用力判断: 原子晶体:微粒是原子,作用力是共价键; 分子晶体:微粒是分子,作用力是分子间作用力。 2、依据物质种类判断 3、依据性质: 熔点:原子晶体的熔点很高,一般在1部分分子溶于水能导电;
分子晶体和原子晶体

HXC60P106, P1010都形成分子晶体,只有很少的一部分和______SiO2,碳化硅,第二节分子晶体和原子晶体一、分子晶体(一)、概念:分子间以______________________ (_____________ , ________________ )相结合的晶体叫分子晶体。
注意:(1)构成分子晶体的粒子是 ______________________ 。
(2 )在分子晶体中,分子内的原子间以结合,而相邻分子靠或相互吸引。
(3 )范德华力化学键的作用:(4 )分子晶体熔化破坏的是O(二)•分子晶体的物理特性:(1)___ 的熔点和沸点,(2) ______________ 的硬度,________ 挥发, _________ 升华(3)—般都是________ 体,固体和熔融状态都__________________ 导电。
(4)分子晶体的溶解性与溶质和溶剂的分子的___________________ 相关一一____________________思考:1、为什么分子晶体熔沸点低、易挥发、易升华、硬度小?原因:分子晶体发生这些变化时_只破坏 __________________________ , ________________ 很弱,克服它时需要的能量小。
所以分子晶体熔沸点低、易挥发、易升华、硬度小。
2、为什么分子晶体在晶体和熔融状态均不导电?它们在晶体和熔融状态均不存在_______________________ 。
部分分子晶体溶于水在水分子作用下发生_____________ 导电,如HCI, H2S04 ;有些溶于水与水反应生成_______________________________ 而导电,晶体硼等。
)(四)分子晶体结构特征1. ______________________________ __ 分子密堆积每个分子周围有______________ 个紧邻的分子,如:C60、干冰、12、02——不具有分子密堆积特征P1,CH4,2,冰中1个水分lmol冰周I韦]有mol氢键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子晶体与原子晶体
1 原子晶体:相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体。
(1)原子晶体中,组成晶体的微粒是原子,原子间的相互作用是共价键,共价键结合牢固,原子晶体的熔、沸点高,硬度大,不溶于一般的溶剂,多数原子晶体为绝缘体,有些如硅、锗等是优良的半导体材料。
原子晶体中不存在分子,用化学式表示物质的组成,单质的化学式直接用元素符号表示,两种以上元素组成的原子晶体,按各原子数目的最简比写化学式。
常见的原子晶体是周期系第ⅣA族元素的一些单质和某些化合物,例如金刚石、硅晶体、SiO2、SiC等。
(但碳元素的另一单质石墨不是原子晶体,石墨晶体是层状结构,以一个碳原子为中心,通过共价键连接3个碳原子,形成网状六边形,属过渡型晶体。
)对不同的原子晶体,组成晶体的原子半径越小,共价键的键长越短,即共价键越牢固,晶体的熔,沸点越高,例如金刚石、碳化硅、硅晶体的熔沸点依次降低。
(2)一般键长越短,熔沸点越高。
例如:金刚石(C—C) > 二氧化硅(Si—O) > 碳化硅(Si—C) > 晶体硅(Si—Si)
2分子间通过分子间作用力(包括范德华力和氢键)构成的晶体。
(1)典型的分子晶体
①所有非金属氢化物
②大部分非金属单质,如:稀有气体、卤素(X2)、氧气、硫(S8)、氮(N2)、白磷(P4)、C60等
③部分非金属氧化物,如:CO2、SO2、SO3、P4O6、P4O10等
④几乎所有的酸
⑤绝大多数有机化合物,如:苯、乙酸、乙醇、葡萄糖等
⑥所有常温下呈气态的物质、常温下呈液态的物质(除汞外)、易挥发的固态物质
(2)分子晶体是由分子组成,可以是极性分子,也可以是非极性分子。
分子间的作用力很弱,分子晶体具有较低的熔、沸点,硬度小、易挥发,许多物质在常温下呈气态或液态,例如O2、CO2是气体,乙醇、冰醋酸是液体。
同类型分子的晶体,其熔、沸点随分子量的增加而升高,例如卤素单质的熔、沸点按F2、Cl2、Br2、I2顺序递增;非金属元素的氢化物,按周期系同主族由上而下熔沸点升高;有机物的同系物随碳原子数的增加,熔沸点升高。
但HF、H2O、NH3、CH3CH2OH等分子间,除存在范德华力外,还有氢键的作用力,它们的熔沸点较高。
在固态和熔融状态时都不导电。
分子组成的物质,其溶解性遵守“相似相溶[1]”原理,极性分子易溶于极性溶剂,非极性分子易溶于非极性的有机溶剂,例如NH3、HCl极易溶于水,难溶于CCl4和苯;而Br2、I2难溶于水,易溶于CCl4、苯等有机溶剂。
根据此性质,可用CCl4、苯等溶剂将Br2和I2从它们的水溶液中萃取、分离出来。
(3)分子间作用力越强,熔沸点越高
①组成和结构相似的分子晶体,一般相对分子质量越大,分子间作用力越强,熔沸点越高。
例如:元素周期表中第ⅦA族的元素单质其熔沸点变化规律为:At2>I2 > Br2 >
Cl2>F2 。
②若分子间有氢键,则分子间作用力比结构相似的同类晶体大,故熔沸点较高。
例如:HF > HI > HBr > HCl。
H2O> H2Se> H2S。
NH3> PH3
③组成和结构不相似的物质,分子极性越大,其熔沸点越高,例如:CO>N2
④在有机物的同分异构体中,一般来说,支链越多,熔沸点越低,例如:正戊烷>异戊烷>新戊烷
⑤互为同分异构体的芳香烃及其衍生物中,熔沸点顺序为:邻位化合物>间位化合物>对位化合物
3几种常见的晶体类型:
(1)原子晶体:晶体内相临原子间以共价键相结合形成的空间网状结构。
如:金刚石、晶体硅、碳化硅、二氧化硅
构成晶体的微粒:原子;
微粒间相互作用:共价键;
物理性质:熔沸点高,高硬度,导电性差。
(2)分子晶体:通过分子间作用力互相结合形成的晶体。
如:所有的非金属氢化物,大多数的非金属氧化物,绝大多数的共价化合物,少数盐(如AlCl3)。
构成晶体的微粒:分子;
微粒间相互作用:范德华力;
物理性质:熔沸点低,硬度小,导电性差。
(3)离子晶体:阴、阳离子以一定的数目比、并按照一定的方式依靠离子键结合而成的晶体。
如“NaCl、CsCl
构成晶体的微粒:阴、阳离子;
微粒间相互作用:离子键;
物理性质:熔点较高、沸点高,较硬而脆,固体不导电,熔化或溶于水导电。
(4)金属晶体(包括合金):由失去价电子的金属阳离子和自由电子间强烈的作用形成的。
构成晶体的微粒:金属阳离子和自由电子;
微粒间相互作用:金属键;
物理性质:熔沸点一般较高部分低,硬度一般较高部分低,导电性良好。
