第八章分析化学答案
分析化学第八章 原子结构 复习题

第八章原子结构复习题(一)填空题1、某电子处在3d 轨道,它的主量子数n为();副量子数l为();磁量子数m可能是()。
2、描述5 d1电子运动状态可用的4 个量子数为()。
3、3 d轨道的主量子数为();角量子数为();可能的磁量子数为();自旋量子数可以为()。
4、在下列各小题的空白处填入所允许的量子数:①n= 1 ,l=(),m=()②n= 2 ,l= 1,m=()③n= 3 ,l= 2 ,m=()5、波函数ψ是描述()数学函数式,它和()是同义词。
|ψ|2的物理意义是();电子云是()形象化描述。
6、基态氢原子的 1 s电子在原子核附近()最大;在r=53 pm 处()最大。
当两个氢原子结合成一个双原子分子时,核间距离的一半称为氢原子的()半径;它的值比53 pm()。
7、Li 原子在基态时 3 个电子的四个量子数分别是()、()、()。
8、用三个量子数n、l、m可以表示一个原子轨道。
则2 p z轨道可以表示为();3 d z2 轨道可以表示为()。
9、符号4 d表示电子的主量子数n=(),角量子数l=(),该轨道有()种空间取向,最多可容纳()个电子。
10、用元素符号填空:第四周期中,原子的 4 p 轨道半充满的元素为()3 d轨道半充满的元素为()。
11、第三周期中有两个成单电子的元素是()、();第四周期元素中未成对电子最多可达();3 d轨道半充满的+3 价阳离子是()。
12、在基态电子构型如下的五种原子中,①1 s 2 2 s 2 ;② 1 s 2 2 s 2 2 p 5 ;③1 s 2 2 s 2 2 p 1 ;④ 1 s 2 2 s 2 2 p 6 3 s 1;⑤ 1 s 2 2 s 2 2 p 6 3 s 2 ,原子半径最大的是(),电离能最小的是(),电负性最大的是()。
(填序号表示)13、比较下列各组中那一个元素的第一电子亲合能较高?①C 和F :()高;② F 和I :()高;③F 和Cl :()高;④O 和S :()高;14、M 3+离子3 d轨道上有3 个电子,则该原子的原子序数是()该原子的核外电子排布是( ) M 属于( )周期( )族的元素 ,它的名称是( ) 。
B133-分析化学-第八章 氧化还原滴定法答案 (2)

第七章氧化还原滴定法第一节氧化还原平衡1 对Ox-Red 电对, 25℃时条件电位(Eө') 等于(D )(A) Eө+ 0059.lgnaaOxRed(B) Eө+ 0059.lgnccOxRed(C) Eө+ 0059.lgnaaγγOx OxRed Red⋅⋅(D) Eө + 0059.lgnaaγγOx RedRed Ox⋅⋅2 为降低某电对的电极电位, 可加入能与( 氧化)态形成稳定络合物的络合剂; 若要增加电极电位, 可加入能与( 还原)态形成稳定络合物的络合剂。
3. MnO4-/Mn2+电对的条件电位与pH的关系是( B )(A) Eө'= Eө -0.047pH (B) Eө'= Eө -0.094pH(C) Eө'= Eө -0.12pH (D) Eө'= Eө -0.47pH4. Fe3+与Sn2+反应的平衡常数对数值(lg K)为( B )(Eө (Fe3+/Fe2+)= 0.77 V, Eө (Sn4+/Sn2+)= 0.15 V)(A) (0.77-0.15)/0.059 (B) 2×(0.77-0.15)/0.059(C) 3×(0.77-0.15)/0.059 (D) 2×(0.15-0.77)/0.0595. 当两电对的电子转移数均为2时,为使反应完全度达到99.9%,两电对的条件电位至少大于( B )(A) 0.09V (B) 0.18V (C) 0.27V (D) 0.36V6 若两电对的电子转移数分别为1 和2, 为使反应完全度达到99.9%, 两电对的条件电位差至少应大于( C )(A) 0.09V (B) 0.18V (C) 0.27V (D) 0.36V7. 欲以氧化剂O T滴定还原剂Rx, O T+n1e=R T Ox=Rx-n2e,设n1=n2=1,要使化学计量点时,反应的完全程度达到99.9%,两个半反应的标准电位的最小差值应为( B )(A) 0.177V (B) 0.354V (C) 0.118V (D) 0.236V8. 下列现象各是什么反应?(填A,B,C,D)(1) MnO4-滴定Fe2+时, Cl-的氧化被加快_______D_________(2) MnO4-滴定C2O42-时, 速度由慢到快_______B _________(3) Ag+存在时, Mn2+氧化成MnO4-_______ A _________(4) PbSO4沉淀随H2SO4浓度增大溶解度增加_______ C _________(A) 催化反应(B) 自动催化反应(C) 副反应(D) 诱导反应9. 用Ce4+滴定Fe2+,当体系电位为0.68V时, 滴定分数为( B )[Eө' (Ce4+/Ce3+)=1.44V,Eө' (Fe3+/Fe2+)=0.68V](A) 0 (B) 50% (C) 100% (D) 200%10. 用铈量法测定铁时, 滴定至50% 时的电位是( A )[已知Eө' (Ce4+/Ce3+)= 1.44 V, Eө' (Fe3+/Fe2+)= 0.68 V](A) 0.68 V (B) 1.44 V(C) 1.06 V (D) 0.86 V11. 用K2Cr2O7滴定Fe2+, 在化学计量点时, 有关离子浓度的关系是( C )(A) [Fe3+] = [Cr3+], [Fe2+] = [Cr2O72-](B) 3[Fe3+] = [Cr3+], [Fe2+] = 6[Cr2O72-](C) [Fe3+] = 3[Cr3+], [Fe2+] = 6[Cr2O72-](D) [Fe3+] = 3[Cr3+], 6[Fe2+] = [Cr2O72-]12. 已知在1 mol/L HCl溶液中Eө' (Fe3+/Fe2+)=0.68 V, Eө' (Sn4+/Sn2+)=0.14 V。
无机及分析化学第八章答案
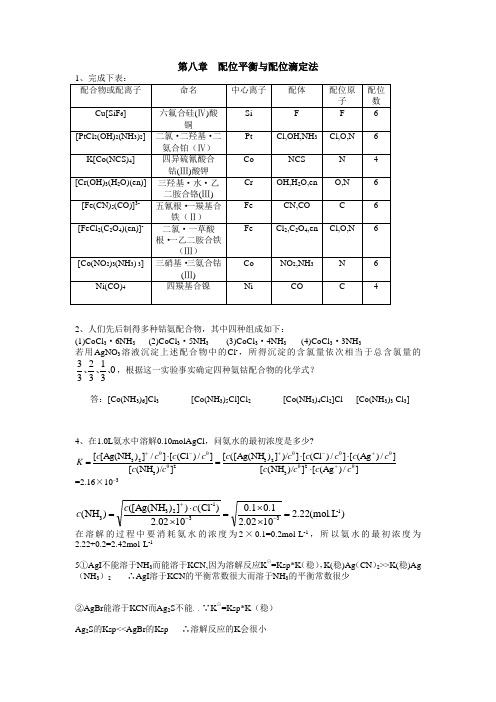
第八章 配位平衡与配位滴定法2、人们先后制得多种钴氨配合物,其中四种组成如下:(1)CoCl 3·6NH 3 (2)CoCl 3·5NH 3 (3)CoCl 3·4NH 3 (4)CoCl 3·3NH 3若用AgNO 3溶液沉淀上述配合物中的Cl -,所得沉淀的含氯量依次相当于总含氯量的0313233、、、,根据这一实验事实确定四种氨钴配合物的化学式?答:[Co(NH 3)6]Cl 3 [Co(NH 3)5Cl]Cl 2 [Co(NH 3)4Cl 2]Cl [Co(NH 3)3 Cl 3]4、在1.0L 氨水中溶解0.10molAgCl ,问氨水的最初浓度是多少?=2.16×10–3)mol.L (22.21002.21.01.01002.2)(Cl )])[Ag(NH ()(NH 1-33-1233=⨯⨯=⨯⋅=--+c c c 在溶解的过程中要消耗氨水的浓度为2×0.1=0.2mol·L -1,所以氨水的最初浓度为 2.22+0.2=2.42mol·L -15①AgI 不能溶于NH 3而能溶于KCN,因为溶解反应K ⊙=Ksp*K (稳),K(稳)Ag (CN )2>>K(稳)Ag (NH 3)2 ∴AgI 溶于KCN 的平衡常数很大而溶于NH 3的平衡常数很少②AgBr 能溶于KCN 而Ag 2S 不能,,∵K ⊙=Ksp*K (稳)Ag 2S 的Ksp<<AgBr 的Ksp ∴溶解反应的K 会很小]/)Ag ([])/(NH []/)Ag ([]/)Cl ([])/])([Ag(NH [])/(NH []/)Cl ([]/])Ag(NH [[θ2θ3θθθ232θ3θθ23c c c c c c c c c c c c c c c c K ++-+-+⋅⋅⋅=⋅=③Fe 与SCN -会生成血红色的配合物 ④略6、0. l0mol ∙L -1的AgNO 3溶液50mL ,加密度为0.932g ∙ mL -1含NH 3 18.24%的氨水30mL ,加水稀释到100mL ,求算这溶液中的Ag +浓度。
分析化学(书后习题参考答案)第八章 电位分析法

(b)pH=4.00 +
(c) pH= 4.00 +
3. 用标准甘汞电极作正极,氢电极作负极与待测的 HCl 溶液组成电池。在 25℃时, 测 得 E=0.342V。当待测液为 NaOH 溶液时,测得 E=1.050V。取此 NaOH 溶液 20.0ml,用上 述 HCl 溶液中和完全,需用 HCl 溶液多少毫升? 解:1.050 = 0.2828 — 0.059lgKw/[OH-] 0.342 =0.2828 — 0.059lg[H+] 需用 HCl 溶液 20.0ml 。 4. 25℃时,下列电池的电动势为 0.518V(忽略液接电位) : Pt H2(100kPa),HA(0.01mol·L-1)A-(0.01mol·L-1 )‖SCE 计算弱酸 HA 的 Ka 值。 解:0.518 = 0.2438— 0.059 lg Ka 0.01/0.01 Ka = 2.29×10-5 5. 已知电池:Pt H2(100kPa),HA(0.200mol·L-1)A-(0.300mol·L-1 )‖SCE 测得 E=0.672V。计算弱酸 HA 的离解常数(忽略液接电位) 。 解:0.672 = 0.2438-0.059lgKa 0.200/0.300 [OH- ]=0.100mol·L-1 [H+]=0.100mol·L-1
AgCl 开始沉淀时:[Ag+] = 1.56 × 10-10 / C mol·L-1,
mol·L-1, 相对误差=1.5×10-16C / 1.56×10-10/C = 0.0001%,这也说明 AgCl 开始沉淀时 AgI 已沉淀完全。 14. 在下列各电位滴定中,应选择何种指示电极和参比电极? 答:NaOH 滴定 HA(Ka C =10-8 ):甘汞电极作参比电极,玻璃电极作指示电极。 K2Cr2O7 滴定 Fe2+:甘汞电极作参比电极,铂电极作指示电极。 EDTA 滴定 Ca2+:甘汞电极作参比电极,钙离子选择性电极作指示电极。 AgNO3 滴定 NaCl:甘汞电极作参比电极,银电极作指示电极。
清华大学无机与分析化学课后习题答案

第八章(p.193)1. 命名下列配合物(1) K2[Ni(CN)4] (2) (NH4)2[FeCl5(H2O)](3) [Ir(ONO)(NH3)5]Cl2 (4) Na2[Cr(CO)5]答:(1) 四氰合镍(II)酸钾(2) 五氯⋅一水合铁(III)酸铵(3) 二氯化亚硝酸根⋅五氨合铱(III)(4) 五羰基合铬(-II)酸钠2. 写出下列配合物(配离子)的化学式:(1) 硫酸四氨合铜(II)(2) 四硫氰⋅二氨合铬(III)酸铵(3) 二羟基⋅四水合铝(III)离子(4) 二苯合铬答:(1) [Cu(NH3)4]SO4(2) NH4[Cr(SCN)4(NH3)2](3) [Al(OH)2(H2O)4]+(4) Cr(C6H6)23. AgNO3能从Pt(NH3)6Cl4溶液中将所有的氯沉淀为AgCl,但在Pt(NH3)3Cl4中仅能沉淀出1/4的氯,试根据这些事实写出这两种配合物的结构式。
答:前者为[Pt(NH3)6]Cl4,后者为 [PtCl3 (NH3)3]Cl4. 画出下列配合物可能有的几异构体:(1) [PtClBr(NH3)py](平面正方形)(2) [Pt(NH3)4(NO2)Cl]Cl2(3) [Pt(NH3)2(OH)Cl3] (4) [Pt(NH3)2(OH)2Cl2]答:(1) 有3种几何异构体,即在氯离子的对位可以分别是Br-, NH3或py。
(2) 六配位应为正八面体构型,有2种几何异构体,即氯离子是在硝基的对位还是在邻位。
(3) 六配位应为正八面体构型,有4种几何异构体,即氨的对位分别可以是氨、羟基和氯离子;当氨的对位是氯离子时,在赤道平面上又可以有另一个氨的对位是羟基或是氯离子。
(4) 六配位应为正八面体构型,有5种几何异构体,即氨的对位分别可以是氨、羟基和氯离子;当氨的对位是羟基或是氯离子时,又可以各有2种异构体,即在赤道平面上的另一个氨的对位是羟基或是氯离子。
分析化学答案(武汉五版)第8,9章

第5章 重量分析法和沉淀滴定法思考题1. 解释下列现象。
a. CaF 2在 pH =3的溶液中的溶解度较在 pH=5的溶液中的溶解度大;答:这是由于酸效应的影响。
因为()spsp F H K K α'=⋅,随着[H +]的增大,()F H α也增大,sp K '也随之增大,即溶解度变大。
所以,CaF 2在 pH =3的溶液中的溶解度较在 pH=5的溶液中的溶解度大。
b .Ag 2CrO 4在0.0010 mol·L -1AgNO 3溶液中的溶解度较在0.0010 mol·L -1 K 2CrO 4溶液中的溶解度小;答:Ag 2CrO 4的p K sp =11.71Ag 2CrO 4在0.0010 mol·L -1AgNO 3溶液中的溶解度s 1:15.7111.7122101[]0.001010sp KAg mol L s ---+⋅=== Ag 2CrO 4在0.0010 mol·L -1 K 2CrO 4溶液中的溶解度s 2:14.36210mol L s --⋅===所以, s 1< s 2,即Ag 2CrO 4在0.0010 mol·L -1AgNO 3溶液中的溶解度较在0.0010 mol·L -1 K 2CrO 4溶液中的溶解度小。
c. BaSO 4沉淀要用水洗涤,而 AgCl 沉淀要用稀 HNO 3洗涤; 答:BaSO 4沉淀要水洗涤的目的是洗去吸附在沉淀表面的杂质离子。
AgCl 沉淀为无定形沉淀,不能用纯水洗涤,这是因为无定形沉淀易发生胶溶,所以洗涤液不能用纯水,而应加入适量的电解质。
用稀HNO 3还可防止Ag + 水解,且HNO 3加热易于除去。
d .BaSO 4沉淀要陈化,而 AgCl 或Fe 2O 3·nH 2O 沉淀不要陈化;答:BaSO 4沉淀为晶形沉淀,陈化可获得完整、粗大而纯净的晶形沉淀。
无机及分析化学第八章选择题及答案

无机及分析化学第八章选择题及答案16. Al3+与EDTA形成( C)A. 非计量化合物B. 夹心化合物C. 鳌合物D. 聚合物17. 下列几种物质中最稳定的是( A)A. [Co(en)3]Cl3B. [Co(NH3)6] (NO3)3C. [Co(NH3)6]Cl2D. Co(NO3)318. 下列配离子在强酸中能稳定存在的是(D)A. [Fe(C4)]3- B. [AlF6]3-C. [Mn(NH3)6]2+ D. [AgCl2]-13. AgNO3处理[Fe(H2O)5Cl]Br溶液,产生沉淀主要是 ( A)A. AgBrB. AgClC. AgBr和AgClD. Fe(OH)38. AgCl在1mol?L?1氨水中比在纯水中的溶解度大。
其原因是:( B )(A)盐效应(B)配位效应(C)酸效应(D)同离子效应10. 在下列浓度相同的溶液中,AgI具有最大溶解度的是:( D)A.NaCl B. AgNO3 C. NH3· HO D. KCN7. 下列物质,能在强酸中稳定存在的是 ( D )A. [Ag(S2O3)2]3- B. [Ni(NH3)6]2+C. [Fe(C2O4)3]3- D. [HgCl4]2-9. 用EDTA直接滴定有色金属离子,终点所呈现的颜色是:(D )A.指示剂-金属离子配合物的颜色 B. 游离指示剂的颜色C. EDTA-金属离配合物的颜色D. (B)和(C)的混合颜色8.下列说法何种错误(C )A.配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。
B.螯合物以六员环、五员环较稳定。
C.配位数就是配位体的个数。
D.二乙二胺合铜(Ⅱ)离子比四氨合铜(Ⅱ)离子稳定。
14.在配位反应中,一种配离子可以转化成()配离子,即平衡向生成()的配离子方向移动。
( C)(A)不稳定的更难解离的(B)更稳定的更易解离的(C)更稳定的更难解离的(D)不稳定的更易解离的11、下列说法何种欠妥C(1)配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。
分析化学课后答案第8章

分析化学课后答案第8章第八章电位分析法思考题1. 参比电极和指示电极有哪些类型?它们的主要作用是什么?答:参比电极包括标准氢电极(SHE),标准氢电极是最精确的参比电极,是参比电极的一级标准。
实际工作中常用的参比电极是甘汞电极和银-氯化银电极。
参比电极电位恒定,其主要作用是测量电池电动势,计算电极电位的基准。
指示电极包括金属-金属离子电极,金属-金属难溶盐电极,汞电极,惰性金属电极,离子选择性电极。
指示电极能快速而灵敏的对溶液中参与半反应的离子活度或不同氧化态的离子的活度比,产生能斯特响应,主要作用是测定溶液中参与半反应的离子活度。
2. 直接电位法的依据是什么?为什么用此法测定溶液pH时,必须使用标准pH缓冲溶液?答:直接电位法是通过测量电池电动势来确定待测离子活度的方法,其主要依据是E=Φ参比—ΦMn+/M= Φ参比—ΦθMn+/M —lnαMn+式中Φ参比和ΦθMn+/M在温度一定时,都是常数。
由此式可知,待测离子的活度的对数与电池电动势成直线关系,只要测出电池电动势E,就可求得αMn+。
测定溶液的pH时是依据:E = ΦHg2Cl2/Hg —ΦAgCl/Ag— K + 0.059 pH试+ ΦL , 式中ΦHg2Cl2/Hg ,ΦAgCl/Ag ,K ,ΦL在一定的条件下都是常数,将其合并为Kˊ,而Kˊ中包括难以测量和计算的不对称电位和液接电位。
所以在实际测量中使用标准缓冲溶液作为基准,并比较包含待测溶液和包含标准缓冲溶液的两个工作电池的电动势来确定待测溶液的pH值,即:25℃时Es = Ksˊ+ 0.059pHs, Ex = Kxˊ+ 0.059pHx,若测量Es和Ex时的条件保持不变,则Ksˊ= Kxˊ,pHx =pHs+ (Ex -Es)/0.059 ,由此可知,其中标准缓冲溶液的作用是确定Kˊ。
3. 简述pH玻璃电极的作用原理。
答:玻璃电极的主要部分是一个玻璃泡,泡的下半部是对H+ 有选择性响应的玻璃薄膜,泡内装有pH一定的0.1mol·L-1的HCl内参比溶液,其中插入一支Ag-AgCl电极作为内参比电极,这样就构成了玻璃电极。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第九章 氧化还原滴定法习题解
20、用一定量的H 3AsO 4氧化过量的KI ,析出的I 2用Na 2S 2O 3溶液滴定至终点,用去30.00 ml;同样量的的H 3AsO 4恰好被0.1000 mol/L 的NaOH 溶液中和至第一计量点时,用去30.00 ml, 试计算Na 2S 2O 3溶液的浓度。
(已知M H3AsO4=141.9) 解:O H I AsO H H I AsO H 22334322++=+++-
34242H AsO NaOH NaH AsO H O +=+
---+=+264232222O S I O S I
3222432~1~1O S molNa molI AsO molH molNaOH AsO molH 1~143 L mol V V C V n C O S Na NaOH NaOH O S Na AsO H O S Na /2000.000
.3000.301000.02.2232232243322=⨯⨯===
22、某样品中含有KMnO 4和K 2Cr 2O 7, 现取此样品0.2400g 溶解, 酸化,加入过量KI ,析出的I 2用0.1000 mol/L Na 2S 2O 3溶液滴定至终点,用去60.00 ml ,计算样品中KMnO 4和K 2Cr 2O 7各为多少克?(已知M KMnO4 =158.0, M K2Cr2O7=294.2)
解:O H I Cr H I O Cr 223272732146++=++++--,
O H I Mn H I MnO 22244528102++=++++--
---+=+264232222O S I O S I
322245~2/5~1O S molNa molI molKMnO
32227226~3~1O S molNa molI O Cr molK
设样品中KMnO 4为x 克,则K 2Cr 2O 7为(0.2400-x 克),依题意: 322722465O S Na O Cr K KMnO n n n =+ 即
3223227224
.)2400.0(65O S Na O S Na O Cr K KMnO V C M x M x
=-+ 31000.601000.02
.294)2400.0(60.1585-⨯⨯=-+x x 解得: x=0.09821(g) ,即高锰酸钾为0.09821克,
0.2400-x=0.1418(g),即重铬酸钾为0.1418克。
25、有苯酚样品0.2401g, 用NaOH 溶液溶解后,定容至250.0 ml, 取此试液25.00
ml, 加KBrO 3和KBr 混合溶液25.00 ml 及5 ml HCl, 稍后加入过量的KI, 析出的I 2用0.1084 mol/L 的Na 2S 2O 3溶液滴定至终点,用去30.00ml ,另取25.00 ml KBrO 3和KBr 混合溶液,做空白试验,用去上述Na 2S 2O 3溶液41.60ml, 计算苯酚的含量。
(已知M C6H5OH =94.11)
解:有关化学反应为
故 3225661O S Na OH H C n n =
26、已知322
e //0.77,0.535F Fe I I E V E V θ
θ++-==, 计算反应 2Fe 3+ + 2I - = 2Fe 2+ + I 2 的平衡常数。
解:72010103.997.7059.0)535.077.0(2059.0)(lg ⨯==-=-=''K E E n K
27、计算在3.0 mol/L HCl 介质中,当Cr2O72-浓度为0.10 mol/L 时,Cr3+浓度为0.030 mol/L 时,电对2327/Cr O Cr -+的电极电位。
解:Cr 2O 72-+6e+14H + = 2Cr 3++7H 2O
O 3H 3Br 6H 5Br BrO 223+++--+ Br + 3HBr OH Br Br 3Br 2 OH 苯酚样品
Br 2(剩余)+2I - I 2+2Br -
-++26
4-23222O S O S I 苯酚
6/1~2/1~2/1~22232I Br O S -2232231()61000%10025.00250.0
194.110.1084(41.6030.00)6100010082.1425.000.2401250.0
Na S O Na S O s M C V V m ω-⨯=⨯⨯⨯⨯-⨯=⨯=⨯空样苯酚
V C C C E E Cr H O Cr Cr O Cr Cr O Cr 17.1]
030.0[0.31.0lg 6059.008.1)(.lg 6059.0214214
/0/327232723272=⨯+=+=++-+-+-'。
