氢光谱与碱金属光谱
§4.1 碱金属原子的光谱(PPT-YBY)
原子实的极化和轨道贯穿 (a)原子实的极化:图1.2
图1.1碱金属原子的结构
n b l a nr n n
l值越小极化越强,能量愈底
图1.2 原字实的极化
(b)轨道的贯穿: 贯穿轨道只能发生在偏心率大的轨道,所以l越小贯穿越强,量 子亏损越大。 原子实的发生极化和电子贯穿原子实时电子感受的有效电荷 数将大于1即:Z * 1
一、碱金属原子的光谱的特征 由氢原子光谱和碱金属光谱的比较可以发现,相对于氢原子的 一条谱线在碱金属中会出现几条.例如相对于氢原子的巴尔末线 系 H (| n 3 | n 2) 的谱线可发现明显分裂为三条。
1、碱金属原子光谱的四组谱线分类:(以锂Li原子为例) (1)主线系 np 2s 系限:(229.97nm) 紫外到可见
(2)第一辅线系(漫)和柏格曼线系(基)分裂为三条。
nd 2p
nf 3d
d13 s
(n) 0 d 12 d d 12
2.定性分析:
一条谱线分裂为两条,这表明跃迁的初态和末态所相应的两 条能级中至少有一条分裂成两条;一条谱线分裂为三条,这表 明跃迁的初态和末态所相应的两条能级都分裂成两条。如果末 态分裂了,那么各谱线的分裂间距一定不随谱线的改态可能产生不同的分裂, 从而使谱线的分裂随谱线的不同而不同。
(a) 第二辅线系(锐) ns 2 p (b)主线系
np 2s
(c)第一辅线系(漫) nd 2 p (d)基线系,又称伯格曼线系 nf 3d 3、结论
(1)碱金属原子的能级S是单层的,其余所有 p, d , 等能级都是双层的。
2、碱金属原子的结构及能级
能级只于量子数n有关
由原子的发光机理可推知,碱金属光谱线的分裂是由能级 分裂造成的,即 碱金属原子能级和氢原子能级相比,同一n 的不同l值的能级明显不同。
氢原子光谱的特点

氢原子光谱的特点
氢原子光谱是指氢原子在特定条件下吸收和辐射能量后所产生的光谱现象。
它具有以下几个特点:
1. 线谱性
氢原子光谱是一种线谱,即氢原子在吸收和发射能量的过程中所产生的光谱线非常锐利而且分立。
线谱性是氢原子光谱的最基本特征,也是区分氢原子光谱和其他光谱的重要依据。
2. 离散性
氢原子光谱只出现在特定波长位置,这是因为氢原子只会吸收和辐射特定能级之间的能量,这些能级是由氢原子的电子所占据的。
这也就是说,氢原子光谱具有离散性,其光谱线的位置是确定的。
3. 频率公式
在氢原子光谱中,每一个谱线所对应的波长和频率都有一定的关系,并且能够通过一个数学公式(Rydberg公式)来描述。
这个公式有助于科学家研究氢原子光谱现象,进而推断出氢原子的电子能级结构和性质等。
4. 吸收和发射对称性
当氢原子从一个低能级到高能级时,它会吸收能量并发射一个光子。
而当它从高能级到低能级时,则会放出能量并吸收一个光子。
这种吸
收和发射能量之间的对称性是氢原子光谱中一个很显著的特点。
总之,氢原子光谱是一种非常独特的光谱现象,它的线谱性、离散性、频率公式和吸收和发射对称性等特点,为我们深入了解原子结构和性
质提供了极为重要的信息。
《氢原子与碱金属原子光谱精细结构的讨论》

《氢原子与碱金属原子光谱精细结构的讨论》
本文旨在分析氢原子与碱金属原子光谱精细结构。
随着科学技术的不断发展,氢原子与碱金属原子光谱精细结构呈现出更加复杂的变化,引起了人们的广泛关注。
氢原子光谱的精细结构是指氢原子在不同能级、不同态间由电磁波吸收而跳转改变能量状态,这种改变最终形成一组特有的光谱线。
氢原子产生这些变化的原因是粒子占有一个被称为可视极性的定向角。
碱金属原子的光谱的精细结构是指其中的原子吸收特定的电磁波来改变其能量状态,从而形成一系列特有的光谱线,也称为精细结构。
氢原子与碱金属原子的光谱精细结构在自然界有重要的意义。
其中,氢原子的跃迁过程可以提供有关物质结构、内能改变规律等重要信息,从而帮助科学研究者探索细胞内电子运动规律。
碱金属原子的光谱精细结构可以提供有关原子结构、能量关系和化学特性的有价值信息,从而为科学研究者帮助实现原子结构及有关变化的规律。
综上所述,氢原子与碱金属原子的光谱精细结构对于促进科学的发展具有重要的意义,帮助研究者探索原子及化学特性的有价值信息,因此必须得到科学家广泛关注和研究。
碱金属原子光谱

所以 n*<n
a 非贯穿轨道
b 贯穿轨道
价电子的轨道运动
三、量子力学定量处理
远离原子实运动
Z e V(r) 4πε0 r
* 2
* 2
靠近原子实运动 V (r ) Z e ep 2 40 r 40 r 能量和光谱项
hcR En 2 (n Δ )
2 2
n F7 / 2
2
3 D3 / 2
2
R R ~ 3d nf (3 d ) 2 (n f ) 2
• 柏格曼系:
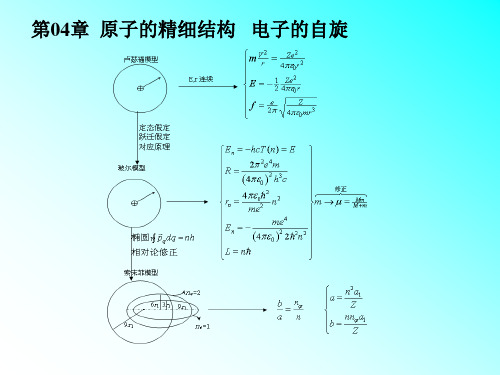
§4.2 原子实的极化和轨道贯穿
一、原子实模型 二、原子实极化、轨道贯穿 三、量子力学定量处理
一、原子实模型
• 内层电子 与原子核结合的较紧密,而价电子
与核结合的很松,可以把内层电子和原子核看 作一个整体称为原子实。价电子绕原子实运动, 原子的化学性质及光谱都决定于这个价电子。
电子的运动=轨道运动+自旋运动
二、电子的总角动量 轨道角动量: L l (l 1) h 2 h 自旋角动量: S s( s 1)
2
l 0,1,2 n 1
1 s 2
J h j ( j 1) 2
总角动量:
J LS
j l s,l s 1 ,…… l s
1 l 0 时,j l , 能级分裂为双层。 2
2.能级分裂的间隔由 n l 决定 当 n 一定时,l 大,E 小,即
E4 p E4d E4 f
当
n 大,E l 一定时,
E2 p E3 p E4 p
小,即
3.双层能级中, j
钠金属光谱

碱金属原子光谱碱金属原子光谱,特指碱金属锂、钠、钾、铷、铯等元素的光谱。
它们具有相似的结构,明显地分成几个线系。
通常观察到的有主线系、第一辅线系(漫线系)、第二辅线系(锐线系)和伯格曼线系(基线系)。
众所熟知的钠黄光波长为589.3纳米,就是钠光谱主线系的第一条谱线。
碱金属原子都具有相似的结碱金属原子光谱构,内层的z-1 个电子与原子核组成原子实,最外层只有一个价电子,与氢原子有些类似,不同的是电子运动对原子实有极化和贯穿作用,引起不同轨道的电子能态的较大分裂,能级对l的简并解除。
另外由于电子自旋取向不同,引起自旋轨道耦合的能量微小分裂,因此碱金属原子的能级除S态是单层的外,其他P、D、F态都是双层的。
根据单价原子光谱的选择定则,可得出,主线系和锐线系是双线结碱金属原子光谱构,漫线系和基线系为三线结构。
观察结果图1画出了锂原子光谱的四个线系。
从图中可以看到主线系的波长范围最宽、第一条是红色的,碱金属原子光谱其余的都在紫外。
线系限是229.97nm;第一辅线系在可见光区部分;第二辅线系的第一条在红外区,其余在可见光区,这二线系有同一线系限,伯格曼线系在红外区,其他碱金属原子也有相似的光谱线系,只是波长不同,例如钠的主线系的第一条线是大家熟悉的黄色光,波长为589.3nm。
原子结构碱金属原子与氢原子光谱规律相似,是由于它们的原子结构相似,虽然碱金属元素与氢元素的性质极不相同,但它们都只有一个外层电子,称为价电子。
内满充壳层电子与原子核组成原子实,价电子即处于原子实的中心势场中。
按锂、钠、钾、铷、铯的次序原子实内的电子数分别是2、10、18、36、54、86,价电子所在的轨道的主量子数分别为n≥2、n≥3、n≥4、n≥5、n≥6。
能级公式碱金属原子的能级公式与氢原子相似公式式中墹l为量子亏损,是一个与角动量量子数l有关的正数,R是碱金属的里德伯常数。
显然,碱金属的能级不但与n有关,而且与l有关。
上式还可写为Z*称为有效核电荷数。
实验用:氢、钠原子光谱实验

实验一氢、氘、钠原子光谱研究元素的原子光谱,可以了解原子的内部结构,认识原子内部电子的运动,并导致电子自旋的发现。
原子光谱的观测,为量子理论的建立提供了坚实的实验基础。
1885年末,巴尔末(J.J.Balmer)根据人们的观测数据,总结出了氢光谱线的经验公式。
1913年2月,玻尔(N.Bohr)得知巴尔末公式后,3月6日就寄出了氢原子理论的第一篇文章,他说:“我一看到巴尔末公式,整个问题对我来说就清楚了。
”1925年,海森伯(W.Heisenberg)提出的量子力学理论,更是建筑在原子光谱的测量基础之上的。
现在,原子光谱的观测研究,仍然是研究原子结构的重要方法之一。
20世纪初,人们根据实验预测氢有同位素,1912年发明质谱仪后,物理学家用质谱仪测得氢的原子量为1.00778,而化学家由各种化合物测得为1.00799。
基于上述微小的差异,伯奇(Birge)和门泽尔(Menzel)认为氢也有同位素2H(元素左上角标代表原子量),它的质量约为1H的2倍,据此他们算得1H和2H在自然界中的含量比大约为4000:1,由于里德伯(J.R.Rydberg)常量和原子核的质量有关,2H的光谱相对于1H的应该会有位移。
1932年,尤雷(H.C.Urey)将3L液氢在低压下细心蒸发至1毫升以提高2H的含量,然后将那1mL 注入放电管中,用它拍得的光谱,果然出现了相对于1H移位了的2H的光谱,从而发现了重氢,取名为氘,化学符号用D表示。
由此可见,对样品的考究,实验的细心,测量的精确,于科学进步非常重要。
一、【实验目的】本实验通过氢氘光谱的测量、氘氢质量比的测定,加深对氢光谱规律和同位素位移的认识,并理解精确测量的重要意义。
通过对钠原子光谱的观察与分析,加深对碱金属原子的外层电子与原子实相互作用以及自旋与轨道运动相互作用的了解。
学会使用光谱仪测量未知元素的光谱。
二、【实验仪器】1.WGD—8A型组合式多功能光栅光谱仪本实验采用WGD—8A型组合式多功能光栅光谱仪,主要由光栅单色仪、接收单元、扫描系统、电子放大器、A/D采集单元和计算机等组成。
原子物理学——碱金属原子的光谱

§4.1 碱金属原子的光谱一、碱金属原子的光谱各个碱金属原子的光谱具有相似的结构,光谱线也类似于氢原子光谱,可分成几个线系,一般观察到的有四个线系,分别称为主线系、第一辅线系(或称漫线系、第二辅线系(或称锐线系)和柏格曼系(基线系)。
(1)主线系(the principal series ):谱线最亮,波长的分布范围最广,第一呈红色,其余均在紫外。
(2)第一辅线系(漫线系the diffuse series ):在可见部分,其谱线较宽,边缘有些模糊而不清晰,故又称漫线系。
(3)第二辅线系(锐线系the sharp series ):第一条在红外,其余均在可见区,其谱线较宽,边缘清晰,故又称锐线系。
锐线系和漫线系的系限相同,所以均称为辅线系。
(4)柏格曼系(基线系the fundamental series ):波长较长,在远红外区,它的光谱项与氢的光谱项相差很小,又称基线系。
二、线系公式H 原子光谱:)11()()(~22n m R n T m T -=-=ν当∞→n 时,2)(~~m R m T ==→∞νν⇒系限。
里德伯研究发现,与氢光谱类似,碱金属原子的光谱线的波数也可以表示为二项之差:)*1*1(~22**n m R T T n m -=-=ν **m n > ⇒碱金属原子的里德伯公式 *n 、*m :有效量子数。
当∞→n 时,*~~m T =→∞νν⇒系限。
1.有效量子数H 原子:主量子数n 是整数碱金属原子:*n 、*m 不是整数⇒有效量子数2.量子数亏损*n 、*m 和整数之间有一个差值,用l ∆表示,*n n l -=∆ ⇒量子数亏损 l ∆与n 无关,与l 有关,→l 大,→∆l 小,=l 0、1、2、3……⇒ f d p s ,,,3.光谱项2**n R T n =⇔2)(nR n T =,*n ⇔n l n T n n T R n T T l n m ∆−−−→−−−−→−−−−→−-=∆=-=**~*~**νν151009729.1-⨯=cm R Li4.电子状态符号电子状态用量子数n 、l 、l m 描述对一定的n ,l =0、1、2……n -1,共n 个值。
碱金属光谱

一、实验目的(1)通过所学的理论知识解释碱金属光谱与氢原子光谱的异同点(2)分析碱金属原子的谱线规律并用实验证明之(3)学会光栅光谱仪的使用方法(及其结构),校准光谱仪并正确测定钠原子光谱(4)由钠原子光谱的波长显示计算光谱项,量子缺和主量子数,学会用里德伯表解决这一复杂问题(5)绘制钠原子能级图及氢原子能级图,并作对比(6)根据钠原子黄双线波长差,估算钠原子实有效电荷数和内部磁场(7)查找相关文献,对本次实验结果进行讨论分析,试图寻找创新点二、实验原理A、钠原子光谱(1)碱金属原子的光谱和氢原子光谱相似,但在能级和谱线系种类方面有所不同(如下表所示)。
我们可以用原子实的极化和轨道贯穿理论很好地解释差别。
注:①为主量子数,为有效量子数,称量子缺、②主要取决于轨道量子数 , 越小,电子轨道的偏心率越大,量子缺也越大。
(2)在(1)表中公式(*)还可写成()()表示(,)跃迁到(,),把作为固定项,记作,固定,()则一系列构成一个光谱线系,用符号表示各线系。
分别用表示。
B、原子实有效电荷数和内部磁场估算(1)由于电子自旋的两种取向(电子磁矩或,为玻尔磁子),钠原子价电子轨道运动产生磁场B与相互作用,产生附加能或即能级发生分裂,两能级间的能量差为,对应于谱线分裂,精细结构,已知可推出原子内部磁场大小B。
(h ,c ,为常量)(2)又谱线双重能级的间隔可用波数差表示,已知n ,l ,即可推出有效电荷数。
(,为常量)三、实验装置WGD-8型组合式多功能光栅光谱仪、钠光谱灯、汞灯、计算机四、实验内容使用光电倍增管接受方式测定钠原子光谱线五、实验步骤①把光栅光谱仪上的接收方式选择开关扳到光电倍增管位置②将光栅光谱仪电源上的负高压置零,然后先接通光谱仪电源,再接通计算机电源③调节光电倍增管电压至500~800V④从计算机程序菜单中选择“WGD--8A”倍增管系统(启动),系统自动初始化⑤用汞的三条谱线校准光谱仪的波长,把汞灯放于入射狭缝处,调入射/出射狭缝宽度0.05mm左右,后打开汞灯⑥选择软件窗口“参数设置”项,设置参数:模式:E 扫描时间:0.025 nm 增益:2 负高压:3最大值:1000 最小值:0 起始波长:200 nm 终止波长:800 nm重复次数:1次⑦选择“单程”,开始扫描。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
R
(
1 22
1 n2
)
分别拟合求出
R (1.0982 0.004)107 m1 H
R (1.0985 0.005)107 m1 D
钠光谱分析
Na原子的双线结构
S =1/2; 双重线;
能级图
元素的光谱线系常用 能级图来表示。最上 面的是光谱项符号, 最下面的横线表示基 态,上面的表示激发 态,根据选择定则可 以产生的跃迁用线连 接. 线系:由各种高能级 跃迁到同一低能级时 发射的一系列光谱 线.
氢光谱与碱金属光谱
光谱的分析与讨论
实验仪器简介
氢光谱分析
H原子的双线结构
在H的H 线旁边还有一条谱线,两者仅差1.79 A
这条谱线属于H的同位素氘(D)
当 m H 1 时,计算值与实验值相符较好,肯定
mD
2
了氘的存在.
里德伯常数的计算
强度较小的H:
~
n1
410.27 2.4374 2
434.20 2.3030 2
Na原子各线系的谱项
锐线系: n2S 32 P跃迁
(n>3)
n 2S
(n
R s )2
主线系: n2P 32 S跃迁
(n 3)
n2P
(n
R p )2
漫线系: n2D 32 P跃迁
(n 3)
n2D
(n
R d )2
486.38 2.0560 2
n n 0.2222
5 0.2100
4 0.1875
强度较大的D:
~
n1
410.16 2.4381 2
434.09 2.3037 2
486.23 2.0566 2
n2
6
n n 2 2
1
2
0.2222
5 0.2100
4 0.1875
利用公式:
~
