一碱金属原子光谱的试验规律
§4.1 碱金属原子的光谱(PPT-YBY)
原子实的极化和轨道贯穿 (a)原子实的极化:图1.2
图1.1碱金属原子的结构
n b l a nr n n
l值越小极化越强,能量愈底
图1.2 原字实的极化
(b)轨道的贯穿: 贯穿轨道只能发生在偏心率大的轨道,所以l越小贯穿越强,量 子亏损越大。 原子实的发生极化和电子贯穿原子实时电子感受的有效电荷 数将大于1即:Z * 1
一、碱金属原子的光谱的特征 由氢原子光谱和碱金属光谱的比较可以发现,相对于氢原子的 一条谱线在碱金属中会出现几条.例如相对于氢原子的巴尔末线 系 H (| n 3 | n 2) 的谱线可发现明显分裂为三条。
1、碱金属原子光谱的四组谱线分类:(以锂Li原子为例) (1)主线系 np 2s 系限:(229.97nm) 紫外到可见
(2)第一辅线系(漫)和柏格曼线系(基)分裂为三条。
nd 2p
nf 3d
d13 s
(n) 0 d 12 d d 12
2.定性分析:
一条谱线分裂为两条,这表明跃迁的初态和末态所相应的两 条能级中至少有一条分裂成两条;一条谱线分裂为三条,这表 明跃迁的初态和末态所相应的两条能级都分裂成两条。如果末 态分裂了,那么各谱线的分裂间距一定不随谱线的改态可能产生不同的分裂, 从而使谱线的分裂随谱线的不同而不同。
(a) 第二辅线系(锐) ns 2 p (b)主线系
np 2s
(c)第一辅线系(漫) nd 2 p (d)基线系,又称伯格曼线系 nf 3d 3、结论
(1)碱金属原子的能级S是单层的,其余所有 p, d , 等能级都是双层的。
2、碱金属原子的结构及能级
能级只于量子数n有关
由原子的发光机理可推知,碱金属光谱线的分裂是由能级 分裂造成的,即 碱金属原子能级和氢原子能级相比,同一n 的不同l值的能级明显不同。
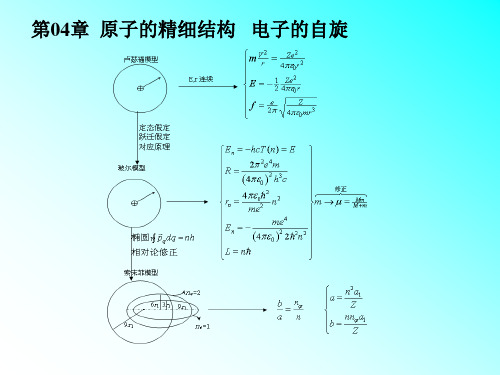
原子物理学总复习

段正路
2014年
1
第一章 原子的基本状况
重点: 1,原子的核式结构 2,α粒子散射实验的意义
2
1、卢瑟福的原子核式模型
原子中的全部正电荷和几乎全部质量都集中在原子中央一 个很小的体积内,称为原子核。原子中的电子在核的周围 绕核运动。
2. α粒子的散射实验:
α粒子被静止核的库仑场散射的角度θ由下式决定
• Z:质子数 • A: 质量数
C4 0
20
a
原子核的角动量
P 核 LnSnLpSp
P核 I(I1)h
原子核的磁矩
I g
I(I1) he 2M
38
原子核的统计性:A为奇数的原子核属于费米子;A为偶 数的原子核属于玻色子。
原子核的结合能
E [Z m p (A Z )m n m 核 ]C 2 或 E [Z m H (A Z )m n m 原 子 ]C 2
r rr 总角动量 JLS JLS,LS 1 ,......,LS
L LS耦合下的原子态符号表示:
2S 1
s=0,单重态
J s=1,三重态
能级排布规则
洪特定则 朗德间隔定则
17
j-j 耦合
rjrj21 rrll12srsr12 rr r Jj1j2
j1 l1 s 1 ,l1 s 1 1 ,....,l1 s 1 j2 l2 s 2 ,l2 s 2 1 ,....,l2 s 2 Jj1j2,j1j2 1 ,....,j1j2
% 1R (m 12n 1 2)Tm Tn
R — 里德堡常数;T(m) —光谱项。
光谱线系 m = 1,n = 2、3、4…,赖曼系(紫外) m = 2,n = 3、4、5…,巴尔末系(可见光) m = 3,n = 4、5、6…,帕邢系(红外) m = 4,n = 5、6、7…,布喇开系(远红外)
原子物理 (4)

-e
2021/1/12
24
二、原子实极化与轨道贯穿
1、原子实极化 (影响小)
价电子产生的电场,使原子实中原子核和电子的中心会发 生微小的相对位移。原子实中的电子的中心不在原子核上,形 成一个电偶极子。
+-
P (z 1)el
虚线:极化前
实线:极化后
2021/1/12
25
原子实极化 的作用 极化产生的电偶极子的电场作用于价电子,使它受到除库
R (n p )2
R
R
第二辅线系: vsn (3 p )2 (n s )2
n=3.4.5… np 3s n=4.5.6…. ns 3 p
第一辅线系:
vdn
R (3 p )2
R (n d )2
n=3.4.5….. nd 3 p
柏格曼系:
R
R
v fn (3 d )2 (n f )2
s,l=0
0.40
n* 1.589 2.596 3.598 4.599 5.599 6.579
T 28581.4 12559.9 7017.0 4472.8 3094.4 2268.9 主线系 p, l=1 n* 1.960 2.956 3.954 4.954 5.955 6.954 0.05
第一辅
用2两021/个1/1量2 子数 n, l 来描述
4
类比H原子光谱
v
RH
(1 m2
1 n2
)
m=1,2,3……; 对每个m, n=m+1,m+2,m+3……构成谱线系
n n>m
m
每一个线系的每一条光谱线的波数都可表示为两个光谱项
之差
vn
碱金属原子光谱线系的确定

碱金属原子光谱线系的确定碱金属原子光谱线系的确定是通过实验和理论计算相结合的方法来探究的。
下面将通过实验和理论计算两方面来介绍碱金属原子光谱线系的确定方法。
一、实验确定碱金属原子光谱线系的方法:1. 碱金属原子光谱实验:通过使用光谱仪等实验设备,将碱金属元素加热到高温并使其发光,然后通过光谱仪将发出的光进行分光,将不同波长的光进行分解并测量其强度,得到光谱线的位置和强度信息。
2. 原子吸收光谱实验:通过将碱金属原子处于冷静态的气态或溶液中,并通过光源照射它们,然后测量通过样品后的光强度,即可得到原子吸收光谱。
通过比较吸收光谱与元素的衣襟光谱的差异,可以确定碱金属原子的光谱线系。
二、理论计算确定碱金属原子光谱线系的方法:1. 化学计算方法:通过量子力学的理论计算方法,如哈特里—福克(Hartree-Fock)方法、密度泛函理论(Density Functional Theory)等,在确定碱金属原子的基态或激发态电子结构的基础上,能够预测出碱金属原子的能级分布和光谱线系。
2. 超结构计算方法:通过基于多重组态耦合方法的计算模拟,可以预测出碱金属原子在高能级激发态下的光谱性质,包括光谱线系的位置和强度分布等。
3. 分子动力学方法:通过模拟碱金属原子的分子动力学过程,可以研究其在高能级激发态下的光谱行为。
通过计算模拟,可以得到碱金属原子的光谱线系的理论结果。
综上所述,通过实验和理论计算相结合的方法可以确定碱金属原子光谱线系。
实验方面,光谱仪、原子吸收光谱等实验设备可以用来观测和测量碱金属原子的光谱特性。
理论方面,化学计算、超结构计算和分子动力学方法等可以通过理论模拟来预测和解释碱金属原子的光谱性质。
这些方法的结合可以更加全面地确定碱金属原子的光谱线系。
实验31 原子发射光谱和原子吸收光谱观测分析

期末考核实验31 原子发射及吸收光谱观测分析临床医学钟潇健04384087(A) 原子发射光谱观测分析【实验目的】1.学会使用光学多通道分析器的方法。
2.了解碱金属原子光谱的一般规律。
3.加深对碱金属原子中外层电子与原子核相互作用以及自旋与轨道运动相互作用的了解。
【仪器用具】光学多通道分析器WGD-6,光学平台GSZ-2,汞灯,钠灯,计算机。
【原理概述】钠原子光谱特点:钠原子光谱分四个线系:主线系:np →3s ( n = 3,4,5, …)锐线系:ns →3p ( n = 4,5,6, …)漫线系:nd →3p ( n = 3,4,5, …)基线系:nf →3d ( n = 4,5,6, …)各线系的共同特点:1.同一线系内,越向短波方向,相邻谱线的波数差越小,最后趋于连续谱与分立谱的边界。
2.在同一线系内,越向短波方向,谱线强度越小。
各线系的区别:1.各线系所在光谱区域不同。
主线系只有3p →3s 的两条谱线(钠双黄线)在可见区,其余在紫外区。
锐线系和漫线系的谱线除第一条线在红外区外,其余都在可见区。
基线系在红外区。
2.由于s能级不分裂,p、d、f能级由于电子自旋与轨道运动作用引起谱项分裂,它们是双重的。
这些双重分裂随能级增高而变小。
因此,根据选择定则,主线系和锐线系是双线的。
主线系双线间的波数差越往短波方向越小,锐线系各双线波数差相等。
漫线系和基线系是复双重线的。
3.从谱线的外表上看,主线系强度较大,锐线系轮廓清晰,漫线系显得弥漫,一般复双重线连成一片。
【实验步骤】1.检查多通道分析器工作状态。
2.点燃汞灯,利用汞灯的546.07nm,576.96nm,578.97nm三条谱线为光学多通道分析器定标,起始波长为440nm。
3.点燃钠灯,实时采集钠灯发射光谱,利用已定标的数据,测出钠谱线双黄线的波长。
4.将光学多通道分析器的起始波长分别改为460nm、480nm、500nm、520nm,重复步骤2和3。
原子物理-碱金属原子

4.6.4
4.6.5
4.6.6
把(4.5.7)、(4.6.5)、(4.6.6)三式代入(4.6.3)式,就得 4.6.7
4.6.8
4.6.9
4.6.10
4.6.11
讨论:
4.6.3碱金属原子态的符号 表4.6.1碱金属原子态的符号
例 题 4.6.1 钾 原 子 的 共 振 线 具 有 双 线 结 构 , 波 长 分 别 为
4.7
氢原子光谱的精细结构与兰姆移位
实验已发现氢原子光谱和碱金属原子光谱类似,也呈现精细结
构。但由于氢原子不存在轨道贯穿和极化现象,因而它的自旋 轨道耦合能Els比碱金属原子小很多,与其相对论效应导致的 附加能Er同数量级。所以在研究了碱金属原子光谱精细结构之 后,再来讨论氢原子光谱精细结构的问题。
766.4nm和769.9nm.试计算的相应的双层P能级的间隔,并估 计电子轨道运动所产生的磁感应强度。
解:
于电子的轨道运动,在固定于电子的坐标系中观察,原子实
绕着电子运动,因而感受到存在一个磁场Bl 。相对于这个磁场 ,电子自旋有两种取向,它在Bl方向的分量μsz=±μB,故电 子自旋和轨道运动的相互作用能
1/2能量相同;3
3/2能量亦相同。
这一点与碱金属原子的情况不同。
(3)精细结构能量与n3成反比,也
随j(或l)的增加而减小。
4.7.2氢原子光
谱的精细结构
图4.7.2巴耳末线
系第一谱线的能级 跃迁图
4.7.3
兰姆移位
四个量子数小结
名称 主量子数 角量子数 取 值 物 理 意 义 电子能量的主体 确定的能级 角动量的可 能取值 对总能量有一定 影响 “轨道”角动量在磁场 中可能的取向 能级分 裂 谱线精细结构
原子物理第四章
3)与 s 对应的磁矩,由 r L 式知, 轨道磁矩 l 与轨道角动量 L 之间的对应 关系是
e l L 2m
(3)
back
next
目录
结束
与此相类比, s 与相应的
s 之间也应有
(4)
相应的对应关系,这个对应关系是
e s S m
S s(s 1)
(1)
next 目录 结束
其中S 称为自旋量子数
back
2)
有2l +1个空间取向,则 s 也应该有 2s+1个空间取向
L
S z ms h
ms s, s 1,…-s (2)
实验表明,对于电子来说
1 s 2
1 1 ms , 2 2
即
s
有两个空间取向。
hv E Em En
1 1 Rhc (4) ' 2 2 (n l ) (m l )
back next 目录 结束
所以碱金属光谱的波数为
~
1 1 v R ' 2 2 (n l ) (m l )
nL mL
'
back
(5)
next
目录
结束
第三节、碱金属原子光谱的精细结构
• 一、光谱的精细结构 • 1、概念 • 2、光谱的精细结构的特点 • 二、光谱的精细结构和能量的联系 • 三、结论
第四节:电子的自旋同轨道运动的相互作用
史特恩-盖拉赫实验中出现偶数分裂的事实 启示人们,电子的轨道运动似乎不是全部的 运动。换句话说,
实验3-3钠原子光谱
实验 33 钠原子光谱对元素的光谱进行研究是了解原子结构的重要途径之一。
通过对原子光谱的研究,不仅让我们 了解了原子内部电子的运动,同时也导致了电子自旋的发现和对元素周期表的解释。
在对氢原子光谱的研究中, 人们认识到电子围绕原子核运动只能处于一系列能量不连续的状态, 从而获得了关于氢原子结构的知识。
但对于多电子原子,除了原子核和电子的相互作用外,还存着 电子之间的相互作用,而且电子的自旋运动和轨道运动的相互作用也更为显著。
为了更好地理解这 方面的知识,我们安排了钠原子光谱实验。
【实验目的】1、通过对钠原子光谱的观察和分析,加深对碱金属原子中外层电子与原子实相互作用以及自旋 与轨道运动相互作用的了解;2、在对光谱线系进行分析和波长测量的基础上,计算钠原子中价电子在不同轨道运动时的量子 缺,绘制钠原子的部分能级图,并根据双重线不同成分的波长差,计算价电子在某些轨道运动时原 子实的有效电荷。
【实验原理】(一) 钠原子光谱的线系为了比较与说明,我们先回忆一下氢原子的光谱规律。
对于氢原子光谱,人们早就发现它们的 光谱线的波数可以用两项值之差表示:2 1 2 2 n R n R - = n (331)式中 R 为里德伯常数。
若令 2 n =2, 1n =3、4、5……,则可得熟知的巴尔末线系。
碱金属原子只有一个价电子,价电子在核和内层电子组成的原子实的中心力场中运动,和氢原 子有点类似。
但是,由于原子实的存在,价电子处在不同量子态时,或者按轨道模型的描述,处于 不同的轨道时,它和原子实的相互作用是不同的。
这主要是因为:首先,价电子处于不同轨道时, 它们的轨道在原子实中贯穿的程度不同,所受到的作用不同;其次,价电子处于不同轨道时,引起 原子实极化的程度也不同。
这二者都要影响原子的能量。
即使电于所处轨道的主量子数 n 相同而轨 道量子数 l 不同,原子的能量也是不同的,因此原子的能量与价电子所处轨道的量子数 n,l 都有关。
碱金属原子的光谱
4.954
4389. 2
5.955
3046. 9
6.954
2239. 4
d,l 2 n
12202. 5 6862. 5
5.000
4381. 2
6.001
3031. 0
7.000
0.001
0.000
f ,l 3
n*
T T
4.000
27419. 4 12186. 4 6854. 8
轨道贯穿
e
e
非贯穿轨道
贯穿轨道
当 l 很小时,价电子的轨道极扁, 价电子的可能穿过原子实 轨道贯穿。 实外 Z*=1 贯穿 Z* > 1 平均:Z* > 1
R * 2 TZ 光谱项: 2 n
T R R n* 2 n 2
R R n 2 n* 2 ( ) * Z
~ 3s np
~ 第一辅线系:
~ 3 p nd
第二辅线系:
~
~ 3 p ns
柏格曼系:
~
R ( 3 d )2
( n f )2
R
~ 3d nf
总结 谱线特征:1)四套线系(四套动项); 2)三个终端(三套固定项); 3)两个量子数(n,l)确定能级 。 光谱项
5.004
4387. 1 3046. 6 2238. 3
氢
n
~
~
R n
*2
n
*
RLi 109729 T T
n *以及 , 表4.1列出了从锂原子的各个线系算出的T、 从表中可以看出: (1) n *一般略小于 n , 只有个别例外。 (2) 同一线系的 差不多相同,即 l 相同的 大概相同。 (3) 不同线系的 不同,且l愈大, 愈小。 (4) 每个线系的系限波数恰好等于另一个线系的第二 项的最大值。
实验二-钠原子光谱
实验二 钠原子光谱碱金属是元素周期表中的第一列元素(H 除外),包括Li 、Na 、K 、Rb 、Cs 、Fr ,是一价元素,具有相似的化学、物理性质。
碱金属原子的光谱和氢原子光谱相似,也可以归纳成一些谱线系列,而且各种不同的碱金属原子具有非常相似的谱线系列。
碱金属原子的光谱线主要由4个线系组成:主线系、第一谱线系(漫线系)、第二辅线系(锐线系)和柏格曼线系(基线系)。
碱金属原子与氢原子在能级方面存在差异,而且谱线系种类也不完全相同。
原子实的极化和轨道贯穿理论很好的解释了这种差别。
进一步对碱金属原子光谱精细结构的研究证实了电子自旋的存在和原子中电子的自旋与轨道运动的相互作用,即自旋-轨道相互作用,这种作用较弱,由它引起了光谱的精细结构。
钠原子光谱及其相应的能级结构具有碱金属原子光谱和能级结构的典型特征。
本实验通过钠原子光谱的观察与分析,加深对有关原子结构、原子内部电子的运动、碱金属原子的外层电子与原子核相互作用以及自旋与轨道运动相互作用的了解,在分析光谱线和测量波长的基础上,计算钠原子中价电子的各能级和相应的量子亏损,绘制钠原子的部分能级图。
【实验原理】原子光谱是研究原子结构的一种重要方法。
1885年,巴尔末()根据人们的观测数据,发现了氢光谱的规律,提出了著名的氢光谱线的经验公式。
氢光谱规律的发现为玻尔理论的建立提供了坚实的实验基础,对原子物理学和量子力学的发展起了重要作用。
根据玻尔理论或量子力学中的相关理论,可得出对氢及类氢离子的光谱规律为:⎥⎦⎤⎢⎣⎡-=222111~n n R H ν (2—1) 其中,ν~为波数,H R 为氢的里德伯常数(109 ),1n 和2n 为整数。
钠是碱金属原子,核外有11个电子,其中622221p s s 这10个电子形成稳定的满壳层结构,并与原子核共同组成原子实,在最外层只有一个价电子。
在这一点上又与最简单的氢原子相似,因此纳原子光谱中各谱线的波数ν~,也可以用下列关系式表示: ⎥⎦⎤⎢⎣⎡-=222111~n n R ν (2—2) 其中 R 为里德伯常数 (= ),在氢原子光谱中,1n 和2n 都是正整数,相应于 1n =1,2,3,···等值,分别有赖曼谱系,巴耳末谱系,帕邢谱系等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2 En hcRZ 2 Z R 光谱项 H原子:能级 E n ( Z 1) T (n) 2 2 n n hc
由
h E n E m
~ 1 T ( m) T ( n)
谱线的波长 解释实验规律
碱金属元素:锂(3)、钠(11)、钾(19)、铷(37)、铯(55)和钫(87) 一价,化学性质相仿,电离电势较小,易被电离,具有金属的一 般性质等。
), 能级和 n, l都有关系
cm-1
(1) n*一般略小于n ,只有个别例外。 (2) 同一线系的Δ差不多相同,即 l 相同的Δ大概相同。 (3) 不同线系的Δ不同,且 l 愈大,Δ愈小。 (4) 每个线系的系限波数恰好等于另一个线系的第二项的最大值。
R 2 n*
主线系:
~
λ2 241.3nm
3p λ1 589.3nm 3s
n=∞
(2)T3 p T3 s 1 / 1 2.447 10 6 m 1 E3 p hcT3 p 3.03eV
例,Na原子基态为3s,已知主线系共振线波长和线系波长分 别为589.3nm和241.3nm. 求,(1)Na原子基态谱项值T3s,能级E3s和量子数亏损Δ3s (2)Na原子3p态的谱项T3p,能级E3p和量子数亏损Δ3p
解, (1) Na原子主线系公式, 1/ T3 s Tp ( 0) T3 s 1 / 1 / 241.3 10 9 4.144 10 6 m 1 E3 s hcT3 s 5.14eV R T3 s 3 s 3 R 1.37 2 (3 3 s )
n* m *
有效量子数
系限对应于电离时的能量
H 原子:主量子数 n 是整数
碱金属原子:n*,
n*
m * 不是整数 有效量子数 RLi 109729 7 1 R 1 . 09729 10 m Li T T (cm 1 )
R 2 n*
• 量子数亏损
n* 和整数 n 之间有一个差值,用Δ表示:
Δ与 n 无关,与l 有关, l 大,Δ小 。
n n * 量子数
亏损
• 光谱项
Tm* R 2 T ( m ) R2 m* m n * R ~ T T ~ m T n n* * n* T n *
• 电子状态符号
二. 线系公式
~ T (m) T (n) R ( 1 1 ) H 原子光谱: 2 2 m n ~ ~ T (m) R m2
n
里德伯研究发现,与氢光谱类似,碱金属原子的光谱线的波数也 可以表示为二项之差:
• 有效量子数
~ T T R( 1 1 ) m* n* m *2 n *2 R ~ ~ n* , Tm* m *2
R R 2 (2 s ) (n p )
R En ,l hc (n l )2 ~ 2 s np , n 2 , 3R R , n 3,4, 2 2 (2 p ) (n s )
R R , n 3,4, 2 2 (2 p ) (n d )
R R , n 3,4, 2 2 (3 p ) ( n d )
~ 3 s np ~ 3 p ns ~ 3 p nd
第二辅线系:
第一辅线系:
柏格曼系:
R R ~ 3 d nf , n 4,5, 2 2 (3 d ) ( n f ) R • 碱金属原子的光谱项 T R 2 n* (n ) 2 ~
电子状态用量子数n、l、ml 描述 对一定的n,l = 0, 1, 2, …, n-1,共 n 个值。 对一定的l, ml = ±1, ±2, …, ±l,共 2l+1 个值。 l = 0, 1, 2, 3, 4, 5, … ; 分别记为s,p,d,f,g,…
R Tn ,l nx (2 s , 2 p , 3d ) 2 (n l ) R En ,l hc nx (2 s , 2 p , 3d 2 (n l )
~ 2 p ns
第一辅线系:
~
~ 2 p nd
柏格曼系:
~
R R , n 4,5, 2 2 (3 d ) ( n f )
~ 3 d nf
主线系:
~ ~
~
R R , n 3,4, 2 2 (3 s ) ( n p ) R R , n 4,5, 2 2 (3 p ) ( n s )
一. 碱金属原子光谱的实验规律(注意和氢原子的比较)
碱金属元素的原子光谱具有相似的结构,类似于氢原子光谱,可 分成几个线系。一般观察到的有四个线系,分别称为主线系、第 一辅线系(或称漫线系)、第二辅线系(或称锐线系)和柏格曼系(基 线系)。
系限 229.97 nm
Li原子光谱
(1) 主线系(the principal series):谱线最亮,波长的分布范围最广, 第一呈红色,其余均在紫外。 (2) 第一辅线系(漫线系the diffuse series):在可见部分,其谱线较 宽,边缘有些模糊而不清晰,故又称漫线系。 (3) 第二辅线系(锐线系the sharp series):第一条在红外,其余均在 可见区,其谱线较宽,边缘清晰,故又称锐线系。锐线系和漫 线系的系限相同,所以均称为辅线系。 (4) 柏格曼系(基线系the fundamental series):波长较长,在远红外 区,它的光谱项与氢的光谱项相差很小,又称基线系。
