§4.1 碱金属原子的光谱(PPT-YBY)
第四章碱金属原子

所以 n*<n
25
能量 E=-hcT 也比氢原子的小
三、量子力学定量处理
远离原子实运动 靠近原子实运动 能量和光谱项
Z e V(r) 4πε0 r
Ze ep V (r ) 2 40 r 40 r
* 2
*
2
hcR R E n T(n,) 2 2 (n Δ ) (n Δ ) 2 ep 2 4 0 ( 2 1)
上式表明由于原子实激化,碱金属原子 的势能变的比氢原子的势能更负,因此求解 薛定谔方程得到能级比氢原子的能级更低
24
轨道贯穿
1.轨道贯穿(电子云的弥散),对于那些偏心率很 大的轨道, 接近原子实的那部分还可能穿入原子实 发生轨道贯穿,这时Z*>1,从而使能量降低。 2.光谱项为:
RZ 2 T n2
由 Tn 和 R 我们可以求得 n 。 对锂原子有 n RLi
*
n
T
6
锂的光谱项值和有效量子数
数据来源 电子态 n=2 3 4 5 6 7 0.40
第二辅 线系 主线系
s,=0
T 43484.4 16280.5 8474.1
n* 1.589 2.596 3.598
5186.9 3499.6 2535.3
2
一、碱金属原子光谱的实验规律
1、 碱金属原子光谱具有原子光谱的一般规律性;
2、通常可观察到四个谱线系。
各种碱金属原子的光谱,具有类似的结构。 主线系(也出现在吸收光谱中); 第二辅线系(又称锐线系);
第一辅线系(又称漫线系);
柏格曼系(又称基线系)。
3
原子物理学4
s
电子的自旋轨道耦合
电子围着原子核做圆周运动, 原子的总磁矩和总角动量都来 源于电子的轨道运动和电子的 自旋。 j l s 总磁矩:
总角动量: P j Pl Ps
价电子
e
Ze
由量子力学可知,Pj也是量子化的, 相应的 总角动量量子数用 j 表示,且有
§4.4 电子自旋同轨道运动的相互作用
电子的自旋
Uhlenbeck and Goudsmit 在1925年提出: 实验依据: (1)史特恩-盖拉赫实验出现偶数分裂的事实 (2)碱金属原子光谱的精细结构
P 电子具有某种方式的自旋; s s ( s 1), s 1 2
相对于外磁场方向,自旋角动量Ps在空间只能取朝上和 P 1 朝下两种取向: s B Psz ms , ms z 自旋磁矩和自旋角动量的关系是:
碱金属原子态的符号:
电子态符号:l 0 ,1, 2 , 3 ,
s, p , d , f ,
比如: n=3时,3s, 3p, 3d
原子态符号:由价电子的诸量子数来描述
L 0 ,1, 2 , 3 , S , P , D , F ,
s 1 2 L l: j ls: ,2 s 1 2 :
2
j
*
j ( j 1) l ( l 1) s ( s 1)
c
j
l
*2
l
*
2
s
*
讨论: (1) n和l相同,s不变,只有j不同,不同的j值具有不同 的能量
l 0 时, j l s l 1 / 2 l 0 时, j l s l 1 / 2,或
原子物理学_碱金属原子的光谱

§4.1 碱金属原子的光谱一、碱金属原子的光谱各个碱金属原子的光谱具有相似的结构,光谱线也类似于氢原子光谱,可分成几个线系,一般观察到的有四个线系,分别称为主线系、第一辅线系(或称漫线系、第二辅线系(或称锐线系)和柏格曼系(基线系)。
(1)主线系(the principal series ):谱线最亮,波长的分布范围最广,第一呈红色,其余均在紫外。
(2)第一辅线系(漫线系the diffuse series ):在可见部分,其谱线较宽,边缘有些模糊而不清晰,故又称漫线系。
(3)第二辅线系(锐线系the sharp series ):第一条在红外,其余均在可见区,其谱线较宽,边缘清晰,故又称锐线系。
锐线系和漫线系的系限相同,所以均称为辅线系。
(4)柏格曼系(基线系the fundamental series ):波长较长,在远红外区,它的光谱项与氢的光谱项相差很小,又称基线系。
二、线系公式H 原子光谱:)11()()(~22n m R n T m T -=-=ν当∞→n 时,2)(~~m R m T ==→∞νν⇒系限。
里德伯研究发现,与氢光谱类似,碱金属原子的光谱线的波数也可以表示为二项之差:)*1*1(~22**n m R T T n m -=-=ν **m n > ⇒碱金属原子的里德伯公式 *n 、*m :有效量子数。
当∞→n 时,*~~m T =→∞νν⇒系限。
1.有效量子数H 原子:主量子数n 是整数碱金属原子:*n 、*m 不是整数⇒有效量子数2.量子数亏损*n 、*m 和整数之间有一个差值,用l ∆表示,*n n l -=∆ ⇒量子数亏损 l ∆与n 无关,与l 有关,→l 大,→∆l 小,=l 0、1、2、3……⇒ f d p s ,,,3.光谱项2**n R T n =⇔2)(nR n T =,*n ⇔n l n T n n T R n T T l n m ∆−−−→−−−−→−−−−→−-=∆=-=**~*~**νν151009729.1-⨯=cm R Li4.电子状态符号电子状态用量子数n 、l 、l m 描述对一定的n ,l =0、1、2……n -1,共n 个值。
§4.1 碱金属原子的光谱(PPT-YBY)

说明:以上给出的光谱线系图,是发射光谱。若观察吸收光谱 则只能观察到与主线系相对应的吸收光谱。这是因为,只有主 线系与原子的基态相联系,而产生吸收光谱的物质一般都处于 基态。 2、光谱项的表达式 里德伯碱金属原子光谱的公式 (1) (2) (3)
RA RA 1 vn T v (固) T( 动) 2 2 n n n 2
图1.3 氢原子和碱金属原子(锂)能级及跃迁示意图
图1.3 氢原子和 碱金属原子(锂、 钠)能级及跃迁 示意图
二、光谱的特征 1、碱金属原子光谱的四组谱线分类:(以锂Li原子为例) (1)主线系 np 2s 系限:(229.97nm) 紫外到可见
(2)锐线系,又称第二辅线系:ns 2p 系限:(349.9nm) 第一条红外,其余可见
第04章 原子的精细结构:电子的自旋
§4.1 碱金属原子的光谱
1 1 2 2 n n
里德伯公式 RH
系限 第一项是固定项,是跃迁末态 第二项是动项,是跃迁初态
一、碱金属原子光谱的特征 1、氢原子结构及能级
mz 2 e4 hcz 2 R En 2 2 2 2 (4 0 ) 2 n n
三、碱金属原子光谱的精细结构: 1、精细结构及特征: (1)主线系和锐线系(第二辅线系)分裂为两条线。
主线系: p : p (n)
p
: ( n ) 锐线系(第二辅线系: s s
s
(2)第一辅线系(漫)和柏格曼线系(基)分裂为三条。
d13
s
: (n) d12 d
能级只于量子数n有关 2、碱金属原子的结构、光谱及能级 (1)碱金属原子的结构: 原子实和一个价电子构成,见图1.1
碱金属原子的光谱

4.954
4389. 2
5.955
3046. 9
6.954
2239. 4
d,l 2 n
12202. 5 6862. 5
5.000
4381. 2
6.001
3031. 0
7.000
0.001
0.000
f ,l 3
n*
T T
4.000
27419. 4 12186. 4 6854. 8
轨道贯穿
e
e
非贯穿轨道
贯穿轨道
当 l 很小时,价电子的轨道极扁, 价电子的可能穿过原子实 轨道贯穿。 实外 Z*=1 贯穿 Z* > 1 平均:Z* > 1
R * 2 TZ 光谱项: 2 n
T R R n* 2 n 2
R R n 2 n* 2 ( ) * Z
~ 3s np
~ 第一辅线系:
~ 3 p nd
第二辅线系:
~
~ 3 p ns
柏格曼系:
~
R ( 3 d )2
( n f )2
R
~ 3d nf
总结 谱线特征:1)四套线系(四套动项); 2)三个终端(三套固定项); 3)两个量子数(n,l)确定能级 。 光谱项
5.004
4387. 1 3046. 6 2238. 3
氢
n
~
~
R n
*2
n
*
RLi 109729 T T
n *以及 , 表4.1列出了从锂原子的各个线系算出的T、 从表中可以看出: (1) n *一般略小于 n , 只有个别例外。 (2) 同一线系的 差不多相同,即 l 相同的 大概相同。 (3) 不同线系的 不同,且l愈大, 愈小。 (4) 每个线系的系限波数恰好等于另一个线系的第二 项的最大值。
碱金属原子光谱

碱金属原子光谱
碱金属原子光谱,特指碱金属锂、钠、钾、铷、铯等元素的光谱。
它们具有相似的结构,明显地分成几个线系。
通常观察到的有主线系、第一辅线系(漫线系)、第二辅线系(锐线系)和伯格曼线系(基线系)。
众所熟知的钠黄光波长为589.3纳米,就是钠光谱主线系的第一条谱线。
碱金属原子都具有相似的结构,内层的z-1 个电子与原子核组成原子实,最外层只有一个价电子,与氢原子有些类似,不同的是电子运动对原子实有极化和贯穿作用,引起不同轨道的电子能态的较大分裂,能级对l的简并解除。
另外由于电子自旋取向不同,引起自旋轨道耦合的能量微小分裂,因此碱金属原子的能级除S态是单层的外,其他P、D、F态都是双层的。
根据单价原子光谱的选择定则,可得出,主线系和锐线系是双线结构,漫线系和基线系为三线结构。
碱金属原子与氢原子光谱规律相似,是由于它们的原子结构相似,虽然碱金属元素与氢元素的性质极不相同,但它们都只有一个外层电子,称为价电子。
内满充壳层电子与原子核组成原子实,价电子即处于原子实的中心势场中。
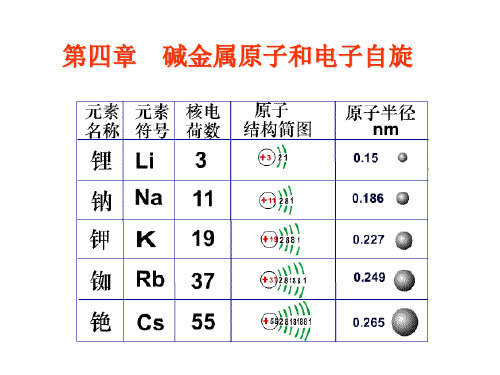
按锂、钠、钾、铷、铯的次序原子实内的电子数分别是2、10、18、36、54、86,价电子所在的轨道的主量子数分别为n≥2、n≥3、n≥4、n≥5、n≥6。
原子物理学_碱金属原子的光谱
§4.1 碱金属原子的光谱一、碱金属原子的光谱各个碱金属原子的光谱具有相似的结构,光谱线也类似于氢原子光谱,可分成几个线系,一般观察到的有四个线系,分别称为主线系、第一辅线系(或称漫线系、第二辅线系(或称锐线系)和柏格曼系(基线系)。
(1)主线系(the principal series ):谱线最亮,波长的分布范围最广,第一呈红色,其余均在紫外。
(2)第一辅线系(漫线系the diffuse series ):在可见部分,其谱线较宽,边缘有些模糊而不清晰,故又称漫线系。
(3)第二辅线系(锐线系the sharp series ):第一条在红外,其余均在可见区,其谱线较宽,边缘清晰,故又称锐线系。
锐线系和漫线系的系限相同,所以均称为辅线系。
(4)柏格曼系(基线系the fundamental series ):波长较长,在远红外区,它的光谱项与氢的光谱项相差很小,又称基线系。
二、线系公式H 原子光谱:)11()()(~22n m R n T m T -=-=ν当∞→n 时,2)(~~m R m T ==→∞νν⇒系限。
里德伯研究发现,与氢光谱类似,碱金属原子的光谱线的波数也可以表示为二项之差:)*1*1(~22**n m R T T n m -=-=ν **m n > ⇒碱金属原子的里德伯公式 *n 、*m :有效量子数。
当∞→n 时,*~~m T =→∞νν⇒系限。
1.有效量子数H 原子:主量子数n 是整数碱金属原子:*n 、*m 不是整数⇒有效量子数2.量子数亏损*n 、*m 和整数之间有一个差值,用l ∆表示,*n n l -=∆ ⇒量子数亏损 l ∆与n 无关,与l 有关,→l 大,→∆l 小,=l 0、1、2、3……⇒ f d p s ,,,3.光谱项2**n R T n =⇔2)(nR n T =,*n ⇔n l n T n n T R n T T l n m ∆−−−→−−−−→−−−−→−-=∆=-=**~*~**νν151009729.1-⨯=cm R Li4.电子状态符号电子状态用量子数n 、l 、l m 描述对一定的n ,l =0、1、2……n -1,共n 个值。
原子物理学——碱金属原子的光谱
§4.1 碱金属原子的光谱一、碱金属原子的光谱各个碱金属原子的光谱具有相似的结构,光谱线也类似于氢原子光谱,可分成几个线系,一般观察到的有四个线系,分别称为主线系、第一辅线系(或称漫线系、第二辅线系(或称锐线系)和柏格曼系(基线系)。
(1)主线系(the principal series ):谱线最亮,波长的分布范围最广,第一呈红色,其余均在紫外。
(2)第一辅线系(漫线系the diffuse series ):在可见部分,其谱线较宽,边缘有些模糊而不清晰,故又称漫线系。
(3)第二辅线系(锐线系the sharp series ):第一条在红外,其余均在可见区,其谱线较宽,边缘清晰,故又称锐线系。
锐线系和漫线系的系限相同,所以均称为辅线系。
(4)柏格曼系(基线系the fundamental series ):波长较长,在远红外区,它的光谱项与氢的光谱项相差很小,又称基线系。
二、线系公式H 原子光谱:)11()()(~22n m R n T m T -=-=ν当∞→n 时,2)(~~m R m T ==→∞νν⇒系限。
里德伯研究发现,与氢光谱类似,碱金属原子的光谱线的波数也可以表示为二项之差:)*1*1(~22**n m R T T n m -=-=ν **m n > ⇒碱金属原子的里德伯公式 *n 、*m :有效量子数。
当∞→n 时,*~~m T =→∞νν⇒系限。
1.有效量子数H 原子:主量子数n 是整数碱金属原子:*n 、*m 不是整数⇒有效量子数2.量子数亏损*n 、*m 和整数之间有一个差值,用l ∆表示,*n n l -=∆ ⇒量子数亏损 l ∆与n 无关,与l 有关,→l 大,→∆l 小,=l 0、1、2、3……⇒ f d p s ,,,3.光谱项2**n R T n =⇔2)(nR n T =,*n ⇔n l n T n n T R n T T l n m ∆−−−→−−−−→−−−−→−-=∆=-=**~*~**νν151009729.1-⨯=cm R Li4.电子状态符号电子状态用量子数n 、l 、l m 描述对一定的n ,l =0、1、2……n -1,共n 个值。
原子物理学 课件-第四章 碱金属原子和电子自旋
原子物理学
证:设是机械自旋 电子半径: 电荷: 磁矩:
安束2(焦/特)
(超过光速)
因此,电子自旋不是机械自旋
(电子自旋,其实一点也没有“自旋”的意义。最好称呼它 为“内禀角动量”,它是微观粒子内部属性,与运动状态毫 无关系。它的性质与角动量类似,但不能用任何经典语言 描述。在经典物理中,找不到对立物)。
原子物理学
二、由光谱精细结构推断碱金属原子能级(以锂为例)
1、二辅系: 的跃迁,由于双线间隔相 等,设想 能级不分裂,单层,p能级分裂,双层。 末态p能级:各能级共 同有关,双线间隔为 2p能级分裂间隔。
2、主线系: 的跃迁,双线间隔随 增 大而减小,p能级分裂间隔随 增大而逐渐减小
原子物理学
原子物理学
(2)自旋取向的意义:
原子实坐标
电子坐标 一个顺着磁场 一个逆着磁场
电子自旋取向:
原子物理学
二、从轨道,自旋角动量的耦合 看能级双分裂
角动量耦合:已知
求:总角动量
原子物理学
1、玻尔理论
与
夹角0,
2、量子力学
从上式可看出,
与
不能平行或反平行
原子物理学
三个终端 主 Ⅰ Ⅱ 柏
光谱项: 若测得T, 则可算得
每一线系限波数 恰为另一线系动 项中最大的一个
原子物理学
对于锂, 表4.1给出, (三)两个量子数 仿效氢光谱:
碱光谱:
即碱原子能量与两个量子数
碱金属原子能级图。
有关.
(1)对同一个主量子数 ,有几个能级 (2)能级按 分类, 相同属同一例
1925年,荷兰:两位大学生,库仑贝克,古兹密特 一)电子自旋假设: 1、每个电子都具有固有的自旋角动量
第四章碱金属原子光谱
dE q( E l cos ) dz
dz
)
z
qE
q
合力
dE dE Fz q l cos pz dz dz
pz p cos :
p 在外场方向的投影
2.磁矩:
(1)均匀磁场中: 方向与 i 方向满足右手螺旋关系
iA
M B F 0
~ T3S TnP 主 线 系: ~ 第一辅线系: T T
3P nd
,n = 3, 4… ,n =3,4,5… ,n =4,5… , n =4,5…
~ T3P TnS 第二辅线系: ~ T T
柏格曼系:
3d nf
§4.1.3能量和能级
R (n l ) 2 R En ,l hc 2 (n l )
e p n B 2m
z cos n cos
2 n 1 个奇数,但实验结果是偶数。
存在问题:
A、按玻尔理论,理论上预言应分为2n+1束,即 奇数束 实验上是两束,为偶数。
B、按量子力学处理 基态,
l (l 1) B ,
l 0,1,2,
dB dB Fz cos z dz dz
1.实验证明了原子的空间量子化。 两条细痕 两个 两个 两个
2.玻尔-索末菲理论与实验比较
轨道角动量:
外场方向投影: 轨道磁矩: 外场方向投影:
h p n 2
h p n 2
n 1,2,3, n
n 0,1,2,, n
z
面积:
i
一个周期扫过的面积:
A dA 0
T
1 2 1 T 2 1 T L dt dt r 0 mr 2m 0 Ldt 2m T 2 2m
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原子实的极化和轨道贯穿 (a)原子实的极化:图1.2
图1.1碱金属原子的结构
n b l a nr n n
l值越小极化越强,能量愈底
图1.2 原字实的极化
(b)轨道的贯穿: 贯穿轨道只能发生在偏心率大的轨道,所以l越小贯穿越强,量 子亏损越大。 原子实的发生极化和电子贯穿原子实时电子感受的有效电荷 数将大于1即:Z * 1
一、碱金属原子的光谱的特征 由氢原子光谱和碱金属光谱的比较可以发现,相对于氢原子的 一条谱线在碱金属中会出现几条.例如相对于氢原子的巴尔末线 系 H (| n 3 | n 2) 的谱线可发现明显分裂为三条。
1、碱金属原子光谱的四组谱线分类:(以锂Li原子为例) (1)主线系 np 2s 系限:(229.97nm) 紫外到可见
(2)第一辅线系(漫)和柏格曼线系(基)分裂为三条。
nd 2p
nf 3d
d13 s
(n) 0 d 12 d d 12
2.定性分析:
一条谱线分裂为两条,这表明跃迁的初态和末态所相应的两 条能级中至少有一条分裂成两条;一条谱线分裂为三条,这表 明跃迁的初态和末态所相应的两条能级都分裂成两条。如果末 态分裂了,那么各谱线的分裂间距一定不随谱线的改态可能产生不同的分裂, 从而使谱线的分裂随谱线的不同而不同。
(a) 第二辅线系(锐) ns 2 p (b)主线系
np 2s
(c)第一辅线系(漫) nd 2 p (d)基线系,又称伯格曼线系 nf 3d 3、结论
(1)碱金属原子的能级S是单层的,其余所有 p, d , 等能级都是双层的。
2、碱金属原子的结构及能级
能级只于量子数n有关
由原子的发光机理可推知,碱金属光谱线的分裂是由能级 分裂造成的,即 碱金属原子能级和氢原子能级相比,同一n 的不同l值的能级明显不同。
(1)碱金属原子的结构:
原子实和一个价电子构成,见图1.1
(2)能级分裂的原因:
mz *2 e4 hcz *2 R En 2 2 2 (4 0 ) 2 n n2
mz *2 e4 hcz *2 R En 2 2 2 (4 0 ) 2 n n2
所以,碱金属能级比氢原子相应能级低。 三、碱金属原子光谱公式的解释: 采用玻尔理论中的光谱项公式,但用Z*代替Z
z*2 RA RA RA RA RA RA Tn 2 n 2 n 2 *2 2 2 n ( Z* ) ( 1 ) (n n) ( n ) n
第04章 原子的精细结构 电子的自旋
§4.1 碱金属原子的光谱及能级 里德伯氢公式
RH 1 1 2 n2 n
系限 第一项是固定项,是跃迁末态 第二项是动项,是跃迁初态
类氢离子光谱公式
1 2 2 z 2e4 1 1 1 2 RA 2 3 2 2 2 (4 0 ) h c n n ( n / z ) ( n / z )
(2)锐线系,又称第二辅线系:ns 2p 系限:(349.9nm) 第一条紫外,其余可见 (3)漫线系,又称第一辅线系 nd 2p 系限:(350nm). 可见光 (4)基线系,又称伯格曼线系。nf 3d 系限:(819nm). 红外 特点: ① 每一个线系的线系限(固定项)数恰好是另一个线系的第二 谱项值(动项)中最大的。 ② 谱线的强度、间距与波长变化的关系: I
(2)双层能及间隔随量子数n的增加而渐减。既对同一l值,即 n增大,El减小。 (3)对同一n值双层能及间隔随量子数l的增加而渐减。即l增大, El减小
至于为什么会出现同一l的双能级结构,这是我们以前所学的 理论所无法解释的,也即单靠电子的轨道运动是无法解释的。
碱金属光谱(三看碱金属光谱)
2、光谱项的表达式 里德伯碱金属原子光谱的公式
RA RA 1 n T v v (固) T( 动) 2 2 n n n 2
n
(1) (2)
n v T固 lim v *
n , n*
n
称为有效量子数,其计算公式为:
n RA Tn
( ns 2 p )
n
R R (2 p )2 (n s )2
一辅 漫
( nd 2 p )
R R n 2 2 (2 ) ( n ) p d ( nd 2 p )
R R n 2 2 (3 ) ( n ) d f ( nF 3d )
(7)
基线 柏格曼
( nF 3d )
(8)
故碱金属原子的光谱项可以表达为:
T
R n
2
R (n ) 2
(9)
它与氢原子光谱项的差别在于有效量子数不是整数,而是 主量子数减去一个数值 二、碱金属原子能级 1、氢原子结构及能级
me4 hcR En 2 2 2 2 (4 0 ) 2 n n
图1.3 氢原子和 碱金属原子(锂、 钠)能级及跃迁 示意图
四、碱金属原子光谱的精细结构: 1、精细结构及特征: (1)主线系和锐线系(第二辅线系)分裂为两条线。 主线系: np 2s
: (n) p p p
锐线系(第二辅线系):ns 2p
(n ) s s s
RA v
(3)
实验规律
n n
---为正数,又叫量子亏损
(4)
由此就可将锂原子的四个光谱线系的数值关系总结为下列 四个公式:
主线系
( np 2 s )
R R n (2 )2 (n )2 v s p ( np 2 s )
(5) (6)
二辅 锐
( ns 2 p )
其中利用公式:
1 1 x x2 (1)n1 xn 1 x
这说明: * n 有效量子数 n 比主量子数n 小。 (n / z*) n 3、氢原子和碱金属原子能级及光谱的比较图(图1.3 ) 跃迁选择定则:l 1 注:由于l的差别就是角动量的差别,由于光子的角动量是1, 要在跃迁时放出一个光子,角动量只能差1。这也是角动量守 恒的要求。
