国内外生物制品、审评指导原则及法律法规清单-2017-01-25
生物制品生物活性效价测定方法验证指导原则

生物制品生物活性/效价测定方法验证指导原则一、前言对药品质量控制分析方法进行验证的目的是证明采用的方法适合于相应检测要求。
生物制品质量控制中生物活性/效价为反映生物制品有效性的关键质量属性,对相应的测定方法进行规范的验证是保障其适用性的前提。
本指导原则从验证方案的制定、各验证指标的具体验证策略、验证结果的记录和方法的监控及再验证的角度阐述了生物活性/效价测定方法验证相关的要求,旨在对新建的或拟修订的生物制品生物活性/效价测定方法所开展的验证工作进行规范与指导。
本指导原则中的生物活性/效价测定主要是指相对效价测定,该法系将供试品的生物反应与已知标准品产生的反应相比较,从而定量测定供试品相对于标准品的效价。
二、方法验证的基本要素1.验证方案方法验证需根据验证方案来完成。
验证方案不仅应包括验证设计、验证指标、合理的可接受标准和数据分析计划,还应涵盖不符合可接受标准时可采取的措施等。
1.1验证设计验证设计主要涉及样品的选择、实验变异来源的考量及试验重复策略等。
应采用具有代表性的样品进行验证试验,并在验证方案中注明所需样品的类型及数量。
实验变异的来源主要包括样品的制备、试验内和试验间的影响因素。
试验内变异可能受方法开发阶段所确定的实验条件(温度、pH、孵育时间等)、实验设计(动物数量、稀释度组数、每个稀释组的重复数、稀释度间隔等)、试验过程、系统适用性和样品适用性要求、统计分析等因素的影响。
而试验间变异主要受不同分析人员、不同试验时间、不同仪器设备和试剂批次等因素的影响。
因此,一个设计良好的验证方案应综合考量试验内和试验间变异的来源。
此外,每轮验证试验中标准品和供试品均应独立制备。
验证中使用的重复策略应尽量反映影响效价测定结果的实验因素。
1.2验证指标与可接受标准由于相对效价测定方法各具特点,并随分析对象而变化,因此需视具体方法拟订具体的验证指标,关于常见验证指标的具体讨论见本节“2.各验证指标的验证策略”项下。
预防用生物制品临床前安全性评价技术审评一般原则

指导原则编号:【S】G P T2-1预防用生物制品临床前安全性评价技术审评一般原则二零零五年十二月目录一、概述 (2)二、适用范围 (3)三、试验设计中的重点问题 (3)(一)相关动物 (3)(二)免疫毒性 (4)(三)具体问题具体分析 (4)四、研究内容 (5)(一)急性毒性试验 (5)(二)长期毒性试验 (5)(三)局部刺激性试验 (7)(四)过敏试验 (7)(五)生殖毒性试验 (8)(六)其它特殊考虑 (8)1.免疫原性试验和保护力试验 (8)2. 佐剂 (9)3.其它 (10)五、结语 (10)六、参考文献 (10)七、起草说明 (11)八、著者 (117)一、概述预防用生物制品(以下简称疫苗)系指含有抗原、能够诱导人体产生特异性主动免疫的制剂,它可以保护机体免受感染原、毒素,以及感染原引起的抗原性物质的损伤。
疫苗的安全性评价贯穿非临床试验、临床试验和上市后评价。
它包括对原辅材料、生产工艺和过程的控制、理化性质和生物学性质的检定、动物安全性评价、临床安全性评价以及上市后不良反应监测等一系列过程。
本文适用于疫苗的临床前动物安全性评价。
临床前动物安全性评价的主要目的系通过相关动物来考察疫苗的安全性,包括对免疫器官和其它毒性靶器官的影响、毒性的可逆性,以及与临床相关的参数,预测其在大规模人群中使用时可能出现的不良反应,降低临床试验受试者和临床使用者承担的风险,并为临床试验方案的制订提供依据。
疫苗可能导致的毒性反应主要包括:制品成分本身作为毒性物质对机体的直接损伤、诱导免疫系统引起的与免疫相关的毒性,以及污染物和残余杂质引起的毒性。
由于疫苗系通过诱导免疫系统产生抗体及/或效应T细胞发挥作用,因此其最主要的潜在毒性来自与免疫系统相关的毒性,常规药物安全性评价的方法并不完全适用于疫苗。
本文仅代表目前对疫苗安全性评价的基本认识,其中的内容并不完全是注册申请人进行开发时必须完成的内容,仅作为技术审评的一般原则。
国内外生物制品、审评指导原则及法律法规清单
体外诊断试剂说明书编写指导原则
2008-09-04
6
体外诊断试剂临床研究技术指导原则
2008-09-04
7
重组制品生产用哺乳动物细胞质量控制技术评价一般原则
2008-09-04
8
预防用疫苗临床试验不良反应分级标准指导原则
2008-09-04
9
预防用生物制品临床前安全性评价技术审评一般原则
2008-09-04
2008-09-04
15
结合疫苗质量控制和临床研究技术指导原则
2008-09-04
16
化学药物和生物制品临床试验的生物统计学技术指导原则
2008-09-04
17
多肽疫苗生产及质控技术指导原则
2008-09-04
18
疫苗临床试验技术指导原则
2008-09-04
19
化学药品、生物制品说明书指导原则(第二稿)
CFDA法律法规
1
中华人民共和国药品管理法
2
药物非临床研究质量管理规范
3
药品注册管理办法
4
生物制品注册分类及申报资料要求
5
预防用生物制品注册申办须知
6
新药注册特殊审批管理规定
7
药品补充申请注册事项及申报资料要求
8
药品包装用材料、容器管理办法(暂行)
9
药品说明书和标签管理规定
10
疫苗储存和运输管理规范
3
人用药物遗传毒性试验和结果分析指导原则
2011年11月
4
研发期间安全性更新报告
2010年8月
5
药物或生物技术产品开发相关的生物标记物:验证申请的背景资料、结构和格式
2010年8月
国内外生物类似药研究指导原则要点之比较

国内外生物类似药研究指导原则有很大的不同,但是旨在保护患者的
安全并获得充分的药物疗效。
下面让我们快速看一看国内外生物类似
药研究指导原则的比较。
首先,注册要求为不同的国内外生物类似药研究指导原则提供了不同
的审查要求。
在国外,申请生物类似药的地方有很多,但是国外新药
申请通常要求比国内要求更严格一些。
国外新药申请除了要提供提名
药的药效学,药代动力学和安全性研究证据之外,还要求申请人必须
提供申请提名药的秋季羹准的药物 - 相关的临床研究的结果,以便证实其疗效和安全性。
此外,对制剂要求也有所不同。
在海外,通常会对新药的制造和装配
流程要求更加严格,这样可以确保药品质量,确保患者可以安全实施。
在国内,生产制造商常常只要求按照规定的质量标准生产制造,这样
做更加简单,更容易获得批准。
另外,国内优先用原百威原料生产药品,而国外对各种原料生产都适用。
另外,监督体系也有所不同。
海外的监管机构会更加严格,他们会定
期对新药的效果和安全性进行审核。
而国内的新药申请审查则相对较松,在申请通过后,药品的疗效和安全性的监管也会相对较轻。
总的来说,不管是在国内还是在国外,申请生物类似药的原则和要求
都是一致的,旨在保护患者的安全和实施有效的药物治疗,而有些方
面和要求往往会有所不同,在研究和实施新药前,必须充分了解当地
的新药注册要求。
以上就是国内外生物类似药研究指导原则的比较。
指导原则不仅仅针
对注册要求,对制剂要求和监督体系也有所不同,但所有这些都旨在保护患者的安全,以获得更好的治疗效果。
生物制品GMP检查指南(双语版)

生物成品GMP查抄指南GMP INSPECTION GUIDELINE FOR BIO-PRODUCT由国家食品药品监督办理局颁布ISSUED BY SFDA OF CHINA1. 机构与人员COMPANY ORGANIZATION AND PERSONNEL→0402:生物成品出产企业出产和质量办理负责人是否具有相应的专业常识〔细菌学、病毒学、生物学、分子生物学、生物化学、免疫学、医学、药学等〕,并具有丰富的实践经验以确保在其出产、质量办理中履行其职责。
Whether the personnel who are in charge of the bio-products production and quality management that have the corresponding knowledge background on Bacteriology, Virology, Biology, Molecular Biology, Biochemistry, Immunology, Medicine,Pharmaceutics etc. and to possess abundant experience to insure fulfilling theresponsibilities in the production and quality management.→0702:从事生物成品制造的全体人员〔包罗清洁人员、维修人员〕是否按照其出产的成品和所从事的出产操作进行专业〔卫生学、微生物学等〕和平安防护培训。
Whether all the personnel (including the cleaning stuff and maintenance stuff) that related with the bio-products production who have received the professional training on production and corresponding knowledge (Hygiene, Microbiology etc.) and security training.2. 厂房与设施PREMISE AND FACILITY→*2201:出产用菌毒种与非出产用菌毒种、出产用细胞与非出产用细胞、强毒与弱毒、死毒与活毒、脱毒前与脱毒后的成品和活疫苗与灭活疫苗、人血液成品、预防成品等加工或灌装是否同时在同一出产厂房内进行。
生物制品相关法规指南汇编

生物制品相关法规指南汇编English Answer:Guidelines for Regulatory Compliance of Biological Products.Introduction.Biological products are a complex and rapidly evolving field, with new products and technologies emerging all the time. This has led to a growing need for clear and comprehensive regulatory guidance to ensure the safety, efficacy, and quality of these products.Regulatory Framework.The regulatory framework for biological products varies from country to country, but there are some general principles that apply to most jurisdictions. These principles include:Pre-market approval: Biological products must be approved by a regulatory authority before they can be marketed. This approval process typically involves a review of the product's safety, efficacy, and quality.Manufacturing standards: Biological products must be manufactured in accordance with Good Manufacturing Practices (GMPs). GMPs are designed to ensure that products are produced in a consistent and controlled manner.Post-market surveillance: Regulatory authorities typically monitor the safety and efficacy of biological products after they have been marketed. This monitoring can include collecting data on adverse events, conducting clinical trials, and reviewing scientific literature.Specific Regulations.In addition to the general principles outlined above, there are a number of specific regulations that apply to biological products. These regulations vary from country tocountry, but some of the most common include:The US Food and Drug Administration (FDA) regulations for biological products: The FDA has a long history of regulating biological products, and its regulations are considered to be among the most stringent in the world. The FDA's regulations cover a wide range of topics, including pre-market approval, manufacturing standards, post-market surveillance, and product labeling.The European Medicines Agency (EMA) regulations for biological products: The EMA is the European Union's regulatory authority for medicinal products, including biological products. The EMA's regulations are based on the EU's pharmaceutical legislation, and they are similar to the FDA's regulations in many respects.The World Health Organization (WHO) guidelines for the regulation of biological products: The WHO provides guidance on the regulation of biological products to help countries develop their own regulatory frameworks. The WHO's guidelines are based on the latest scientificevidence and best practices.Conclusion.The regulatory landscape for biological products is complex and ever-changing. However, by understanding the general principles and specific regulations that apply to these products, manufacturers and regulators can ensure that they are safe, effective, and of high quality.Chinese Answer:生物制品的相关法规指南汇编。
国内外生物制品审评指导原则及法律法规清单

1
中华人民共和国药品管理法
2
药物非临床研究质量管理规范
3
药品注册管理办法
4
生物制品注册分类及申报资料要求
5
预防用生物制品注册申办须知
6
新药注册特殊审批管理规定
7
药品补充申请注册事项及申报资料要求
8
药品包装用材料、容器管理办法(暂行)
9
药品说明书和标签管理规定
10
疫苗储存和运输管理规范
2015年7月
2
妊娠、哺乳和生殖潜能:人用处方药和生物制品说明书—内容和格式—行业指南(小企业遵从指南)
2015年6月
3
申办方-研究者准备和提交的研究新药申请
2015年5月
4
风险评估和减低对策:修改和校正
2015年4月
5
抗非小细胞肺癌药物和生物制品批准的临床试验终点
2015年4月
6
在临床研究中使用电子知情同意书—问题和解答
2008-09-04
20
预防用以病毒为载体的活疫苗制剂的技术指导原则
2008-09-04
21
预防用DNA疫苗临床前研究技术指导原则
2008-09-04
22
人用重组DNA制品质量控制技术指导原则
2008-09-04
23
细胞培养用牛血清生产和质量控制技术指导原则
2008-09-04
24
人用单克隆抗体质量控制技术指导原则
36
临床试验中应用计算机系统的技术指导原则
2007年5月
37
抗肿瘤药物临床试验终点的技术指导原则
2007年5月
38
以临床为目标制定研发策略
2007年3月
国内外生物制品、审评指导原则及法律法规清单-2017-01-25

1
中华人民共和国药品管理法
2
药物非临床研究质量管理规范
3
药品注册管理办法
4
生物制品注册分类及申报资料要求
5
预防用生物制品注册申办须知
6
新药注册特殊审批管理规定
7
药品补充申请注册事项及申报资料要求
8
药品包装用材料、容器管理办法(暂行)
9
药品说明书和标签管理规定
10
疫苗储存和运输管理规范
2014-05-13
4
药物毒代动力学研究技术指导原则
2014-05-13
5
药物单次给药毒性研究技术指导原则
2014-05-13
6
药物刺激性、过敏性和溶血性研究技术指导原则
2014-05-13
7
药物安全药理学研究技术指导原则
2014-05-13
8
药物QT间期延长潜在作用非临床研究技术指导原则
2014-05-13
2015年7月
2
妊娠、哺乳和生殖潜能:人用处方药和生物制品说明书—内容和格式—行业指南(小企业 Nhomakorabea从指南)
2015年6月
3
申办方-研究者准备和提交的研究新药申请
2015年5月
4
风险评估和减低对策:修改和校正
2015年4月
5
抗非小细胞肺癌药物和生物制品批准的临床试验终点
2015年4月
6
在临床研究中使用电子知情同意书—问题和解答
11
疫苗流通和预防接种管理条例(2016年修正)
12
药品注册现场核查管理规定
三、国外药品法规及指导原则清单
序号
名称
颁布时间
国际人用药品注册技术要求-国际协调会(ICH)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
儿科人群中的医学产品临床研究
2000年7月
9
人用药物安全药理学研究指导原则
2000年11月
10
临床试验中对照组的选择
2000年7月
11
临床试验的统计学指导原则
1998年2月
12
接受国外临床资料的种族影响因素
1998年2月
13
临床研究的一般考虑
1997年7月
14
生物技术药物的临床前安全性评价
1997年7月
2014-05-13
4
药物毒代动力学研究技术指导原则
2014-05-13
5
药物单次给药毒性研究技术指导原则
2014-05-13
6
药物刺激性、过敏性和溶血性研究技术指导原则
2014-05-13
7
药物安全药理学研究技术指导原则
2014-05-13
8
药物QT间期延长潜在作用非临床研究技术指导原则
2014-05-13
2008-09-04
25
人体细胞治疗研究和制剂质量控制技术指导原则
2008-09-04
26
人基因治疗研究和制剂质量控制技术指导原则
2008-09-04
27
变态反应原(变应原)制品质量控制技术指导原则
2008-09-04
28
艾滋病疫苗临床研究技术指导原则
2008-09-04
29
血液制品去除灭活病毒技术方法及验证指导原则
5
体外诊断试剂说明书编写指导原则
2008-09-04
6
体外诊断试剂临床研究技术指导原则
2008-09-04
7
重组制品生产用哺乳动物细胞质量控制技术评价一般原则
2008-09-04
8
预防用疫苗临床试验不良反应分级标准指导原则
2008-09-04
9
预防用生物制品临床前安全性评价技术审评一般原则
2008-09-04
11
疫苗流通和预防接种管理条例(2016年修正)
12
药品注册现场核查管理规定
三、国外药品法规及指导原则清单
序号
名称
颁布时间
国际人用药品注册技术要求-国际协调会(ICH)
1
临床研究报告的结构和内容问与答
2012年6月
2
非抗心律失常药物致QT QTc间期延长及潜在致心律失常作用的临床评价问与答(R1)
2012年4月
CFDA法律法规
1
中华人民共和国药品管理法
2
药物非临床研究质量管理规范
3
药品注册管理办法
4
生物制品注册分类及申报资料要求
5
预防用生物制品注册申办须知
6
新药注册特殊审批管理规定
7
药品补充申请注册事项及申报资料要求
8
药品包装用材料、容器管理办法(暂行)
9
药品说明书和标签管理规定
10
疫苗储存和运输管理规范
2015年3月
7
药物和生物制品儿科研究的一般临床药理学考虑
2014年12月
8
妊娠、哺乳和生殖潜能:人用处方药和生物制品说明书—内容和格式
2014年12月
9
人用处方药和生物制品说明书的患者咨询信息部分—内容和格式
2014年12月
10
以电子形式进行监管提交—标准化研究数据
2008-09-04
审评一般指导原则
1
治疗用生物制品非临床安全性技术审评一般原则
2010-05-06
2
预防用生物制品临床前安全性评价技术审评一般原则
2007-08-23
3
疫苗生产用细胞基质研究审评一般原则
2007-08-23
4
生物制品质量控制分析方法验证技术一般原则
2007-08-23
5
生物组织提取制品和真核细胞表达制品的病毒安全性评价的技术审评一般原则
2015年7月
2
妊娠、哺乳和生殖潜能:人用处方药和生物制品说明书—内容和格式—行业指南(小企业遵从指南)
2015年6月
3
申办方-研究者准备和提交的研究新药申请
2015年5月
4
风险评估和减低对策:修改和校正
2015年4月
5
抗非小细胞肺癌药物和生物制品批准的临床试验终点
2015年4月
6
在临床研究中使用电子知情同96年6月
16
临床安全性资料的管理:加速报告的定义与标准
1994年10月
17
药物代谢动力学(药代动力学):重复给药的组织分布研究指导原则
1994年10月
18
.药品注册所需的量效关系资料
1994年3月
19
特殊人群的研究:老年医学
1993年6月
美国食品药品监督管理局(FDA)
1
生殖毒性:药物研发过程中评价的行业指南
2008-09-04
15
结合疫苗质量控制和临床研究技术指导原则
2008-09-04
16
化学药物和生物制品临床试验的生物统计学技术指导原则
2008-09-04
17
多肽疫苗生产及质控技术指导原则
2008-09-04
18
疫苗临床试验技术指导原则
2008-09-04
19
化学药品、生物制品说明书指导原则(第二稿)
10
疫苗生产用细胞基质研究审评一般原则
2008-09-04
11
生物组织提取制品和真核细胞表达制品的病毒安全性评价技术审评一般原则
2008-09-04
12
生物制品质量控制分析方法验证技术一般原则
2008-09-04
13
生物制品生产工艺过程变更管理技术指导原则
2008-09-04
14
联合疫苗临床前和临床研究技术指导原则
2007-08-23
6
重组制品生产用哺乳动物细胞质量控制技术评价一般原则
2007-08-13
二、非临床研究指导原则及CFDA法律法规清单
非临床研究指导原则
序号
名称
颁布时间
1
非临床安全性评价供试品检测要求的Q&A
2014-05-13
2
药物重复给药毒性研究技术指导原则
2014-05-13
3
药物非临床药代动力学研究技术指导原则
3
人用药物遗传毒性试验和结果分析指导原则
2011年11月
4
研发期间安全性更新报告
2010年8月
5
药物或生物技术产品开发相关的生物标记物:验证申请的背景资料、结构和格式
2010年8月
6
上市后安全数据管理:快速报告的定义和标准
2003年11月
7
临床安全数据管理:已上市药品周期性安全数据更新报告
2003年6月
2008-09-04
20
预防用以病毒为载体的活疫苗制剂的技术指导原则
2008-09-04
21
预防用DNA疫苗临床前研究技术指导原则
2008-09-04
22
人用重组DNA制品质量控制技术指导原则
2008-09-04
23
细胞培养用牛血清生产和质量控制技术指导原则
2008-09-04
24
人用单克隆抗体质量控制技术指导原则
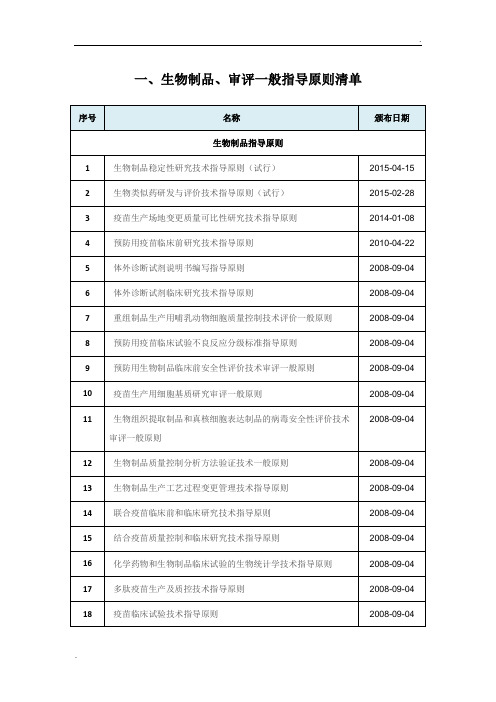
一、生物制品、审评一般指导原则清单
序号
名称
颁布日期
生物制品指导原则
1
生物制品稳定性研究技术指导原则(试行)
2015-04-15
2
生物类似药研发与评价技术指导原则(试行)
2015-02-28
3
疫苗生产场地变更质量可比性研究技术指导原则
2014-01-08
4
预防用疫苗临床前研究技术指导原则
2010-04-22
