酯的氨解
苯甲酸甲酯的氨解

苯甲酸甲酯的氨解苯甲酸甲酯,化学式为C8H8O2,是一个广泛应用于化学工业的有机化合物。
它具有特殊的化学性质,其中包括氨解反应。
本文将重点介绍苯甲酸甲酯的氨解反应及其相关应用。
一、苯甲酸甲酯的氨解反应概述苯甲酸甲酯的氨解反应是指苯甲酸甲酯与氨(NH3)在适当条件下发生反应,生成苯甲酸和甲胺。
该反应是一种酯的水解反应,也被称为酯水解。
苯甲酸甲酯的氨解反应可以通过加热或催化剂的作用来进行。
在常温下,苯甲酸甲酯与氨的反应速度较慢,需要较长的反应时间。
但是,使用催化剂可以加速反应速率,提高反应效率。
二、苯甲酸甲酯氨解反应的机理在苯甲酸甲酯的氨解反应中,催化剂通常起到促进反应的作用。
常用的催化剂包括氢氧化钠(NaOH)、氨基催化剂等。
这些催化剂能够提高反应中间体的活性,降低反应活化能,从而加速反应进程。
苯甲酸甲酯的氨解反应可以分为以下几个步骤:1. 水解反应:苯甲酸甲酯在水的存在下与氢氧化钠发生水解,生成苯甲酸盐。
C8H8O2 + NaOH → C6H5COONa + CH3OH2. 中和反应:苯甲酸盐与氨发生中和反应,生成苯甲酸和甲胺。
C6H5COONa + NH3 → C6H5COOH + CH3NH23. 氨解反应:甲酯中的甲基与甲胺发生反应,生成苯甲酸和二甲胺。
CH3OC6H5 + CH3NH2 → C6H5COOH + CH3NHCH3以上反应步骤是苯甲酸甲酯的氨解反应的主要过程,并且受催化剂的调节。
三、苯甲酸甲酯的氨解反应的应用1. 生产苯甲酸:苯甲酸甲酯的氨解反应是常见的合成苯甲酸的方法之一。
通过该反应,可以将苯甲酸甲酯转化为苯甲酸,用于医药、染料、香料等行业的生产。
2. 生产甲胺:苯甲酸甲酯的氨解反应还可用于甲胺的合成。
甲胺是一种重要的有机合成中间体,广泛应用于医药、农药等领域。
3. 催化剂研究:苯甲酸甲酯的氨解反应中,催化剂起到了关键作用。
通过研究不同催化剂的应用,可以提高反应效率,优化反应条件,推动催化剂领域的发展。
酯交换为酰胺-060123

经典化学合成反应标准操作酯交换为酰胺编者:杜晓行药明康德新药开发有限公司化学合成部目录1.前言 (2)2.酯交换为酰胺 (2)3.酯交换为N-取代酰胺 (2)1.前言酯和氨水反应可以很方便地得到酰胺。
N-取代酰胺一般可以利用相应的胺与酯直接反应得到,在有些条件下,需要有铝试剂的存在反应才能够顺利进行。
2.酯与氨交换一般酯的氨解通过氨的醇溶液或氨水来进行。
氨的醇溶剂氨解反应可通过加入适量的甲醇钠和氰化钠来催化。
用氨水直接氨解一般需要加热(当该反应温度到100度时,一定要用高压釜做这一反应),这类反应一般可以通过硫酸铜来进行催化。
反应的条件选择主要看酯的活性程度,一般脂肪酸酯的交换要比芳香羧酸酯来得容易,甲酯要比乙酯来得快。
对脂肪酸酯,α位的位阻大小也决定了反应的快慢。
酯通过甲酰胺在乙醇钠的存在下,高温也可得到相应的酰胺。
这一方法对各类的酯都比较有效,只是产品的分离比直接氨解稍微麻烦一些,但反应较快。
另外近年来,AlMe 3-NH 4Cl 或Me 2AlNH 2在多官能团及复杂化合物的合成中用的较多,该方法条件较强,各类酯都能很快的氨解。
其缺点是AlMe 3易自燃,操作不是太方便。
2.1 氨水用于脂肪羧酸酯氨解示例[1]NO OOOO NO H 2NOO NH OHTo ethyl 5-ethoxycarbonylmethyl-3-methylisoxazole-4-carboxylate (1.00 g, 4.15 mmol) was added an excess of conc. aqueous ammonia (d = 0.88 kg·dm -3, 5.0 cm 3) and EtOH (3.0 cm 3), and the suspension was stirred vigorously at room temperature for 14 h. After this period a white solid had precipitated which was filtered and recrystallized (EtOAc) to yield the desired product as a white solid (0.81 g, 92%).NO OOOO NO HNOOO MeNH 2 / toluenePrepared as described above for ethyl 5-carbamoylmethyl-3-methylisoxazole-4-carboxylate but using methyl-5-ethoxycarbonyl- 3-methylisoxazole-4-carboxylate (1.00 g, 4.15 mmol) and methylamine in toluene (30% w/v, 10.0 cm 3), to yield the desired product as a white solid (0.93 g, 99%).2.2 氨甲醇氨解脂肪羧酸酯示例[2] [3]NH O OCOOEtNH OO CONHMe MeNH / MeOHThe ester (4.11 g, 14 mmol) was dissolved in absol. methanolic ammonia (100 ml, 20 % NH 3), and the solution was allowed to stand at temperature for 3 days, the solvent was then evaporated, and the resulting crystalline was purified by recrystallization.2.3 氨水用于芳香羧酸酯氨解示例[4]NNCONH 2To an autoclave, was added methyl 6-methylniconate (500 g, 3.31 mol), sat. aq. NH 4OH (500 ml) and ethanol (500 ml). After sealing, the reaction was heated to 80℃ for 2 days. The cooled reaction mixture was filtrated, and the filter cake was recrystallized to afford white solid (247 g, 54.8%)。
酯的氨解
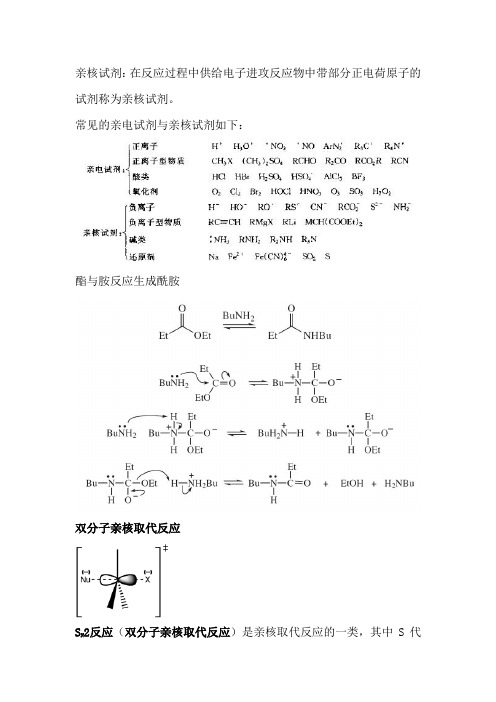
亲核试剂:在反应过程中供给电子进攻反应物中带部分正电荷原子的试剂称为亲核试剂。
常见的亲电试剂与亲核试剂如下:酯与胺反应生成酰胺双分子亲核取代反应S N2反应(双分子亲核取代反应)是亲核取代反应的一类,其中S代表取代(Substitution),N代表亲核(Nucleophilic),2代表反应的决速步涉及两种分子。
与S N1反应相对应,S N2反应中,亲核试剂带着一对孤对电子进攻具亲电性的缺电子中心原子,形成过渡态的同时,离去基团离去。
反应中不生成碳正离子,速率控制步骤是上述的协同步骤,反应速率与两种物质的浓度成正比,因此称为双分子亲核取代反应。
反应机理S N2反应最常发生在脂肪族sp3杂化的碳原子上,碳原子与一个电负性强、稳定的离去基团(X)相连。
亲核试剂(Nu)从离去基团的正后方进攻碳原子,Nu-C-X角度为180°,以使其孤对电子与C-X键的σ*反键轨道可以达到最大重叠。
然后形成一个五配位的反应过渡态,碳约为sp2杂化,用两个垂直于平面的p轨道分别与离去基团和亲核试剂成键。
C-X的断裂与新的C-Nu键的形成是同时的,X很快离去,形成含C-Nu键的新化合物。
由于亲核试剂是从离去基团的背面进攻,故如果受进攻的原子具有手性,则反应后手性原子的立体化学发生构型翻转,也称“瓦尔登翻转”。
这也是S N2反应在立体化学上的重要特征。
反应过程类似于大风将雨伞由里向外翻转。
例如溴乙烷与氢氧根离子发生S N2生成乙醇和溴离子。
上例中,OH−(亲核试剂)进攻C2H5Br(底物)发生S N2反应,经过不稳定的过渡态,最终Br−离去,得到乙醇。
S N2反应一般发生在伯碳原子上,很难成为有位阻分子的反应机理,并且取代基越多,按S N2机理反应的可能性越小。
基团在空间上比较拥挤的分子一般采用S N1机理,可以缓解一部分的位阻,也可生成较稳定的碳正离子(通常为三级碳正离子)。
影响因素离去基团的碱性:离去基团的碱性越强,其离去能力越弱,反之亦然。
酯交换为酰胺-060123

经典化学合成反应标准操作酯交换为酰胺目录1.前言 (2)2.酯交换为酰胺 (2)3.酯交换为N-取代酰胺 (2)1.前言酯和氨水反应可以很方便地得到酰胺。
N-取代酰胺一般可以利用相应的胺与酯直接反应得到,在有些条件下,需要有铝试剂的存在反应才能够顺利进行。
2.酯与氨交换一般酯的氨解通过氨的醇溶液或氨水来进行。
氨的醇溶剂氨解反应可通过加入适量的甲醇钠和氰化钠来催化。
用氨水直接氨解一般需要加热(当该反应温度到100度时,一定要用高压釜做这一反应),这类反应一般可以通过硫酸铜来进行催化。
反应的条件选择主要看酯的活性程度,一般脂肪酸酯的交换要比芳香羧酸酯来得容易,甲酯要比乙酯来得快。
对脂肪酸酯,α位的位阻大小也决定了反应的快慢。
酯通过甲酰胺在乙醇钠的存在下,高温也可得到相应的酰胺。
这一方法对各类的酯都比较有效,只是产品的分离比直接氨解稍微麻烦一些,但反应较快。
另外近年来,AlMe 3-NH 4Cl 或Me 2AlNH 2在多官能团及复杂化合物的合成中用的较多,该方法条件较强,各类酯都能很快的氨解。
其缺点是AlMe 3易自燃,操作不是太方便。
2.1 氨水用于脂肪羧酸酯氨解示例[1]NO OOO NO H 2NOOO NH OHTo ethyl 5-ethoxycarbonylmethyl-3-methylisoxazole-4-carboxylate (1.00 g, 4.15 mmol) was added an excess of conc. aqueous ammonia (d = 0.88 kg·dm -3, 5.0 cm 3) and EtOH (3.0 cm 3), and the suspension was stirred vigorously at room temperature for 14 h. After this period a white solid had precipitated which was filtered and recrystallized (EtOAc) to yield the desired product as a white solid (0.81 g, 92%).NO OOO NO HNOO MeNH 2 / toluenePrepared as described above for ethyl 5-carbamoylmethyl-3-methylisoxazole-4-carboxylate but using methyl-5-ethoxycarbonyl- 3-methylisoxazole-4-carboxylate (1.00 g, 4.15 mmol) and methylamine in toluene (30% w/v, 10.0 cm 3), to yield the desired product as a white solid (0.93 g, 99%).2.2 氨甲醇氨解脂肪羧酸酯示例[2] [3]NH O OCOOEtNH OO CONHMe MeNH / MeOHThe ester (4.11 g, 14 mmol) was dissolved in absol. methanolic ammonia (100 ml, 20 % NH 3), and the solution was allowed to stand at temperature for 3 days, the solvent was then evaporated, and the resulting crystalline was purified by recrystallization.2.3 氨水用于芳香羧酸酯氨解示例[4]NNH OHNCONH 2To an autoclave, was added methyl 6-methylniconate (500 g, 3.31 mol), sat. aq. NH 4OH (500 ml) and ethanol (500 ml). After sealing, the reaction was heated to 80℃ for 2 days. The cooled reaction mixture was filtrated, and the filter cake was recrystallized to afford white solid (247 g, 54.8%)。
酯交换为酰胺

经典化学合成反应标准操作酯交换为酰胺编者:杜晓行药明康德新药开发有限公司化学合成部目录1.前言 (2)2.酯交换为酰胺 (2)3.酯交换为N-取代酰胺 (2)1.前言酯和氨水反应可以很方便地得到酰胺。
N-取代酰胺一般可以利用相应的胺与酯直接反应得到,在有些条件下,需要有铝试剂的存在反应才能够顺利进行。
2.酯与氨交换一般酯的氨解通过氨的醇溶液或氨水来进行。
氨的醇溶剂氨解反应可通过加入适量的甲醇钠和氰化钠来催化。
用氨水直接氨解一般需要加热(当该反应温度到100度时,一定要用高压釜做这一反应),这类反应一般可以通过硫酸铜来进行催化。
反应的条件选择主要看酯的活性程度,一般脂肪酸酯的交换要比芳香羧酸酯来得容易,甲酯要比乙酯来得快。
对脂肪酸酯,α位的位阻大小也决定了反应的快慢。
酯通过甲酰胺在乙醇钠的存在下,高温也可得到相应的酰胺。
这一方法对各类的酯都比较有效,只是产品的分离比直接氨解稍微麻烦一些,但反应较快。
另外近年来,AlMe 3-NH 4Cl 或Me 2AlNH 2在多官能团及复杂化合物的合成中用的较多,该方法条件较强,各类酯都能很快的氨解。
其缺点是AlMe 3易自燃,操作不是太方便。
2.1 氨水用于脂肪羧酸酯氨解示例[1]NO OOO NO H 2NOOO NH OHTo ethyl 5-ethoxycarbonylmethyl-3-methylisoxazole-4-carboxylate (1.00 g, 4.15 mmol) was added an excess of conc. aqueous ammonia (d = 0.88 kg·dm -3, 5.0 cm 3) and EtOH (3.0 cm 3), and the suspension was stirred vigorously at room temperature for 14 h. After this period a white solid had precipitated which was filtered and recrystallized (EtOAc) to yield the desired product as a white solid (0.81 g, 92%).NO OOOO NO HNOOO MeNH 2 / toluenePrepared as described above for ethyl 5-carbamoylmethyl-3-methylisoxazole-4-carboxylate but using methyl-5-ethoxycarbonyl- 3-methylisoxazole-4-carboxylate (1.00 g, 4.15 mmol) and methylamine in toluene (30% w/v, 10.0 cm 3), to yield the desired product as a white solid (0.93 g, 99%).2.2 氨甲醇氨解脂肪羧酸酯示例[2] [3]NH O OCOOEtNH OO CONHMe MeNH / MeOHThe ester (4.11 g, 14 mmol) was dissolved in absol. methanolic ammonia (100 ml, 20 % NH 3), and the solution was allowed to stand at temperature for 3 days, the solvent was then evaporated, and the resulting crystalline was purified by recrystallization.2.3 氨水用于芳香羧酸酯氨解示例[4]NNH OHNCONH 2To an autoclave, was added methyl 6-methylniconate (500 g, 3.31 mol), sat. aq. NH 4OH (500 ml) and ethanol (500 ml). After sealing, the reaction was heated to 80℃ for 2 days. The cooled reaction mixture was filtrated, and the filter cake was recrystallized to afford white solid (247 g, 54.8%)。
名词解释酯的氨解反应

名词解释酯的氨解反应酯的氨解反应是一种有机化学反应,主要指酯与氨(或胺类物质)在适当条件下发生水解作用,生成相应的酰胺和醇。
这一反应常用于有机合成和药物合成领域,具有广泛的应用价值。
在本文中,将介绍酯的氨解反应的基本原理、反应机制、反应条件及其应用领域。
1. 基本原理:酯的氨解反应基于水解的原理,即通过水分子的加入使酯分子的酰基与氨基或胺基发生断裂,生成酰胺和醇。
酯的氨解反应是一个亲核取代反应,其中氨或胺作为亲核试剂进攻酯的羰基碳,攻击后产生过渡态,然后发生脱水、质子转移等步骤,最终得到酰胺和醇。
2. 反应机制:酯的氨解反应经历了几个关键步骤。
首先,亲核试剂(氨或胺)的氢原子被酯的羰基氧原子中间的C-O键的电子吸引,形成一个亲核试剂攻击羰基碳原子的过程。
然后形成临时的过渡态,即酯酰氧负离子与亲核试剂结合形成一个酰胺酰基加合物。
接下来,通过脱水和质子转移的步骤,酰胺酰基加合物分解为酰胺和醇的生成。
最后通过中和或其他化学转化,得到最终产物。
3. 反应条件:酯的氨解反应的条件可以在不同的实验室设定下变化,主要取决于反应底物和所需产物的特性。
一般来说,这一反应需要保持适当的催化剂存在,通常是氢氧化物、醇或酸等。
此外,反应中需要提供恰当的温度和反应时间,以确保反应的进行和产物的优化。
4. 应用领域:酯的氨解反应在有机合成和药物合成领域具有广泛的应用。
其中一个重要的应用是在药物合成过程中,通过酯的氨解反应可以转化合成药物中的酯基团。
此外,酯的氨解反应还可以用于合成具有特定结构和功能的材料,如高分子聚酰胺的合成。
此外,该反应还能被应用于有机合成过程中的其他反应,如酯键的断裂等。
在总结中,酯的氨解反应是一种有机化学反应,通过水解作用将酯转化为酰胺和醇。
这一反应具有重要的应用价值,在药物合成和有机合成领域得到广泛应用。
深入了解酯的氨解反应的原理、机制、反应条件和应用领域,有助于我们更好地理解和应用这一反应,推动有机化学的发展。
酯的氨解成酰胺反应温度

酯的氨解成酰胺反应温度1.引言1.1 概述酯的氨解成酰胺反应是一种重要的有机化学反应,通过在酯分子中加入氨基基团,将酯转化为相应的酰胺化合物。
这一反应在化学合成和药物制造等领域有着广泛的应用。
在酯的氨解成酰胺反应中,酯与氨基化合物在适当的条件下反应生成酰胺化合物。
这个化学过程涉及到酯的酯基与氨基之间的交换,同时伴随着水的生成。
该反应是一个平衡反应,其速率和平衡位置受到多种因素的影响。
本文将重点讨论这一反应中反应温度的选择对反应速率和产物选择性的影响。
在不同的温度条件下,反应的动力学和平衡性质可能发生变化,从而影响到反应的效果和产物的结构。
通过合理选择反应温度,可以控制反应速率和产物的组成,从而实现对合成过程的精确控制。
进一步了解酯的氨解成酰胺反应及其温度调控的相关内容,将对有机合成和药物制造等领域的研究和应用具有重要的指导意义。
在本文的后续部分中,将详细介绍影响反应温度选择的因素并探讨低温和高温条件下的反应特点。
通过对这些内容的探究,我们希望能为进一步优化反应条件和合成策略提供一定的参考和指导。
文章结构部分的内容如下:1.2 文章结构本文共分为三个主要部分:引言、正文和结论。
引言部分主要包括概述、文章结构和目的。
首先,文章将概述酯的氨解成酰胺反应这一化学反应过程,并介绍其在有机合成中的重要性和应用。
其次,文章将介绍整篇文章的结构安排,以使读者能够清晰地了解文章的逻辑和内容组织。
最后,文章将明确阐述本文的目的,即通过研究和分析影响酯的氨解成酰胺反应温度的因素,探讨反应温度的选择及其对反应结果的影响。
正文部分包括两个主要的子节:酯的氨解成酰胺反应和反应温度的选择。
在酯的氨解成酰胺反应一节中,将详细介绍该反应的原理和机制,并探讨影响反应温度的因素,包括催化剂的选择、底物的结构和浓度、反应时间等。
在反应温度的选择一节中,将讨论在低温和高温条件下酯的氨解成酰胺反应的特点和优缺点,以及如何选择合适的反应温度以达到预期的反应结果。
酯的氨解催化剂_概述及解释说明

酯的氨解催化剂概述及解释说明1. 引言1.1 概述本文将对酯的氨解催化剂进行综述和解释说明。
酯的氨解是一种重要的有机合成反应,通过在酯分子中引入氨基团,可以生成多种有机化合物。
鉴于其广泛的应用前景和产生的化学品多样性,研究人员已经开发了各种催化剂来促进此类反应。
本文旨在概述酯的氨解催化剂的研究进展,并探讨影响反应速率和产物选择性的因素。
1.2 文章结构文章将按以下顺序展开讨论:首先介绍引言部分,然后详细介绍酯的氨解催化剂(包括反应机制、催化剂种类及特点以及催化活性和选择性研究)。
随后,我们将探讨反应条件对氨解酯反应以及催化剂对反应速率和产物选择性的影响。
最后,在分析了其他影响因素及调控方法后,我们将探讨酯的氨解催化剂在有机合成中的应用潜力,并提出技术发展和改进方向需求分析。
最后,我们将讨论持续提高催化活性和选择性所面临的挑战与展望。
1.3 目的本文的目的是系统地总结和分析酯的氨解催化剂在有机合成中的重要性及研究进展,并对其应用前景和挑战进行评估。
通过深入理解反应机制、催化剂种类及特点以及反应条件对反应结果的影响,我们将为酯的氨解催化剂领域的未来发展提供新思路和方向。
2. 酯的氨解催化剂2.1 酯的反应机制酯的氨解指的是酯与氨在催化剂存在下发生反应生成胺和醇的过程。
在这个反应中,催化剂起到了促进反应速率和选择性的作用。
该反应一般分为两个步骤:氨解和氧化脱羧。
第一步,酯与氨先发生氨解,生成相应的胺和醇,并释放出水分子。
第二步,生成的胺进一步经历氧化脱羧,产生亚胺中间体,然后将亚胺加氢生成相应的胺。
2.2 催化剂种类及特点目前已经开发出多种类型的催化剂用于酯的氨解反应。
常见的催化剂包括金属催化剂、有机催化剂和生物催化剂。
金属催化剂如钯、铜、铁等具有高效且广泛适用于不同类型酯底物的特点。
有机催化剂如吡啶、三甲基溴硷等对高活性要求较低,但对底物选择性较差。
而生物催化剂如酯酶具有良好的底物选择性和环境适应性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
亲核试剂:在反应过程中供给电子进攻反应物中带部分正电荷原子的试剂称为亲核试剂。
常见的亲电试剂与亲核试剂如下:
酯与胺反应生成酰胺
双分子亲核取代反应
S N2反应(双分子亲核取代反应)是亲核取代反应的一类,其中S代
表取代(Substitution),N代表亲核(Nucleophilic),2代表反应的决速步涉及两种分子。
与S N1反应相对应,S N2反应中,亲核试剂带着一对孤对电子进攻具亲电性的缺电子中心原子,形成过渡态的同时,离去基团离去。
反应中不生成碳正离子,速率控制步骤是上述的协同步骤,反应速率与两种物质的浓度成正比,因此称为双分子亲核取代反应。
反应机理
S N2反应最常发生在脂肪族sp3杂化的碳原子上,碳原子与一个电负性强、稳定的离去基团(X)相连。
亲核试剂(Nu)从离去基团的正后方进攻碳原子,Nu-C-X角度为180°,以使其孤对电子与C-X键的σ*反键轨道可以达到最大重叠。
然后形成一个五配位的反应过渡态,碳约为sp2杂化,用两个垂直于平面的p轨道分别与离去基团和亲核试剂成键。
C-X的断裂与新的C-Nu键的形成是同时的,X很快离去,形成含C-Nu键的新化合物。
由于亲核试剂是从离去基团的背面进攻,故如果受进攻的原子具有手性,则反应后手性原子的立体化学发生构型翻转,也称“瓦尔登翻转”。
这也是S N2反应在立体化学上的重要特征。
反应过程类似于大风将雨伞由里向外翻转。
例如溴乙烷与氢氧根离子发生S N2生成乙醇和溴离子。
上例中,OH−(亲核试剂)进攻C2H5Br(底物)发生S N2反应,经过不稳定的过渡态,最终Br−离去,得到乙醇。
S N2反应一般发生在伯碳原子上,很难成为有位阻分子的反应机理,并且取代基越多,按S N2机理反应的可能性越小。
基团在空间上比较拥挤的分子一般采用S N1机理,可以缓解一部分的位阻,也可生成较稳定的碳正离子(通常为三级碳正离子)。
影响因素
离去基团的碱性:离去基团的碱性越强,其离去能力越弱,反之亦然。
氨是碱性物质,但当氨分子中的氢原子被酰基取代后则碱性减弱,它不能使石蕊变色,一般认为是中性化合物。
这是由于酰胺中氮原子上未共用电子对与碳氧双键形成p,π-共轭,从而使氮原子上电子云密度降低,因此减弱了它接近质子的能力,故碱性大大降低。
与此同时,氮氢键的极性又有所增强,从而又表现了微弱的酸性。
所
以,是一个很好的离去基团,有利于反应的进行。
亲核试剂的亲核性:亲核性需要与上面的碱性相区别。
碱性是试剂对质子的亲和能力,而亲核性是试剂形成过渡态时,对碳原子的亲和能力。
一般来讲,试剂的负电性、碱性和可极化性越强,其亲核性也越强。
实际上通常需要综合考虑这几个因素以及溶剂的影响。
而亲核性:I-<CH3COO-<OH-<<RO- < NH2-,所以,反应容易进行。
溶剂:S N2反应在质子溶剂中进行时,一方面,溶剂化作用有利于
离去基团的离去;另一方面,溶剂也会与亲核试剂发生作用,使亲核试剂与底物的接触变得困难。
最后的影响是这两种因素的综合结果。
相对而言,极性非质子性分子很少包围负离子,因此对S N2反应是有利的。
而DMF,DMSO都是极性疏质子性溶剂,也有利于实验的进行。
空间效应:立体阻碍性(含体积大的取代基)会使亲核试剂的亲核性下降。
空间效应基本上与链长短无关,主要与碳原子上的取代基多少有关,如果取代基越多,那各取代基的空间位置基本固定,键就无法自由旋转,所以我们说空间效应比较大。
而与链长无关。
NHS ester reaction scheme for chemical conjugation to a primary amine. (R) represents a labeling reagent or one end of a crosslinker having the NHS ester reactive group; (P) represents a protein or other molecule that contains the target functional group (i.e., primary amine).
综上反应条件
1、Calculate required amount of NHS ester:
NHS_ester_weight [mg] = 8 ×amino_compound_weight [mg] ×NHS_ester_molar_weight [Da] / amino_compound_molar_weight [Da].
2、Dissolve NHS ester in 1/10 reaction volume of DMF or DMSO. Amine-free DMF is preferred solvent.
3、Dissolve biomolecule in 9/10 reaction volume of buffer with pH
8.3-8.5. The reaction of NHS esters with amines is strongly pH-dependent: at low pH, the amino group is protonated, and no modification takes place. At
higher-than-optimal pH, hydrolysis of NHS ester is quick, and modification yield diminishes. Optimal pH value for modification is 8.3-8.5.
配制100ml pH8.34的磷酸缓冲液(PBS)配制方法可以这样配制:
1/15 mol/L Na2HPO4溶液的配制:准确称取Na2HPO4•12H2O 2.3876 g,用水溶解,定容至100 mL;
1/15 mol/L KH2PO4溶液的配制:准确称取KH2PO4 0.4540 g,用水溶解,定容至100 mL;再取上述1/15 mol/L Na2HPO4溶液97.5ml+l/15 mol/L KH2PO4溶液2.5ml即得
0.1 M Sodium bicarbonate solution has appropriate pH. Other alternatives are 0.1 M Tris buffer(although Tris has amino group, it is hindered and does not react with NHS esters), or 0.1 M phosphate buffer. Note pH is the most important thing. While Tris is primary amine is not compatible, because it competes for reaction; however, in some procedures, it is useful to add Tris or glycine buffer at the end of a conjugation procedure to quench (stop) the reaction.
4、Add NHS ester solution to the solution of biomolecule, and vortex well. Keep on ice overnight, or at room temperature during at least 4 hours.
5、Purify the conjugate using appropriate method: gel-filtration for macromolecules is most universal. Precipitation and chromatography is another alternative. Organic impurities (such as N-hydroxysuccinimide, NHS ester, acid produced by hydrolysis) are almost always easily separated. For proteins and nucleic acids, ethanol or acetone precipitation can be used.。
